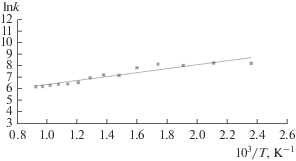Неорганические материалы, 2020, T. 56, № 3, стр. 241-246
Влияние вольфрама на процесс восстановления тетрахлорида германия
А. В. Кадомцева 1, *, А. М. Объедков 2, М. А. Засовская 3
1 Приволжский исследовательский медицинский университет Министерства здравоохранения
Российской Федерации
603005 Нижний Новгород, пл. Минина и Пожарского, 10/1, Россия
2 Институт металлоорганической химии им. Г.А. Разуваева Российской академии наук
603950 Нижний Новгород, ул. Тропинина, 49, Россия
3 Ухтинский государственный технический университет
169300 Республика Коми, Ухта, ул. Первомайская, 13, Россия
* E-mail: kadomtseva@pimunn.ru
Поступила в редакцию 26.06.2019
После доработки 05.09.2019
Принята к публикации 17.09.2019
Аннотация
Изложены перспективы применения наноматериалов на основе германия в наноэлектронике. Разработан каталитический метод восстановления тетрахлорида германия водородом в присутствии вольфрама. Установлено, что процесс протекает с 98.9%-ной конверсией по тетрахлориду германия при температуре 1073 К, также рассчитаны кинетические характеристики каталитического восстановления тетрахлорида германия водородом. Современным квантово-химическим методом с использованием теории функционала плотности (DFT, B3LYP/6-311++G(2d,2р)) исследованы основная реакция восстановления тетрахлорида германия и все стадии этого процесса.
ВВЕДЕНИЕ
Развитие современных технологий требует разработки новых функциональных материалов. Одним из важных направлений современной оптоэлектроники является изучение процессов синтеза композиционных наноструктурированных материалов с воспроизводимыми и управляемыми эксплуатационными характеристиками, важными для функциональных изделий в виде диэлектрических матриц, содержащих отдельно локализованные полупроводниковые наночастицы, а также оптоэлектронных приборов и устройств энергонезависимой памяти [1, 2].
В последнее время синтезировано большое число неорганических наноматериалов. Известны работы по синтезу наноструктур как соединений, так и простых элементов [3]. Наименее исследованной, но перспективной является проблема получения наноразмерных материалов на основе германия. Известно [4], что германий входит в состав полупроводниковых материалов, применяемых в микроэлектронике.
В настоящее время германий стал базовым элементом при получении качественно новых материалов [5, 6]. Полупроводниковые свойства германия востребованы в электронных приборах, в приборах ночного видения, солнечных преобразователях, а также в Si–Ge-чипах [7]. Ранее авторами [8] был разработан метод восстановления тетрахлорида германия водородом в присутствии катализатора на основе зольных микросфер с покрытием из пиролитического вольфрама.
Несмотря на то что германий как материал полупроводниковой техники давно и систематически изучен, технология его получения представляет большой интерес для исследователей.
В настоящей работе предлагается перспективный каталитический метод получения германия. Впервые представлены результаты оптимизации реакции восстановления тетрахлорида германия водородом в присутствии вольфрама.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В ходе эксперимента температура реактора варьировалась в интервале от 423 до 1073 К. Нагрев осуществлялся электронагревателем, подключенным к пропорционально-интегрально-дифференциальному регулятору для поддержания выбранного температурного режима. Тетрахлорид германия подавался в реактор путем барботирования водорода через тетрахлорид германия. В работе использовался тетрахлорид германия (99.999%) и водород (99.9999%) с примесями воды и кислорода на уровне 0.1 и 15.0 ppm соответственно. Блок подготовки газов обеспечивает возможность установки расходов газа-носителя (от 5 до 75 мл/мин) в двух линиях при установлении рабочего давления 0.3 МПа, водорода (от 5 до 75 мл/мин) при установлении рабочего давления 0.1 МПа, воздуха (от 20 до 600 мл/мин) при установлении рабочего давления 0.15 МПа.
Система накопления, предназначенная для сбора продуктов реакции, состоит из накопительного баллона, помещенного в криостат, где в качестве хладагента используется жидкий азот. Накопительный баллон снабжен системой экстренного сброса продуктов, системой отбора проб и подсоединен к вакуумной системе. Вакуумная система служит для скачивания продуктов реакций из отдельных узлов системы. Кассетный фильтр заполнен абсорбентом (активированный уголь, гидроксид калия) для поглощения и удерживания хлористого водорода. В качестве системы отбора использовались ампулы для хроматографического анализа состава реакционной смеси.
Количественный анализ образующихся веществ проводили газохроматографическим методом с использованием детектора по теплопроводности на газовом хроматографе “Цвет-800” с вакуумной системой напуска пробы. Для разделения продуктов реакции использовалась насадочная колонка, заполненная хроматоном N-AW-HMDS (0.16–0.20 мм) с 15% нанесенной жидкой фазы E-301 при температуре 373 К в течение 6 мин, газ-носитель – водород (99.9999%). Обработка результатов выполнялась в программе “Цвет-аналитик” с использованием относительной градуировки.
В качестве катализатора был использован вольфрамовый порошок ПВП-1, полученный методом плазменного восстановления вольфрама, содержание вольфрама не менее 99.9%. Главными преимуществами использования ПВП-1 являются жаростойкость и устойчивость к агрессивным средам. Высота слоя катализатора составила 120 мм, масса 137 г.
Реакция восстановления тетрахлорида германия и все стадии этого процесса были исследованы современным квантово-химическим методом с использованием теории функционала плотности (DFT, B3LYP/6–311++G(2d,2р)). Для всех изученных молекулярных структур проведена полная оптимизация геометрии с последующим расчетом колебательных частот. Для всех оптимизированных структур в рамках гармонического приближения рассчитаны термодинамические функции. Расчеты выполнены с помощью программы Gaussian03. Для анализа результатов и термодинамических расчетов была использована программа Moltran.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 приведены термодинамические параметры предполагаемых элементарных стадий реакции восстановления тетрахлорида германия на уровне B3LYP/6–311++G(2d,2p).
Таблица 1.
Энергия, стандартная энтальпия и стандартная свободная энергия Гиббса (кДж/моль) реакций восстановления тетрахлорида германия (B3LYP/6–311G(2d,2p))
| Реакция | ∆rE | ∆rH | ∆rG |
|---|---|---|---|
| GeCl4 + 2H2 → Ge + 2HCl | 561.44 | 568.51 | 509.25 |
| GeCl4 + 2H2 → GeCl4 · (H2)2 | –0.37 | 4.75 | –8.09 |
| GeCl4 · (H2)2 → GeCl2 · H2 + 2HCl | 98.99 | 97.80 | 54.01 |
| Путь 1 | |||
| GeCl2 · H2 → Ge + 2HCl | 462.83 | 465.96 | 463.33 |
| Путь 2 | |||
| GeCl2 · H2 + GeCl4 → (GeCl2)2 + 2HCl | 53.02 | 53.65 | 29.73 |
| (GeCl2)2 → GeCl2 + GeCl2 | 46.48 | 41.79 | –0.98 |
| GeCl2 + H2 → GeCl2 · H2 | –0.44 | 3.56 | 8.58 |
| GeCl2 · H2→ Ge + 2HCl | 462.83 | 465.96 | 463.33 |
Почти все представленные стадии реакции восстановления тетрахлорида германия характеризуются положительными энергиями Гиббса при стандартной температуре 298 К, т.е. с термодинамической точки зрения эти процессы являются невыгодными. Небольшими отрицательными энергиями Гиббса характеризуются процессы образования комплекса GeCl4 · (H2)2 и распада комплекса (GeCl2)2. Также было рассмотрено образование комплекса GeCl4 · (H2)2 в две стадии:
(1)
${\text{GeC}}{{{\text{l}}}_{4}} + {{{\text{H}}}_{2}} \to {\text{GeC}}{{{\text{l}}}_{4}} \cdot {{{\text{H}}}_{2}},$(2)
${\text{GeC}}{{{\text{l}}}_{4}} \cdot {\text{ }}{{{\text{H}}}_{2}} + {{{\text{H}}}_{2}} \to {\text{GeC}}{{{\text{l}}}_{4}} \cdot {{\left( {{{{\text{H}}}_{2}}} \right)}_{2}}.$Обе стадии характеризуются отрицательными энергиями образования (–0.11 и –0.25 кДж/моль соответственно) и отрицательными энергиями Гиббса (–7.03 и –1.07 кДж/моль).
На рис. 1 показаны структуры интермедиатов и продуктов реакций восстановления тетрахлорида германия, оптимизированные методом B3LYP/6–311++G(2d,2p), полученные двумя путями.
Рис. 1.
Структуры интермедиатов и продуктов реакций восстановления тетрахлорида германия, оптимизированные методом B3LYP/6–311++G(2d,2p).
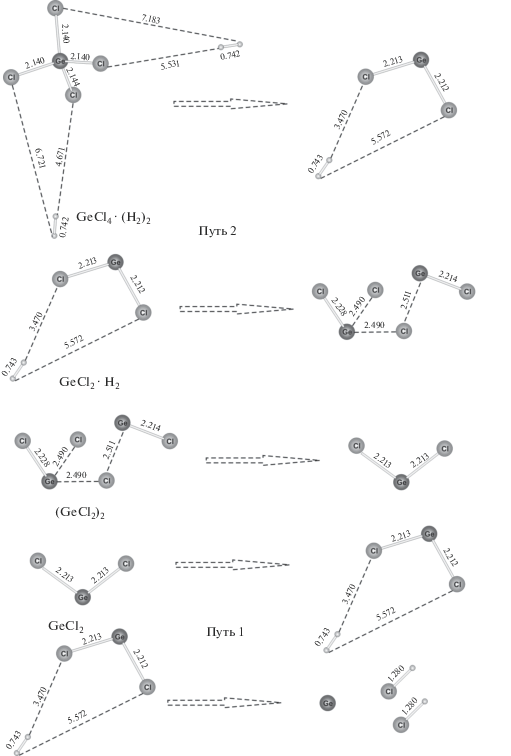
Таким образом, образование комплекса GeCl4 · · (H2)2 энергетически выгоднее при одновременном присоединении 2 молекул водорода, а не через стадию комплекса GeCl4 · H2.
Так как эксперимент проводился при температурах, отличных от 298 К, был проведен расчет энергии Гиббса как критерия вероятности протекания реакции при минимальной и максимальной температурах реактора. Результаты приведены в табл. 2. Как видно из представленных данных, при температуре 423 К практически все стадии характеризуются положительной энергией Гиббса, т.е. процесс термодинамически не выгоден. Повышение температуры до 1123 К делает значения энергий Гиббса промежуточных стадий отрицательными, но основная реакция восстановления тетрахлорида германия так и остается в зоне больших положительных значений. Данный результат находится в хорошем соответствии с экспериментом, в котором положительный результат был получен только при использовании вольфрама в качестве катализатора.
Таблица 2.
Стандартная свободная энергия Гиббса реакций восстановления тетрахлорида германия при разных температурах
| Реакция | ∆rG, кДж/моль | ||
|---|---|---|---|
| 298 К | 423 К | 1123 К | |
| GeCl4 + 2H2 → Ge + 2HCl | 509.25 | 484.39 | 345.18 |
| GeCl4 + 2H2 → GeCl4 · (H2)2 | –8.09 | –13.48 | –43.65 |
| GeCl4 · (H2)2 → GeCl2 · H2 + 2HCl | 54.01 | 35.64 | –67.23 |
| Путь 1 | |||
| GeCl2 · H2 → Ge + 2HCl | 463.33 | 462.83 | 465.96 |
| Путь 2 | |||
| GeCl2 · H2+ GeCl4 → (GeCl2)2 + 2HCl | 29.73 | 19.70 | –36.47 |
| (GeCl2)2 → GeCl2 + GeCl2 | –0.98 | –18.92 | –119.40 |
| GeCl2 + H2 → GeCl2 · H2 | 8.58 | 10.69 | 22.49 |
| GeCl2 · H2 → Ge + 2HCl | 463.33 | 462.23 | 456.06 |
В результате хроматографического анализа были получены концентрации реагирующих веществ и продуктов восстановления GeCl4 при максимальной и минимальной температурах реактора (табл. 3).
Таблица 3.
Концентрации реагирующих веществ и продуктов восстановления тетрахлорида германия водородом при максимальной и минимальной температурах реактора
| Вещество | С, мол. % | |||
|---|---|---|---|---|
| без катализатора | W | |||
| 423 | 1123 | 423 | 1073 | |
| HCl | 0.01 | 0.18 | 0.01 | 0.43 |
| GeCl4 | 0.08 | 0.001 | 0.2 | 0.001 |
| Н2 | 0.91 | 0.81 | 0.79 | 0.569 |
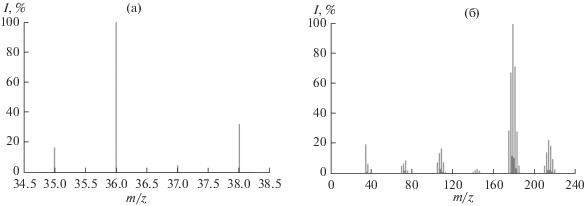
В результате хромато-масс-спектрометрических исследований были получены масс-спектры хлористого водорода и тетрахлорида германия (рис. 2).
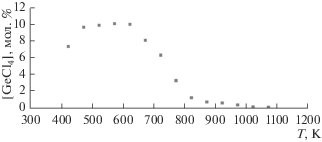
По данным газохроматографического анализа также получены зависимости концентрации тетрахлорида германия от температуры (рис. 3). Установлено, что восстановление тетрахлорида германия водородом на вольфраме протекает с 98.9%-ной конверсией по тетрахлориду германия при температуре 1073 К, в то время как без катализатора при 1123 К конверсия составила 98.9%.
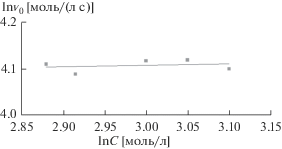
На рис. 4 представлена логарифмическая зависимость скорости реакции от концентрации, которая описывается уравнением:
где v0 – скорость химической реакции, моль/(л с), С – текущая концентрация GeCl4, моль/л.Следует отметить, что каталитическое восстановление GeCl4 описывается уравнением нулевого порядка, что свидетельствует о высокой адсорбции реагирующих веществ на катализаторе (рис. 4).
В аррениусовских координатах lnk = f (1/T) зависимость имеет линейный характер (рис. 5). В результате обработки полученных данных получено уравнение для определения константы скорости:
Энергия активации каталитического восстановления тетрахлорида германия водородом составила 35 кДж/моль, что на 13 кДж/моль меньше значения энергии активации некаталитической реакции [9].
ЗАКЛЮЧЕНИЕ
Разработан каталитический метод восстановления тетрахлорида германия водородом, позволяющий снизить температуру процесса, а также сократить количество стадий получения германия.
Современным квантово-химическим методом с использованием теории функционала плотности (DFT, B3LYP/6–311++G(2d,2р)) исследованы основная реакция восстановления тетрахлорида германия и все стадии этого процесса, рассмотрены два пути реакции. Полученные структурные данные, энергии активации и термодинамические величины хорошо согласуются с экспериментальными значениями.
Рассчитаны кинетические характеристики восстановления тетрахлорида германия водородом в присутствии вольфрама. Определена скорость каталитического восстановления тетрахлорида германия водородом, установлен нулевой порядок реакции. Выявлено, что реакция в присутствии катализатора на основе вольфрама имеет кажущуюся энергию активации на 13 кДж/моль меньше в сравнении с некаталитическим способом проведения реакции.
Список литературы
Karatutlu A., Little W.R., Sapelkin A.V., Dent A., Mosselmans F., Cibin G., Taylor R. OD-XAS and EXAFS: Structure and Luminescence in Ge Quantum Dots // J. Phys: Conf. Ser. 2013. V. 430. № 1. P. 12026.
Гриценко В.А., Тысченко И.Е., Попов В.П., Перевалов Т.В. Диэлектрики в наноэлектронике. Новосибирск: Изд-во СО РАН, 2010. С. 258.
Jianchun Bao, Zheng Xu, Jianming Hong, Xiang Ma, Zuhong Lu. Fabrication of Cobalt Nanostructures with Different Shapes in Alumina Template // Scr. Mater. 2004. 50. P. 19–23. https://doi.org/10.1016/j.scriptamat.2003.09.047
Дорошенко М.Н., Набока О.В., Мазуренко Е.А., Огенко В.М. Синтез каталитически активных подложек для получения наноструктур германия(IV) // Неорган. и физ. химия. 2011. Т. 77. № 8. С. 94–99.
Novikov V.V., Matovnikov A.V., Avdashchenko D.V., Mitroshenkov N.V., Dikarev E., Takamizawa S., Kirsanova M.A., Shevelkov A.V. Low-Temperature Structure and Lattice Dynamics of the Thermoelectric Clathrate Sn24P19.3I8 // J. Alloys Compd. 2012. 520. P. 174–179.
Борщ Н.А., Переславцева Н.С., Курганский С.И. Пространственная и электронная структура германий-танталовых кластеров ${\text{TaGe}}_{n}^{ - }$ (n = 8−17) // Физика твердого тела. 2014. Т. 56. № 11. С. 2259–2264.
Наумов А.В. Мировой рынок германия и его перспективы // Изв. вузов. Цв. металлургия. 2007. № 4. С. 32–40.
Кадомцева А.В., Объедков А.М., Семенов Н.М., Каверин Б.С., Гусев С.А. Получение и исследование влияния катализатора на основе зольных микросфер с покрытием из пиролитического вольфрама на процесс получения металлического германия // Журн. прикл. химии. 2016. Т. 89. № 11. С. 1428–1437.
Кадомцева А.В., Объедков А.М. Восстановление GeCl4 в присутствии катализатора на основе модифицированного NiCl2 // Неорган. материалы. 2017. Т. 53. № 12. С. 1342–1347. https://doi.org/10.7868/S0002337X17120144
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы