Неорганические материалы, 2020, T. 56, № 6, стр. 666-680
Совместный анализ теплоемкости и теплового расширения твердого хлорида калия
В. Ю. Бодряков *
Уральский государственный педагогический университет
620017 Екатеринбург, пр. Космонавтов, 26, Россия
* E-mail: Bodryakov_VYu@e1.ru
Поступила в редакцию 17.02.2019
После доработки 29.11.2019
Принята к публикации 23.12.2019
Аннотация
Проведен совместный корреляционный анализ теплоемкости Cp(T) и коэффициента объемного теплового расширения β(T) хлорида калия (KCl) во всей области твердого состояния (0 – Tm). Построена адекватная наблюдаемым данным трехлинейная модель корреляционной зависимости β(Cp), состоящая из трех гладко сопряженных линейных участков. Удобный для описания такого поведения дифференциальный параметр Грюнайзена γ' ~ ∂β/∂Cp имеет характерный трехступенчатый вид. Анализ данных в рамках модели позволил табулировать термодинамические данные и данные по тепловому расширению твердого KCl в хорошем согласии с наиболее надежными экспериментальными сведениями.
ВВЕДЕНИЕ
На примере многих простых веществ – от криокристаллов инертных газов [1–4] до тугоплавких металлов [5–7] и диэлектриков [8, 9] – показано, что между молярной теплоемкостью Cp(T) и коэффициентом объемного теплового расширения (КОТР) β(T) существует выраженная корреляционная взаимосвязь β(Cp) во всей области температур твердого состояния: от T = 0 до точек плавления Tm, покрывающих промежуток от десятков ($T_{m}^{{{\text{Ne}}}}$ = 24.45 K) до тысяч кельвинов ($T_{m}^{{\text{W}}}$ = 3690 K). Корреляция β(Cp) при этом имеет характерный билинейный вид из двух гладко сопряженных линейных участков с “изломом” вверх, приходящимся примерно на классический предел Дюлонга и Пти по теплоемкости CDP = 3νR, где R – универсальная газовая постоянная, ν – число атомов на формульную единицу. По температуре излом в корреляционной зависимости β(Cp) приблизительно соответствует температуре Дебая Θ. Вид наблюдаемой корреляционной зависимости β(Cp) позволил сформулировать и реализовать билинейную корреляционную модель (обозначим ее как модель ℬ2ℳ). Модель ℬ2ℳ оказалась мощным инструментом верификации первичных данных разных авторов, нередко плохо согласующихся между собой. Действительно, если корреляция β(Cp) установлена и имеется набор надежных данных по одному из свойств (обычно это теплоемкость Cp(T)), то можно количественно точно восстановить другое свойство (как правило, β(T)). Модель ℬ2ℳ имеет ясное термодинамическое обоснование и хорошо моделируется компьютерными средствами [1, 8].
Изученные вещества имели, как правило, кубическую структуру и не претерпевали дополнительных фазовых превращений вплоть до своих точек плавления Tm. Вместе с тем, были изучены и вещества, имеющие более сложную корреляцию β(Cp), чем билинейная. Примером такого вещества является ртуть (Hg), которая в твердой фазе испытывает аллотропное α ↔ β-превращение, так что корреляция β(Cp) становится не би-, а трехлинейной [10]. Логика построения и применения трехлинейной корреляционной модели (ℬ3ℳ) остается при этом той же, что и для ℬ2ℳ.
Целью настоящей работы является совместный (корреляционный) анализ молярной теплоемкости Cp(T) и КОТР β(T) твердого хлорида калия во всей области твердого состояния (от T = 0 до Tm = 1044 K) и моделирование наблюдаемой корреляционной зависимости в рамках трехлинейной модели ℬ3ℳ, поскольку, как видно далее, для KCl билинейная модель ℬ2ℳ оказывается недостаточной.
При анализе использованы следующие первичные данные: теплоемкость и связанные с ней термодинамические функции (изменение энтальпии и др.) – из работ [11–33]; коэффициент теплового расширения и связанные с ним величины (молярный объем и др.) – [16, 23, 27–29, 33–57]; упругие модули и связанные с ними величины (упругие постоянные, параметр Грюнайзена и др.) – [16, 27, 29, 37, 42–44, 50, 52, 58–69]. Краткая характеристика деталей эксперимента и погрешностей оригинальных работ, в которых были определены ключевые для настоящей работы свойства KCl (теплоемкость и коэффициент теплового расширения), приведена в приложениях. А именно, работы по измерению калориметрических свойств соли охарактеризованы в прил. 1, дилатометрических свойств – в прил. 2.
АНАЛИЗ ДАННЫХ
Температурная зависимость молярной теплоемкости Cp(T) хлорида калия представлена на рис. 1 (23 набора первичных данных, около 900 точек). Данные разных авторов находятся в удовлетворительном согласии друг с другом за исключением явно заниженных данных [17] – во всем диапазоне температур, [20, 21] – выше 900 К и явно завышенных данных [26]. Несоответствующие данные были исключены из расчетных процедур и на рис. 1 приведены лишь для сопоставления. Высокотемпературные данные Cp(T) для хлорида калия нуждаются в уточнении.
Рис. 1.
Температурная зависимость изобарной молярной теплоемкости хлорида калия: символы – первичные данные, сплошная линия – расчет.
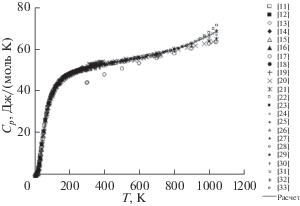
Сплошная линия на рис. 1 представляет собой тренд зависимости Cp(T), полученный статистическим усреднением в каждой табулированной температурной точке с последующим сглаживанием. Рекомендованные (трендовые) значения Cp(T) наряду с КОТР β(T) и молярным объемом V(T) во всем температурном диапазоне твердого состояния KCl даны в табл. 1. С учетом вариации калориметрических данных разных авторов согласие с расчетами настоящей работы можно признать вполне удовлетворительным (табл. 2).
Таблица 1.
Изобарная молярная теплоемкость Cp (Дж/(моль К)), КОТР β (10–6 К–1) и молярный объем V (см3/моль) твердого KCl
| T, K | Cp | β | V | T, K | Cp | β | V | T, K | Cp | β | V |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 0.000308 | 0.00015 | 36.672 | 60 | 26.21 | 45.36 | 36.705 | 250 | 50.11 | 107.04 | 37.318 |
| 2 | 0.00246 | 0.00120 | 65 | 28.43 | 50.07 | 36.713 | 260 | 50.38 | 108.12 | 37.358 | |
| 3 | 0.00831 | 0.00405 | 70 | 30.48 | 54.43 | 36.723 | 270 | 50.64 | 109.17 | 37.399 | |
| 4 | 0.0197 | 0.00960 | 75 | 32.34 | 58.39 | 36.733 | 280 | 50.89 | 110.19 | 37.440 | |
| 5 | 0.0395 | 0.0192 | 36.672 | 80 | 34.03 | 61.98 | 36.744 | 290 | 51.13 | 111.17 | 37.481 |
| 6 | 0.0682 | 0.0332 | 85 | 35.54 | 65.19 | 36.756 | 300 | 51.36 | 112.13 | 37.523 | |
| 7 | 0.112 | 0.0546 | 90 | 36.89 | 68.06 | 36.768 | 310 | 51.59 | 113.09 | 37.565 | |
| 8 | 0.171 | 0.0833 | 95 | 38.10 | 70.63 | 36.781 | 320 | 51.81 | 114.02 | 37.608 | |
| 9 | 0.248 | 0.121 | 100 | 39.19 | 73.01 | 36.794 | 350 | 52.42 | 116.64 | 37.738 | |
| 10 | 0.349 | 0.170 | 36.672 | 110 | 41.05 | 77.48 | 36.822 | 400 | 53.26 | 120.33 | 37.963 |
| 12 | 0.634 | 0.311 | 120 | 42.49 | 81.32 | 36.851 | 450 | 54.02 | 123.74 | 38.195 | |
| 14 | 1.031 | 0.525 | 130 | 43.68 | 84.73 | 36.882 | 500 | 54.74 | 126.98 | 38.435 | |
| 15 | 1.276 | 0.668 | 36.672 | 140 | 44.69 | 87.81 | 36.914 | 550 | 55.49 | 130.35 | 38.683 |
| 16 | 1.548 | 0.837 | 150 | 45.54 | 90.52 | 36.947 | 600 | 56.25 | 133.76 | 38.940 | |
| 18 | 2.196 | 1.281 | 160 | 46.27 | 92.94 | 36.981 | 650 | 57.07 | 137.44 | 39.204 | |
| 20 | 2.974 | 1.891 | 36.672 | 170 | 46.92 | 95.16 | 37.015 | 700 | 57.95 | 141.40 | 39.479 |
| 25 | 5.454 | 4.400 | 36.673 | 180 | 47.49 | 97.17 | 37.051 | 750 | 58.94 | 145.84 | 39.763 |
| 30 | 8.557 | 8.751 | 36.674 | 190 | 47.99 | 98.97 | 37.087 | 800 | 60.09 | 151.01 | 40.059 |
| 35 | 11.93 | 15.01 | 36.676 | 200 | 48.44 | 100.62 | 37.124 | 850 | 61.44 | 157.07 | 40.369 |
| 40 | 15.21 | 21.97 | 36.680 | 210 | 48.84 | 102.12 | 37.162 | 900 | 62.98 | 163.99 | 40.694 |
| 45 | 18.28 | 28.50 | 36.684 | 220 | 49.20 | 103.49 | 37.200 | 950 | 64.73 | 171.85 | 41.038 |
| 50 | 21.15 | 34.60 | 36.690 | 230 | 49.53 | 104.76 | 37.239 | 1000 | 66.78 | 181.06 | 41.401 |
| 55 | 23.78 | 40.19 | 36.697 | 240 | 49.83 | 105.93 | 37.278 | Tm | 68.9 | 190.58 | 41.741 |
Таблица 2.
Значения молярных теплоемкости, энтропии и изменения энтальпии твердого KCl при стандартных условиях (Tref = 298.15 К)
| Источник | Настоящая работа | Данные других авторов |
| $C_{p}^{^\circ }$(Tref), Дж/(моль К) | 51.32 | 51.3 [20]; 51.37 [22]; 51.29 [24]; 51.30 [25]; 51.287 [30]; 51.44 [31] |
| S°(Tref), Дж/(моль К) | 82.53 | 82.55 [22]; 82.59 ± 0.20 [24]; 82.57 [25]; 82.55 ± 0.17 [30]; 82.71 [31] |
| ΔH°(Tref, 0), кДж/моль | 11.361 | 11.370 [22]; 11.368 [24]; 11.37 [25]; 11.368 [30]; 11.395 [31] |
Анализ низкотемпературного поведения теплоемкости показал, что ниже ~6 К теплоемкость KCl ведет себя обычным дебаевским образом: Cp = kCT3, где угловой коэффициент kC = (307.8 ± ± 2.5) × 10–6 Дж/(К4 моль) дает низкотемпературный предел температуры Дебая Θ0 = 232.87 ± 0.62 К. Последний находится в удовлетворительном согласии с литературными данными Θ0 (К): 232 [12]; 222 [13]; 233 [14]; 232 [16]; 230 [28]; 234 ± 1 [59]; 229.0–237.1 [66] и др. Отметим, впрочем, сильную немонотонную температурную зависимость Θ(T) [16, 29].
Температурная зависимость КОТР β(T) твердого хлорида калия представлена на рис. 2 (25 наборов первичных данных, около 490 точек). Для KCl c его близкой к изотропной кубической структурой справедливо соотношение β = 3α, где α – линейный коэффициент расширения, обычно измеряемый в эксперименте. Данные разных авторов находятся в приемлемом согласии друг с другом за исключением явно несоответствующих ранних данных [35, 36]. Внутренняя согласованность данных β(T), однако, существенно ниже таковой для Cp(T). Сплошная линия на рис. 2 представляет собой тренд температурной зависимости β(T). Рекомендованные (трендовые) КОТР β(T) приведены в табл. 1.
Рис. 2.
Температурная зависимость коэффициента объемного теплового расширения хлорида калия: символы – первичные данные, сплошная линия – расчет.
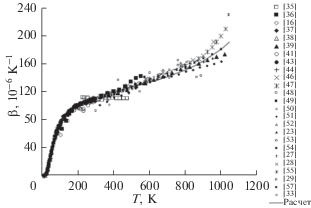
Грюнайзеновский анализ низкотемпературного поведения коэффициента расширения KCl показал, что ниже ~7 К КОТР ведет себя обычным образом: β(10–6 K–1) = kβT3, где угловой коэффициент kβ = (148.76 ± 2.66) × 10–6 K–4 дает низкотемпературную оценку барической производной температуры Дебая (∂Θ0/∂p)T = 4.13 ± 0.12 К/ГПа. Для сравнения укажем, что, согласно работе [52], ниже 10 К температурный коэффициент линейного расширения KCl составляет α(10–11 К–1) = = (4.8 ± 0.2)T3 + 0.007T5, т.е. приблизительно kβ = = k3α ≈ (144 ± 6) × 10–6 K–4, что хорошо согласуется с результатами настоящей работы; по [44] kβ ≈ ≈ (132 ± 9) × 10–6 K–4. Автору неизвестны прямые измерения величины (∂Θ0/∂p)T, однако можно получить альтернативную оценку из соотношения (∂Θ0/∂p)T = γ0Θ0/K0 [1, 8]. Принимая для оценки γ0 = 0.35 [52], Θ0 = 233 К, K0 ≈ K(4.2 K) = = 19.7 ГПа [66], имеем (∂Θ0/∂p)T = 4.14 К/ГПа – отлично согласуется с дилатометрической оценкой (∂Θ0/∂p)T.
Температурная зависимость молярного объема KCl представлена на рис. 3 (26 наборов первичных данных, более 490 точек). За исключением завышенных результатов [55], данные разных авторов находятся в приемлемом согласии до ~700 К; расхождения возрастают с приближением к точке плавления. Сплошной линией показана трендовая зависимость V(T), полученная численным интегрированием КОТР β(T):
Рис. 3.
Температурная зависимость молярного объема хлорида калия: символы – первичные данные, сплошная линия – расчет.
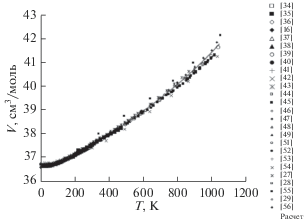
Расчетная зависимость V(T) находится в удовлетворительном согласии с первичными данными для KCl, что свидетельствует об адекватности тренда β(T). Оценка низкотемпературного предела молярного объема дает V(0) = 36.672 ± ± 0.016 см3/моль, что соответствует плотности ρ(0) = μ/V(0) = 2032.9 ± 0.9 кг/м3. При T = 300 K расчетное значение плотности KCl составляет ρ(300) = 1986.8 кг/м3. Это согласуется с имеющимися литературными данными по плотности вещества (в кг/м3): 1997 [16, 250 К]; 1986.8 ± 0.2 [24, 298.15 К]; 1982.9 [27, 294 К]; 1990 [28, 293 К]; 1982 [29]; 1987.21 ± 0.02 [34, 298 К]; 1993 [44, 290 К]; 1987.7 [47]; 1996 [52, 280 К]; 1992.9 [54, 303 К]; 1984 ± 1 [65, 292 К]; 1987.9 [55, 298 К].
Для вычисления производной
(2)
$\frac{{\partial {\beta }}}{{\partial {{C}_{p}}}} \equiv \frac{{({{\partial {\beta }} \mathord{\left/ {\vphantom {{\partial {\beta }} {\partial T}}} \right. \kern-0em} {\partial T}})}}{{\left( {{{\partial {{C}_{p}}} \mathord{\left/ {\vphantom {{\partial {{C}_{p}}} {\partial T}}} \right. \kern-0em} {\partial T}}} \right)}}$было применено табличное численное дифференцирование после сглаживания по пятиточечным формулам на основании трендовых значений Cp(T) и β(T). Полученная зависимость β'(Cp) имела отчетливо трехступенчатый вид, так что можно было выделить условно: участок (I) самых низких теплоемкостей и температур, участок (II) низких и средних теплоемкостей и температур и участок (III) повышенных и высоких теплоемкостей и температур. Наблюдаемая трехступенчатая зависимость β'(Cp) позволила сформулировать трехлинейную модель β(Cp) для KCl (ℬ3-модель), подобно тому, как это было сделано для твердой ртути [10].
Для общности опишем трехлинейную корреляционную модель (модель ℬ3) в терминах Y(X); в нашем рассмотрении X ≡ CP, Y ≡ β. Эмпирические данные представлены точками yi(xi) (i = 1, 2, …, n). Модельная зависимость Y(X) дается соотношениями:
(3)
$Y(X) = \left\{ \begin{gathered} {{Y}_{{\text{I}}}} = {{k}_{{\text{I}}}}X,\,\,\,{\text{в}}\,\,{\text{области}}\,\,{\text{I}}{\kern 1pt} :0 \leqslant X \leqslant {{X}_{{\text{I}}}}; \\ {{Y}_{{{\text{I}} - {\text{II}}}}} = a{{X}^{2}} + bX + c,\,\,\,{\text{в}}\,\,{\text{области}}\,\,{\text{II}}{\kern 1pt} :{{X}_{{\text{I}}}} < X < {{X}_{{{\text{II}}}}}; \\ {{Y}_{{{\text{II}}}}} = {{k}_{{{\text{II}}}}}X + {{\ell }_{{{\text{II}}}}},\,\,{\text{в}}\,\,{\text{области}}\,\,{\text{III}}{\kern 1pt} :{{X}_{{{\text{II}}}}} \leqslant X \leqslant {{X}_{{{\text{III}}}}}; \\ {{Y}_{{{\text{II}} - {\text{III}}}}} = d{{X}^{2}} + eX + f,\,\,\,{\text{в}}\,\,{\text{области}}\,\,{\text{IV}}{\kern 1pt} :{{X}_{{{\text{III}}}}} < X < {{X}_{{{\text{IV}}}}}; \\ {{Y}_{{{\text{III}}}}} = {{k}_{{{\text{III}}}}}X + {{\ell }_{{{\text{III}}}}},\,\,\,{\text{в}}\,\,{\text{области}}\,\,{\text{V}}{\kern 1pt} :{{X}_{{{\text{IV}}}}} \leqslant X \leqslant {{X}_{{\text{V}}}}. \\ \end{gathered} \right.$С учетом восьми условий гладкой “сшивки” на границах промежутков из 15-элементного множества варьируемых параметров ℬ3-модели {XI, XII, XIII, XIV, kI, kII, kIII, ${{\ell }_{{{\text{II}}}}}$, ${{\ell }_{{{\text{III}}}}}$, a, b, c, d, e, f} остается семь свободно варьируемых параметров. В качестве таковых естественно выбрать границы “линейных участков” и угловые коэффициенты для этих участков. Оставшиеся параметры модели выражаются через указанные семь свободно варьируемых параметров {XI, XII, XIII, XIV, kI, kII, kIII}. Соответствующие соотношения могут быть получены путем несложных преобразований и не приведены здесь для краткости. Свободно варьируемые параметры были определены методом наименьших квадратов (МНК) с применением соответствующей процедуры электронной таблицы MS Excel. Вычисление зависимости Y(X) и ее производной Y'(X) выполнено с помощью созданной автором процедуры на языке VBA для MS Excel. Минимизируемый функционал представлял собой остаточную сумму квадратов отклонений в каждой “эмпирической” точке xi:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Корреляционная зависимость β(Cp) для KCl приведена на рис. 4. Символы соответствуют трендовым значениям CP(T) и β(T), взятым в соответствующих температурных точках. В качестве ошибок приведены стандартные отклонения свойств в каждой точке. Отчетливо видно, что корреляционная зависимость β(Cp) с весьма высокой точностью (для всех трех линейных участков квадрат коэффициента линейной корреляции R2 > 0.9999) может быть действительно представлена совокупностью трех гладко сопряженных линейных участков. МНК-оценки свободно варьируемых параметров модели приведены в табл. 3. По температурной шкале участок I приблизительно соответствует промежутку 0 < T < 11 К; участок II – диапазону 35–100 К; участок III – 400 К < T < Tm.
Рис. 4.
Корреляционная зависимость β(Cp) для KCl: сплошная линия – расчет в рамках ℬ3-модели, прямые – линейные тренды (планки погрешностей – стандартные отклонения Cp(T) и β(T) в каждой температурной точке).
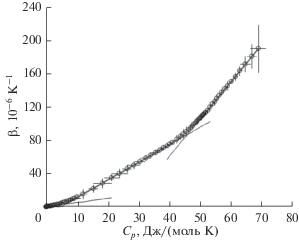
Таблица 3.
МНК-оценки свободно варьируемых параметров ℬ3-модели для твердого KCl (границы Cp,j линейных участков даны в Дж/(моль К), угловые коэффициенты kj – в 10–6 моль/Дж)
| Cp, I | Cp, II | Cp, III | Cp, IV | kI | kII | kIII |
|---|---|---|---|---|---|---|
| 0.4592 | 12.1851 | 38.3335 | 53.4152 | 0.4872 | 2.1257 | 4.4918 |
Температурная зависимость дифференциального параметра Грюнайзена γ'(T) = V(0)K(0)$\frac{{\partial {\beta }(T)}}{{\partial {{C}_{p}}(T)}}$ приведена на рис. 5 в сопоставлении с имеющимися первичными данными по термодинамическому параметру Грюнайзена γ = βVK/CV. В последнем соотношении изохорическая молярная теплоемкость CV(T) была найдена из изобарической теплоемкости Cp(T) с помощью соотношения CV = Cp – Tβ2VK. Тренд температурной зависимости изотермического модуля всестороннего сжатия, необходимый для расчетов, был получен путем усреднения и сглаживания первичных данных по упругим свойствам KCl. В частности, получена оценка K(0) = 19.53 ± 0.48 ГПа.
Рис. 5.
Температурные зависимости параметра Грюнайзена γ(T) и дифференциального параметра Грюнайзена γ'(T) для KCl: символы – первичные данные, линии – расчет, сплошная линия – расчет γ' в рамках ℬ3-модели, пунктир – расчет γ = βVK/CV.
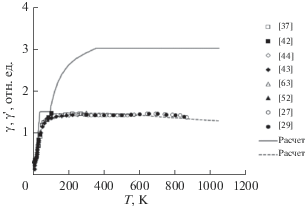
Из рис. 5 видно, что ниже ~100 К согласие в величине и характере температурного поведения параметров Грюнайзена γ'(T) и γ(T) удовлетворительно. Как и термодинамический параметр Грюнайзена, дифференциальный параметр Грюнайзена постоянен при самых низких температурах γ'(0 < T < 10 К) = 0.348; затем быстро возрастает, после чего принимает постоянное значение γ'(40 < T < 100 К) = 1.520. При дальнейшем повышении температуры дифференциальный параметр Грюнайзена γ'(T) вновь растет и значительно превышает термодинамический параметр Грюнейзена γ(T), становясь выше 400 К равным γ'(400 < T < Tm) = 3.212. Для сравнения укажем некоторые независимые определения параметра Грюнайзена для KCl. Согласно [37], параметр Грюнайзена приблизительно монотонно возрастает от γ(30 К) = 0.70 до γ(270 К) = 1.46. При самых низких температурах параметр γ0 = γ(T → 0) лежит в диапазоне 0.33–0.35 [52]; согласно [44], параметр Грюнайзена монотонно возрастает от γ0 = 0.32 ± ± 0.02 до γ(283) = 1.45. Согласно [42], параметр γ изменяется от γ(30) = 0.84 до γ(104) = 1.47. Согласно высокотемпературным расчетам [27], температурное поведение параметра Грюнайзена немонотонно; в области 294–865 К он слабо изменяется с температурой, оставаясь в диапазоне 1.38–1.46. Согласно [63], γ(25°C) = 1.48 ± 0.05.
Стандартные термодинамические функции KCl вплоть до точки плавления были вычислены по известным термодинамическим формулам на основании трендовых значений Cp(T) (табл. 1). Сравнение базовых молярных термодинамических функций (теплоемкость $C_{p}^{^\circ }$(Tref), энтропия S°(Tref) и изменение энтальпии ΔH°(Tref, 0) = = H°(Tref) – H°(0)) твердого хлорида калия при стандартной температуре Tref = 298.15 К и давлении с результатами других авторов проведено в табл. 2. Видно, что согласие в значениях $C_{p}^{^\circ }$(Tref), S°(Tref) и ΔH°(Tref, 0) из настоящей работы и литературных данных хорошее. Рекомендуемые значения термодинамических функций твердого KCl даны в табл. 4.
Таблица 4.
Стандартные молярные термодинамические функции твердого KCl: изменение энтальпии ΔH° ≡ ≡ ΔH°(Tref, T), энтропия S°(T) и приведенный потенциал Гиббса Φ°(T) (S° и Φ° в Дж/(моль К), ΔH° в кДж/моль; Tref = 298.15 К)
| T, K | ΔH° | S° | Φ° | T, K | ΔH° | S° | Φ° | T, K | ΔH° | S° | Φ° |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | –11.361 | 0.000103 | 2.57 × 10–5 | 60 | –10.752 | 14.88 | 4.73 | 250 | –2.443 | 73.60 | 37.93 |
| 2 | –11.361 | 0.000821 | 0.000205 | 65 | –10.615 | 17.07 | 5.60 | 260 | –1.940 | 75.57 | 39.34 |
| 3 | –11.361 | 0.00278 | 0.000681 | 70 | –10.468 | 19.25 | 6.49 | 270 | –1.435 | 77.48 | 40.72 |
| 4 | –11.361 | 0.00659 | 0.00161 | 75 | –10.311 | 21.42 | 7.42 | 280 | –0.928 | 79.33 | 42.06 |
| 5 | –11.361 | 0.0130 | 0.00310 | 80 | –10.145 | 23.56 | 8.36 | 290 | –0.418 | 81.12 | 43.38 |
| 6 | –11.361 | 0.0226 | 0.00541 | 85 | –9.971 | 25.67 | 9.32 | 300 | 0.095 | 82.85 | 44.67 |
| 7 | –11.361 | 0.0363 | 0.00868 | 90 | –9.790 | 27.74 | 10.28 | 310 | 0.610 | 84.54 | 45.93 |
| 8 | –11.361 | 0.0550 | 0.0131 | 95 | –9.603 | 29.77 | 11.26 | 320 | 1.127 | 86.18 | 47.16 |
| 9 | –11.360 | 0.0795 | 0.0190 | 100 | –9.409 | 31.75 | 12.23 | 350 | 2.690 | 90.86 | 50.71 |
| 10 | –11.360 | 0.111 | 0.0264 | 110 | –9.008 | 35.57 | 14.18 | 400 | 5.332 | 97.93 | 56.20 |
| 12 | –11.359 | 0.198 | 0.0470 | 120 | –8.590 | 39.21 | 16.12 | 450 | 8.014 | 104.26 | 61.21 |
| 14 | –11.358 | 0.324 | 0.0768 | 130 | –8.159 | 42.66 | 18.03 | 500 | 10.733 | 109.99 | 65.81 |
| 15 | –11.356 | 0.404 | 0.0958 | 140 | –7.717 | 45.94 | 19.91 | 550 | 13.489 | 115.26 | 70.08 |
| 16 | –11.355 | 0.494 | 0.118 | 150 | –7.266 | 49.05 | 21.75 | 600 | 16.282 | 120.12 | 74.05 |
| 18 | –11.351 | 0.713 | 0.171 | 160 | –6.807 | 52.01 | 23.55 | 650 | 19.115 | 124.66 | 77.78 |
| 20 | –11.346 | 0.983 | 0.238 | 170 | –6.341 | 54.84 | 25.31 | 700 | 21.991 | 128.93 | 81.28 |
| 25 | –11.325 | 1.90 | 0.472 | 180 | –5.869 | 57.54 | 27.03 | 750 | 24.913 | 132.96 | 84.60 |
| 30 | –11.290 | 3.16 | 0.810 | 190 | –5.392 | 60.12 | 28.71 | 800 | 27.889 | 136.80 | 87.74 |
| 35 | –11.239 | 4.73 | 1.25 | 200 | –4.910 | 62.60 | 30.34 | 850 | 30.927 | 140.49 | 90.74 |
| 40 | –11.171 | 6.53 | 1.79 | 210 | –4.423 | 64.97 | 31.93 | 900 | 34.038 | 144.05 | 93.60 |
| 45 | –11.088 | 8.50 | 2.43 | 220 | –3.933 | 67.25 | 33.49 | 950 | 37.230 | 147.50 | 96.35 |
| 50 | –10.989 | 10.57 | 3.14 | 230 | –3.439 | 69.45 | 35.01 | 1000 | 40.518 | 150.87 | 98.99 |
| 55 | –10.877 | 12.71 | 3.91 | 240 | –2.943 | 71.56 | 36.48 | Tm | 43.503 | 153.79 | 101.24 |
На рис. 6 показана температурная зависимость изобарной молярной теплоемкости Cp(T) хлорида калия и масштабированное отклонение ΔCp(T) = = Cp(T) – Cp,trend(T) наиболее представительных данных разных авторов от трендовых значений теплоемкости Cp,trend(T). Видно, что расчетная температурная зависимость Cp(T) настоящей работы во всем температурном диапазоне твердого состояния KCl находится во вполне удовлетворительном согласии с калориметрическими данными других авторов, за исключением устаревших и явно заниженных справочных данных [17]. Вместе с тем, с приближением к точке плавления отклонение ΔCp(T) возрастает, свидетельствуя о необходимости уточнения кривой Cp(T) в области предплавления с использованием современных экспериментальных методик. Ненадежность высокотемпературных измерений Cp(T) влечет за собой снижение уровня достоверности оценки вакансионных вкладов в термодинамические свойства KCl.
Рис. 6.
Температурная зависимость изобарной молярной теплоемкости Cp(T) хлорида калия и масштабированное отклонение ΔCp(T) = Cp(T) – Cp,trend(T) (помечено штрихом) данных разных авторов от трендовых значений теплоемкости: для Cp(T) сплошная линия – тренд, символы – первичные данные; для ΔCp(T) – пунктир с символами (отклонение ΔCp для данных [17] не масштабировано).
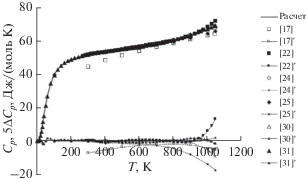
Анализ температурных зависимостей молярных энтропии S°(T) и изменения энтальпии ΔH°(Tref, T) = H°(T) – H°(Tref) KCl и масштабированных отклонений ΔS°(T) = S°(T) – $S_{{trend}}^{^\circ }$(T) и Δ(ΔH°(Tref, T)) = ΔH°(Tref, T) – $\Delta H_{{trend}}^{^\circ }$ (Tref, T) разных данных от трендовых значений свойств привел в целом к тем же заключениям, что и при анализе теплоемкости.
ЗАКЛЮЧЕНИЕ
В работе проведено изучение корреляционной зависимости β(Cp) теплоемкости Cp(T) и КОТР β(T) хлорида калия во всей области твердого состояния вещества – от T = 0 до Tm = 1044 К. Установлено, что с высокой точностью корреляционная зависимость β(Cp) хлорида калия может быть описана трехлинейной модельной зависимостью (модель ℬ3ℳ), которая представляет собой совокупность трех последовательных гладко (квадратично) сопряженных линейных участков. Удобным инструментом описания корреляции β(Cp) является дифференциальный параметр Грюнайзена γ'(T) = V(0) K(0) $\frac{{\partial {\beta }(T)}}{{\partial {{C}_{p}}(T)}},$ температурная зависимость которого имеет характерный трехступенчатый вид. При низких температурах значения γ'(T) и γ(T) близки, однако при температурах выше комнатной, где молярная теплоемкость KCl превосходит классический предел 6R Дюлонга и Пти, дифференциальный параметр Грюнейзена γ'(T) быстро возрастает и выше 400 К достигает постоянного уровня, более чем вдвое превышая γ(T > 400 К).
Установлены и табулированы взаимоcогласованные значения ряда термодинамических функций KCl. Вычисленные во всей области твердого состояния вещества значения термодинамических функций находятся в согласии с современными литературными данными. Вместе с тем, расчет по модели ℬ3ℳ позволил четко выявить те области, где данные нуждаются в уточнении. Модель ℬ3ℳ практична и представляет собой удобный инструмент верификации данных по одному недостаточно изученному свойству, если другое изучено хорошо.
Результативное применение трехлинейной корреляционной модели ℬ3ℳ позволяет утверждать, что модель может быть применена и для других подобных веществ, характеризующихся низкотемпературными особенностями в поведении термодинамических свойств. Для таких веществ характерны необычно сильные изменения температуры Дебая Θ(T) и параметра Грюнейзена γ(T); коэффициент теплового расширения таких веществ в некоторых случаях может стать отрицательным, возможно изменение типа кристаллической структуры веществ и т.п.
Выраженная зависимость Θ(T) свидетельствует о существенных изменениях в динамическом фононном спектре вещества с температурой, что может быть отражением изменений в характере межатомных взаимодействий. Следствием этих изменений могут быть различные физические проявления. Так, в твердой ртути [10], где наблюдается немонотонная зависимость Θ(T), кристаллическая решетка претерпевает аллотропное низкотемпературное α ↔ β-превращение, а на кривой корреляционной зависимости β(Cp) появляется дополнительный излом. Вероятные изменения в характере межатомных взаимодействий в кремнии и германии, находящие отражение в острых минимумах на кривых Θ(T), недостаточны для изменения типов кристаллических решеток Si и Ge, но приводят к отрицательным минимумам в температурных зависимостях β(T) и γ(T) (см., например, [70–73]). Авторы [73], основываясь на данных проведенных ими экспериментов по неупругому рассеянию нейтронов на монокристаллическом кремнии, объяснили отрицательный ниже ~120 К коэффициент теплового расширения Si проявлением ангармонических ядерных квантовых эффектов. Можно предполагать, что как в [10] для Hg, так и в настоящей работе для KCl, вероятные изменения характера межатомных взаимодействий, находящие отражение в особенностях поведения Θ(T), приводят к появлению дополнительного излома на корреляционной зависимости β(Cp). По-видимому, такого же эффекта следует ожидать и от других веществ с немонотонным поведением Θ(T) – кремния, германия, других галогенидов щелочных металлов и др. Систематической проверке справедливости сформулированной гипотезы автор намерен посвятить последующие работы.
Список литературы
Bodryakov V.Yu. Bi-Linear Model of Correlation between Heat Capacity and Volume Thermal Expansivity of Solids as a Novel Tool for Evaluation the Reliable Numerical Data for Purposes of Chemical Thermodynamics. Application to Rare Gas Solids. Hauppauge (N.Y.): Nova Science, 2018. 180 p.
Бодряков В.Ю. О корреляции коэффициента теплового расширения и теплоемкости криокристалла аргона // ФТТ. 2014. Т. 56. № 11. С. 2279–2285.
Бодряков В.Ю. Корреляция коэффициента теплового расширения и теплоемкости криокристалла инертного газа: криптон // ЖТФ. 2015. Т. 85. Вып. 3. С. 65–68.
Бодряков В.Ю. О корреляции коэффициента теплового расширения и теплоемкости криокристалла инертного газа ксенона // Неорган. материалы. 2015. Т. 51. № 2. С. 213–217.
Бодряков В.Ю. О корреляции температурных зависимостей теплового расширения и теплоемкости вплоть до точки плавления тугоплавкого металла: молибден // ТВТ. 2014. Т. 52. № 6. С. 863–869.
Бодряков В.Ю. Корреляция температурных зависимостей теплового расширения и теплоемкости вплоть до точки плавления тантала // ТВТ. 2016. Т. 54. № 3. С. 336–342.
Бодряков В.Ю. О корреляции температурных зависимостей теплового расширения и теплоемкости вплоть до точки плавления тугоплавкого металла: Вольфрам // ТВТ. 2015. Т. 53. № 5. С. 676–682.
Bodryakov V.Yu. A Bi-Linear Model of the Correlation between Heat Capacity and Volume Thermal Expansivity of Refractories as a Novel Tool for the Evaluation of the Reliable Numerical Data for Chemical and Physical Thermodynamics. Ch. 3. Grounds and Modelling. Ch. 4. Application to Periclase and Corundum // Bodryakov V.Yu., Belgacem S., Gregorová E. et al. Refractory Materials. Characteristic Properties and Uses / Ed. Bryant C. Hauppauge (N.Y.): Nova Science, 2018. 238 p.
Bodryakov V.Yu. Specific Heat and Thermal Expansion of Refractory Nonmetal: CaO // Open Sci. J. Mod. Phys. 2015. V. 2. № 4. P. 50–54.
Бодряков В.Ю., Бабинцев Ю.Н. Совместный анализ теплоемкости и теплового расширения твердой ртути // ФТТ. 2015. Т. 57. № 6. С. 1240–1244.
Southard J.C., Nelson R.A. Low Temperature Specific Heats. IV. The Heat Capacities of Potassium Chloride, Potassium Nitrate and Sodium Nitrate // J. Am. Chem. Soc. 1933. V. 55. № 12. P. 4865–4869.
Keesom W.H., Clark C.W. The Heat Capacity of Potassium Chloride from 2.3 to 17 K // Physica. 1935. V. 2. № 1. P. 698–706.
Clusius K., Goldmann J., Perlick A. Ergebnisse der Tieftemperatur-forschung. VII. Die Molwärmen der Alkalihalogenide LiF, NaCl, KCl, KBr, KJ, RbBr und RbJ von 10° bis 273° abs // Z. Naturforsch. 1949. Band 4a. Heft 6. S. 424–432.
Keesom P.H., Pearlman N. The Heat Capacity of KCl below 4 K // Phys. Rev. 1953. V. 91. № 6. P. 1354.
Webb F.J., Wilks J. The Measurement of Lattice Specific Heats at Low Temperatures Using a Heat Switch // Proc. R. Soc. Lond. A. 1955. V. 230. № 1183. P. 549–559.
Berg W.T., Morrison J.A. The Thermal Properties of Alkali Halide Crystals. I. The Heat Capacity of Potassium Chloride, Potassium Bromide, Potassium Iodide and Sodium Iodide between 2.8 and 270 K // Proc. Royal Soc. London. A. 1957. V. 242. № 1231. P. 467–477.
Kelley K.K. Contributions to the Data on Theoretical Metallurgy. XIII. High Temperature Heat Content, Heat Capacity and Entropy Data for the Elements and Inorganic Compounds. Washigton: US Government printing office, 1960. 232 p.
Kirkham A.J., Yates B. The Adiabatic Measurement of the Specific Heats of Potassium Chloride and Rubidium Chloride at Low Temperatures // Cryogenics. 1968. V. 8. № 6. P. 381–385.
Leadbetter A.J., Settatree G.R. Anharmonic Effects in the Thermodynamic Properties of Solids. IV. The Heat Capacities of NaCl, KCl and KBr between 30 and 500°C // J. Phys. C: Solid State Phys. 1969. V. 2. № 3. P. 385–392.
Touloukian Y.S., Buyco E.H. Thermophysical Properties of Matter. V. 5. Specific Heat – Nonmetallic Solids. N.Y., Washington: IFI/Plenum, 1970. 1737 p.
Thompson W.T., Flengas S.N. Drop Calorimetric Measurements on Some Chlorides, Sulfides, and Binary Melts // Can. J. Chem. 1971. V. 49. № 9. P. 1550–1563.
Douglas T.B., Harman A.W. Measured Enthalpy and Derived Thermodynamic Properties of Crystalline and Liquid Potassium Chloride, KCl, from 273 to 1174 K // J. Res. NBS. 1974. V. 78A. № 4. P. 515–529.
Новицкий Л.А., Кожевников И.Г. Теплофизические свойства материалов при низких температурах. Справ. изд. М.: Машиностроение, 1975. 216 с.
Robie R.A., Hemingway B.S., Fisher J.R. Thermodynamic Properties of Minerals and Related Substances at 298.15 K (25°C) and One Atmosphere (1.013 Bars) Pressure and at Higher Temperatures. U.S. Geological Survey Bulletin. 1452. Washington: US Government Printing Office, 1979. 456 p.
Гурвич Л.В., Вейц И.В., Медведев В.А. и др. Термодинамические свойства индивидуальных веществ. Справочное издание. В 4-х томах. Т. IV. М.: Наука, 1982. Кн. 1. 623 с.; Кн. 2. 560 с.
El-Sharkawy A.A., Rashed I.H., Zaghloul M.S., Ghoniem M.H. Study of Thermal Properties of Polycrystalline KCl, KBr, and KI in the Temperature Range 300 to 600 K // Phys. Status. Solidi A. 1984. V. 86. № 2. P. 429–434.
Yamamoto S., Anderson O.L. Elasticity and Anharmonicity of Potassium Chloride at High Temperature // Phys. Chem. Miner. 1987. V. 14. № 4. P. 332–340.
Физические величины. Справ. изд. / Под ред. Григорьева И.С., Мейлихова Е.З. М.: Энергоатомиздат, 1991. 1232 с.
Anderson O.L. Equations of State of Solids for Geophysics and Ceramic Sciences. Oxford Monographs on Geology and Geophysics. 1995. № 31. 405 p.
Chase M.W. NIST-JANAF Thermochemical Tables // J. Phys. Chem. Ref. Data. 1998. Monograph 9. P. 1–1951.
Archer D.G. Thermodynamic Properties of the KCl + H2O System // J. Phys. Chem. Ref. Data. 1999. V. 28. № 1. P. 1–16.
Sirdeshmukh D.B., Sirdeshmukh L., Subhadra K.G. Thermal Properties // Alkali Halides. Springer Series in Materials Science. Berlin; Heidelberg: Springer, 2001. V. 49. P. 51–101.
DDBST GmbH. Dortmund Data Bank (Online Services) // URL: http://www.ddbst.com/en/EED/PCP/HCP_ C4577.php
Hutchison D.A. Density of Potassium Chloride // Phys. Rev. 1944. V. 66. № 5–6. P. 144.
Combes L.S., Ballard S.S., McCarthy K.A. Mechanical and Thermal Properties of Certain Optical Crystalline Materials // J. Opt. Soc. Am. 1951. V. 41. № 4. P. 215–222.
Srinivasan R. Thermal Expansion of Sodium and Potassium Chlorides from Liquid-Air Temperatures to +300°C // J. Ind. Inst. Sci. Sect. A. 1955. V. 37. № 4. P. 232–241.
Yates B., Panter C.H. Thermal Expansion of Alkali Halides at Low Temperatures // Proc. Phys. Soc. London. 1962. V. 80. № 2. P. 373–382.
Rubin T., Johnston H.L., Altman H.W. The Thermal Expansion of Potassium Chloride // J. Phys. Chem. 1962. V. 66. № 5. P. 948–950.
Enck F.D., Engle D.G., Marks K.I. Thermal Expansion of KCl at Elevated Temperatures // J. Appl. Phys. 1962. V. 33. № 6. P. 2070–2072.
Whittemore D.O. Thermal Expansion of Polycrystalline Alkali Halides // Bull. Am. Ceram. Soc. 1962. V. 41. № 8. P. 513–515.
Trost K.F. Die thermische Ausdehnung der Alkalihalogenide vom NaCl-Typ bei hohen und tiefen Temperaturen // Z. Naturforsch. B. 1963. B. 18b. H. 8. S. 662–664.
Schuele D.E., Smith C.S. Low Temperature Thermal Expansion of RbI // J. Phys. Chem. Solids. 1964. V. 25. № 8. P. 801–814.
Meincke P.P.M., Graham G.M. The Thermal Expansion of Alkali Halides // Can. J. Phys. 1965. V. 43. № 10. P. 1853–1866.
White G.K. The Thermal Expansion of Alkali Halides at Low Temperatures // Proc. Roy. Soc. Lond. A. 1965. V. 286. № 1405. P. 204–217.
Von Guerard B., Peisl H., Waidelich W. Equilibrium Vacancy Concentration in KCl // Phys. Status. Solidi B. 1968. V. 29. № 1. P. K59–K61.
Leadbetter A.J., Newsham D.M.T. Anharmonic Effects in the Thermodynamic Properties of Solids III. A Liquid Gallium Immersion Dilatometer for the Range 50–700°C: Thermal Expansivities of Hg, Ga, NaCl and KCl // J. Phys. C. 1969. V. 2. № 2. P. 210–219.
Pathak P.D., Vasavada N.G. Thermal Expansion of NaCl, KCl and CsBr by X-ray Diffraction and the Law of Corresponding States // Acta Crystallogr., Sect. A. 1970. V. 26. № 6. P. 655–685.
Awad F.G., Gugan D. The Thermal Expansion of Copper, Aluminum, Potassium Chloride, and Potassium Iodide between 10 and 80 K // Cryogenics. 1971. V. 11. № 5. P. 414–415.
Rapp J.E., Merchant H.D. Thermal Expansion of Alkali Halides from 70 to 570 K // J. Appl. Phys. 1973. V. 44. № 9. P. 3919–3923.
Botaki A.A., Gyrbu I.N., Ivankina M.S., Pozdeeva É.V., Sharko A.V. Temperature Dependence of the Elastic Constants of a KCl-NaCl Solid Solution // Sov. Phys. J. 1973. V. 16. № 10. P. 1441–1443.
Srivastava K.K., Merchant H.D. Thermal Expansion of Alkali Halides above 300 K // J. Phys. Chem. Solids. 1973. V. 34. № 12. P. 2069–2073.
White G.K., Collins J.G. The Thermal Expansion of Alkali Halides at Low Temperatures. II. Sodium, Rubidium and Caesium Halides // Proc. Roy. Soc. Lond. A. 1973. V. 333. № 1593. P. 237–259.
Touloukian Y.S., Kirby R.K., Taylor R.E., Lee T.Y.R. Thermophysical Properties of Matter. V. 13. Thermal expansion – Nonmetallic Solids. N.Y., Washington: IFI/Plenum, 1977. 1786 p.
Venudhar Y.C., Iyengar L., Krishna Rao K.V. Thermal Expansion and Debye Temperatures of KCl-KBr Mixed Crystals by an X-ray Method // J. Mater. Sci. 1986. V. 21. № 1. P. 110–116.
Kumar M., Upadhyay S.P. Analysis of the Thermal Expansion Coefficient and Its Temperature Dependence for Alkali Halides // Phys. Status Solidi B. 1994. V. 181. № 1. P. 55–61.
Fang Zh.-H. Temperature Dependence of Volume Thermal Expansion for NaCl and KCl Crystals // Physica B. 2005. V. 357. № 3–4. P. 433–438.
Srivastava S.K., Sinha P., Panwar M. Thermal Expansivity and Isothermal Bulk Modulus of Ionic Materials at High Temperatures // Indian J. Pure Appl. Phys. 2009. V. 47. P. 175–179.
Durand M.A. The Temperature Variation of the Elastic Moduli of NaCl, KCl and MgO // Phys. Rev. 1936. V. 50. № 5. P. 449–455.
Norwood M.H., Briscoe C.V. Elastic Constants of Potassium Iodide and Potassium Chloride // Phys. Rev. 1958. V. 112. № 1. P. 45–48.
Karo A.M. Lattice Vibrations in Alkali Halide Crystals. II. Potassium and Rubidium Halides; Cesium Fluoride // J. Chem. Phys. 1960. V. 33. № 1. P. 7–20.
Enck F.D. Behavior of the Principal Elastic Moduli and Specific Heat at Constant Volume of KCl at Elevated Temperatures // Phys. Rev. 1960. V. 119. № 6. P. 1873–1877.
Slagle O.D., McKinstry H.A. Temperature Dependence of the Elastic Constants of the Alkali Halides. I. NaCl, KCl, and KBr // J. Appl. Phys. 1967. V. 38. № 2. P. 437–446.
Decker D.L. High-Pressure Equation of State for NaCl, KCl, and CsCl // J. Appl. Phys. 1971. V. 42. № 8. P. 3239–3244.
Madan M.P. Temperature Dependence of the Bulk Modulus of Alkali Halides // J. Appl. Phys. 1971. V. 42. № 10. P. 3888–3893.
Benckert L., Bäckström G. Elastic Constants of KCl and NaCl from Brillouin Scattering // Phys. Scr. 1975. V. 11. № 1. P. 43–46.
Кучин В.А., Ульянов В.Л. Упругие и неупругие свойства кристаллов. М.: Энергоатомиздат, 1986. 136 с.
Kumar M. Temperature Dependence of Interatomic Separation and Bulk Modulus for Ionic Solids // Phys. B: Condens. Matter. 1995. V. 205. № 2. P. 175–179.
Vijay A., Verma T.S. Analysis of Temperature Dependence of Elastic Constants and Bulk Modulus for Ionic Solids // Phys. B: Condens. Matter. 2000. V. 291. № 3–4. P. 373–378.
Singh M., Singh P.P., Gupta B.R., Kumar M. Temperature and Pressure Dependence of Elastic Constants // High Temp. – High Press. 2001. V. 33. № 2. P. 199–206.
Бодряков В.Ю., Повзнер А.А. Самосогласованное термодинамическое описание неметаллического неферромагнитного твердого тела на примере кремния // ТВТ. 2004. Т. 42. № 4. С. 563–571.
Бодряков В.Ю., Повзнер А.А. Описание термодинамических свойств неметаллического твердого тела в рамках самосогласованного термодинамического подхода (на примере германия) // ФТТ. 2003. Т. 45. №. 7. С. 1196–1201.
Бодряков В.Ю. Комплексное исследование влияния решеточного и магнитного ангармонизма на термодинамические свойства твердых тел: Дис. … докт. физ.-мат. наук. Екатеринбург. 2005. 500 с.
Kim D.S., Hellman O., Herriman J., Smith H.L., Lin J.Y.Y., Shulumba N., Niedziela J.L., Li C.W., Abernathy D.L., Fultz B. Nuclear Quantum Effect with Pure Anharmonicity and the Anomalous Thermal Expansion of Silicon // PNAS. 2018. V. 115. № 9. P. 1992–1997.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


