Неорганические материалы, 2020, T. 56, № 7, стр. 738-745
Синтез и свойства марганецсодержащих кальцийфосфатных материалов
И. В. Фадеева 1, *, А. С. Фомин 1, С. М. Баринов 1, Г. А. Давыдова 2, И. И. Селезнева 2, И. И. Преображенский 3, М. К. Русаков 4, А. А. Фомина 1, В. А. Волченкова 1
1 Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук
119991 Москва, Ленинский пр., 49, Россия
2 Институт теоретической и экспериментальной биофизики Российской академии наук
142290 Московская обл., Пущино, Институтская ул., 3, Россия
3 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
4 МИРЭА – Российский технологический университет, Институт тонких химических технологий
им. М.В. Ломоносова
119571 Москва, пр. Вернадского, 86, Россия
* E-mail: fadeeva_inna@mail.ru
Поступила в редакцию 26.08.2019
После доработки 26.11.2019
Принята к публикации 27.12.2019
Аннотация
Исследованы марганецсодержащие фосфаты кальция с различными содержанием марганца и соотношением фаз. При содержании марганца 0.15 мас. % содержание фазы витлокита ~90 мас. %, фазы пирофосфата кальция ~10 мас. %. При повышении содержания марганца до 1.49 мас.% содержание фазы витлокита ~70 мас. %, фазы пирофосфата кальция ~30 мас. %. Методом ИК-спектроскопии показано, что образцы, прокаленные при 400°С, обладают структурой апатита, тогда как повышение температуры прокалки до 900°С приводит к формированию структуры витлокита и пирофосфата кальция. Интенсификация процесса спекания начинается в интервале температур 920–1050°С. Повышение температуры обжига до 1200°С приводит к формированию плотноспеченной структуры с оплавленными участками и средним размером зерна 15–25 мкм. Увеличение содержания марганца в образцах приводит к снижению размера зерна полученной керамики. По результатам исследований цитотоксических свойств установлено, что все образцы не являются цитотоксичными, поддерживают пролиферацию и распластывание клеток. Увеличение концентраций пирофосфата кальция, а также марганца в образцах не оказывает влияния на их цитотоксичность. Полученные порошки и керамики из них могут быть основой для создания новых материалов для инженерии костной ткани.
ВВЕДЕНИЕ
Рост продолжительности жизни приводит к росту возрастных заболеваний костной ткани, таких как остеопороз, остеомиелит, остеосаркома и др., что ставит перед материаловедами и медиками задачу разработки новых материалов для их лечения. Фосфаты кальция являются основным минеральным компонентом костной ткани, поэтому гидроксиапатит (ГА, Ca10(PO4)6(OH)2), трикальцийфосфат (ТКФ, Ca3(PO4)2), пирофосфат кальция (ПФК, Ca2P2O7) и ряд других соединений наиболее часто используются для создания новых материалов для восстановления поврежденной костной ткани [1].
Катионные замещения в кристаллической структуре фосфатов кальция являются эффективным способом модификации их свойств [2]. Среди множества элементов интерес представляют и ионы марганца. Несмотря на то что в состав костной ткани ионы Mn2+ входят в микроколичествах (менее 0.1 мас. %), они влияют на рост и метаболизм костных тканей [3]. Ранее было показано, что подобные материалы обладают большим потенциалом для регенерации костных и хрящевых тканей [4]. Известно, что изоморфные замещения в структуре фосфатов кальция приводят к увеличению растворимости полученных соединений за счет возникновения локальных дефектов в решетке [5].
Настоящее исследование посвящено изучению физико-химических и биологических свойств марганецсодержащих фосфатов кальция.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Марганецсодержащие фосфаты кальция синтезировали с применением механоактивации из исходных реагентов: оксида кальция, ацетата марганца и двухзамещенного фосфата аммония, по методике, описанной ранее [6]. Для синтеза использовали свежепрокаленный при 900°С оксид кальция, тетрагидрат ацетата марганца, двухзамещенный фосфат аммония. Соотношение реагентов подбиралось из расчета (Ca + Mn)/P = 1.5. Взаимодействие между реагентами с получением конечного продукта после термообработки можно описать общей схемой
(1)
$\begin{gathered} \left( {3--x} \right){\text{CaO}} + x{\text{Mn}}{{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{COO}}} \right)}_{2}} + \\ + \,\,2{{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{2}}{\text{HP}}{{{\text{O}}}_{4}} \to {\text{C}}{{{\text{a}}}_{{3--x}}}{\text{M}}{{{\text{n}}}_{x}}{{\left( {{\text{P}}{{{\text{O}}}_{4}}} \right)}_{2}}, \\ \end{gathered} $Фазовый состав полученных соединений изучали после термообработки при 900°С в течение 1 ч в муфельной печи с помощью рентгеновского дифрактометра Rigaku D/max-2500 (Япония), в режиме отражения, с использованием CuKα-излучения (λ = 1.5406 Å) в интервале углов 2θ 10°–60°, скорость 3 град/мин. Расшифровку дифрактограмм проводили с помощью программного комплекса Match! Phase Identification from Powder Diffraction (версия 3.8.0.137) с использованием встроенной базы данных COD-Inorg REV214414.
Микроструктуру ТКФ изучали с помощью сканирующего электронного микроскопа Tescan Vega II SBU (Чехия), оснащенного энергодисперсионным спектрометром INCA Energy 300 фирмы Oxford Instruments (Великобритания). Работу осуществляли в режиме действия вторичных электронов (SE), разрешающая способность прибора 3.0 нм (при 30 кэВ), максимальное увеличение до ×300 000, ускоряющее напряжение 1–3 кэВ. Для уменьшения электрического заряда, образующегося на образце при его сканировании пучком электронов с высокой энергией, при помощи напылительной установки Q150R фирмы Quorum Technologies (Великобритания) на поверхность керамики наносили токопроводящее покрытие – золото. Размер зерен керамики определяли методом случайных секущих [7].
ИК-спектры синтезированных соединений получали для образцов в смесях с бромидом калия на спектрометре Nicolet Avatar-330 (Франция) в интервале 400–4000 см–1.
Количественное определение содержания марганца выполняли методом атомно-абсорбционной спектрометрии (пламенным вариантом) на атомно-абсорбционном спектрометре iCE 3500 (Thermo Fisher Scientific, США) (пламя: воздух + ацетилен, длина волны 279.5 нм, щель 0.2 нм).
Процесс усадки материала изучали с помощью дилатометра DIL 402-C Netzsch (Германия). В качестве основной методики изучения поведения керамики при нагреве было выбрано измерение линейных размеров образцов при непрерывном повышении температуры с постоянной скоростью (10 град/мин), в диапазоне tкомн–1200°С.
Образцы керамики получали обжигом дисков в муфельной печи при температурах 1000, 1100 и 1200°С, полученных методом двухстороннего одноосного прессования при удельном давлении 100 МПа.
Исследование цитотоксичности проводили с использованием вытяжек и самих материалов согласно требованиям [8, 9]. В качестве модельной среды для приготовления вытяжек была использована культуральная среда ДМЕМ/F12 с добавлением 100 Ед/мл пенициллин/стрептомицина. Приготовление вытяжек проводилось с соблюдением асептики в течение 72 ч. Отношение массы образца (г) к объему экстрагирующей среды (мл) составило 0.1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
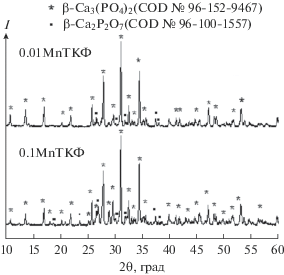
Согласно данным РФА, полученные материалы двухфазны: в случае 0.01MnТКФ содержание фазы витлокита (β-Ca3(PO4)2) составляет ~90 мас. %, фазы ПФК (β-Ca2P2O7) – ~10 мас. %. (рис. 1).
Увеличение содержания марганца в 10 раз привело к увеличению содержания фазы ПФК в 0.1MnТКФ до ~30 мас. % и уменьшению содержания фазы витлокита до ~70 мас. %. Образование фазы ПФК может быть связано с термическим разложением брушита, сформированного в ходе синтеза
(2)
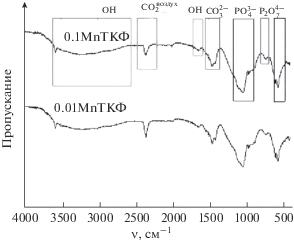
$2{\text{CaHP}}{{{\text{O}}}_{4}} \cdot {\text{ }}2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + 5{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \uparrow .$ИК-спектры снимали для образцов, прокаленных при 400 и 900°С (рис. 2, 3). Отмечено, что в порошках, прокаленных при 400°С, присутствует интенсивный пик при 3570 см–1, а также пик при 632 см–1, которые соответствуют деформационным колебаниям гидроксильной группы [10]. Кроме того, присутствуют колебания, отнесенные к группам ${\text{CO}}_{3}^{{2 - }}$ (1300–1550 см–1) [11]. Также в области 2350 см–1 наблюдаются пики колебаний, отнесенных нами к CO2 из воздуха, появление которых обусловлено особенностями пробоподготовки [12]. Согласно полученным данным, после термообработки при 400°С формируются соединения со структурой апатита.
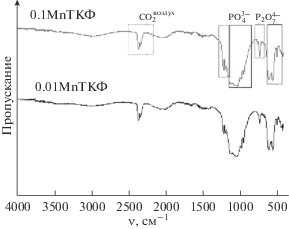
В порошках, прокаленных при 900°С, пики колебаний гидроксильной группы и ${\text{CO}}_{3}^{{2 - }}$ исчезают, что свидетельствует о разрушении апатитовой структуры.
В ИК-спектрах выделены области наиболее интенсивных колебаний, соответствующих группе ${\text{PO}}_{4}^{{3 - }}$ (565, 603 см–1, область при 900–1200 см–1) [13]. С повышением температуры разрешенность этих пиков возрастает.
Кроме того, отмечены интенсивные колебания, отнесенные к группе ${{{\text{P}}}_{{\text{2}}}}{\text{O}}_{7}^{{4 - }}$ (валентные колебания связи P–O–P) [16 ] . При 900°С разрешенность и интенсивность этих пиков возрастает, что свидетельствует о формировании ПФК в виде отдельной фазы. Относительная интенсивность колебаний группы ${{{\text{P}}}_{{\text{2}}}}{\text{O}}_{7}^{{4 - }}$ выше в случае образца с бóльшим содержанием марганца. Этот факт согласуется с результатами, полученными методом РФА.
Возможность вхождения в структуру ТКФ ионов марганца ранее была доказана в [14]. Ионный радиус Mn2+ составляет 0.83 Å, что меньше ионного радиуса кальция (1.0 Å) [3]. В случае рассматриваемых соединений содержание марганца несколько занижено (0.15 мас. %) по сравнению с рассчитанным для предложенной брутто-формулы Ca2.99Mn0.01(PO4)2 (0.18 мас. %), что может быть связано с погрешностью при проведении синтеза. Такая же ситуация наблюдается для образца с бóльшим содержанием марганца: вычисленное для брутто-формулы Ca2.9Mn0.1(PO4)2 значение составляет 1.77 мас. %, в то время как по данным элементного анализа – 1.49 мас. %.
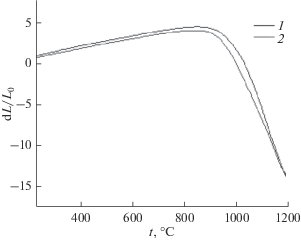
Поведение материалов при нагреве изучали методом дилатометрии (рис. 4). Из полученных кривых непрерывной усадки видно, что интенсивный процесс спекания начинается в интервале 920–1050°С.
Микроструктура скола полученной керамики представлена на рис. 5. В табл. 1 представлены значения средних размеров зерна керамики, определенные методом случайных секущих [7].
Рис. 5.
Микроструктура скола керамики из 0.01MnТКФ (а–в) и 0.1MnТКФ (г–е); температура обжига 1000 (а, г), 1100 (б, д) и 1200°С (в, е).

Таблица 1.
Средний размер зерна керамики
| t, °С | Dср, мкм | |
|---|---|---|
| 0.01MnТКФ | 0.1MnТКФ | |
| 1000 | 8 ± 2 | 8 ± 2 |
| 1100 | 25 ± 4 | 15 ± 3 |
| 1200 | 23 ± 4 | 18 ± 3 |
Образцы, полученные отжигом при 1000°С с выдержкой 1 ч, характеризуются неоднородной структурой; при этом изменения элементного и фазового состава не приводят к изменениям микроструктуры. Присутствуют крупные агломераты размером 5–15 мкм. На сколе видны трещины, что может свидетельствовать о низкой прочности и недоспеченности материала.
С увеличением температуры обжига до 1100°С происходит рост зерна керамики; при этом средний размер зерна для образцов с бóльшим содержанием марганца несколько ниже (табл. 1).
На сколе керамики, обожженной при 1200°С, видны сплошные оплавленные области; такой характер микроструктуры свидетельствует о высокой интенсивности процессов спекания, происходящих в материале, и протекании вторичной рекристаллизации.
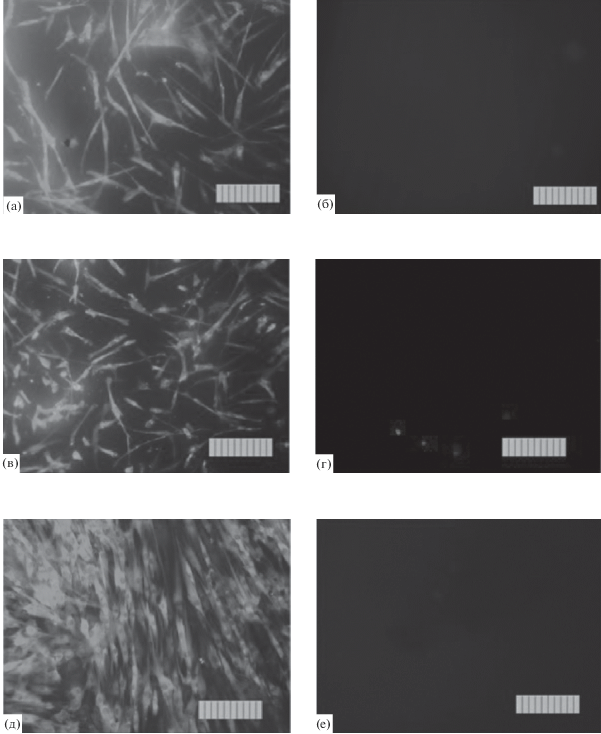
Исследование цитотоксических свойств вытяжек из исследуемых материалов проводилось на первичной культуре мезенхимальных стромальных клеток человека DPSC 32 (5-й пассаж) с использованием МТТ-теста. На всех исследованных образцах наблюдается нормальная морфология клеток DPSC 32 (рис. 6), однако плотность клеточного слоя на вторые сутки после посева на исследуемых образцах несколько ниже, чем в контроле (на покровном стекле), что обусловлено, по-видимому, условиями начальной адгезии клеток. Ранее было исследовано влияние различных количеств ионов марганца на биологические свойства ТКФ, допированных марганцем. Показано, что наилучшая пролиферативная активность остеобластоподобных клеток наблюдается при содержании 1 мол. % марганца [3]. На основании проведенных экспериментов in vitro на трансформированных клетках DPSC (рис. 6) не выявлено существенных различий между образцами керамики из 0.01ТКФ и 0.1MnТКФ. Данный факт может быть связан с тем, что в исследованных образцах керамики содержание марганца слишком мало для выявления его влияния на пролиферацию остеобластоподобных клеток.
Рис. 6.
Внешний вид трансформированных клеток DPSC через 24 ч после посева на поверхности образцов: контроль (а), 0.01MnТКФ (б), 0.1MnТКФ (в).

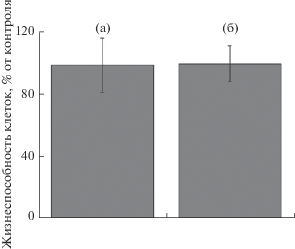
Исследование цитотоксических свойств вытяжек из исследуемых материалов проводилось на клетках линии NCTC (клон L-929) с использованием МТТ-теста. Образцы вытяжек из исследуемых образцов не оказывали угнетающего воздействия на клетки (рис. 7–9).
Рис. 7.
Метаболическая активность клеток по результатам МТТ-теста при инкубации 48 ч c вытяжками из материалов: а – 0.01MnТКФ, б – 0.1MnТКФ.
ЗАКЛЮЧЕНИЕ
Проведено исследование марганецсодержащих фосфатов кальция с различным соотношением фаз. При х = 0.01 содержание фазы витлокита составляет ~90 мас. %, ПФК ~10 мас. %. При повышении содержания марганца (х = 0.1) содержание фазы витлокита ~70 мас. %, ПФК ~30 мас. %. Содержание марганца в образцах составляет ~90 мас. % от заложенного.
Методом ИК-спектроскопии показано, что образцы, прокаленные при 400°С, обладают структурой апатита, тогда как повышение температуры прокалки до 900°С приводит к формированию структуры витлокита и ПФК. Интенсификация процесса спекания начинается в интервале температур 920–1050°С.
Керамика, обожженная при температуре 1000°С, характеризуется недоспеченной структурой скола с трещинами. Повышение температуры обжига до 1100 и 1200°С приводит к формированию плотноспеченной структуры с оплавленными участками и средним размером зерна 15–25 мкм. Увеличение содержания марганца в образцах приводит к снижению размера зерна полученной керамики.
По результатам исследований цитотоксических свойств установлено, что все образцы не являются цитотоксичными, поддерживают пролиферацию и распластывание клеток. Увеличение концентраций ПФК, а также марганца в образцах не оказывает влияния на их цитотоксичность.
Полученные порошки и керамики из них могут быть основой для создания новых материалов для инженерии костной ткани.
Список литературы
Hernigou P., Dubory A., Pariat J., Potage D., Roubineau F., Jammal S., Lachaniette C.F. Beta-Tricalcium Phosphate for Orthopedic Reconstructions as an Alternative to Autogenous Bone Graft // Morphologie. 2017. V. 101. P. 173–179.
Murzakhanov F., Gabbasov B., Iskhakova K., Voloshin A., Mamin G., Biktagirov T., Orlinskii S., Gafurov M., Putlyaev V., Klimashina E., Fadeeva I., Fomin A., Barinov S. Conventional Electron Paramagnetic Resonance for Studying Synthetic Calcium Phosphates with Metal Impurities (Mn2+, Cu2+, Fe3+) // Magn. Reson. Solids. 2017. V. 19. P. 17207.
Vieira S.I., Cerqueira A.R., Pina S., da Cruz Silva O.A.B., Abrantes J.C., Ferreira J.M.F. Effects of Mn-Doping on the Structure and Biological Properties of β-Tricalcium Phosphate // J. Inorg. Biochem. 2014. V. 136. P. 57–66.
Deng C., Yao Q., Feng C., Li J., Wang L., Cheng G., Shi M., Chen L., Chang J., Wu C. 3D Printing of Bilineage Constructive Biomaterials for Bone and Cartilage Regeneration // Adv. Funct. Mater. 2017. V. 27. № 36. P. 1703117.
Солоненко А.П. Исследование влияния условий кристаллизации на физико-химические свойства химически модифицированных фосфатов кальция: Дис. к. х. н. Тюмень. 2014.
Чайкина М.В. Механохимический синтез изоморфных разновидностей апатита в качестве материалов для биокерамики // Физическая мезомеханика. 2004. Т. 7. № 5. С. 101–110.
Салтыков С.А. Стереометрическая металлография. М.: Металлургия, 1976. 272 с.
ГОСТ Р ИСО 10993.5-11 “Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro”.
ГОСТ Р ИСО 10993.12-15 “Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и стандартные образцы”.
Barralet J., Best S., Bonfield W. Carbonate Substitution in Precipitated Hydroxyapatite: an Investigation into the Effects of Reaction Temperature and Bicarbonate Ion Concentration // J. Biomed. Mater. Res. 1998. V. 41. № 1. P. 79–86.
Бибиков В.Ю., Смирнов В.В., Фадеева И.В., Рау Д., Ферро Д., Баринов С.М., Шворнева Л.И. Интенсификация спекания карбонат гидроксиапатитовой керамики для костных имплантатов // Перспективные материалы. 2005. № 6. С. 43–48.
Тарасевич Б.Н. Основы ИК-спектроскопии с преобразованием Фурье. Подготовка проб в ИК-спектроскопии. М.: МГУ, 2012. 24 с.
Sinusaite L., Renner A.M., Schütz M.B., Antuzevics A., Rogulis U., Grigoraviciute-Puroniene I., Mathur S., Zarkova A. Effect of Mn Doping on the Low-Temperature Synthesis of Tricalcium Phosphate (TCP) Polymorphs // J. Eur. Ceram. Soc. 2019. V. 39. P. 3257–3263.
Cheng G., Deng C., Wu C., Yin H., Ruan Y., Sun Y., Xie O., Wu X. Effects of Mn-Doping on the Structural Evolution of β-Tricalcium Phosphate by Rietveld Refinement and Raman Spectroscopy // Mater. Lett. 2019. V. 235. P. 236–238.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы