Неорганические материалы, 2021, T. 57, № 1, стр. 33-40
Кальциетермическое восстановление оксидных соединений титана
В. М. Орлов 1, *, М. В. Крыжанов 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение ФИЦ “Кольский научный центр Российской академии наук”
184209 Мурманская обл., Апатиты, Академгородок, 26а, Россия
* E-mail: v.orlov@ksc.ru
Поступила в редакцию 18.06.2020
После доработки 22.07.2020
Принята к публикации 03.08.2020
Аннотация
Исследован процесс восстановления TiO2 и CaTiO3 в смеси с кальцием в атмосфере аргона и вакууме, в интервале температур 1023–1123 K. Определена адиабатическая температура реакций восстановления в зависимости от избытка кальция и начальной температуры шихты. Показано, что присутствие на частицах кальция тонкой пленки CaCl2 и использование в качестве прекурсора титаната способствуют ускорению процесса восстановления. С использованием в качестве прекурсора CaTiO3 и кальция, активированного CaCl2, после выдержки при температуре 1073 K в течение 6 ч получены порошки титана с содержанием кислорода 0.5 мас. % и удельной поверхностью 1.2 м2/г.
ВВЕДЕНИЕ
Восстановление диоксида титана кальцием протекает по экзотермической реакции:
(1)
${\text{Ti}}{{{\text{О}}}_{2}} + 2{\text{Са}} = {\text{Ti}} + 2{\text{СаО}} + 24.5\,\,{\text{ккал}}.$Обычно восстановление проводят при температуре 1273–1473 K. В этих условиях сродство кальция к кислороду около 120 ккал/г-атом [1]. Однако следует учитывать, что титан с кислородом образуют твердый раствор с широкой областью концентрации последнего [2]. Стабильность твердого раствора Ti–О увеличивается со снижением в нем содержания кислорода [3], поэтому возможности получения титана с низким содержанием кислорода ограничены. При содержании в твердом растворе 0.07% кислорода и температуре 1273 K термодинамический потенциал образования связи титан–кислород практически равен таковому для СаО. На практике в шихту восстановления добавляют значительное количество хлорида кальция, достаточное для растворения в его расплаве образовавшегося СаО. Удаление из зоны реакции оксида кальция способствует снижению содержания кислорода в порошке титана.
В работе [4] исследовали восстановление порошка диоксида титана разной крупности. Восстановление вели в расплаве CaCl2 при температуре 1173 K. По мнению авторов, процесс протекает ступенчато с образованием на промежуточных стадиях низших оксидов титана Ti2O3, TiO, Ti2O, Ti3O и Ti6O. Кроме того, при неполном восстановлении в порошке может присутствовать СаTiO3, образующийся в результате взаимодействия продукта реакции СаО с остатками TiO2. В процессе восстановления произошло значительное уменьшение поверхности, которая у исходного TiO2 составляла 120.3 м2/г, а у порошка титана – всего 1.794 м2/г. Содержание кислорода в порошке титана 0.42 мас. %.
Восстановление TiO2 парами кальция исследовали в работах [5–9]. Восстановлению подвергали предварительно изготовленные брикеты из смеси TiO2 и CaCl2. Восстановление брикетов из TiO2 со средним размером частиц 0.2 мкм при 1173 K завершилось полностью через 6 ч. Размер частиц титана 1–2 мкм [6]. В работах [7–9] исследовали восстановление таблеток, спрессованных из смеси хлорида кальция и TiO2 в разных соотношениях. Процесс вели в вакууме 8–20 Па при температуре 1273 K. Оптимальное отношение СаCl2 : TiO2 по массе – 1 : 2. В качестве промежуточных продуктов реакции авторы наблюдали низшие оксиды титана и титанат CaTiO3. По их мнению, он восстанавливается легче, чем Ti2O, являющийся последним низшим оксидом перед образованием металлического титана.
Возможность получения титана восстановлением титаната CaTiO3 исследовали в работе [10]. Исходными материалами для синтеза титаната служили TiO2 и СаCl2 ∙ 2Н2О в мольном соотношении 2 : 1. Шихту прессовали в таблетки, сушили и спекали на воздухе при температуре 1273 K в течение 2 ч. Таблетки характеризовались пористой структурой, что способствовало диффузии паров кальция в зону реакции. Восстановление вели в вакууме 20 Па при температуре 1273 K в течение 6 ч. О содержании кислорода в полученном порошке Ti не сообщается.
В рассмотренных работах восстановление вели при температуре 1173–1273 K. Однако, как следует из соотношения энергии Гиббса образования низших оксидов титана, твердых растворов кислорода в титане и оксида кальция [3], снижение температуры процесса способствует получению металла с более низким содержанием кислорода. Равновесное содержание кислорода в случае восстановления оксидов титана кальцием составляет при температуре 1273 K 0.1 мас. %, а при 927 K – 0.03 мас. % [1].
Цель настоящей работы – исследование возможности получения порошка титана восстановлением диоксида титана и титаната CaTiO3 кальцием при температуре ниже 1073 K. Высокая степень восстановления диоксида циркония и цирконата CaZrO3 кальцием в этих условиях установлена ранее [11].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Определение адиабатической температуры (Тад) реакции (1) и реакции восстановления титаната CaTiO3
в зависимости от температуры шихты (Тш) и избытка восстановителя (∆mCa) проводили с использованием программного комплекса моделирования химических и фазовых равновесий TERRA [12]. Подробно методика термодинамического анализа изложена в работе [13].
В качестве исходного материала для восстановления использовали порошок диоксида титана квалификации “ч.” (ТУ 6-09-2166-77) (модификация рутил) с удельной поверхностью 7 м2/г и порошок титаната CaTiO3 с удельной поверхностью 1.5 м2/г. Последний синтезировали методом твердофазного спекания диоксида титана и карбоната кальция при температуре 1573 K в течение 2 ч и измельчали до крупности менее 400 мкм. Восстановителем служил кальций в виде гранул с размером частиц 0.04–2.0 мм (ТУ 083.5.290-92) производства АО “Чепецкий механический завод”. Кальций использовали как в состоянии поставки, так и после активации путем смачивания насыщенным раствором CaCl2 в этиловом спирте с последующей сушкой на воздухе [11]. Количество вводимого с раствором CaCl2 составляло 10–20 г на 100 г кальция, что значительно меньше количества CaCl2 в рассмотренных работах.
Навеску исходного материала 8 (TiO2) или 10 г (CaTiO3) смешивали с кальцием, взятым с избытком 25 или 50% относительно стехиометрического количества по реакциям (1) и (2). Полученную смесь загружали в цилиндрический контейнер диаметром 23 мм из ниобия, высота загрузки составляла 30–40 мм. Для улучшения контакта между реагентами шихту уплотняли.
Восстановление вели в интервале 1023–1123 K либо при постоянном вакуумировании реактора форвакуумным насосом 2НВР‑5ДМ, либо в атмосфере аргона (давление 110 кПа). Выдержка составляла 1–6 ч. Продукты реакции для удаления избытка кальция и образовавшегося СаО дважды выщелачивали 10%-ным раствором соляной кислоты. Порошок титана промывали дистиллированной водой до нейтральной реакции раствора и сушили при температуре 323 K.
Фазовый состав полученных порошков определяли с помощью рентгеновского дифрактометра XRD-6000 фирмы Shimadzu (CuKα-излучение) с использованием базы дифрактометрических данных ICDD PDF-2. Величину удельной поверхности измеряли адсорбционным статическим методом БЭТ на приборе Micromeritics TriStar II 3020. Концентрацию кислорода определяли методом газоадсорбционной хроматографии в сочетании с импульсным нагревом на анализаторе К-671. Распределение частиц порошков по крупности анализировали на фотометрическом седиментометре ФСХ-6К производства ООО “ЛабНаучПрибор”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
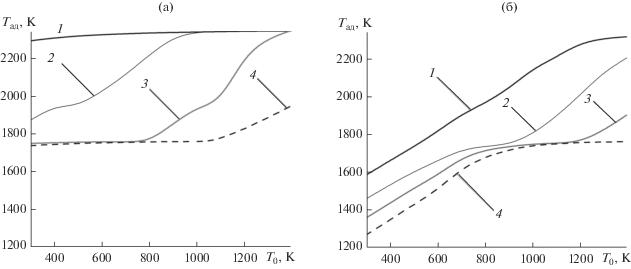
Расчет показал, что адиабатическая температура реакции (1) со стехиометрическим количеством кальция составляет 2285 K. Значение ее близко к адиабатической температуре, рассчитанной с использованием программы “Термо” (ИСМАН) в работе [14], – 2470 K, что свидетельствует о корректности метода. Это следует подчеркнуть, поскольку полученное нами значение адиабатической температуры реакции (2) – 1580 K – значительно ниже приведенного в работе [10], – 2740 K. Последнюю следует считать чрезмерно завышенной, т.к. в ходе реакции (2) выделяется гораздо меньше тепла, чем при реакции (1). Зависимость адиабатической температуры обеих реакций от избытка Ca в шихте и ее начальной температуры представлена на рис. 1. Она в условиях экспериментов, заданных в работе, либо ниже, либо лишь незначительно превышает температуру кипения кальция. То есть не следует опасаться взрывного характера реакции, вызванного высоким давлением его паров.
Рис. 1.
Зависимости адиабатической температуры восстановления от температуры шихты в системах TiO2–Ca (а), CaTiO3–Ca (б); содержание кальция: 1 – стехиометрическое, 2 – 25, 3 – 50, 4 – 75% избытка.
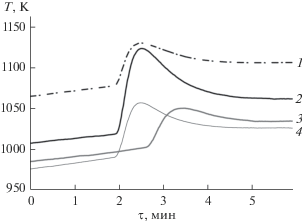
Исследование влияния состояния шихты и условий восстановления показало, что при нагреве в аргоне смеси TiO2 с кальцием в состоянии поставки увеличение температуры, свидетельствующее о начале реакции восстановления, наблюдалось при 1060–1080 K (кривая 1 на рис. 2). Использование в шихте кальция, смоченного его хлоридом, привело к снижению температуры начала реакции до 1020–1030 K (кривая 2 на рис. 2). При нагреве в вакууме взаимодействие между TiO2 и кальцием началось уже при 960–980 К (кривая 4 на рис. 2). Порошок титаната, несмотря на более крупный размер частиц, был более активен, чем TiO2, его взаимодействие с активированным кальцием в атмосфере аргона началось при температуре около 1000 К (кривая 3 на рис. 2).
Рис. 2.
Изменение температуры в процессе восстановления TiO2 в аргоне (1, 2), в вакууме (4) и CaTiO3 в аргоне (3): 1, 4 – кальций в состоянии поставки, 2 и 3 – предварительно смочен хлоридом кальция.
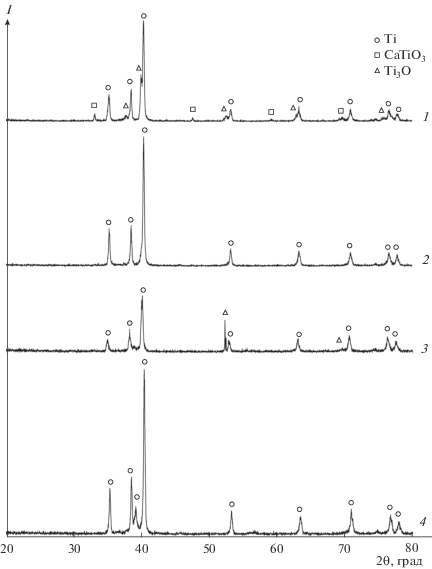
Характеристики продуктов, полученных восстановлением диоксида титана в атмосфере аргона, приведены в табл. 1. При использовании в качестве восстановителя кальция в состоянии поставки в порошках помимо металлического Ti (ICDD № 89-5009) присутствовали CaTiO3 (ICDD № 89-0056) и Ti3O (ICDD № 76-1644) (рис. 3, дифрактограмма 1). Увеличение избытка кальция в шихте с 25 до 50% позволило снизить содержание кислорода с 2.7 до 1.8 мас. %. При использовании в качестве восстановителя активированного кальция в тех же условиях был получен продукт с содержанием кислорода всего 1 мас. %. Увеличение длительности до 6 ч привело к более полному восстановлению: содержание кислорода снизилось до 0.7 мас. %. По данным РФА, в порошках титана отсутствуют побочные продукты даже после восстановления при температуре ниже температуры плавления кальция (№ 3 в табл. 1; рис. 3, дифрактограмма 2).
Таблица 1.
Характеристики порошков, полученных восстановлением диоксида титана в атмосфере аргона
| № | ∆mCa, % | T, K | τ, ч | Фазовый состав | Sуд, м2/г | ${{С}_{{{{{\text{O}}}_{{\text{2}}}}}}},$ мас. % |
|---|---|---|---|---|---|---|
| Ca в состоянии поставки | ||||||
| 1 | 25 | 1123 | 3 | Ti, CaTiO3, Ti3O | 0.7 | 2.7 |
| 2 | 50 | Ti, CaTiO3, Ti3O | 1.0 | 1.8 | ||
| Ca, активированный CaCl2 | ||||||
| 3 | 50 | 1073 | 6 | Ti | 0.7 | 0.9 |
| 4 | 50 | 1123 | 3 | Ti, CaTiO3*, Ti3O* | 0.6 | 1.0 |
| 5 | 6 | Ti | 0.5 | 0.7 | ||
Рис. 3.
Рентгенограммы порошков, полученных восстановлением TiO2 (1, 2) и CaTiO3 (3, 4) с использованием кальция в состоянии поставки (1, 3) и смоченного CaCl2 (2, 4).
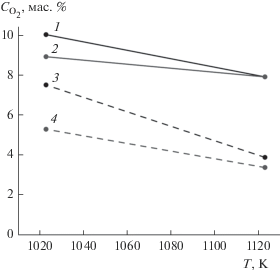
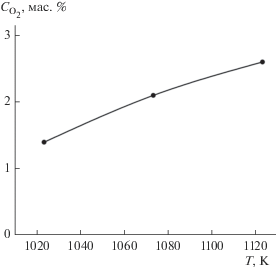
Ведение процесса в вакууме, несмотря на более низкую температуру начала реакции, не привело к увеличению степени восстановления диоксида титана. Более того, степень восстановления значительно снизилась. При восстановлении шихты с кальцием в состоянии поставки в интервале 1073–1123 K в течение 1–3 ч в порошках содержалось 9–10 мас. % кислорода. Использование в шихте активированного кальция позволило несколько улучшить показатели процесса. На рис. 4 представлена зависимость содержания кислорода в титане от температуры восстановления при избытке кальция в шихте 25 и 50 мас. % и продолжительности выдержки 1 и 3 ч. С увеличением температуры процесса содержание кислорода снижается, а влияние длительности выдержки уменьшается. Во всех порошках этой серии, за исключением полученных восстановлением шихты с избытком кальция 50 мас. % при температуре 1123 К, кроме фаз Ti и CaTiO3, присутствовал оксид титана Ti3O (ICDD № 76-1644).
Рис. 4.
Влияние температуры восстановления TiO2 в вакууме кальцием, смоченным CaCl2, на содержание кислорода в порошке титана; избыток Са: 1 и 2 – 25, 3 и 4 – 50 мас. %; длительность выдержки: 1 и 3 – 1, 2 и 4 – 3 ч.
Удельная поверхность порошков с минимальным содержанием кислорода, полученных восстановлением диоксида титана активированным кальцием в атмосфере аргона, составляет 0.5–0.7 м2/г; в вакууме – 0.9–1.2 м2/г. Это значительно меньше удельной поверхности прекурсора (7.0 м2/г). Аналогичный эффект уменьшения поверхности порошков титана по отношению к прекурсору наблюдали авторы [4].
Характеристики порошков, полученных восстановлением титаната в атмосфере аргона, представлены в табл. 2. Результаты подтверждают данные работы [10] о возможности использования этого прекурсора. Рост температуры, сопровождающий начало реакции, при нагреве шихты с Ca в исходном состоянии наблюдался при 1123 K, т.е. соответствовал использованной в работе температуре восстановления. После часовой выдержки при этой температуре в атмосфере аргона были получены порошки титана с содержанием кислорода 3.2 мас. %, в которых, однако, присутствовали в качестве примесей титанат CaTiO3 и оксид титана Ti3O (рис. 3, дифрактограмма 3). Увеличение продолжительности выдержки до 3 ч позволило получить, по данным РФА, однофазный порошок титана (№ 2 в табл. 2).
Таблица 2.
Характеристики порошков, полученных восстановлением CaTiO3 в атмосфере аргона
| № | ∆mCa, % | T, K | τ, ч | Фазовый состав | Sуд, м2/г | ${{С}_{{{{{\text{O}}}_{{\text{2}}}}}}},$ мас. % |
|---|---|---|---|---|---|---|
| Ca в состоянии поставки | ||||||
| 1 | 50 | 1123 | 1 | Ti, CaTiO3, TiO0.89 | 3.2 | 3.2 |
| 2 | 3 | Ti | 1.8 | 2.6 | ||
| Ca, активированный CaCl2 | ||||||
| 3 | 50 | 1073 | 6 | Ti | 1.2 | 0.5 |
| 4 | 50 | 1123 | 1 | Ti | 1.0 | 0.4 |
| 5 | 3 | Ti | 0.8 | 0.4 | ||
Использование в шихте кальция, предварительно смоченного раствором его хлорида, значительно активировало процесс восстановления. Температура начала реакции была около 1000 К (кривая 3 на рис. 2). В порошках не наблюдалось фаз помимо титана. Порошки (№ 3–5 в табл. 2) при большей в 1.7 раза удельной поверхности содержали в два раза меньше кислорода, чем полученные восстановлением TiO2 в тех же условиях (№ 4, 5 в табл. 1).
При восстановлении в вакууме реакция начиналась при той же температуре, что и в атмосфере аргона. В экспериментах с избытком кальция в шихте 25 мас. % содержание кислорода в порошках было на уровне 8 мас. %. Порошки, полученные с избытком кальция в шихте 50 мас. % (рис. 5), содержали кислорода в 1.5–3 раза меньше по сравнению с порошками, полученными из диоксида титана в тех же условиях. При этом содержание кислорода уменьшается с понижением температуры восстановления в соответствии с закономерностью, установленной для процесса восстановлении оксидных соединений циркония [11].
Рис. 5.
Влияние температуры восстановления CaTiO3 в вакууме кальцием, смоченным CaCl2, на содержание кислорода в порошке титана: избыток Са 50 мас. %, длительность выдержки 3 ч.
То, что при восстановлении диоксида титана содержание кислорода в порошке не снижалось с уменьшением температуры восстановления (рис. 4), как это наблюдалось ранее [11], можно объяснить следующим образом. Восстановление диоксида титана в отличие от восстановления диоксида циркония протекает ступенчато, с образованием промежуточных низших оксидов. После образования частиц низшего оксида титана дальнейшее снижение содержания кислорода связано с его диффузией из объема к поверхности, контактирующей с кальцием. Скорость диффузии увеличивается с ростом температуры, соответственно, ускоряется удаление кислорода и увеличивается степень восстановления. Другим лимитирующим фактором, влияющим на скорость удаления кислорода, является размер частиц.
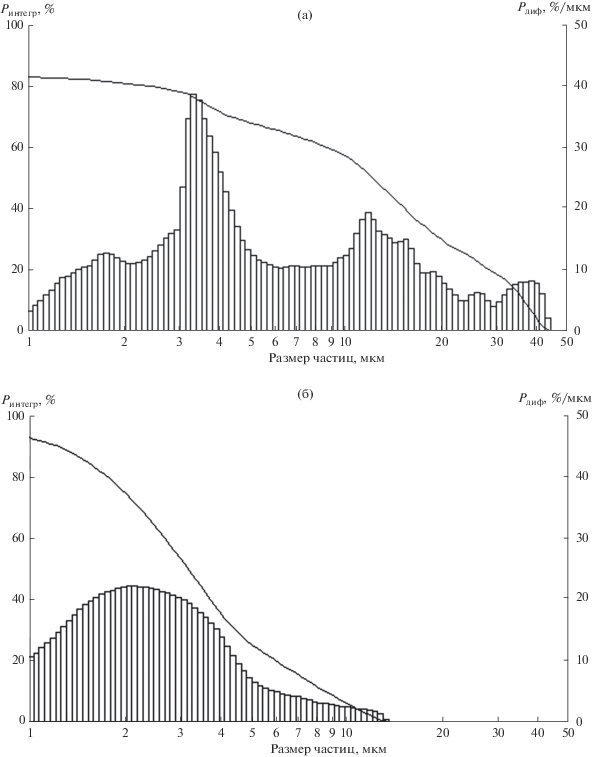
Распределение частиц в порошках по размерам приведено на рис. 6. В порошке, полученном восстановлением TiO2, доля частиц менее 10 мкм составляет примерно 40%, менее 5 мкм – около 30% (рис. 6а). Порошок, полученный восстановлением CaTiO3, существенно мельче. В нем около 95% частиц размером менее 10 мкм, при этом доля частиц менее 5 мкм составляет около 75% (рис. 6б), т.е. в этом порошке путь диффузии кислорода к поверхности значительно короче и снижение его содержания происходит эффективнее. Вероятно, существенное уменьшение размеров частиц порошка, полученного с использованием в качестве прекурсора CaTiO3, привело к снижению содержания кислорода в титане с понижением температуры восстановления, что обусловлено термодинамикой процесса.
Рис. 6.
Распределение частиц в порошках, полученных восстановлением при температуре 1123 K: а – TiO2 (Sуд = 0.9 м2/г), б – CaTiO3 (Sуд = 1.6 м2/г).
Удельная поверхность порошков, полученных восстановлением титаната, превышает удельную поверхность порошков, полученных с использованием в качестве прекурсора TiO2, хотя не в такой степени, как наблюдалось при восстановлении простых и двойных оксидов тугоплавких редких металлов V (Nb, Ta) и VI (Mo, W) групп Периодической системы элементов [15–17]. Это подтверждает ранее высказанное предположение о другом механизме образования частиц металла при восстановлении оксидных соединений металлов IV группы [11]. Бóльшая поверхность порошков, полученных восстановлением титаната, обусловлена меньшей степенью агрегации первичных частиц титана в процессе восстановления.
Эффект уменьшения степени восстановления при проведении процесса в вакууме носит аномальный характер. Для его объяснения требуются дополнительные исследования.
ЗАКЛЮЧЕНИЕ
Рассчитана адиабатическая температура реакций восстановления TiO2 и CaTiO3 кальцием в зависимости от избытка восстановителя и начальной температуры реагентов. При начальной температуре 1100 К и избытке кальция 50 мас. % относительно стехиометрии адиабатическая температура реакции восстановления TiO2 – 1970 К, а CaTiO3 – 1750 К. Это указывает на спокойное течение реакции в смеси реагентов, не сопровождающееся выбросом шихты парами кальция.
Найдено, что температура начала взаимодействия кальция с TiO2 – 1070 К, а с CaTiO3 – 1123 К. Использование в качестве восстановителя кальция, активированного путем нанесения на его поверхность небольшого количества CaCl2 (10–20 г CaCl2 на 100 г Са), снижает температуру начала реакции соответственно на 50 и 100 К, а также способствует более полному восстановлению. В одних и тех же условиях степень восстановления титана при использовании в качестве прекурсора CaTiO3 выше. Использование в шихте активированного кальция позволило после 6 ч выдержки при температуре 1073 К получить порошки титана с достаточно низким содержанием кислорода: 0.9 мас. % (прекурсор TiO2) и 0.5 мас. % (прекурсор CaTiO3), удельная поверхность порошков – 0.7 и 1.2 м2/г соответственно. Показано, что одним из факторов, влияющих на степень восстановления, является размер частиц образующегося порошка титана.
Список литературы
Гармата В.А., Гуляницкий Б.С., Крамник В.Ю. и др. Металлургия титана. М.: Металлургия, 1967. 643 с.
Okamoto H. O-Ti (Oxygen-Titanium) // J. Phase Equilib. Diffus. 2011. V. 32. № 5. P. 473–474. https://doi.org/10.1007/s11669-011-9935-5
Murray J.L., Wriedt H.A. The O-Ti (Oxygen-Titanium) System // J. Phase Equilib. 1987. V. 8. № 2. P. 148–165.
Kikuchi T., Yoshida M., Matsuura S. et al. Rapid Reduction of Titanium Dioxide Nano-Particles by Reduction with a Calcium Reductant // J. Phys. Chem. Solids. 2014. V. 75. № 9. P. 1041–1048.
Okabe T.H., Oda T., Mitsuda Y. Titanium Powder Production By Preform Reduction Process (PRP) // J. Alloys Compd. 2004. V. 364. № 1–2. P. 156–163.
Zheng H., Ito H., Okabe T.H. Production of Titanium Powder by the Calciothermic Reduction of Titanium Concentrates or Ore Using the Preform Reduction Process // Mater. Trans. 2007. V. 48. № 8. P. 2244–2251.
Wan H., Xu B., Dai Y. et al. Preparation of Titanium Powders by Calciothermic Reduction of Titanium Dioxide // J. Cent. South Univ. 2012. V. 19. № 9. P. 2434−2439.
Xu B., Yang B., Jia J. et al. Behavior of Calcium Chloride in Reduction Process of Titanium Dioxide by Calcium Vapor // J. Alloys Compd. 2013. V. 576. № 5. P. 208–214.
Jia J., Xu B., Yang B. et al. Preparation of Titanium Powders from TiO2 by Calcium Vapor Reduction // JOM. 2013. V. 65. № 5. P. 630–635.
Lei X., Xu B., Yang G. et al. Direct Calciothermic Reduction of Porous Calcium Titanate to Porous Titanium // Mater. Sci. Eng. 2018. V. 91. № 10. P. 125–134.
Орлов В.М., Крыжанов М.В. Восстановление оксидных соединений циркония кальцием // Неорган. материалы. 2020. Т. 56. № 7. С. 774–779.
Трусов Б.Г. Программная система ТЕРРА для моделирования фазовых и химических равновесий в плазмохимических системах [Электронный ресурс]. 4-й Междунар. симп. по теоретической и прикладной плазмохимии (Иваново, 13–18 мая 2005 г.): режим доступа: http://main.isuct.ru/files/konf/ISTAPC2005/proc/2-11.pdf, свободный (дата обращения 12.03.20).
Орлов В.М., Крыжанов М.В. Термодинамическое моделирование процесса магниетермического восстановления танталатов магния и лития // Неорган. материалы. 2015. Т. 51. № 6. С. 680–684.
Nersisyan H., Kwona S.C., Rib V. et al. Shape-Controlled Synthesis of Titanium Microparticles Using Calciothermic Reduction Concept // J. Solid. State Chem. 2018. V. 267. P. 13–21.
Орлов В.М., Крыжанов М.В., Калинников В.Т. Магниетермическое восстановление оксидных соединений тантала // Докл. АН. 2014. Т. 457. № 5. С. 555–558.
Орлов В.М., Крыжанов М.В., Калинников В.Т. Восстановление оксидных соединений ниобия парами магния // Докл. АН. 2015. Т. 465. № 2. С. 182–185.
Орлов В.М., Колосов В.Н. Магниетермическое восстановление оксидных соединений вольфрама и молибдена // Докл. АН. 2016. Т. 468. № 3. С. 282–292.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


