Неорганические материалы, 2021, T. 57, № 10, стр. 1128-1137
Фазовый состав и структура керамических образцов на основе диоксида циркония, полученных экзотермическим синтезом
К. Б. Подболотов 1, 2, 3, *, Н. А. Хорт 1, А. Ю. Изобелло 1
1 Физико-технический институт Национальной академии наук Беларуси
220141 Минск, ул. Купревича, 10, Беларусь
2 НИТУ Московский институт стали и сплавов
119049 Москва, Ленинский пр., 4, Россия
3 Белорусская государственная академия авиации
220096 Минск, ул. Уборевича, 77, Беларусь
* E-mail: k.podbolotov@yahoo.com
Поступила в редакцию 28.03.2021
После доработки 21.05.2021
Принята к публикации 20.06.2021
Аннотация
Диоксид циркония получен методом экзотермического синтеза из растворов с применением нитратов и глицин-карбамидного восстановителя. Установлены зависимости фазового состава и соотношения полиморфных модификаций диоксида циркония от количества и типа оксида-стабилизатора, а также температуры последующей термообработки. Показана возможность получения материала с частичной стабилизацией тетрагональной модификации (содержание 50–70%) при введении кальция и иттрия до 5%, а также полной стабилизации тетрагональной модификации. Синтезированный диоксид циркония представлен хлопьевидными макрочастицами различного размера, состоящими из нанокристаллических частиц округлой формы с размером до 100 нм, при этом размер кристаллитов составляет 10–20 нм.
ВВЕДЕНИЕ
Керамические материалы на основе диоксида циркония нашли широкое применение в различных отраслях техники, медицины, энергетики и др. Из них изготавливаются огнеупоры [1–5], тигли для плавки металлов [6–8], режущий инструмент [9–11], твердотопливные элементы [12–14], эндопротезы [15–17], катализаторы [18–20], люминофоры [21, 22] и др.
Известны три кристаллические модификации ZrO2: моноклинная (M), тетрагональная (T) и кубическая (C), фазовые переходы обратимы и при нагревании реализуются в последовательности: ($M\frac{{1160^\circ {\text{C}}}}{{}}\,\,T\frac{{2370^\circ {\text{C}}}}{{}}$ C) [1–6, 23–26]. С практической точки зрения при создании высокопрочной керамики интерес представляет тетрагональная модификация ZrO2, однако она не стабильна и при нормальной температуре превращается в моноклинную, что сопровождается резким увеличением объема (около 4%) и приводит к разрушению изделий из ZrО2.
Стабилизация тетрагональной или кубической фазы ZrO2 достигается путем допирования различными катионами (например, Y3+, Ca2+, Mg2+, Ce3+ и др.) [24–26], а также уменьшением размера частиц менее 30 нм [27]. Для внедрения стабилизирующих ионов в кристаллическую решетку диоксида циркония за счет диффузии требуются сравнительно высокие температуры (более 1300°С). На практике для получения технической керамики из стабилизированного диоксида циркония термодиффузионный метод стабилизации применяется редко ввиду высоких энергозатрат на гомогенизацию, термическую обработку и диспергирование.
В настоящее время для получения керамики на основе стабилизированного нанокристаллического диоксида циркония используются различные методы: осаждение, золь–гель, термическое разложение, гидротермальная обработка и др. [27–33]. Активно развивается перспективное направление получения диоксида циркония с применением метода горения растворов (Solution Combustion Synthesis) [34–38]. Длительность реакции при этом составляет порядка нескольких секунд с разогревом до температур 500–1500°С. Высокая температура способствует формированию кристаллических материалов без дополнительной термообработки. Наиболее важным является то, что при горении растворов выделяется большое количество газообразных соединений, что способствует формированию наноразмерных продуктов.
Целью настоящей работы является исследование экзотермического синтеза диоксида циркония, в том числе с добавками ионов-стабилизаторов высокотемпературных модификаций (Ca2+, Mg2+ и Y3+), и структурно-фазовых превращений в полученных материалах при их термообработке.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных компонентов применялись: нитрат цирконила (CAS 13746-89-9), нитрат кальция (ГОСТ 4142), нитрат магния (ГОСТ 11088), нитрат иттрия (ТУ 6-09-4676-83), азотная кислота (ГОСТ 4461) и органические соединения – глицин (ГОСТ 5860), карбамид (ГОСТ 6691).
Процесс синтеза в общем случае можно описать следующими уравнениями реакций (M – ZrO2+, Ca2+, Mg2+, Y3+):
(1)
$\begin{gathered} {{{\text{M}}}^{\vartheta }}{{({\text{N}}{{{\text{O}}}_{3}})}_{\vartheta }} + \left( {\frac{5}{6}\vartheta \varphi } \right){\text{C}}{{{\text{H}}}_{{\text{4}}}}{{{\text{N}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,\vartheta \frac{5}{4}(\varphi - 1){{{\text{O}}}_{2}} = {{{\text{M}}}^{\vartheta }}{{{\text{O}}}_{{\frac{\vartheta }{2}}}} + \left( {\frac{5}{6}\vartheta \varphi } \right){\text{C}}{{{\text{O}}}_{2}} + \\ + \,\,\vartheta \left( {\frac{{5\varphi + 3}}{6}} \right){{{\text{N}}}_{2}} + \left( {\frac{{10}}{6}\vartheta \varphi } \right){{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(2)
$\begin{gathered} {{{\text{M}}}^{\vartheta }}{{({\text{N}}{{{\text{O}}}_{3}})}_{\vartheta }} + \left( {\frac{5}{9}\vartheta \varphi } \right){{{\text{C}}}_{2}}{{{\text{H}}}_{{\text{5}}}}{\text{N}}{{{\text{O}}}_{2}} + \\ + \,\,\vartheta \frac{5}{4}(\varphi - 1){{{\text{O}}}_{2}} = {{{\text{M}}}^{\vartheta }}{{{\text{O}}}_{{\frac{\vartheta }{2}}}} + \left( {\frac{{10}}{9}\vartheta \varphi } \right){\text{C}}{{{\text{O}}}_{2}} + \\ + \,\,\vartheta \left( {\frac{{5\varphi + 9}}{{18}}} \right){{{\text{N}}}_{2}} + \left( {\frac{{25}}{{18}}\vartheta \varphi } \right){{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $Для реализации процесса синтеза экзотермическим методом готовили раствор, включающий нитраты цирконила и металлов – окислители и органическую составляющую – глицин и карбамид в качестве восстановителя. Для приготовления раствора компоненты взвешивали и переносили при одновременном перемешивании в термостойкий стакан с водой, которая подогревалась для улучшения растворения до температуры 50–60°С. После этого осуществлялась гомогенизация раствора путем его перемешивания в течение 25–30 мин.
Количественное содержание компонентов для приготовления раствора рассчитывали исходя из условия получения 30 г порошка заданного состава (табл. 1) с учетом использования смеси восстановителей глицин : карбамид и стехиометрии реакций (1) и (2) при φ = 1.25.
Процесс горения инициировали, помещая раствор в термостойком стакане в нагретую до 600°С печь. После окончания синтеза полученную агломерированную массу измельчали в ступке и исследовали. Также проводили термическую обработку полученных порошков на воздухе при 800–1200°С с выдержкой 1 ч.
Порошки полученных образцов исследовали методами рентгенофазового и полнопрофильного анализа, дифференциальной сканирующей калориметрии (ДСК), сканирующей электронной микроскопии.
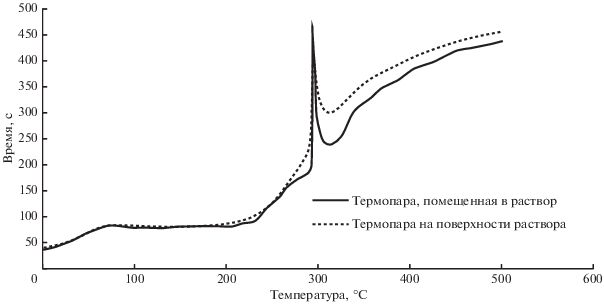
Запись профилей горения проводилась на самодельной установке, состоящей из вертикальной печи с микроконтроллерным управлением температурой; держателя, совмещенного с термопарами ХА; модуля аналогового ввода ОВЕН МВ110-224.8А, подключенного к компьютеру. Регистрация велась двумя термопарами: первая располагалась внутри раствора около дна, но не касалась его; вторая погружалась на 1 мм ниже уровня поверхности раствора. Объем раствора для исследования составлял 15 ± 1 мл. Регистрация сигнала в координатах температура–время начиналась после помещения раствора в тигле в нагретую до 600°С печь и завершалась после окончания процесса горения, общая выдержка составляла около 10 мин.
Дифференциальная сканирующая калориметрия образцов выполнялась на приборе DSC 404 F3 NETZSCH в диапазоне температур 20–1500°С. Были проведены два цикла нагрев–охлаждение образца в платиновом тигле с регистрацией ДСК-сигнала: первый цикл – 20–1300–100°С, скорость изменения температуры 10°С/мин, продувка воздухом 50 мл/мин; второй цикл – 100–1500–200°С, скорость изменения температуры 10°С/мин, продувка аргоном 50 мл/мин.
Запись дифрактограмм проводилась на установке AL-27 mini при использовании CuKα-катода. Для идентификации кристаллических фаз использовалась международная картотека PDF-2004. Расчет размера кристаллитов (областей когерентного рассеяния (ОКР)), микронапряжений и обработка данных проводилась при помощи пакета программ HighScore Plus 3.0.
Микроструктуру изучали с использованием сканирующего электронного микроскопа высокого разрешения TESCAN MIRA3 с рентгеноспектральным микроанализатором EDX X-Max Oxford Ins.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В случае синтеза с использованием карбамида реакция горения протекает чрезвычайно активно с воспламенением и большим уносом получаемого материала с выделяющимися газами. Материал представлен достаточно прочными пористыми агрегатами неизометрической формы размерами до 2 мм, имеет белый цвет, что говорит об отсутствии углерода или невыгоревших органических включений.
При использовании глицина реакция горения проходит в спокойном режиме, пламени и уноса материала не наблюдается. Образуется высокопористый пеноподобный материал, имеющий цвет от темно-коричневого до черного, что связано с наличием углерода и невыгоревших органических включений.
Для снижения экзотермичности и активности процесса с использованием карбамида, который обуславливает не только высокий унос материала с выделяющимися газами, но и спекание образующихся кристаллитов в прочные агрегаты, в качестве восстановителя использовали смесь глицина и карбамида в мольном соотношении 1 : 1 при φ = 1.25. Это позволило получить пеноподобный высокопористый продукт с малой долей включений остаточного углерода и неразложившихся органических соединений.
Кривые нагревания при горении для составов без модификаторов (рис. 1) и с добавлением ионов-стабилизаторов Ca2+ и Y3+ в виде нитратов показали, что добавки не влияют на ход процесса. Максимальная температура горения для всех образцов 450–500°С. Из кривой нагревания следует, что после установки раствора в нагретую печь первоначально идут разогрев раствора (0–80 с), испарение воды (80–200 с). Далее (200–300 с) наблюдаются повышение температуры и, вследствие этого, разложение нитрата цирконила и органических восстановителей (карбамида и глицина) с образованием газообразных соединений (вода, аммиак, оксиды углерода и азота) и полимерных высокомолекулярных комплексов, которые вспучиваются выделяющимися газами. При достижении температуры воспламенения (180°С) наблюдается резкий подъем температуры, связанный с инициированием процесса горения (сильноэкзотермический процесс). При этом визуально наблюдается пламенное горение, что говорит о взаимодействии преимущественно в газовой фазе выделяющихся при разложении органических веществ монооксида углерода, аммиака и низкомолекулярных соединений (углеводородов и т.п.) с оксидами азота, образующимися при термическом разложении нитратов. После окончания процесса горения идет дальнейший плавный тепловой разогрев твердых продуктов реакции.
По данным рентгенофазового анализа (РФА), полученные после процесса горения образцы имеют кристаллическое строение. Данные РФА представлены на рис. 2–4.
Рис. 2.
Дифрактограммы диоксида циркония, полученного методом горения растворов при отсутствии добавок (а) и с 5% CaO (б) при различных температурах термообработки.

Рис. 3.
Дифрактограммы диоксида циркония, полученного методом горения растворов при 10 (а) и 15% CaO (б) при различных температурах термообработки.
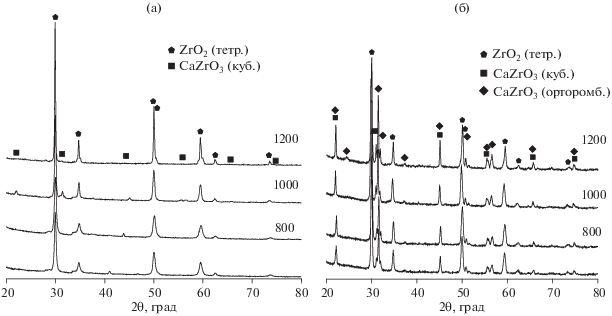
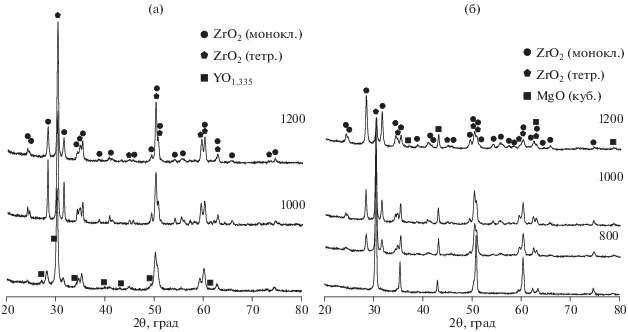
Рис. 4.
Дифрактограммы диоксида циркония, полученного методом горения растворов при 5% Y2O3 (а) и 15% MgO (б) при различных температурах термообработки.
При синтезе в смесях без введения ионов-стабилизаторов наблюдается формирование преимущественно моноклинной модификации диоксида циркония. Повышение температуры отжига полученного материала приводит к уменьшению интенсивности дифракционных максимумов тетрагональной фазы, что говорит о ее переходе в моноклинную.
При добавлении оксида-стабилизатора CaO в количестве 5% происходит стабилизация тетрагонального диоксида циркония и его количество возрастает. При дальнейшем повышении содержания CaO до 10% наблюдается формирование тетрагональной модификации с небольшой примесью кубического цирконата кальция. Температура отжига практически не оказывает влияния на фазовый состав продуктов. При 15% CaO наблюдается формирование тетрагональной модификации диоксида циркония, а также кубической и орторомбической модификаций цирконата кальция.
При введении иона иттрия (Y3+) образуются тетрагональная и моноклинная фазы, кроме того, наблюдается примесь оксида иттрия. При термообработке рефлексы оксида иттрия исчезают, что, вероятно, объясняется растворением его в диоксиде циркония.
Введение 15% MgO позволяет получить тетрагональную форму диоксида циркония, однако при повышении температуры отжига наблюдается переход в моноклинную модификацию.
Микроструктура полученных после горения образцов на основе диоксида циркония, стабилизированного различным количеством кальция, представлена на рис. 5, а после их термообработки при 1000°С – на рис. 6.
Рис. 5.
Электронные микрофотографии образцов на основе диоксида циркония, стабилизированного различным количеством кальция, полученных горением растворов: Z-0 (а, б), Z-C5 (в, г), Z-C10 (д, е).

Рис. 6.
Электронные микрофотографии образцов на основе диоксида циркония, стабилизированного различным количеством кальция, полученных горением растворов, после обжига при 1000°С: а–е – см. подпись к рис. 5.

Видно, что структура образца, полученного после горения, представлена хлопьевидными макрочастицами различного размера, состоящими из нанокристаллических частиц округлой формы с размером до 100 нм. После обжига при 1000°С макроструктура практически не меняется, наблюдается рост частиц до ≈200 нм.
Соотношения кристаллических фаз диоксида циркония, размеры кристаллитов и микронапряжения представлены в табл. 2. Из приведенных данных следует, что при отсутствии стабилизаторов наблюдается преимущественное формирование моноклинной модификации с небольшой (12–20%) долей тетрагональной. Стабилизация тетрагональной модификации диоксида циркония, получаемого при горении растворов, наблюдается при введении 5% CaO, после горения продукт содержит до 68% тетрагональной модификации, а при последующем обжиге материала ее доля плавно возрастает до 98% и более. При введении 10% CaO после горения наблюдается формирование продукта с долей тетрагональной фазы около 89%, при обжиге которого уже при 800°С моноклинная фаза полностью исчезает. При увеличении содержания оксида кальция до 15% формируется только тетрагональная модификация диоксида циркония, однако при этом наблюдается большое количество (до 36%) цирконата кальция.
Таблица 2.
Содержание кристаллических фаз диоксида циркония и их параметры в зависимости от состава и режима получения
| Образец | Температура обжига, °С | Содержание, % | Размер кристал-литов, Å | Микронап-ряжения, % | Содержание, % | Размер кристал-литов, Å | Микронап-ряжения, % |
|---|---|---|---|---|---|---|---|
| М-ZrO2 | T-ZrO2 | ||||||
| Z-0 | – | 87.5 | 420 | 0.35 | 12.5 | 156 | 0.95 |
| 800 | 81.0 | 470 | 0.33 | 19.0 | 155 | 0.96 | |
| 1000 | 85.2 | 500 | 0.30 | 14.8 | 150 | 0.95 | |
| 1200 | 82.0 | 320 | 0.45 | 18.0 | 152 | 0.9 | |
| Z-C5 | – | 43.2 | 158 | 0.95 | 56.8 | 172 | 0.85 |
| 800 | 31.5 | 140 | 1.10 | 68.5 | 255 | 0.5 | |
| 1000 | 9.6 | 200 | 0.7 | 90.4 | 180 | 0.8 | |
| 1200 | – | – | – | 98.7 | 350 | 0.35 | |
| Z-C10 | – | 11.0 | 165 | 0.85 | 89.0 | 100 | 2.5 |
| 800 | – | – | – | 83.9 | 155 | 0.9 | |
| 1000 | – | – | – | 76.8 | 260 | 0.5 | |
| 1200 | – | – | – | 100.0 | 500 | 0.25 | |
| Z-C15 | – | – | – | – | 64.6 | 285 | 0.5 |
| 800 | – | – | – | 62.3 | 300 | 0.45 | |
| 1000 | – | – | – | 63.6 | 340 | 0.4 | |
| 1200 | – | – | – | 58.3 | 280 | 0.46 | |
| Z-Y5 | – | 31.6 | 110 | 1.05 | 67.4 | 175 | 0.78 |
| 1000 | 41.1 | 380 | 0.55 | 58.9 | 240 | 0.32 | |
| 1200 | 34.6 | 250 | 0.55 | 65.4 | 300 | 0.34 | |
| Z-M15 | – | – | – | – | 80.1 | 305 | 0.64 |
| 800 | 20.4 | 250 | 0.55 | 55.3 | 250 | 0.6 | |
| 1000 | 28.9 | 290 | 0.5 | 40.6 | 300 | 0.5 | |
| 1200 | 59.4 | 217 | 0.6 | 13.0 | 210 | 0.46 | |
При добавлении 5% Y2O3 происходит формирование частично стабилизированного диоксида циркония. Количество тетрагональной фазы составляет около 60–68%. В продукте после синтеза наблюдается до 1–2% примеси оксида иттрия, которая при термообработке исчезает, что связано с формированием его твердого раствора в диоксиде циркония.
При введении 15% MgO наблюдается противоположная зависимость: после горения продукт состоит из тетрагональной модификации, а после нагревания наблюдается переход в моноклинную фазу, содержание которой увеличивается до 59%. Это связано с большим количеством оксида магния, который не растворяется в решетке диоксида циркония, при этом формируется цирконат магния, в результате чего при повышении температуры происходят обеднение твердого раствора диоксид циркония–оксид магния и дестабилизация тетрагональной модификации.
Размер кристаллитов образцов, рассчитанный на основе дифрактограмм, колеблется в пределах 15–30 нм. Микронапряжения в кристаллической решетке составляют от 2.5 до 0.6% (от модуля упругости материала) в синтезированном продукте и снижаются при темрообработке до 0.9–0.3%, что связано с релаксацией напряжений и уменьшением дефектности решетки.
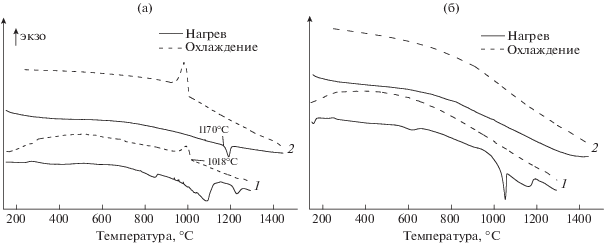
Результаты ДСК синтезированных образцов на основе диоксида циркония, без добавки и стабилизированного 10% CaO, приведены на рис. 7. При первичном нагреве образцов при температурах 900–1150°С на воздухе наблюдается эндоэффект, связанный, видимо, с завершением процесса фазообразования в материале. Формируется более совершенная кристаллическая структура, снижается уровень напряжений, укрупняются кристаллиты, что подтверждается данными РФА (дифракционные максимумы становятся более интенсивными и узкими). В диапазоне температур 1150–1180°С идет процесс перехода моноклинной модификации в тетрагональную, а также завершается формирование твердого раствора иона-стабилизатора в диоксиде циркония. При охлаждении в отсутствие стабилизирующей добавки наблюдается экзотермический эффект с началом при 1018°С, связанный с обратным переходом тетрагональной модификации в моноклинную, при этом при наличии стабилизатора на кривой ДСК эффекты отсутсвуют. Отмечено, что температуры прямого перехода моноклинной модификации в тетрагональную при нагреве и обратного при охлаждении не совпадают (разница составляет порядка 150°С). На кривых второго цикла нагрева–охлаждения тепловые эффекты, отвечающие полиморфным переходам, наблюдаются только при отсутствии добавки стабилизатора (CaO).
ЗАКЛЮЧЕНИЕ
Показана возможность экзотермического синтеза материалов на основе ZrO2 с различным фазовым составом. В качестве восстановителя для синтеза использовалась смесь глицина и карбамида в мольном соотношении 1 : 1 при отношении восстановителя к окислителю 1.25. Это позволяет получить пеноподобный высокопористый продукт с малой долей включений остаточного углерода и неразложившихся органических соединений. Съемка кривых нагревания показала, что максимальная температура горения для всех составов 450–500°С.
Установлено, что при горении растворов в смесях без введения стабилизирующего оксида наблюдается формирование преимущественно моноклинной модификации диоксида циркония. При добавлении CaO, Y2O3, MgO происходит стабилизация тетрагональной фазы диоксида циркония. Для получения материала с частичной стабилизацией тетрагональной модификации (содержание 50–70%) наиболее эффективно введение кальция и иттрия с содержанием их в виде оксидов около 5%. Показано, что при увеличении содержания кальция происходит практически полная стабилизация тетрагональной модификации, однако также наблюдается повышенное образование цирконата кальция. Установлена зависимость фазового состава полученных материалов от температуры термообработки в диапазоне 800–1200°С.
Структура материала, полученного после горения, представлена хлопьевидными макрочастицами различного размера, состоящими из нанокристаллических частиц округлой формы с размером до 100 нм. После обжига при 1000°С макроструктура практически не меняется, наблюдается рост частиц до ≈200 нм.
Полученные нанокристаллические материалы на основе диоксида циркония могут быть использованы для высокопрочных керамических изделий и покрытий технического, медицинского и других функциональных назначений.
Список литературы
Балкевич В.Л. Техническая керамика : уч. пособие для вузов. М.: Стройиздат, 1984. С. 256.
Андрианов Н.Т., Балкевич В.Л, Беляков А.В. и др. / Под общ. ред. Гузмана И.Я. Химическая технология керамики: уч. пособие для вузов. М.: РИФ “Стройматериалы”, 2003. С. 496.
Стрелов К.К., Мамыкин П.С. Технология огнеупоров. М.: Металлургия, 1978. С. 376.
Boch P., Nièpce J.-C. Ceramic Materials: Processes, Properties and Applications. N.Y.: Wiley-ISTE, 2007. P. 592.
Barry C.C., Grant N.M. Ceramic Materials: Science and Engineering // Springer Ser. Chem. Phys. 2007. P. 716.
Рутман Д.С., Торопов Ю.С., Плинер С.Ю. Высокоогнеупорные материалы из диоксида циркония. М.: Металлургия, 1985. С. 136.
Примаченко В.В. и др. Высокоогнеупорные тигли из стабилизированного диоксида циркония для индукционной плавки металлов платиновой группы, изготовленные методом вибролитья // Литье и металлургия: научно-производственный журн. 2012. № 3(67). С. 166–168.
Жигачев А.О., Головин Ю.И., Умрихин А.В., Коренков В.В., Тюрин А.И., Родаев В.В., Дьячек Т.А. Керамические материалы на основе диоксида циркония / Под общ. ред. Головина Ю.И. М.: ТЕХНОСФЕРА, 2018. С. 358.
Sornakumar T. Advanced Ceramic Composite Tool Materials for Metal Cutting Applications // Key Eng. Mater.1996. V. 114. P. 173–188.
Dow Whitney E., Vaidyanathan N. Engineered Ceramics for High Speed Machining // ASM Int. Conf. Proc. 1987. P. 77–82.
Charles W. Ceramic Cutting Tools Update // Manuf. Eng. 1988. V. 100. P. 81–86.
Mahato N., Gupta A., Balani K. Doped Zirconia and Ceria-based Electrolytes for Solid Oxide Fuel Cells: a Review // Nanomater. Energy. 2012. V. 1. № 1. P. 27–45.
Zhou X.-D., Singhal S.C. Fuel Cells. Solid Oxide Fuel Cells: Overview // Encyclopedia of Electrochemical Power Sources. 2009. P. 1–16.
Seongkook Oh, Junsuk Park, Jeong Woo Shin, Byung Chan Yang. High Performance Low-Temperature Solid Oxide Fuel Cells with Atomic Layer Deposited-Yttria Stabilized Zirconia Embedded Thin Film Electrolyte // J. Mater. Chem. A. 2018. P. 7401–7408.
Ossama Saleh Abd El-Ghany, Ashraf Husein Sherief. Zirconia Based Ceramics, Some Clinical and Biological Aspects: Review // Future Dent. J. 2016. V. 2. P. 55–64.
Chevalier J., Gremillard L. Ceramics for Medical Applications: A Picture for The Next 20 Years // J. Eur. Ceram. Soc. 2009. V. 29. № 7. P. 1245–1255.
Dearnley P.A. A Review of Metallic, Ceramic and Surface-Treated Metals Used for Bearing Surfaces in Human Joint Replacements // Proc. Inst. Mech. Eng. Part H-J Eng. Med. 1999. V. 213. № 2. P. 107–135.
Kauppi E.I., Rönkkönen E.H., Airaksinen S.M.K. et al. Influence of H2S on ZrO2-Based Gasifcation Gas Clean-Up Catalysts: Meoh Temperature-Programmed Reaction Study // Appl. Catal. B: Environ. 2012. № 111–112. P. 605–613.
Zhang X., Su H., Yang X., Zhang X. Catalytic Performance of a Threedimensionally Ordered Macroporous Co/ZrO2 Catalyst in Fischer-Tropsch Synthesis // J. Mol. Catal. A: Chem. 2012. № 360. P. 16–25.
Signoretto M., Menegazzo F., Contessotto L. et al. Au/ZrO2: an Efficient and Reusable Catalyst for the Oxidative Esterifcation of Renewable Furfural // Appl. Catal. B: Environ. 2013. № 129. P. 287–293.
Никифоров С.В., Кортов В.С., Киряков А.Н., Конев С.Ф., Меньшенина А.А. Повышение выхода люминесценции диоксида циркония // Письма в ЖТФ. 2017. Т. 43. Вып. 23. С. 55–61.
Kiisk V., Puust L., Utt K., Maaroos A., Mandar H., Viviani E., Piccinelli F., Saar R., Joost U., Sildos I. Photo-, Thermo- and Optically Stimulated Luminescence of Monoclinic Zirconia // J. Lumin. 2016. V. 174. P. 49–55.
Горелов В.П. Высокотемпературные фазовые переходы в ZrO2 // Физика твёрдого тела. 2019. Т. 61. Вып. 7. С. 1342–1346.
Заводинский В.Г. Исследование механизма фазовой стабильности диоксида циркония, легированного магнием и кальцием // Перспективные материалы. 2005. № 2. С. 5–9.
Оковитый В.В. Выбор оксидов для стабилизации диоксида циркония при получении теплозащитных покрытий // Наука и техника. 2015. № 5. С. 26–32.
Fenech J., Viazzi C., Bonino J-P. et al. Morphology and Structure of YSZ Powders: Comparison between Xerogel and Aerogel // Ceram. Int. 2009. V. 35. P. 3427–3433.
Кривцов И.В., Устименко А.В, Илькаева М.В., Авдин В.В. Синтез наночастиц диоксида циркония путем термического разложения комплекса циркония с лимонной кислотой // Вестн. ЮУрГУ. Сер. Химия. 2013. Т. 5. № 4. С. 38–41.
Huang W., Yang J., Meng X., Cheng Y., Wang C., Zou B., Khan, Z., Zhen W., Cao X. Effect of the Organic Additions on Crystal Growth Behavior of ZrO2 Nanocrystals Prepared Via Sol-Gel Process // Chem. Eng. J. 2011. V. 168. P. 1360–1368.
Tok A.I.Y., Boey F.Y.C., Du S.W., Wong B.K. Flame Spray Synthesis of ZrO2 Nano-Particles Using Liquid Precursors // Mater. Sci. Eng., B-Adv. 2006. V. 130. P. 114–119.
Duran C., Jia Y., Sato K., Hotta Y., Watari K. Hydrothermal Synthesis of Nano ZrO2 Powders // Key Eng. Mater. 2006. V. 317–318. P. 195–198.
Liao J., Zhou D., Yang B., Liu R., Zhang Q. Sol-Gel Preparation and Photoluminescence Properties of Tetragonal ZrO2: Y3+, Eu3+ Nanophosphors // Opt. Mater. 2012. № 35. P. 274–279.
Wang S., Zhai Y., Li X., Yang L., Wang K. Coprecipitation Synthesis of MgO-Doped ZrO2 Nano Powder // J. Amer. Ceram. Soc. 2010. № 89. P. 3577–3581.
Nogami M., Tomozawa M. ZrO2-Transformation-Toughened Glass-Ceramics Prepared by the Sol-Gel Process from Metal Alkoxides // J. Mater. Sci. Lett. 2010. № 69. P. 99–102.
Purohit a R.D., Saha a S., Tyagi A.K. Combustion Synthesis of Nanocrystalline ZrO2 Powder: XRD, Raman Spectroscopy and TEM Studies // Mater. Sci. Eng., B. V. 130. 2006. P. 57–60.
Jafari Ayoub Z., Jafar Tafreshi M., Fazli M. Effect of Calcination Temperature on the Alumina-Zirconia Nanostructures Prepared by Combustion // Synth. JNS. 2013. V. 2. P. 457–461.
Boobalan K., Vijayaraghavan R., Chidambaram K., Mudali U., Mudali K., Raj B. Preparation and Characterization of Nanocrystalline Zirconia Powders by the Glowing Combustion Method // JACS. 2010. V. 93. № 11. P. 3651–3656.
Denisova E.I., Ustyuzhaninova I.A., Kartashov V.V., Volkovich V.A., Chernetskiy I.V., Vlasov A.V. Glycine-Nitrate Combustion Synthesis of ZrO2-Y2O3 Nanopowders // Adv. Mater. Res. 2015. V. 1103 P. 37–43.
Mimani T., Patil K.C. Solution Combustion Synthesis of Nanoscale Oxides and Their Composites // Mater. Phys. Mech. 2001. № 4. P. 134–137.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы