Неорганические материалы, 2021, T. 57, № 12, стр. 1292-1305
Одностадийный синтез нанокомпозитов на основе CdSe и исследование их проводимости
М. Н. Кокорина 1, А. К. Корытцева 1, *, Е. В. Зайцева 1, А. В. Будруев 1, В. В. Карзанов 1, Е. В. Сулейманов 1, А. Е. Баранчиков 2
1 Нижегородский государственный университет им. Н.И. Лобачевского
603022 Нижний Новгород, пр. Гагарина, 23, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119071 Москва, Ленинский пр., 31, 1, Россия
* E-mail: koak@mail.ru
Поступила в редакцию 28.05.2021
После доработки 11.08.2021
Принята к публикации 29.08.2021
Аннотация
Разработаны новые гидротермальные (ГТ) и гидротермально-микроволновые (ГТМВ) способы синтеза нанокристаллического селенида кадмия по реакции восстановления с использованием глюкозы и сульфита натрия. Образцы охарактеризованы методами рентгеновской дифракции, CHNS-анализа, электронной микроскопии. Установлено, что они кристаллизуются в кубической и/или гексагональной модификациях и представляют собой нанокомпозиты с содержанием органической части от 14 до 60 мас. %. Варьирование условий синтеза: температуры, соотношения реагентов, времени реакции – позволяет получать образцы с размерами областей когерентного рассеяния от 6 до 80 нм. Применение ГТМВ снижает время получения продуктов по сравнению с ГТ до 15 мин. Электрическое сопротивление нанокомпозитов, измеренное методом СВЧ-потерь, составляет 10–4–10–3 Ом см, что значительно ниже сопротивления соответствующих кристаллов селенида кадмия. Полученные данные объяснены наличием углеродсодержащих частей композита, составляющих оболочку частиц. Увеличение сечения “углеродных каналов” с уменьшением размеров наночастиц приводит к возрастанию проводимости.
ВВЕДЕНИЕ
Селенид кадмия – хорошо известный неорганический полупроводник n-типа и перспективный материал для фотовольтаики. Известны как твердофазные методы синтеза селенида кадмия [1, 2], так и синтезы в растворе. Растворные синтезы включают металлоорганические пути и водные пути реализации, которые отличаются друг от друга химической природой используемых реагентов, а также количеством стадий синтеза. В металлоорганическом варианте используется инжекционная технология при высоких температурах реакции. В работах [3, 4] диметилкадмий и селен растворяли в триалкилфосфине и в полученный раствор инжектировали оксид триоктилфосфина при 340–360°C. Этот метод позволяет получать квантовые точки CdSe с перспективными оптическими свойствами. В настоящее время появилось значительное количество вариаций металлоорганического синтеза CdSe. Однако использование токсичных и дорогостоящих реагентов, технологическая сложность и высокие температуры ограничивают широкое применение этого способа.
Синтез в водных растворах является альтернативным способом получения нанокристаллов CdSe. В таком варианте (табл. 1) реакционная температура значительно ниже и процедура реализации значительно проще по сравнению с металлоорганическим синтезом. Он включает два типа реакций: реакции ионного обмена и реакции восстановления. В качестве восстановителей наиболее часто используют боргидрид натрия и гидразин-гидрат. Обычно такие реакции имеют два этапа в технологической последовательности и длительное время (до 48 ч), что связано с предварительным получением и выделением Se-прекурсора. Для получения наночастиц часто используют синтез в обратных мицеллах, что требует использования дорогостоящих реагентов, таких как поверхностно-активные вещества (Aerosol OT, бромид цетилтриметиламмония) и комплексообразователи (тиогликолевая кислота, олеиновая кислота, меркаптопропионовая кислота). Кроме того, некоторые методы требуют атмосферы инертного газа, поскольку используются пирофорные восстановители (например, гидразин). Все это заставляет задуматься о возможном улучшении способа синтеза CdSe.
Таблица 1.
Литературные сведения о получении нанокристаллов CdSe с использованием низкотемпературных способов
| Реагенты | Число стадий | t, ºC | Структура | Размер частиц, нм | Литература | |||
|---|---|---|---|---|---|---|---|---|
| Cd2+-источник | Se2–-источник | восстано-витель | координирующий агент/лиганд | |||||
| CdSO4 | Se | Na2SO3 | Диоктилсульфосукцинат натрия | 2 | 60.7; 70 | * | 2.2 и 4.5 | [5] |
| Cd(NO3)2·5H2O | Na2SeO3 | N2H4·H2O | Цетилтриметиламмоний бромид |
1 | 180 | Гекс. | 40–60 | [6] |
| Cd(NO3)2·4H2O | Na2SeO3 | N2H4·H2O | Диоктилсульфосукцинат натрия | 1 | 100 | Гекс. | 15–75 | [7] |
| CdCl2 | Na2Se | – | Цетилтриметиламмоний бромид |
1 | 30–40 | Гекс. | 9 | [8] |
| CdCl2·2.5H2O | Se | NaBH4 | Цитрат натрия | 2 | 20–94 | Куб. | 2.0–3.2 | [9] |
| CdCl2·2.5H2O | Se | NaOH | ЭДТА | 2 | 80 | Куб. | 4–7 | [10] |
| Cd(OAc)2·2H2O | Se | Na2SO3 | Олеиновая кислота | 2 | 40–120 | Куб. | 2.1–2.7 | [11] |
| Cd(NO3)2·4H2O | Se | Na2SO3 | Тиогликолевая кислота | 1 | 120 | Куб. | 4.8 | [12] |
| CdCl2 | Se | NaBH4 | Меркаптопропионовая Кислота |
2 | 140 | Куб. | * | [13] |
| Сd(OAc)2 | Se | NaOH | Этиленгликоль | 3 | * | Гекс. | 5–7 | [14] |
| CdCl2·2H2O | Se | Na2SO3 | – | 2 | 120–180 | Гекс. | 10–60 | [15] |
| Cd(NO3)2·4H2O | Na2SeO3 | N2H4·H2O | ЭДТА, аммиак | 1 | 100–180 | Куб.; гекс. | 20–60 | [16] |
В данной работе предложен новый метод синтеза нанокристаллического CdSe, основанный на использовании гидротермальной (ГТ) или гидротермально-микроволновой (ГТМВ) обработки растворов, содержащих нитрат кадмия и селенит натрия. Кристалличность и размеры частиц оценены с использованием рентгеновской дифракции и электронной микроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали нитрат кадмия Cd(NO3)2⋅4H2O (“х. ч.”), селен Se (“ос. ч.”), селенит натрия Na2SeO3 (“х. ч.”), сульфит натрия Na2SO3 (“х. ч.”), D-глюкозу C6H12O6 (“х. ч.”), аммиак NH4OH (“ч. д. а.”), соляную кислоту, этанол и бидистиллированную воду. Водные растворы нитрата кадмия, селенита натрия, аммиака и D-глюкозы (или сульфита натрия) смешивали в определенной последовательности в тефлоновой ампуле емкостью 100 мл. Мольное соотношение селенит натрия : глюкоза составляло 2, 3 и 10 в разных синтезах. Концентрация D-глюкозы (или сульфита натрия) в итоговом растворе – 0.01–0.05 моль/л. Полученный прозрачный раствор подвергали двум видам термической обработки: ГТ и ГТМВ в течение заданных промежутков времени. ГТМВ-обработка осуществлялась в микроволновой печи MS-6 мощностью 1000 Вт при 130–200°С, давлении 3–17 атм. ГТ-обработку осуществляли в стальных автоклавах с тефлоновыми внутренними ампулами. Степень заполнения ампул составляла 20–50%, температура 130–200°С, при автоматически достигаемом давлении насыщенных паров компонентов при данной степени заполнения автоклава. После завершения реакции автоклавы охлаждали до комнатной температуры естественным образом. Образующийся осадок отделяли центрифугированием, для удаления примесей промывали соляной кислотой (1 мас. %), а также бидистиллированной водой, этанолом и сушили 6 ч на воздухе при 60°C.
Рентгенограммы порошкообразных образцов записывали на рентгеновском дифрактометре Shimadzu XRD-7000 в фильтрованном излучении СuKα (λ = 1.54178 Å) в области углов отражения 2θ от 10° до 70°. Систематические ошибки за счет геометрических факторов были устранены внесением поправки. Дебаеграммы образцов записывали на рентгеновском монокристальном дифрактометре Oxford Diffraction Gemini S в фильтрованном излучении СuKα. Образцы готовили в виде шариков размером около 2 мм, смешивая порошки CdSe c вазелином. Фазовый состав идентифицировали с использованием программного комплекса TOPAS [17] и базы данных PDF-2 [18].
Анализ методом растровой электронной микроскопии выполняли с использованием микроскопа высокого разрешения Carl Zeiss NVision40 при ускоряющем напряжении 5 кВ. Анализ проводили без напыления проводящего слоя на поверхность образца.
Микроморфологию образцов исследовали методом просвечивающей электронной микроскопии (ПЭМ) с использованием электронного микроскопа Leo912 AB Omega при ускоряющем напряжении 100 кВ. Перед съемкой образцы наносили на покрытые полимерной пленкой медные сетки диаметром 3.05 мм.
CHNS-анализ был выполнен на элементном анализаторе Elementar Vario EL Cube. Разложение образцов происходило в потоке кислорода при температуре 1200°C.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основываясь на литературных данных (табл. 1), в качестве исходных Se-содержащих реагентов мы использовали элементарный селен и селенит натрия. Попытки получить CdSe по реакции восстановления с использованием элементарного селена не привели к желаемому результату. Даже при продолжительном синтезе (до 48 ч) и высоких температурах (200–220°С) получить продукт не удалось. Мы полагаем, что металлический селен оказался не реакционноспособным в данных условиях. Реакционная способность вещества, как известно, во многом зависит от термической предыстории, состояния его поверхности, наличия дефектов и т.п. Поэтому аморфный или нанокристаллический селен будут быстрее реагировать в данных условиях. Мы предположили следующую цепочку: 1-я стадия – получение аморфного селена, 2-я стадия – восстановление селена до селенида с одновременным ионным обменом натрия на кадмий. Для исключения стадии выделения селена мы осуществили весь процесс в одном реакционном сосуде. Такая организация процесса очень эффективна и позволяет минимизировать отходы, экономит время и упрощает общую реализацию синтеза. Таким образом, в качестве исходного селенсодержащего реагента во всех последующих опытах мы использовали селенит натрия, поэтапное восстановление которого можно представить следующими химическими реакциями:
При проведении многокомпонентного синтеза в одном сосуде возможно протекание побочных реакций, приводящих к образованию примесных продуктов. Поэтому важное значение имеет порядок смешения реагентов. Изначально к раствору нитрата кадмия добавляли раствор аммиака до образования аммиачных комплексов (рН 12.8–13)
Сформированный на начальном этапе синтеза аммиачный комплекс позволяет избегать образования селенита и гидроксида кадмия (CdSeO3 и Cd(OH)2), т.е. фактически регулирует чистоту продукта. Далее к полученному прозрачному щелочному раствору добавляли селенит натрия и восстановитель (глюкозу или сульфит натрия [19]). Итоговый прозрачный раствор переносили в тефлоновые ампулы и подвергали ГТ- или ГТМВ-обработке. Целевая реакция не начиналась, пока раствор не нагревался до 100–130°С. На рентгенограммах некоторых продуктов обнаруживались соли металлов на уровне фона, которые полностью исчезали после промывки образцов 1%-ным раствором HCl.
В работе варьировали такие параметры синтеза, как соотношение Na2SeO3 : восстановитель, температура, давление, продолжительность, способ термообработки. Все экспериментальные условия суммированы в табл. 2.
Таблица 2.
Экспериментальные условия, размеры ОКР и параметры элементарных ячеек полученных образцов CdSe
| Мольное соотношение Na2SeO3 : восстановитель |
t, °С; p, атм |
Продолжительность | Результаты РФА (вклады модификаций) |
Размеры ОКР, нм | Параметры элементарной ячейки | Rwp, % | ||
|---|---|---|---|---|---|---|---|---|
| a, Å | c, Å | V, Å3 | ||||||
| ГТМВ-синтез (восстановитель глюкоза) | ||||||||
| 1 : 3 | 130; | 15 мин | CdSe куб. (42%), | 7.2 ± 1.3 | 6.04 | 220.35 | 12.05 | |
| 3 | CdSe гекс. (58%) | 7 ± 0.7 | 4.297 | 7.0065 | 112.0477 | 12.05 | ||
| 30 мин | CdSe куб. (49%), | 11.6 ± 1.9 | 6.04 | 220.34 | 8.25 | |||
| CdSe гекс. (51%) | 12.3 ± 1.1 | 4.2985 | 7.0152 | 112.25 | 8.25 | |||
| 200; | 15 мин | CdSe куб. (39%), | 13.2 ± 1.9 | 6.04 | 220.3489 | 8.02 | ||
| 17 | CdSe гекс. (61%) | 28.6 ± 5.1 | 4.2972 | 7.0065 | 112.0477 | 8.02 | ||
| 30 мин | CdSe куб. (40%), | 16.5 ± 0.7 | 6.074 | 224.09 | 6.43 | |||
| CdSe гекс. (60%) | 16.4 ± 0.6 | 4.296 | 7.016 | 112.14 | 6.43 | |||
| 1 : 10 | 130; | 15 мин | Se (100%) | |||||
| 3 | 30 мин | CdSe куб. (51%), | 6.9 ± 0.1 | 6.079 | 224.64 | 6.78 | ||
| CdSe гекс. (49%) | 6.1 ± 0.03 | 4.307 | 7.043 | 113.15 | 6.78 | |||
| 180; | 5 мин | Se (100%) | ||||||
| 12 | 30 мин | CdSe куб. (40%), | 20.9 ± 1.4 | 6.084 | 225.20 | 6.25 | ||
| CdSe гекс. (60%) | 17.1 ± 0.6 | 4.307 | 7.025 | 112.86 | 6.25 | |||
| 200; | 30 мин | CdSe куб. (49%), | 15.6 ± 1 | 6.071 | 223.76 | 6.45 | ||
| 17 | CdSe гекс. (51%) | 10.6 ± 0.2 | 4.293 | 7.019 | 112.03 | 6.45 | ||
| ГТ-синтез (восстановитель глюкоза) | ||||||||
| 1 : 3 | 130 | 42 ч | CdSe куб. (44%), | 7.4 ± 0.6 | 6.085 | 225.31 | 6.86 | |
| CdSe гекс. (56%) | 7.6 ± 0.2 | 4.302 | 7.013 | 112.40 | 6.86 | |||
| 180 | 42 ч | CdSe куб. (47%), | 11.9 ± 0.2 | 6.083 | 225.09 | 7.28 | ||
| CdSe гекс. (53%) | 13.2 ± 0.2 | 4.304 | 7.031 | 112.80 | 7.28 | |||
| 200 | 42 ч | CdSe куб. (49%), | 13.5 ± 0.3 | 6.078 | 224.53 | 6.4 | ||
| CdSe гекс. (51%) | 51.8 ± 12.4 | 4.296 | 7.017 | 112.15 | 6.4 | |||
| 1 : 10 | 200 | 42 ч | CdSe куб. (36%), | 25.9 ± 1.8 | 6.095 | 226.42 | 7.21 | |
| CdSe гекс. (64%) | 52.6 ± 6.3 | 4.310 | 7.039 | 113.24 | 7.21 | |||
| ГТ-синтез (восстановитель сульфит натрия) | ||||||||
| 1 : 2 | 160 | 12 ч* | CdSe гекс. (100%) | 53.1 ± 0.5 | 4.2939 | 7.0025 | 111.81 | 9.92 |
| 200 | 3 ч* | CdSe гекс. (100%) | 69.8 ± 1.2 | 4.2923 | 7.0020 | 111.72 | 8.99 | |
| 6 ч* | CdSe гекс. (100%) | 71.4 ± 0.9 | 4.2921 | 7.0003 | 111.68 | 9.38 | ||
| 200 | 6 ч** | CdSe гекс. (100%) | 34.5 ± 0.2 | 4.2951 | 7.0046 | 111.91 | 10.68 | |
| 12 ч** | CdSe гекс. (100%) | 76.2 ± 1.4 | 4.2927 | 7.0001 | 111.71 | 9.90 | ||
| 1 : 3 | 180 | 24 ч* | CdSe гекс. (100%) | 55.4 ± 2.6 | 4.2964 | 7.0087 | 112.04 | 7.96 |
| 1 : 10 | 200 | 24 ч* | CdSe гекс. (100%) | 63.3 ± 0.9 | 4.2935 | 7.0014 | 111.77 | 8.53 |
Кристаллическая структура и размер областей когерентного рассеяния. Согласно данным рентгенофазового анализа (РФА) (табл. 2), все образцы, полученные в ГТМВ-условиях, равно как и в ГТ, являются однофазными (CdSe) и обладают гексагональной кристаллической структурой вюртцита и кубической структурой цинковой обманки. Первоначально уточнение структуры проводили только по аналогу кубической модификации. Однако анализ соотношения интенсивностей дифракционных пиков (рис. 1а) показывает, что рефлекс 002 является самым интенсивным для всех образцов, синтезированных в этой работе, что противоречит данным рентгенографической базы, согласно которым наиболее интенсивным должен быть рефлекс 100. Поэтому было сделано предположение о наличии преимущественной ориентации при росте кристаллов CdSe вдоль направления [002]. Текстура проявляется в том, что интенсивность дифрагированного пучка в этом направлении может значительно возрастать или уменьшаться. Для проверки этого предположения были записаны дебаеграммы образцов, наиболее характерные из них представлены на рис. 2. Интенсивность равномерно распределена по кольцам, что говорит об отсутствии преимущественной ориентации.
Рис. 1.
Рентгенограмма CdSe, полученного ГТМВ-синтезом при мольном соотношении Na2SeO3 : C6H12O6 = 1 : 2, температуре 200°С и продолжительности 15 мин; а – соотнесение с базой данных [18]; б – вклад гексагональной модификации по полнопрофильному анализу; в – вклад кубической модификации по полнопрофильному анализу.
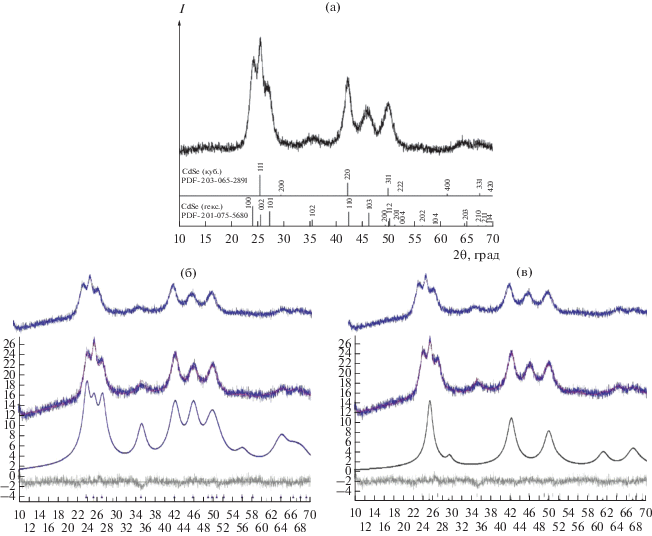
Рис. 2.
Дебаеграммы образцов CdSe, полученных в разных условиях: а – ГТМВ-синтез, 130°C, Na2SeO3 : C6H12O6 = = 1 : 10, продолжительность 30 мин; б – ГТ-синтез, 200°C, Na2SeO3 : C6H12O6 = 1 : 10, продолжительность 42 ч.

Далее мы проводили уточнение структуры, учитывая вклады обеих модификаций селенида кадмия: кубической и гексагональной (рис. 1б, 1в), без текстуры, но с учетом вклада напряжений. Размер формирующихся наночастиц оценивали по размеру областей когерентного рассеяния (ОКР). Параметры элементарной ячейки и величину ОКР рассчитывали методом полнопрофильного анализа с использованием программного обеспечения TOPAS. Размеры ОКР образцов селенида кадмия, вклады модификаций в зависимости от условий синтеза приведены в табл. 2, они позволяют также оценить фазообразование и эволюцию наночастиц при изменении условий синтеза.
Увеличение температуры синтеза приводит к укрупнению частиц (рис. 3). Так, для образцов, представленных на рис. 3, увеличение температуры синтеза от 130 до 200°С приводит к увеличению размера частиц от 7 до 50 нм. Значительное увеличение размера кристаллитов подтверждается результатами сканирующей электронной микроскопии (СЭМ): порошки, полученные при 180°С, состоят из относительно мелких частиц (11–13 нм), а при 200°С – из более крупных агрегатов с практически гладкой поверхностью (рис. 4). Сглаживание поверхности агрегатов, а также появление характерной огранки свидетельствуют о том, что при 200°С протекают процессы роста частиц, по-видимому, по механизму оствальдова созревания (растворения–кристаллизации). Увеличение продолжительности синтеза также способствует росту размера частиц.
Рис. 3.
Рентгенограммы образцов CdSe, синтезированных в ГТ-условиях: а – при разной продолжительности (24 и 42 ч) и при одинаковых температуре 200°C и мольном соотношении Na2SeO3 : C6H12O6 = 1 : 10; б – при разной температуре (130, 180, 200°С) и при одинаковых продолжительности (42 ч) и мольном соотношении Na2SeO3 : C6H12O6 = 1 : 3.
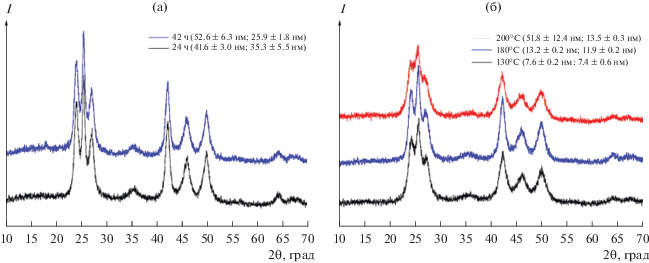
Сравнение рентгенограмм показывает, что в ГТ-методе зафиксировать кристаллический продукт можно не ранее чем через 3 ч. В случае микроволновой обработки уже через 15 мин формируется продукт (табл. 2, рис. 5). Таким образом, скорость формирования кристаллического продукта существенно возрастает при микроволновой обработке.
Рис. 5.
Рентгенограммы образцов CdSe, синтезированных в ГТМВ-условиях при разных мольных соотношениях Na2SeO3 : C6H12O6 и постоянных температуре 200°С и продолжительности 30 мин.
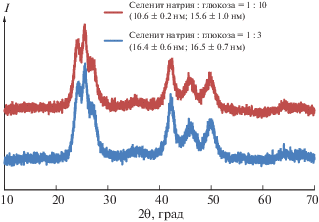
Наибольший интерес представляет изучение влияния количества глюкозы на продукт. При проведении реакции при мольных соотношениях селенит натрия : глюкоза 1 : 2, 1 : 3 и 1 : 10 оказалось, что размеры ОКР уменьшаются с увеличением указанного соотношения (табл. 2). Глюкоза, являясь восстановителем, в процессе реакции окисляется. Поскольку в данном случае синтез происходит в щелочной среде, окисление идет до глюконовой или глюкаровой кислот по реакциям
Мы полагаем, что продукты окисления глюкозы координируются на поверхности формирующихся частиц селенида кадмия, полимеризуются и образуют слой смолистых, карамелизованных полимерных продуктов – т. н. оболочку, которая препятствует дальнейшему росту наночастиц.
Следует также обратить внимание, что частицы обеих модификаций в микроволновом синтезе одинаковы по размерам, а в гидротермальном – нет, там гексагональные частицы крупнее кубических, хотя вклады модификаций сравнимы по величине.
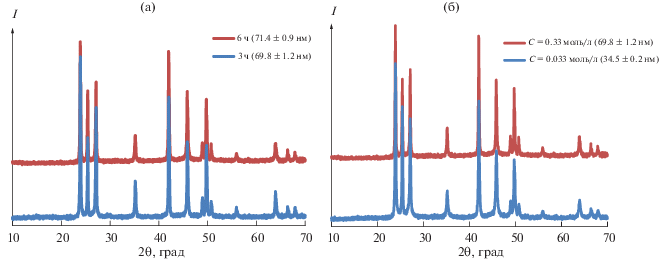
Изменение условий синтеза (концентрации, температуры, продолжительности) позволило, как мы видим, варьировать размеры частиц, но не способствовало получению продукта одной модификации (либо кубической, либо гексагональной). Вероятно, это связано с окислительно-восстановительным потенциалом используемого восстановителя (глюкозы). Применение восстановителя с более высоким потенциалом позволило решить эту проблему. С этой целью был проведен ряд экспериментов с сульфитом натрия. Последовательность операций и вся методика синтеза были идентичны синтезу с глюкозой, подробные условия представлены в табл. 2. Согласно данным РФА (рис. 6), все полученные образцы являются однофазными и обладают гексагональной кристаллической структурой вюртцита. По полученным данным видно, что размер ОКР увеличивается при возрастании продолжительности синтеза. Увеличение концентрации исходного раствора с 0.033 до 0.33 моль/л, т.е. в 10 раз, ведет к укрупнению частиц с 35 до 70 нм (рис. 6б), подтверждая, что в разбавленных растворах образуются более мелкие частицы.
Рис. 6.
Рентгенограммы образцов CdSe, полученных с использованием неорганического восстановителя при мольном соотношении Na2SeO3 : Na2SO3 = 1 : 2 и температуре 200°С: а – влияние продолжительности синтеза (6 и 3ч) на размер ОКР, концентрация Na2SeO3 0.33 моль/л; б – влияние концентрации Na2SeO3 (0.33 и 0.033 моль/л) на размер ОКР при постоянной продолжительности синтеза 6 ч.
Таким образом, использование неорганического восстановителя приводит к более крупным частицам, но позволяет получить частицы только одной структурной модификации, что важно для структурно-чувствительных областей применения.
Изображения, полученные методом ПЭМ (рис. 7), позволяют увидеть достаточно четкую гексагональную форму частиц. На увеличенном фрагменте ПЭМ (рис. 7б) также видно органическую оболочку нанокомпозита, о которой шла речь выше.
Рис. 7.
ПЭМ-изображения образцов CdSe: а – гексагональная модификация CdSe, синтезированная в ГТ-условиях при 180°C; б – увеличенный фрагмент.

Анализ изображений образцов в СЭМ оказался достаточно затруднен (рис. 4). Видно, что частицы образуют агломераты разного размера, поэтому форму и размер частиц по снимкам СЭМ не определяли. Очевидно, в данном случае агломерированию наночастиц способствует органическая оболочка.
Существование углеродсодержащей части (органической оболочки) в продуктах было зафиксировано различными методами. Количественное содержание С, H и N определяли на элементном CHNS-анализаторе. Из табл. 3 видно, что содержание органической части (суммарное содержание C, H, N) в наночастице достаточно большое и составляет от 14 до 60 мас. %. При этом оно пропорционально увеличивается с ростом температуры, временем синтеза, а также с повышением содержания глюкозы в реакционной системе. Вместе с тем, мольное соотношение элементов С : H : N сохраняется при изменении указанных условий. На основании этих данных мы склонны называть полученные продукты скорее нанокомпозитами, чем просто нанокристаллами или наночастицами.
Таблица 3.
Содержание С, Н, N в нанокомпозитах на основе селенида кадмия
| Мольное соотношение Na2SeO3 : глюкоза |
t, °С | Продолжительность | Вид синтеза | Содержание элементов, мас. % | ||
|---|---|---|---|---|---|---|
| С | H | N | ||||
| 1 : 3 | 180 | 30 мин | ГТМВ | 9.68 | 0.97 | 3.31 |
| 1 : 10 | 130 | 30 мин | ГТМВ | 14.55 | 1.29 | 3.98 |
| 200 | 30 мин | ГТМВ | 23.19 | 1.92 | 6.89 | |
| 1 : 3 | 130 | 42 ч | ГТ | 11.38 | 1.04 | 3.95 |
| 180 | 24 ч | ГТ | 22.00 | 1.87 | 7.76 | |
| 180 | 42 ч | ГТ | 19.83 | 1.55 | 6.93 | |
| 200 | 42 ч | ГТ | 23.66 | 1.76 | 8.21 | |
| 1 : 10 | 200 | 42 ч | ГТ | 42.07 | 3.25 | 12.48 |
С целью идентификации химической природы органической оболочки были записаны спектры протонного магнитного резонанса (ПМР). При приготовлении образца для записи спектра ~60 мг вещества растворяли в дейтерированном растворителе объемом 0.4 мл: в диметилсульфоксиде (ДМСО) или в дейтерированной воде D2O. В спектрах (рис. 8) обнаружены только линии поглощения растворителя – ДМСО и дейтерированной воды. Отсутствие сигналов протонов от органической части нанокомпозита свидетельствовало о ее низкой растворимости в этих растворителях, что подтверждает наше предположение об образовании смолистых, карамелеподобных продуктов. Таким образом, разделить органическую и неорганическую части наносистемы без изменения химической природы одной из них в данном случае было невозможно.
Термодеструкция нанокомпозита. Поскольку состав органической оболочки практически не изменяется от синтеза к синтезу, а ее количество зависит от параметров синтеза, то для термогравиметрического анализа был выбран образец с невысоким содержанием органической части. Идентификация продуктов термической десорбции и пиролиза композитного материала проведена на основании базы данных NIST [20].
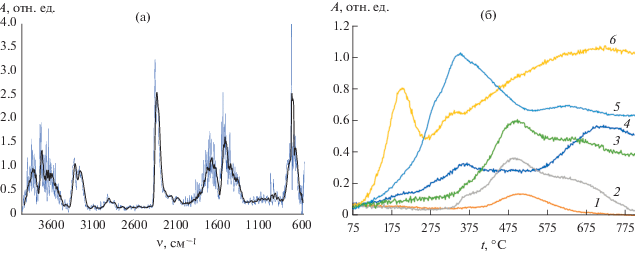
Типичные кривые термического анализа синтезированных образцов и ИК-спектры газов, выделяющихся при их термораспаде, в зависимости от времени показаны на рис. 9а и 9б соответственно. ИК-спектры газовой фазы, образующейся при термораспаде нанокомпозитов, в зависимости от температуры представлены на рис. 10.
Рис. 9.
Термораспад образца CdSe: а – кривые ДСК и ТГА; б – ИК-спектры газов, выделяющихся при термораспаде.
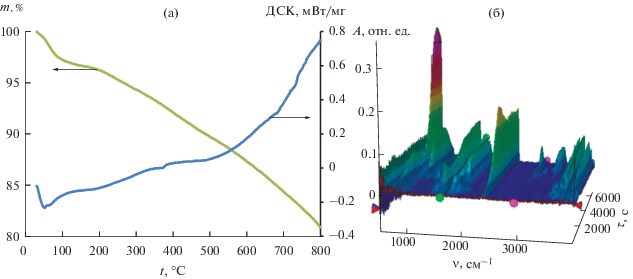
Рис. 10.
ИК-спектральный анализ газовой фазы при термораспаде образца CdSe: а – ИК-спектр газовой фазы при термической десорбции и пиролизе; б – изменения интегральной оптической плотности в области характеристических полос поглощения в ИК-спектрах газовой фазы при термической десорбции и пиролизе: 1 –симметричное валентное колебание С–Н-связи в диапазоне 3028–3010 см–1, характерное для метана; 2 – симметричное деформационное колебание NH3 в диапазоне 1100–1060 см–1; 3 – разность полос поглощения в диапазонах 3800–3750 и 1660–1620 см–1, характерных для поглощения спиртовых ОН-групп; 4 – деформационное колебание HCN в диапазоне 730–710 см–1; 5 – асимметричное валентное колебание CO2 в диапазоне 2410–2340 см–1; 6 – валентное колебание ОН-групп в диапазоне 3800–3750 см–1.
Пиролиз композитного материала при 800°С в атмосфере аргона приводил к потере 19.1% массы образца. На ДСК-кривой отсутствуют четко выраженные пики термодеструкции и структурной перестройки материала.
В интервале температур 30–150°С тепловые свойства композита определял процесс термической десорбции воды, захваченной в ходе синтеза и физически ограниченной структурой материала. Термодесорбция приводила к потере 2.8% массы образца и была подтверждена появлением в ИК-спектрах газовой фазы (рис. 10б) полос поглощения в области ~3770 и ~1600 см–1, отнесенных к валентному колебанию ОН-группы и деформационному колебанию H2O соответственно.
Дальнейший нагрев материала с 150 до 300°С приводил к потере 2.3% массы и появлению в ИК-спектрах газовой фазы полосы поглощения асимметричного валентного колебания углекислого газа при ~2360 см–1. Выделение углекислого газа начиналось при ~120°C, достигало максимума при 275°С, постепенно спадало к 410°C и было нами объяснено декарбоксилированием глюконовой кислоты, входящей в структуру композитного материала, т.е. свидетельствовало о начальной стадии термодеструкции органической фазы полученного материала. Процесс термодеструкции при 275°C приводил к выделению в газовую смесь молочной кислоты, имеющей полосы поглощения при 1795 и 1164 см–1, отнесенные к валентным колебаниям групп С=О и С–О соответственно.
Начиная с 370°С деструкция композита сопровождалась повторным появлением в ИК-спектрах пиролитических газов полос поглощения валентного и деформационного колебаний воды, которое мы объясняем дегидратацией глюконовой кислоты и продуктов ее декарбоксилирования. Начиная с этой же температуры в ИК-спектрах появлялась характерная для аммиака полоса поглощения симметричного деформационного колебания при 1078 см–1, интенсивность которой увеличивалась до 550°С и постепенно спадала к 800°С.
Дегидратация является основным тепловым процессом моносахаридов и других полиспиртов и сопровождается хорошо заметными максимумами на кривой ДСК в интервале температур ~200–300°С.
В интервале 550–800°С, одновременно с уменьшением интенсивности полосы поглощения симметричного деформационного колебания аммиака, зарегистрирован рост полосы поглощения при 715 см–1, отнесенной к деформационному колебанию HCN. Интенсивность этой полосы поглощения увеличивалась вплоть до 800°С. В этом же интервале температур наблюдался рост полосы поглощения симметричного валентного колебания связи С–Н при 3016 см–1, характерной для метана.
Образование метана при нагреве свыше 550°С говорит о глубокой структурной термодеструкции органической фазы композитного материала, а уменьшение концентрации аммиака, выделяемого образцом, с одновременным увеличением концентрации циановодорода свидетельствуют о его высокотемпературном синтезе, предположительно катализированном селенидом кадмия [21].
Электрическое сопротивление композитного материала. В образцах, синтезированных с помощью неорганического восстановителя, спектры ЭПР не наблюдались.
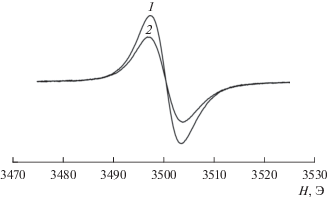
В образцах нанокомпозитов, имеющих углеродсодержащую часть, наблюдались спектры ЭПР (рис. 11), состоящие из одиночных линий с параметрами: g = 2.0033 ± 0.0003 и ΔHpp = 6.2 ± 0.3 Э, которые мы связываем с наличием ненасыщенных углерод-углеродных связей. При регистрации спектров ЭПР было замечено, что добротность резонатора зависит от размеров синтезированных наночастиц: при размерах ≤10 нм она была минимальна и возрастала для образцов с характерными размерами кристаллов ≈50 нм.
Рис. 11.
Типичный вид спектров ЭПР образцов CdSe, синтезированных при мольном соотношении Na2SeO3 : C6H12O6 = 1 : 10: 1 – ГТ-синтез, 200°С, 42 ч; 2 – ГТМВ-синтез, 130°C, 30 мин.
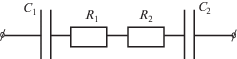
Оценка эффективного удельного сопротивления была сделана по экспериментальным значениям добротности резонатора, определенной из спектра ЭПР с использованием модели, в которой образец представлен в виде эквивалентной схемы последовательно соединенных емкости и сопротивления [22] (рис. 12). Поскольку стекло капилляров, в которые помещался исследуемый образец, также вносило вклад в величину добротности, то для учета этого вклада фиксировалась добротность резонатора как последовательной R–C-цепочки. При описании добротности резонатора с образцом полагалось, что R–C-цепи порошка и капилляра включены параллельно. В качестве эталонного использовался образец кремния марки КДБ7,5 с размерами 0.3 × 1.5 × 10 мм, который также помещался в капилляр и с ним точно так же настраивался резонатор. Кроме этого, настройка резонатора выполнялась и с пустым капилляром.
Рис. 12.
Эквивалентная схема электрической цепи с образцом для измерения удельного сопротивления емкостным методом.
Удельное сопротивление для образцов оценивалось по формуле
Здесь ρобр и ρэт – удельные сопротивления образца и эталона соответственно; Sэт = 0.3 × 1.5 мм – поперечное сечение эталона; Sобр – площадь поперечного сечения капилляра, где размещался синтезированный порошок; lэт = 10 мм – длина эталонного образца; lобр – длина капилляра, на которую он заполнен порошком; Qэт, Qкап, Qобр – добротности резонатора с эталоном, с пустым капилляром и с образцом соответственно.
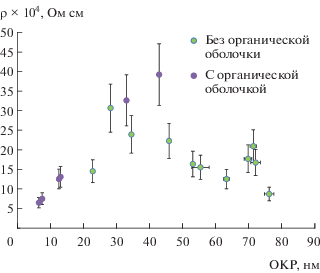
Рассчитанные на основе экспериментальных частот и добротностей по представленным выше формулам значения сопротивления представлены на рис. 13. Из-за большой погрешности в таких измерениях экспериментальные точки имеют значительный разброс. Однако обращают на себя внимание следующие факты. Во-первых, эффективное сопротивление порошков в СВЧ-диапазоне имеет довольно низкие значения и находится в интервале 10–4–10–3 Ом см. Это говорит о том, что полученные нанопорошки имеют электрическую проводимость, на 2 порядка превышающую значения для обычного кристаллического селенида кадмия (0.1–1 Ом см). Во-вторых, наблюдается качественная тенденция уменьшения сопротивления образца при уменьшении размера зерна для образцов, содержащих органическую оболочку. Порошок в электромагнитном поле можно рассматривать как случайную сетку сопротивлений [23], состоящую из участков с большим сопротивлением (частицы CdSe) и участков с малыми сопротивлениями (углеродные части органической оболочки, покрывающей частицы CdSe). Если на качественном уровне представить, что частицы имеют близкую к шарообразной форму, а углеродная часть – это оболочка, покрывающая ее, то можно геометрически рассчитать относительное содержание органической части как Vоб/Vч для частиц разного размера и разной толщины углеродной пленки-оболочки (табл. 4). Очевидно, что с уменьшением размера частиц доля органической оболочки возрастает. Это позволяет предполагать, что органическая часть является именно наружной оболочкой, а не внутренними вкраплениями. И именно это увеличение относительной доли углеродной оболочки в нанокомпозите, иначе говоря, увеличение эффективного сечения углеродных “каналов” при небольших размерах частиц приводит к возрастанию проводимости.
Таблица 4.
Теоретический расчет геометрических параметров органической оболочки частиц нанокомпозита
| Диаметр частицы без оболочки, нм |
Предполагаемая толщина органической оболочки, нм |
Vоб/Vч, %* | ||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 1 | 2 | 3 | |
| 5 | 0.5 | 1 | 2 | 72.8 | 174.4 | 483.2 |
| 6 | 0.5 | 1 | 2 | 58.8 | 137.0 | 363.0 |
| 7 | 0.5 | 1 | 2 | 49.3 | 112.5 | 288.0 |
| 8 | 0.5 | 1 | 2 | 42.4 | 95.3 | 237.5 |
| 9 | 0.5 | 1 | 2 | 37.2 | 82.6 | 201.4 |
| 10 | 0.5 | 1 | 2 | 33.1 | 72.8 | 174.4 |
| 20 | 0.5 | 1 | 2 | 15.8 | 33.1 | 72.8 |
| 30 | 0.5 | 1 | 2 | 10.3 | 21.4 | 45.6 |
| 40 | 0.5 | 1 | 2 | 7.7 | 15.8 | 33.1 |
| 50 | 0.5 | 1 | 2 | 6.1 | 12.5 | 26.0 |
| 100 | 0.5 | 1 | 2 | 3.0 | 6.1 | 12.5 |
ЗАКЛЮЧЕНИЕ
Новые ГТ- и ГТМВ-способы проведения реакции восстановления с глюкозой или сульфитом натрия упрощают синтез нанокомпозитов селенида кадмия и позволяют проводить его в одну стадию.
Варьирование условий синтеза позволяет получать образцы кубической и/или гексагональной модификаций с размерами ОКР от 6 до 80 нм.
Наличие углеродсодержащей оболочки наночастиц позволило предположить у них достаточно низкое электрическое сопротивление. Его измерение показало величину порядка 10–4–10–3 Ом см, что значительно ниже сопротивления соответствующих кристаллов CdSe.
Список литературы
Stijn Flamee, Marco Cirillo, Sofie Abe, Kim De Nolf, Raquel Gomes, Tangi Aubert, Zeger Hens. Fast, High Yield, and High Solid Loading Synthesis of Metal Selenide Nanocrystals // Chem. Mater. 2013. V. 25. № 12. P. 2476–2483.
Srvani Gullapalli, Jason M. Grider, Hitesh G. Bagaria, Kyu-Sung Lee, Minjung Cho, Vicky L. Colvin, Ghassan E. Jabbour, Michael S. Wong. Molten-Droplet Synthesis of Composite CdSe Hollow Nanoparties // Nanotechnology. 2012. V. 23. № 49. P. 495605.
Xiaogang Peng, Liberato Manna, Weidong Yang, Juanita Wickham, Erik Scher, Andreas Kadavanich, Alivisatos A.P. Shape Control of CdSe Nanocrystals // Nature. 2000. V. 404. P. 59–61.
Adam Peng Z., Xiaogang Peng. Nearly Monodisperse and Shape-Controlled CdSe Nanocrystals via Alternative Routes: Nucleation and Growth // J. Am. Chem. Soc. 2002. V. 124. № 13. P. 3343–3353.
Гак В.Ю., Бричкин С.Б., Разумов В.Ф. Спектрально-люминесцентные свойства наночастиц селенида кадмия, синтезированных в обратных мицелах АОТ // Химия высоких энергий. 2010. Т. 44. № 6. С. 560–565.
Minghai Chen, Lian Gao. Synthesis and Characterization of Selenide Nanorods Via Surfactant-Assisted Hydrothermal Method // J. Am. Ceram. Soc. 2005. V. 88. № 6. P. 1643–1646.
Xi L.F., Lam Y.M. Synthesis and Characterization of CdSe Nanorods Using a Novel Microemulsion Method at Moderate Temperature // J. Colloid Interface Sci. 2007. V. 316. № 2. P. 771–778.
Chen C.C., Chao C.Y., Lang Z.H. Simple Solution-Phase Synthesis of Soluble CdS and CdSe Nanorods // Chem. Mater. 2000. V. 12. № 6. P. 1516–1518.
Da-Wei Deng, Jun-Sheng Yu, Yi Pan. Water-Soluble CdSe/CdS Nanocrystals: A Greener Synthetic Route // J. Colloid Interface Sci. 2006. V. 299. № 1. P. 225–232.
Weixin Zhang, Cheng Wang, Lei Zhang, Xiaoming Zhang, Xianming Liu, Kaibin Tang, Yitai Qian. Room Temperature Synthesis of Cubic Nanocrystalline CdSe in Aqueous Solution // J. Solid State Chem. 2000. V. 151. № 2. P. 241–244.
Delele Worku Ayele, Hung-Ming Chen, Wei-Nien Su, Chun-Jern Pan, Liang-Yih Chen, Hung-Lung Chou, Ju-Hsiang Cheng, Bing-Joe Hwang, Jyh-Fu Lee. Controller Synthesis of CdSe Quantum Dots by a Microwave-Enhanced Process: A Green Approach for Mass Production // Chem. Eur. J. 2011. V. 17. № 20. P. 5737–5744.
Tongtong Xuan, Xiaojun Wang, Guang Zhu, Huili Li, Likun Pan, Zhuo Su. One-Step Microwave-Assisted Synthesis of Water Soluble CdSe Quantum Dots for White Light-Emitting Diodes with Excellent Color Rendering // J. Alloys Compd. 2013. V. 558. P. 105–108.
Huifeng Qian, Liang Li, Jicun Ren. One-Step and Rapid Synthesis of High Quality Alloyed Quantum Dots (CdSe-CdS) in Aqueous Phase by Microwave Irradiation with Controllable Temperature // Mater. Res. Bull. 2005. V. 40. № 10. P. 1726–1736.
Grisaru H., Palchik O., Gedanken A., Palchic V., Slif-kin M.A., Weiss A.M., Rosenfeld Hacohen Y. Preparation of Cd1 – xZnxSe using Microwave-Assisted Polyol Synthesis // Inorg. Chem. 2001. V. 40. № 19. P. 4814–4815.
Fen Xu, Wei Zhou, Navrotsky A. Cadmium Selenide: Surface and Nanoparticle Energetics // J. Mater. Res. 2011. V. 26. № 5. P. 720–725.
Peng Q., Dong Y.J., Deng Z.X., Li Y.D. Selective Synthesis and Characterization of CdSe Nanorods and Fractal Nanocrystals // Inorg. Chem. 2002. V. 41. № 20. P. 5249–5254.
Bruker AXS. TOPAS. Version 4.2. Copyright 1999, 2009 Bruker AXS. www.bruker-axs.de.
DIFFRAC.EVA. Release 2011. Copyright Bruker AXS 2010, 2011. Version 2.0. www.bruker-axs.com.
Назаренко И.И., Ермаков А.Н. Аналитическая химия селена и теллура, М: Наука, 1971. 251 с.
Coblentz Society, Inc., Evaluated Infrared Reference Spectra // NIST Chemistry WebBook, NIST Standard Reference Database Number 69 / Eds. Linstrom P.J. and Mallard W.G., Gaithersburg: National Institute of Standards and Technology, 20899. https://doi.org/10.18434/T4D303
Endter F. Die technische Synthese von Cyanwasserstoff aus Methan und Ammoniak ohne Zusatz von Sauerstoff // Chem. Ing. Tech. 1958. V. 30. № 5. P. 305–310. https://doi.org/10.1002/cite.330300506
Павлов Л.П. Методы измерения параметров полупроводниковых материалов. М.: Высшая школа, 1987. 239 с.
Шкловский Б.И., Эфрос А.Л. Электронные свойства легированных полупроводников. М.: Наука, 1979. 416 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы