Неорганические материалы, 2021, T. 57, № 2, стр. 150-153
Система КLa(SO4)2–CaSO4
Н. Н. Бушуев 1, *, А. Н. Егорова 1, Г. С. Тюльбенджян 1
1 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: nbushuev@muctr.ru
Поступила в редакцию 30.06.2020
После доработки 05.10.2020
Принята к публикации 06.10.2020
Аннотация
Методом твердофазных реакций исследовано взаимодействие KLa(SO4)2 и CaSO4 при температурах 600–800°С. С использованием термогравиметрии и рентгенофазового анализа построена фазовая диаграммa системы KLa(SO4)2–CaSO4. В данной системе не образуется промежуточных соединений и твердых растворов. Двойной сульфат KLa(SO4)2 разлагается при температуре 970°С. Эндотермический эффект при температуре 900°С наблюдается во всем концентрационном интервале и относится к линии эвтектики. На ДТА-кривых исходных компонентов – KLa(SO4)2 и СаSO4 – этот эффект отсутствует. Максимальная величина указанного эффекта при 900°С отвечает эвтектике, содержащей 70 мол. % СаSO4.
ВВЕДЕНИЕ
Безводный сульфат кальция СаSO4, а также его кристаллогидратные модификации СаSO4 · 2Н2О и СаSO4 · 0.5Н2О находят широкое использование в производстве вяжущих и строительных материалов, а также в медицине. Фазовые диаграммы с участием сульфата кальция, например СаSO4–SrSO4 [1], позволили определить температурные и концентрационные интервалы синтеза материалов для замены суставов и костных тканей [2].
C другой стороны, сульфат кальция используется в качестве абсорбента редкоземельных элементов (РЗЭ) и Sr благодаря изоморфному изовалентному замещению ионов Са2+ на Sr2+ или гетеровалентному замещению по схеме: 2Са2+ → → Na+ + Ln3+.
Известно, что в бинарных системах СаSO4–NaLn(SO4)2, где Ln = La, Ce, Nd, существуют достаточно широкие области гомогенности на основе СаSO4 [3–8]. Образование твердого раствора на основе сульфата кальция объясняется гетеровалентным замещением ионов Ca2+ на ионы Na+ и Ln3+, имеющих очень близкие размеры радиусов – 1.02 Å. В литературе отсутствуют сведения о гетеровалентном замещении в структуре безводной модификации СаSO4 с участием ионов калия по схеме: 2Ca2+ → K+ + Ln3+.
Целью настоящей работы является исследование системы KLa(SO4)2–CaSO4 в широких концентрационном и температурном интервалах и построение ее фазовой диаграммы, а также определение возможности абсорбции РЗЭ в результате гетеровалентного замещения 2Ca2+ → K+ + Ln3+ и образования твердых растворов на основе CaSO4.
МЕТОДИКА И РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
В качестве исходных образцов использовали СаSO4 квалификации “х. ч.” и предварительно синтезированный KLa(SO4)2. Двойной сульфат калия-лантана синтезирован из сульфатов K2SO4 (“х. ч.”) и La2(SO4)3 (“х. ч.”) в результате твердофазного взаимодействия. Образцы тщательно смешивали и перетирали в агатовой ступке и далее подвергали отжигу при температуре 550°С в течение 30 ч с промежуточными перетираниями через каждые 5 ч с целью увеличения скорости твердофазных реакций и достижения состояния равновесия.
Рентгенографический анализ выполнен с использованием фокусирующей камеры-монохроматора G-670 (фирма HUBER, CuKα1-излучение, шаг измерения 0.005° 2θ) и программного комплекса WinXPOW (version 2.20 2006 г.) фирмы STOE. Точность определения параметров элементарной ячейки составляла 0.002 Å. Однофазность полученного соединения KLa(SO4)2 была рентгенографически подтверждена. В табл. 1 приведены рентгенографические характеристики синтезированного KLa(SO4)2. Параметры триклинной элементарной ячейки: а = 7.027(2) Å, b = 8.498 (2) Å, с = 5.436 (1) Å, α = 91.76 (2)°, β = = 91.34 (2)°, γ = 86.57 (2)°, V = 322.8 (2) Å3.
Таблица 1.
Рентгенографические характеристики KLa(SO4)2
| d, Å | I, % | h k l |
|---|---|---|
| 8.500 | 9.60 | 0 1 0 |
| 7.025 | 18.32 | 1 0 0 |
| 5.569 | 66.89 | 1 1 0 |
| 5.437 | 10.07 | 0 0 1 |
| 5.253 | 33.93 | $\bar {1}$ 1 0 |
| 4.642 | 30.02 | 0 $\bar {1}$ 1 |
| 4.516 | 14.62 | 0 1 1 |
| 4.340 | 21.20 | $\bar {1}$ 0 1 |
| 4.246 | 10.09 | 0 2 0 |
| 3.822 | 20.45 | 1 1 1 |
| 3.783 | 21.48 | 1 $\bar {1}$ 1 |
| 3.730 | 5.14 | 1 2 0 |
| 3.501 | 54.21 | 2 0 0 |
| 3.395 | 19.60 | 0 $\bar {2}$ 1 |
| 3.302 | 100.00 | 0 2 1 |
| 3.130 | 53.83 | $\bar {1}$$\bar {2}$ 1 |
| 3.022 | 8.04 | 1 2 1 |
| 2.984 | 45.33 | 1 $\bar {2}$ 1 |
| 2.946 | 35.65 | $\bar {1}$ 2 1 |
| 2.916 | 1.45 | 2 0 1 |
| 2.865 | 1.00 | $\bar {2}$$\bar {1}$ 1 |
| 2.785 | 5.80 | 2 2 0 |
| 2.748 | 53.38 | $\bar {2}$ 1 1 |
| 2.731 | 17.12 | 2 $\bar {1}$ 1 |
| 2.718 | 46.47 | 0 0 2 |
| 2.612 | 4.18 | 0 $\bar {1}$ 2 |
| 2.565 | 14.30 | 0 1 2 |
| 2.541 | 10.84 | 0 $\bar {3}$ 1 |
| 2.514 | 15.29 | $\bar {2}$$\bar {2}$ 1 |
| 2.478 | 17.50 | $\bar {1}$$\bar {1}$ 2 |
| 2.440 | 24.98 | 2 2 1 |
| 2.412 | 2.60 | $\bar {1}$ 1 2 |
| 2.368 | 5.03 | 2 $\bar {2}$ 1 |
| 2.360 | 3.87 | $\bar {2}$ 2 1 |
| 2.344 | 1.86 | 1 $\bar {3}$ 1 |
| 2.320 | 15.48 | 0 $\bar {2}$ 2 |
| 2.306 | 5.64 | $\bar {1}$ 3 1 |
| 2.266 | 9.49 | 2 3 0 |
| 2.236 | 3.37 | $\bar {1}$$\bar {2}$ 2 |
| 2.169 | 13.67 | 1 $\bar {2}$ 2 |
| 2.160 | 13.90 | 1 2 2 |
| 2.139 | 21.35 | $\bar {2}$ 3 0 |
| 2.128 | 21.72 | 2 0 2 |
| 2.065 | 56.57 | $\bar {3}$ 1 1 |
| 2.054 | 12.50 | 2 $\bar {1}$ 2 |
| 1.9959 | 36.63 | 0 $\bar {4}$ 1 |
| 1.9821 | 15.61 | $\bar {3}$$\bar {2}$ 1 |
Образцы СаSO4 и синтезированного KLa(SO4)2 с шагом 10 мол. % тщательно перетирали и подвергали отжигу при температуре 750–800°С в течение 30 ч с промежуточными перетираниями через каждые 10 ч с целью достижения состояния равновесия. Рентгенофазовый анализ образцов системы KLa(SO4)2–CaSO4, отожженных при температуре 800°С, не показал образования каких-либо промежуточных соединений или твердых растворов на основе CaSO4. Термогравиметрический анализ выполнен с использованием аппарата Netzsch STA 409 PC (скорость нагревания 10°С/мин).
В результате выполненных исследований впервые построена фазовая диаграмма KLa(SO4)2– CaSO4 (рис. 1).
Рис. 1.
Диаграмма состояния системы KLa(SO4)2–CaSO4: І – KLn(SO4)2, ІІβ – β-CaSO4, ІІα – α-CaSO4 (пунктир – линия ликвидуса).
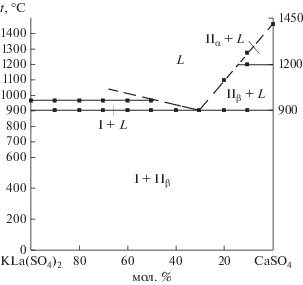
Двойной сульфат KLa(SO4)2 разлагается при температуре 970°С с выделением оксидов SO3, La2O3 и K2SO4. Эндотермические эффекты разложения KLa(SO4)2 при температуре 970°С в концентрационной области 100–50 мол. % KLa(SO4)2 отмечены на линии его разложения (рис. 1). Cульфат кальция CaSO4 плавится с разложением при температуре 1450°С и претерпевает полиморфное превращение при 1200°С. Эндотермический эффект при температуре 900°С наблюдается на кривых нагревания во всем концентрационном интервале и относится к линии эвтектики. На ДТА-кривых исходных образцов KLa(SO4)2 и CaSO4 эндотермический эффект при температуре 900°С отсутствует. Максимальная величина эндотермического эффекта эвтектики отвечает составу 70 мол. % CaSO4.
В результате разложения KLa(SO4)2 система превращается в многокомпонентную, поэтому ее нельзя рассматривать как бинарную выше температуры разложения KLa(SO4)2 – при 970°С. Разложение двойного сульфата KLa(SO4)2 с выделением SO3 и образованием La2O3 может носить достаточно сложный характер и в настоящей работе не рассматривается.
Образующийся оксид лантана способствует разложению CaSO4, особенно выше температуры полиморфного превращения сульфата кальция при 1200°С. Взаимодействие оксида лантана с сульфатом кальция носит сложный характер и может протекать через стадию образования метастабильного оксисульфата кальция CaO · CaSO4 переменного состава на основе твердого раствора высокотемпературной кубической модификации α‑CaSO4 [3, 8].
Взаимодействие оксида кальция с оксидом лантана исследовано в работах [9, 10]. Установлено, что в результате высокотемпературной обработки СaO (при 1650°C) в присутствии La2O3 параметры кристаллической решетки CaO заметно возрастают в результате образования твердого раствора. Можно сделать вывод, что оксид лантана, взаимодействуя с сульфатом кальция при высоких температурах, может способствовать снижению температуры разложения CaSO4 с образованием оксида кальция CaO. В результате последующего взаимодействия оксида кальция с оксидом лантана образуется твердый раствор CaO–La2O3. Влияние оксида лантана на разложение солей кальция может носить и другой характер. Например, в работе [11] установлено, что оксид лантана способствует снижению температуры разложения карбоната кальция СaCO3 c 875 до 736°С, что имеет значение в технологии получения СaO.
В работе [3] установлено, что в системе NaLa(SO4)2–CaSO4 образуются два промежуточных соединения составов 4 : 1 и 2 : 3 и широкая область (100–80 мол. % СaSO4) твердых растворов на основе сульфата кальция. Тройной сульфат состава NaLa4Ca(SO4)9 существует в узком температурном интервале: образуется при 800°С и разлагается в твердой фазе при 900°С. Тройной сульфат состава Na2La2Ca3(SO4)7 более устойчив, разлагается при температуре 1125°С и имеет структуру, производную от структуры СaSO4.
В результате выполненного исследования можно сделать вывод, что в системе KLa(SO4)2–CaSO4 в отличие от системы NaLa(SO4)2–CaSO4 не образуется никаких промежуточных соединений или твердых растворов на основе структуры безводной и нерастворимой модификации CaSO4, что исключает возможность изоморфного включения лантана по схеме гетеровалентного замещения: 2Ca2+ → K+ + La3+.
В противоположность данному исследованию с участием ионов калия более ранние исследования с участием ионов натрия на примере безводных систем NaLn(SO4)2–CaSO4 [3–8], а также аналогичных кристаллогидратных систем NaLn(SO4)2 · · H2O– CaSO4 · 0.5H2O (Ln = La, Ce, Nd) [7, 8, 12] свидетельствуют о наличии широких областей твердых растворов с включением РЗЭ в кристаллическую структуру как CaSO4 · 0.5H2O при низких температурах, так и CaSO4 при высоких температурах (600–800°С).
Хорошо известно, что щелочные металлы, в том числе и калий, способствуют кристаллизации сульфата лантана на поверхности кристаллов CaSO4 · 0.5H2O. Природа этого явления еще недостаточно изучена. Однако можно с уверенностью предполагать, что использование дешевого абсорбента с участием чистого, не содержащего натрий, CaSO4 · 0.5H2O, и сульфата калия может привести к успешной абсорбции лантана и его десорбции после термической обработки при температуре 600–800°С.
Сульфат кальция CaSO4 переходит в нерастворимую модификацию выше 600°С [13]. Двойной сульфат KLa(SO4)2, а также сульфат калия K2SO4 имеют существенно более высокую растворимость, чем безводный β-CaSO4, что может способствовать отделению РЗЭ от нерастворимой β-модификации сульфата кальция.
Полученные результаты могут быть полезны как при разработке технологии извлечения РЗЭ с использованием дешевого абсорбента CaSO4, так и при его переработке с получением строительного материала в виде сульфата, оксида или гидроксида кальция.
Список литературы
Бушуев Н.Н., Никонова Н.С., Мишенина Н.В. Система CaSО4–SrSО4 // Журн. неорган. химии. 1988. Т. 33. № 2. С. 531–534.
Ying-Cen Chen, Pei-Yi Hsu, W. Tuan, Po-Liang Lai. From Phase Diagram to the Design of Strontium-Containing Carrier // J. Asian Ceram. Soc. Published online: 05 Jun 2020. https://doi.org/10.1080/21870764.2020.1774972
Бушуев Н.Н., Тавровская А.Я., Бабаев С.И., Егорова А.Н. Исследование системы NaLa(SO4)2–CaSO4 // Журн. неорган. химии. 1989. Т. 34. № 3. С. 179–183.
Бушуев Н.Н., Ефремов О.Н., Тавровская А.Я. Система NaCe(SO4)2–CaSO4 // Журн. неорган. химии. 1988. Т. 33. № 3. С. 743–746.
Бушуев Н.Н., Тавровская А.Я., Зайцев П.М. Система NaNd(SO4)2–CaSO4 // Журн. неорган. химии. 1988. Т. 33. № 9. С. 2420–2422.
Бушуев Н.Н., Галактионов С.С., Майер А.А. Исследование систем NaLn(SO)2–CaSO4, Ln – La, Ce, Nd // Изв. АН СССР. Неорган. материалы. 1990. Т. 26. № 1. С. 167–171.
Бушуев Н.Н., Набиев А.Г., Классен П.В. Влияние примесей на кристаллизацию сульфата кальция в производстве экстракционной фосфорной кислоты. Сер. Минеральные удобрения и серная кислота. М.: НИИТЭХИМ, 1990. 36 с.
Бушуев Н.Н. Физико-химическое исследование структурных особенностей сульфата кальция. Сер. Минеральные удобрения и серная кислота. М.: НИИТЭХИМ, 1990. 31 с.
Zhang H., Zhao H., Chen J., Li J., Yu J., Nie J. Defect Study of MgO–CaO Material Doped with CeO2 // Adv. Mater. Sci. Eng. 2013. V. 2013. P. 5. ID 673786.
Ghoneim N.M., Mandour M.A., Serry M.A. Sintering of Lime Doped with La2O3 and CeO2 // Ceram. Int. 1989. V. 15. № 6. P. 357–362.
Бушуев Н.Н., Зинин Д.С. Особенности термического разложения оксалатов кальция и РЗЭ // Журн. неорган. химии. 2016. Т. 61. № 2. С. 173–179.
Бушуев Н.Н., Набиев А.Г., Петропавловский И.А., Смирнова И.С. Характер включения РЗЭ цериевой подгруппы в структуре кристаллогидратов сульфата кальция // ЖПХ. 1988. Т. 61. № 10. С. 2153–2158.
Бушуев Н.Н., Масленников Б.М., Борисов В.М. Фазовые переходы при дегидратации CaSО4 · 2Н2О // Журн. неорган. химии. 1983. Т. 28. № 10. С. 2469–2476.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


