Неорганические материалы, 2021, T. 57, № 4, стр. 457-464
Стехиографический метод дифференцирующего растворения в исследовании химического состава функциональных материалов
А. А. Почтарь 1, *, В. В. Малахов 1
1 Институт катализа им. Г.К. Борескова СО Российской академии наук
630090 Новосибирск, пр. Академика Лаврентьева, 5, Россия
* E-mail: po4tar@catalysis.ru
Поступила в редакцию 29.10.2020
После доработки 20.11.2020
Принята к публикации 24.11.2020
Аннотация
Представлены примеры, с разных сторон характеризующие возможности определения стехиографическим методом дифференцирующего растворения фазового состава твердых многоэлементных веществ и материалов, содержащих наноструктурированные формы различных компонентов. Применение стехиографии позволяет без использования эталонов твердых фаз обнаруживать и количественно определять как известные, так и неизвестные кристаллические и аморфные фазы постоянного и переменного составов. Применение методов стехиографии и положений неравновесной термодинамики позволяет получить принципиально новые сведения о твердофазных превращениях в многоэлементных многофазных веществах и материалах.
ВВЕДЕНИЕ
Многообразны химические и структурные формы гетерофазных твердых неорганических веществ и материалов. Образцы твердых фаз одинакового стехиометрического состава, но с различной предысторией (природные или синтетические образцы, подвергавшиеся в той или иной степени термическому, механическому, радиационному воздействию и т.п.) всегда различаются морфологией, дисперсностью, пористой структурой и удельной поверхностью, а также природой межфазных поверхностей раздела. Различные формы фаз могут быть беспорядочно распределены в навесках проб, в том числе одни фазы в открытых и закрытых порах других. Никакое измельчение проб не приводит к гомогенному распределению. Как следствие, приготовить стандартные образцы твердых многоэлементных многофазовых объектов неизвестного фазового состава фактически невозможно.
При анализе твердых веществ неизвестного фазового состава необходимо, прежде всего, обнаружить присутствующие в них фазы, определить их стехиометрический состав и затем провести количественное определение. Все эти три этапа фазового анализа можно проводить с помощью стехиографического метода дифференцирующего растворения (ДР). К настоящему времени развиты подходы к формированию условий динамических процессов ДР, разработана система стехиографических расчетов результатов анализа методом ДР, обнаружения химических соединений в неразделившихся смесях [1, 2]. В работе [3] были изложены стехиографические подходы к определению неоднородности состава и структуры твердых веществ методом ДР, обоснованные результатами математического моделирования. В настоящей статье приведены новые примеры, с разных сторон характеризующие возможности определения методом ДР данных о фазовом составе анализируемых веществ.
Стехиография существенно дополняет данные рентгенофазового анализа (РФА). Метод ДР позволяет количественно определить элементный состав и содержание фаз в объектах анализа в виде стехиометрических формул известных и неизвестных фаз, кристаллических и аморфных фаз, фаз постоянного и переменного состава с различной степенью насыщения. Чувствительность количественного определения на 2−3 порядка выше, чем РФА.
Материаловеды обычно воспринимают результаты метода ДР как некое добавление к РФА и другим методам фазового анализа. С химико-аналитической точки зрения методы стехиографии можно сравнить с хроматографией, вольтамперометрией и др. методами. С физико-химической точки зрения методы стехиографии − пример эволюции процессов растворения твердых веществ в динамическом режиме. Эти выводы подтверждают стехиографические исследования многих тысяч твердых образцов, содержащих почти все элементы Периодической системы Д.И. Менделеева.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ДР анализируемых проб функциональных материалов проводили в проточном динамическом режиме при увеличении концентрации и температуры растворения с использованием стехиографа [4], в качестве детектора-анализатора использовали атомно-эмиссионный спектрометр с индуктивно связанной плазмой (АЭС-ИСП) фирмы Baird (Голландия). Фото и схема стехиографа приведены на рис. 1. Перистальтические насосы подают компоненты растворителя по капиллярам в смеситель с различной скоростью. Электронное устройство регулирует скорость потоков по заданной программе и обеспечивает объединенный поток растворителя из смесителя в реактор с постоянной объемной скоростью (~3 мл/мин) и непрерывно возрастающей концентрацией растворителя. Реактор представляет собой трубку из полиэтилена или другого кислотостойкого материала с внутренним диаметром ≈5 мм и длиной до 5–6 см. В реактор помещается навеска анализируемой пробы ≈10 мг, закрепленная на вкладыше одноразового использования (рис. 2). Вкладыш изготовлен из полимерной пленки с липкой поверхностью. На поверхности вкладыша прилипшая навеска пробы образует монослой из дисперсных частиц ≤40 мкм. В реакторе происходит растворение навески, и образующийся раствор направляется в детектор-анализатор. Детектор-анализатор позволяет определять в потоке образующегося раствора одновременно с периодичностью от 1 с почти все элементы Периодической системы с чувствительностью n × 10–2‒n × 10–3 мкг/мл и погрешностью ≤5%.
Рис. 1.
Фото и схема стехиографа: 1, 2 – емкости с компонентами растворителя; 3 – электронное устройство; 4, 5 – перистальтические насосы; 6 – смеситель, 7 – реактор; 8 – детектор-анализатор, 9 – ЭВМ.
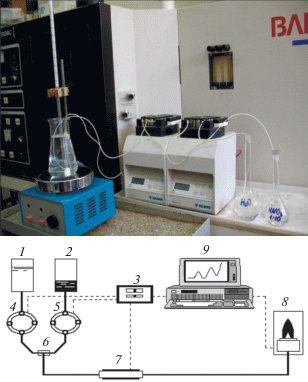
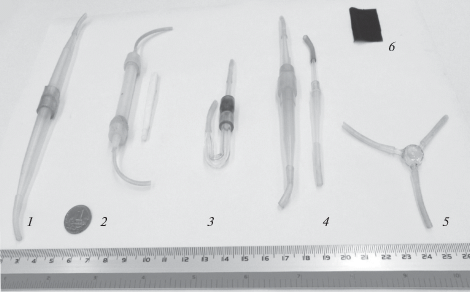
Рис. 2.
Фото реакторов, смесителя и вкладыша одноразового использования проточного стехиографа: 1–4 – реакторы различного объема, 5 – стеклянный смеситель потоков компонентов растворителя, 6 – липкий вкладыш с нанесенной на его поверхность навеской пробы.
Элементный состав потока образующегося раствора анализировали по следующим спектральным линиям элементов (нм): Al 308.2, Fe 238.2, In 230.3, Se 196.0, La 379.0, Cu 324.7, Mo 202.0, Li 670.7, Nb 315.9, Te 214.2. Они были выбраны с учетом отсутствия прямого спектрального наложения. В тех случаях, когда все же обнаруживаются спектральные помехи, программное обеспечение прибора позволяет рассчитать математическую поправку на межэлементное наложение. Информацию о концентрации элементов по ходу растворения и возникающие на экране монитора кинетические кривые растворения элементов фиксировали, корректируя в режиме стехиографического титрования [2]. Промежуточную информацию в виде кинетических кривых растворения элементов получают в абсолютном и нормированном виде, в интегральной и дифференциальной формах, а также в виде стехиограмм. Расчеты выполняли по средним значениям участков стехиограмм, рассчитанных по нескольким десяткам расчетных точек [1]. Конечная информация выдается в виде кинетических кривых растворения найденных фаз. Поскольку кислород указанным методом не определяется, формулы соответствующих фаз представлены в их фрагментарной форме – без кислорода.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Применения стехиографического метода ДР для анализа функциональных материалов
Катализаторы на основе оксида меди-железа для дегидрирования амминборана. Метод послойного горения глицин-нитратного предшественника является одим из эффективных способов получения смешанного оксида меди-железа со структурой кубической шпинели [5]. На основании метода РФА невозможно делать выводы о стехиометрии полученного оксида Cu1 –xFe2 +xO4, поскольку структуры и дифракционные картины оксида Cu–Fe и Fe3O4 близки. С другой стороны, стехиометрия является важной характеристикой, определяющей каталитические свойства синтезируемых образцов феррита меди. Использование метода ДР позволило установить, что основной фазой в исходном продукте горения является Cu–Fe-фаза со стехиометрией Cu : Fe = 0.29, поэтому можно утверждать, что обнаруженная РФА фаза кубической шпинели имеет состав Cu0.7Fe2.3O4. При дополнительном прокаливании образца феррита меди при 300°С наблюдается изменение состава медьсодержащих оксидных примесных фаз; при этом содержание, стехиометрия и кристаллическая модификация основной фазы феррита сохранились. Прокаливание образцов при более высокой температуре приводит к ожидаемому результату. Согласно РФА и ДР, наблюдаются снижение содержания примесных фаз, структурный переход кубической шпинели в тетрагональную, увеличение ее содержания (табл. 1).
Таблица 1.
Фазовый состав катализатора на основе оксида Cu-Fe по данным РФА и ДР
| Образец | Состав | |
|---|---|---|
| РФА | ДР (фрагментарная формула, мас. %) | |
| CuFe, исходный | Cu1 –xFe2 +xO4 (куб.), a = 8.386 Å, D = 915 Å CuFeO2 CuO Cu2O |
Cu0.29 ± 0.02Fe, 65.1
Fe, 9.7
CuFe, 9.3 CuFe0.4 ± 0.02*, 14.4 Cu, 1.4 |
| CuFe, 300°С | Cu1 –xFe2 +xO4 (куб.), a = 8.370 Å, D = 300 Å CuFeO2 CuO |
Cu0.29 ± 0.06Fe, 62.0 Fe, 13.2 CuFe, 10.1 CuFe0.24 ± 0.02*, 14.5 Cu, 0.2 |
| CuFe, 700°С | Cu1 – xFe2 + xO4 (тетр.), a = b = 5.817, c = 8.708 Å, D = 460 Å Fe2O3 CuO |
Cu0.41 ± 0.02Fe, 93.6 Fe, 3.2 Cu, 3.2 |
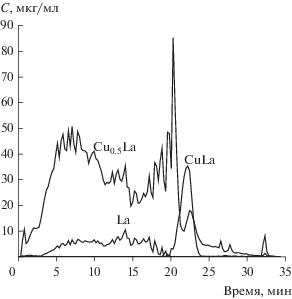
Катализаторы глубокого окисления перовскитового ряда. При анализе методом ДР катализаторов на основе оксида La-Cu, также синтезированных из металлорганических комплексных соединений в двух режимах: объемного и послойного горения [6], был применен двухстадийный способ расчета. Это позволило обнаружить фазу LaCu (La2Cu2O5), включенную в объем матричной фазы LaCu0.5 (La2CuO4) (рис. 3). Результаты ДР согласуются с результатами определения фазового состава образцов с помощью РФА и просвечивающей электронной микроскопии (ПЭМ) на качественном уровне [6].
Рис. 3.
Кинетические кривые растворения фаз, обнаруженных в составе образца La–Cu–O послойного горения.
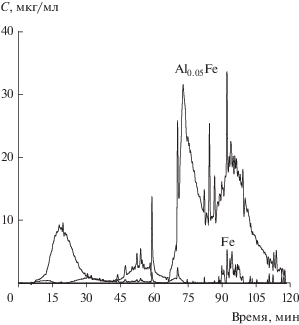
Катализаторы на основе Fe2O3 для окисления продуктов газификации твердых топлив. Увеличение активности, улучшение текстурных характеристик и стабильность работы катализатора на основе оксида железа(III) могут быть достигнуты путем введения промоторов на основе Cu, Al. На рис. 4 приведены результаты ДР для композитного катализатора на основе оксида Fe-Al. Известно, что оксиды алюминия и железа образуют гомогенные твердые растворы с любым соотношением этих элементов. На рис. 4, по существу, приведены зависимости ДР одного и того же твердого раствора, но в двух формах: первая − твердый раствор оксида железа в оксиде алюминия, а вторая, наоборот, раствор оксида алюминия в оксиде железа. Обе формы характеризуются невысокой концентрацией растворенных веществ. Согласно данным РФА, при введении алюминия в оксид железа не наблюдается появления кристаллических алюминийсодержащих фаз. В то же время происходит изменение объема элементарной ячейки гематита, что может свидетельствовать о вхождении катионов алюминия в решетку Fe2O3 [7].
Для катализаторов Cu–Fe–Al данные ДР также показывают наличие фазы Fe–Al с небольшим содержанием алюминия. Медь в составе катализатора находится в нескольких состояниях: в виде, предположительно, оксида и как компонент Cu0.19Fe0.05Al, также наблюдается образование фазы на основе оксида железа состава Cu0.36Al0.11Fe (рис. 5). Последнее соединение ассоциируется с рентгенографически наблюдаемой фазой шпинели (Cu,Fe,Al)3O4 [7].
Рис. 5.
Кинетические кривые растворения фаз Al0.05Fe (F1), Cu0.36Al0.11Fe (F2), Cu0.19Fe0.05Al (F3), обнаруженных в составе оксида Сu-Fe-Al.
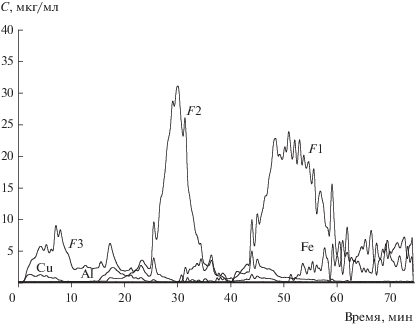
Халькогенидная система Li2Se–In2Se3. LiInSe2 востребован в качестве материалов нелинейной оптики. Главное требование ‒ высокая химическая однородность и оптическое качество. С целью обнаружения и идентификации неоднородностей кристаллов был применен метод ДР как высокочувствительный к обнаружению наноразмерных фаз. Объектами исследования были желтые и красные участки кристаллов, однофазные по данным РФА [8]. Для светлых участков кристалла отношение Li : In близко к стехиометрическому 1 : 1, а темные участки характеризуются пониженным содержанием Li в составе фазы переменного состава Li3x– 1In1 +xSe2 и повышенным содержанием примесных фаз (табл. 2). Этот факт объясняет механизм распада пересыщенного твердого раствора Li3x– 1In1 +xSe2 с понижением температуры. По результатам проведенного исследования были оптимизированы условия выращивания однородных кристаллов высокого оптического качества [8].
Таблица 2.
Фазовый состав кристалла LiInSe2 по данным ДР
| Цвет кристалла | Содержание Li-фазы, мкг | Содержание основной фазы,мас. %; Li : In | Содержание примесных фаз, мас. % | |
|---|---|---|---|---|
| Li | In | |||
| Желтый | 0.03 | 99.3; 0.98 : 1.01 | 0.10 | 0.6 |
| Коричневатый | 0.28 | 97.7; 0.86 : 1.05 | 0.07 | 1.6 |
| Темно-красный | ‒ | 98.0; 0.79 : 1.07 | 0.06 | 1.7 |
| Темно-красный | 1.7 | 97.6; 0.72 : 1.09 | 0.19 | 2.1 |
| Темно-красный | 2.2 | 98.0; 0.70 : 1.10 | 0.06 | 1.7 |
| Красный | ‒ | 99.0; 0.96 : 1.01 | 0.10 | 0.9 |
| Светло-красный | 0.1 | 98.8; 0.98 : 1.01 | 0.2 | 0.6 |
Метод ДР в исследовании эволюции необратимых процессов приготовления функциональных материалов. Многие теории современной химии в значительной степени основаны на закономерностях обратимых процессов с константами равновесия. Обратимые равновесные процессы всегда предсказуемы, что обеспечивает правильность и точность интерпретации их результатов. Необратимые процессы также широко используют в химии, особенно при приготовлении катализаторов. Но результаты необратимых процессов всегда непредсказуемы. В необратимых процессах образуются вещества, определение состава которых является фундаментальной и нерешенной проблемой химии. Однако развитый арсенал абстрактных положений неравновесной термодинамики и ее специфическая терминология (бифуркации, аттракторы, детерминистский хаос, диссипативные структуры и другие термины) едва ли присутствуют в языке химиков-экспериментаторов. Это относится и к эволюции Т–Т-процессов.
Важнейшее положение неравновесной термодинамики заключается в том, что для получения наиболее полной и содержательной информации о необратимых процессах необходимо исследовать их эволюцию. Эволюция состава, структуры и свойств продуктов необратимых процессов приготовления функциональных материалов проходит в динамическом режиме − при возрастании движущей силы процессов (температуры, концентрации компонентов и др.).
Рассмотрим пример исследования процессов эволюции при приготовлении функционального материала – катализатора состава Mo–V–Te–Nb–O для окислительного аммонолиза пропана [9]. Динамический режим процессов заключался в поэтапном (через 1 ч) повышении температуры системы от 25 до 600°С. После каждого этапа отбирали пробу продукта и определяли фазовый состав методом ДР (табл. 3).
Таблица 3.
Условия приготовления и состав детектируемых при стехиографическом анализе образцов оксидных фаз системы Mo–V–Te–Nb–O
| Время, ч | t, °С | Формула | С, мас. % | Формула | С, мас. % | Формула | С, мас. % | С, мас. % | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| прекурсор* и фаза 1 | фаза 2 (В2) | фаза 3 (В1) | Mo | V | Te | Nb | |||||
| 1* | 25 | MoV0.21Te0.22Nb0.06 | 87.0 | − | − | − | − | 3.4 | 3.3 | 1.8 | 4.4 |
| 2* | 220 | MoV0.27Te0.15Nb0.03 | 81.7 | − | − | − | − | 4.0 | 1.8 | 6.9 | 5.7 |
| 3 | 300 | MoV0.13Te0.10 | 70.2 | − | − | − | − | 2.2 | 5.9 | 12.2 | 8.8 |
| 4 | 350 | MoV0.13Te0.13 | 11.3 | MoV0.20Te0.25 | 39.3 | MoV0.19Te0.02Nb0.12 | 34.8 | 4.5 | 4.3 | 8.9 | 4.8 |
| 5 | 400 | MoV0.14 Te0.07 | 2.7 | MoV0.43Te0.43 | 40.8 | MoV0.20Te0.04Nb0.13 | 49.3 | 0.84 | 0.13 | 1.3 | 2.5 |
| 6 | 500 | MoV0.14Te0.05 | 2.3 | MoV0.35Te0.28 | 24.9 | MoV0.25Te0.05Nb0.13 | 65.4 | 2.7 | 0.25 | 2.7 | 1.7 |
| 7 | 550 | MoV0.14Te0.04 | 0.45 | MoV0.28Te0.30 | 13.5 | MoV0.27Te0.08Nb0.12 | 80.4 | 0.12 | 0.34 | 4.1 | 0.99 |
| 8 | 600 | – | − | MoV0.30Te0.31 | 10.6 | MoV0.28Te0.08Nb0.12 | 79.8 | 2.5 | 0.33 | 6.2 | 1.3 |
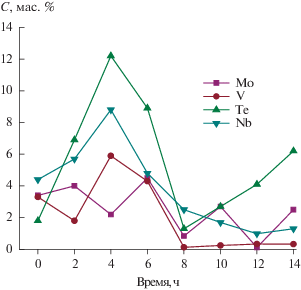
Переменный состав аморфных многоэлементных фаз облегчает процессы твердофазного взаимодействия и определят разнообразие их скоростей. Рассматривая данные табл. 3, можно предположительно выделить 17 таких процессов. Потеря прекурсором всего Nb (1) и образование оксидных фаз Mo (2), V (3), Te (4), Nb (5) – точка бифуркации. Превращение фазы 1 в фазу 2 (6) и в оксидные фазы Mo (7), V (8), Te (9) и Nb (10). Превращение фазы 1 в фазу 3 (11) и в оксидные фазы Mo (12), V (13), Te (14) и Nb (15). Превращение фазы 1 в фазу 3 (16) и фазы 2 в фазу 3 (17). Процессы 6−17 − область бифуркации и детерминистского хаоса. Анализ данных табл. 3 не по строкам, а по столбцам позволяет выявить кинетические зависимости обобщенных потоков вещества и закономерности процессов эволюции (рис. 6 и 7). Фазы 1 и 2 − это две формы распадающейся фазы 1. Эти формы фазы 1 имеют одинаковый элементный состав (Mo, V и Te), но различаются по степени насыщения. Фаза 3 − иная оксидная фаза переменного состава, которая состоит не только из Mo, V и Te, но также из Nb. При увеличении температуры от 350 до 600°С эволюция выражается в постепенном превращении фазы 1 в две конечные оксидные многоэлементные фазы: в фазу 2 (B2) и в фазу 3 (B1), а также в оксидные фазы Mo, V, Te и Nb.
Рис. 6.
Содержание оксидных многоэлементных фаз в системе Mo–V–Te–Nb–O в зависимости от температуры процесса термообработки (см. табл. 3).
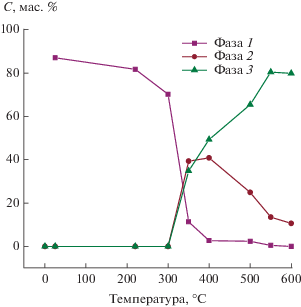
Рис. 7.
Содержание оксидных одноэлементных фаз в системе Mo–V–Te–Nb–O в зависимости от времени процесса термообработки.
Исследование эволюции позволяет выявить причину случайного события в процессе приготовления катализатора системы Mo–V–Te–Nb–O. На рис. 6 видно, что фаза 2 (В2) стремится к своему полному исчезновению. Однако произошло случайное пресечение хода двух независимых процессов: распада и кристаллизации аморфных частиц фаз. Кристаллизация приводит к прекращению распада фазы 2 (В2). Причина этого события − случайный выбор экспериментатором продолжительности ступени нагрева в 2 ч. Вероятно, следовало бы увеличить продолжительность стадий до начала кристаллизации, что могло бы привести к полному превращению фазы В2 в селективную фазу В1.
Процессы диссипативной самоорганизации в эволюционирующих неравновесных системах как следствие случайных равновероятных флуктуаций обычно приводят к появлению и развитию не одной, а нескольких форм новообразований в составе таких систем [10]. Химико-аналитический подход к описанию процессов эволюции позволяет использовать не абстрактные физико-химические, а химические термины, понятные химикам. При полном распаде прекурсора (точка бифуркации) продукты распада “забывают” о его существовании и при увеличении температуры начинают взаимодействовать между собой. При дальнейшем повышении температуры одни продукты накапливаются, а другие, менее устойчивые, разрушаются (область бифуркаций и детерминистского хаоса). При более высоких температурах происходит кристаллизация аморфных форм твердых фаз. На этом обычно заканчивают процесс приготовления катализаторов, заботясь о сохранении их высокой удельной поверхности.
ЗАКЛЮЧЕНИЕ
Неоднородность функциональных материалов возникает по двум основным причинам. С одной стороны, это зачастую необходимое условие получения желательных свойств материалов. С другой – следствие неконтролируемых процессов при их приготовлении. В этой ситуации определение пространственной и локальной неоднородности состава и структуры материалов приобретает первостепенное значение. Сведения на этот счет приведены и обобщены в недавно опубликованной монографии [11].
В настоящей работе приведены новые результаты определения стехиографическим методом ДР неоднородности состава и структуры гетерогенных катализаторов и других функциональных материалов, возникающей при их приготовлении.
Список литературы
Малахов В.В., Власов А.А. Расчеты и интерпретация результатов стехиографического анализа твердых многоэлементных многофазовых веществ и материалов // Журн. аналит. химии. 2011. Т. 66. № 3. С. 268–275.
Малахов В.В., Болдырева Н.Н., Власов А.А., Довлитова Л.С. Методология и техника стехиографического анализа твердых неорганических веществ и материалов // Журн. аналит. химии. 2011. Т. 66. № 5. С. 473–479.
Почтарь А.А., Малахов В.В. Новые стехиографические методы определения пространственной неоднородности состава и структуры твердых веществ и материалов // Неорган. материалы. 2018. Т. 54. № 7. С. 790–796.
Малахов В.В. Особенности динамического режима дифференцирующего растворения как метода фазового анализа // Журн. аналит. химии. 2009. Т. 64. № 11. С. 1125–1135.
Sutka A., Mezinskis G. Sol-gel auto-combustion synthesis of spinel-type ferrite nanomaterials // Front. Mater. Sci. 2012. V. 6. P. 128.
Komova O.V., Mukha S.A., Netskina O.V., Odegova G.V., Pochtar A.A., Ishchenko A.V., Simagina V.I. A Solid Glycine-Based Precursor for the Preparation of La2CuO4 by Combustion Method // Ceram. Int. 2015. V. 41. P. 1869.
Bulavchenko O.A., Pochtar A.A., Gerasimov E.Y., Fedorov A.V., Chesalov Y.A., Saraev A.A., Yakovlev V.A., Kaichev V.V. Chemical and Texture Promoters in Cu-Fe-Al Oxide Nanocomposite Catalysts for Combustion of Solid Fuel Gasification products // Appl. Catal., A. 2020. V. 590. P. 117364.
Vasilyeva I.G., Pochtar A.A., Isaenko L.I. Origin of the Solid Solution in the LiInSe2–In2Se3 System // J. Solid State Chem. 2014. V. 220. P. 91–96.
Малахов В.В., Пармон В.Н. Неравновесная термодинамика и стехиография в исследовании твердофазных процессов приготовления функциональных материалов // Докл. РАН. 2019. Т. 488. № 3. С. 272.
Третьяков Ю.Д. Процессы самоорганизации в химии материалов // Успехи химии. 2003. Т. 72. № 8. С. 731.
Малахов В. В. Стехиография. Новосибирск: Изд-во СО РАН, 2018. 284 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы