Неорганические материалы, 2022, T. 58, № 10, стр. 1151-1159
Структурные особенности и сорбционные свойства мезопористого углеродного материала, полученного из природного шунгита
Н. С. Сухинина 1, И. И. Ходос 2, И. И. Зверькова 1, А. Н. Туранов 1, В. К. Карандашев 2, Г. А. Емельченко 1, *
1 Институт физики твердого тела им. Ю.А. Осипьяна Российской академии наук
142432 Московская обл., Черноголовка,
ул. Академика Осипьяна, 2, Россия
2 Институт проблем технологии микроэлектроники и особочистых материалов Российской
академии наук
142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 6, Россия
* E-mail: emelch@issp.ac.ru
Поступила в редакцию 08.04.2022
После доработки 23.06.2022
Принята к публикации 30.06.2022
- EDN: PNFEFI
- DOI: 10.31857/S0002337X22100141
Аннотация
Получен новый углеродный сорбент из природного шунгита путем удаления из него неуглеродных компонентов. Исследованы сорбционные свойства этого материала по отношению к ионам тяжелых металлов и катионного красителя – метиленового синего. Показано, что сорбент обладает высокой адсорбционной способностью по отношению к ионам тяжелых металлов (247 мг/г) и катионным красителям (120 мг/г) и может использоваться для очистки от них водных растворов.
ВВЕДЕНИЕ
Сорбционные методы широко используются для очистки природных и промышленных сточных вод от примесей тяжелых металлов и токсичных красителей. В качестве адсорбентов исследованы полимерные смолы и мезопористые силикагели с функциональными группами различной природы, получаемые путем химической модификации поверхности сорбента [1–5]. В последнее время возрос интерес к использованию в качестве сорбентов углеродных материалов, таких как углеродные нанотрубки [6–9] и оксид графена [10, 11]. Однако широкое применение таких материалов ограничено их достаточно высокой стоимостью. Высокую сорбционную способность по отношению к ионам тяжелых металлов и токсичных красителей показали углеродные материалы, получаемые гидротермальной карбонизацией глюкозы, полисахаридов и недорогих растительных материалов, таких как побочные продукты сельского хозяйства и деревообрабатывающей промышленности [12–14]. Источником получения высокоэффективных углеродных сорбентов могут быть также природные минералы, содержащие углерод, в частности шунгит.
Шунгит – природный, добываемый в Карелии материал, образованный карбонизацией углеводородов. Помимо углерода шунгиты могут содержать силикаты и карбонаты [15], что обуславливает различные свойства и структуру образцов. Углерод в шунгитах имеет многообразные формы. Выделяют несколько типов структур: глобулярный, пачечный, чешуйчатый, пленочный [16]. А по молекулярной структуре шунгит представлен широким рядом твердого углерода: от графитоподобной структуры до близкой стеклографиту [17]. Наноразмерные структурные элементы шунгитов включают фуллереноподобные частицы, нанотрубки, луковичные структуры и ультрадисперсные алмазы, которые отличаются высокоразвитой поверхностью и реакционной способностью [18]. Авторы [19] представили шунгит как природный углеродный аллотроп многоуровневой фрактальной структуры, который формируется путем последовательной агрегации нанолистов восстановленного оксида графена размером ~1 нм. Турбостратные стопки листов толщиной ~1.5 нм и глобулярным составом стопки размером ~6 нм определяют вторичный и третичный уровни структуры. Завершают структуру агрегаты глобул размером в десятки нанометров. Для таких структур с повышенной неупорядоченностью характерна высокая адсорбционная способность [20–22].
Цель настоящей работы – получение нового углеродного сорбента из природного шунгита путем удаления из него неуглеродных компонентов и исследование сорбционных свойств этого материала по отношению к ионам тяжелых металлов и катионного красителя – метиленового синего (МС).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали образцы шунгита из месторождения Нигозеро (Карелия). Используемые реактивы: HNO3, HF, NaOH, МС, нитраты Pb(II), Cu(II), Cd(II), Zn(II), Sr(II), Eu(III) и U(VI) – соответствовали квалификации “х. ч.” или “ч. д. а.”. Для приготовления растворов и для промывки сорбента использовали бидистиллированную воду.
Исходный шунгит размалывали в шаровой мельнице до размеров в несколько микрон и обрабатывали смесью азотной и фтористоводородной кислот (1 : 1) при 100°C в течение 2 ч. После охлаждения сорбент промывали водой до нейтральной реакции. После этого углеродный сорбент (УС-Ш) высушивали при 50°C до постоянного веса.
Морфологические характеристики исходного шунгита и полученного из него углеродного сорбента УС-Ш исследовали методами сканирующей электронной микроскопии (СЭМ, Zeiss Supra 50 VP), просвечивающей электронной микроскопии (ПЭМ, JEM-2100) и рентгенографического анализа (Дифрактометр Rigaku SmartLab SE, CuKα-излучение). Характеристики пористой системы шунгита определяли методом адсорбции–десорбции азота (Quantachrome QuadraWin). Для расчета параметров пористой системы были использованы стандартные методы: БЭТ, DFT.
Распределение ионов металлов и метиленового синего в сорбционных системах изучали в статических условиях при соотношении объема водного раствора и массы сорбента V/m = 500 мл/г. Требуемые значения рН водной фазы устанавливали добавлением растворов NaOH или HNO3. Контакт фаз осуществляли на роторном аппарате для перемешивания со скоростью вращения 60 об./мин в течение 2 ч. Предварительно установлено, что этого времени достаточно для достижения равновесия в системе. Концентрацию ионов металлов в исходных и равновесных водных растворах определяли методом масс-спектрометрии с ионизацией пробы в индуктивно связанной плазме с использованием масс-спектрометра XSeries II (Thermo Scientific, США). Концентрацию MС определяли спектрофотометрически при λ = 655 нм с использованием спектрофотометра UNICO 1201 (United Products & Instruments Inc, США). Концентрацию металлов и MС в фазе сорбента, qe (мг/г), определяли по уравнению материального баланса
где C0 и Ce (мг/л) – исходная и равновесная концентрации в водной фазе, V (мл) – объем водной фазы, m (г) – масса сорбента. Коэффициент распределения (Kd, мл/г) рассчитывали как(2)
${{K}_{d}} = {\text{ }}\left[ {\left( {{{C}_{0}}--{{C}_{e}}} \right){{C}_{e}}^{{ - 1}}} \right]V{\text{/}}m.$Погрешность определения Kd не превышала 5%. Степень извлечения ионов металлов (E, %) выражается как
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Состав, структура и пористость образцов. Образцы исходного шунгита имели форму обломков в несколько сантиметров и демонстрировали высокую твердость и прочность. На рис. 1 приведены изображения образца шунгита, размолотого до размеров несколько микрон, при различном увеличении.
На сколах частиц при большем увеличении можно наблюдать следы слоевой структуры. Локальный рентгеноспектральный элементный анализ показал, что образец исходного шунгита неоднороден по составу (мас. %): C – 12–30, Si – 16–21, O – 44–50, Al – ~5, остальные элементы – менее 2 мас. %. В табл. 1 представлен один из результатов элементного анализа, где выявлены 11 различных элементов. Наибольшую массовую долю составляют три элемента: углерод, кислород и кремний.
Таблица 1.
Элементный состав исходного образца шунгита
| Элемент | Содержание | |
|---|---|---|
| мас. % | ат. % | |
| C | 11.93 | 18.55 |
| O | 49.61 | 57.92 |
| Na | 1.95 | 1.58 |
| Mg | 1.65 | 1.27 |
| Al | 5.21 | 3.61 |
| Si | 21.12 | 14.04 |
| K | 0.42 | 0.20 |
| Ca | 0.65 | 0.30 |
| Ti | 0.74 | 0.29 |
| Fe | 6.33 | 2.12 |
| Cu | 0.39 | 0.11 |
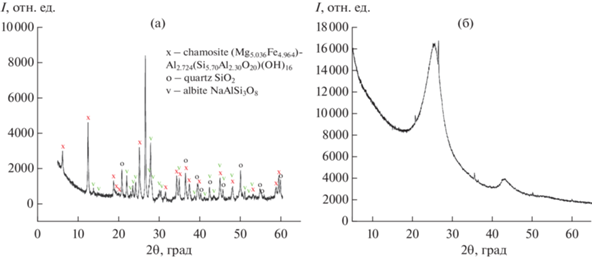
Рентгенофазовый анализ обнаружил в шунгите следующие фазы: Chamosite (Mg5.036Fe4.964)Al2.724(Si5.70Al2.30O20)(OH)16 (PDF 85-2163), Quartz SiO2 (PDF 46-1045), Albite NaAlSi3O8 (PDF 19-1184) и, возможно, Nimite (Ni,Mg,Al)6(Si,Al)4O10(OH)8 (PDF 22-0712) (рис. 2а). Кристаллографические данные последней фазы близки к фазе Chamosite, поэтому по спектру многофазного образца трудно сделать однозначный вывод о ее наличии. Дифракционные пики фазы кварца на рентгенограмме (рис. 2а) явно преобладают по интенсивности. Интенсивности пиков фаз Chamosite и Albite сопоставимы друг с другом.
Рентгенофазовый анализ образца УС-Ш (рис. 2б) выявил наноструктурную фазу графитоподобного углерода с межплоскостным расстоянием d = = 0.347 нм и размером зерна ~2 нм. Увеличенное межплоскостное расстояние в углеродном шунгите в сравнении с расстоянием 0.337 нм в кристаллической решетке графита и размер зерна (~2 нм) согласуются с турбостратной моделью шунгита [19]. Кроме основного широкого пика наноуглерода на рентгенограмме (рис. 2б) присутствуют слабые рефлексы кварца SiO2 и карбида кремния SiC. Проведенная оценка количественного содержания этих фаз с помощью программы PowderCell показала, что фаза кварца составляет ~0.2 мас. %, а карбида кремния – ~0.05 мас. %. Остальные безуглеродные фазы были удалены при обработке образца в смеси кислот.
Изображения УС-Ш в ПЭМ (рис. 3а) демонстрируют глобулярную структуру углеродной матрицы. При большем увеличении (рис. 3б) видно, что этот углеродный материал состоит в основном из изогнутых или ограненных 3–10-слойных листов углерода, ограждающих пустоты, 5–15 нм по размеру. Можно предположить, что огранка и кривизна обусловлены присутствием пяти- и других, не шестиугольных, колец углерода в структуре. Такая структура с фуллерено-подобными элементами характерна для неграфитизирующихся материалов, что согласуется с результатами [16, 18, 23, 24]. Изредка встречаются нанокристаллы углерода размерами 50–70 нм, состоящие (агрегированные) из частиц размерами около 5–10 нм (рис. 3в).
На рис. 4 приведены изотермы адсорбции–десорбции азота для образцов исходного шунгита и УС-Ш, а также распределение пор по размерам и объемов, аккумулированных в этих порах. Рассчитанные параметры пористой системы измеренных образцов приведены в табл. 2.
Рис. 4.
Изотермы адсорбции–десорбции азота (77 К) для исходного порошка шунгита (а) и УС-Ш (б) и объемное распределение пор по диаметру для исходного порошка шунгита (в) и УС-Ш (г).
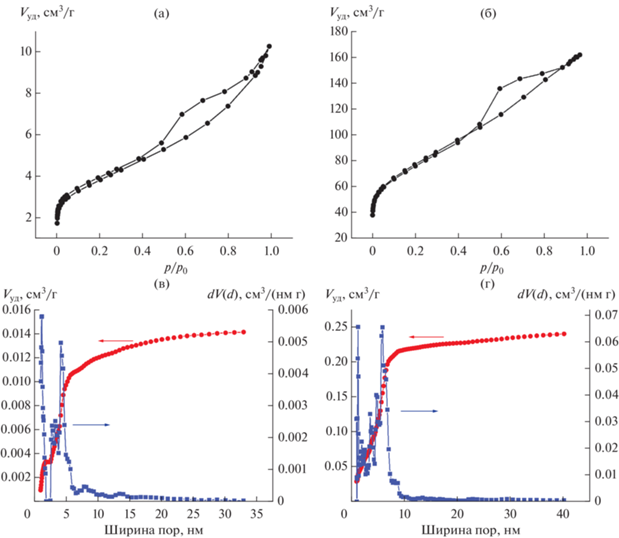
Таблица 2.
Параметры пористой системы образцов шунгита и УС-Ш
| Образец | Площадь удельной поверхности*, м2/г | Общий объем пор**, см3/г | Объем микропор***, см3/г | Объем мезопор***, см3/г | Диаметр пор***, нм |
|---|---|---|---|---|---|
| Шунгит исходный | 13 | 0.016 | 0.003 | 0.013 | 1.0, 2.7, 3.3, 4.1, 5.4, 8.0, 13.5 |
| УС-Ш | 276 | 0.25 | 0.06 | 0.19 | 1.1, 1.8, 2.4, 3.5, 4.7, 5.8, 6.3, 8.3, 13.2 |
* Рассчитана методом БЭТ в диапазоне давлений 0.05–0.20. ** Рассчитан по объему адсорбированного азота при р/р0 = 0.99. *** Объем микропор (<2 нм) и размеры наиболее заметных пор рассчитаны методом DFT в модели щелевых пор QSDFT (Quenched solid density functional theory), ошибка при подгонке составляет 0.3–0.7% для разных изотерм.
Изотермы адсорбции–десорбции образцов (рис. 4а, 4б) относятся к IV типу по классификации [25], который характерен для адсорбции в мезопорах и отвечает полимолекулярной адсорбции. Петля сорбционного гистерезиса приближается к точке относительного давления р/р0 = 0.4, что указывает на заметную долю микропор (размер менее 2 нм). Расчет распределения пор по размерам был выполнен в модели QSDFT для морфологии щелевых/цилиндрических/сферических пор в соответствии с рекомендацией авторов [26]. Анализ результатов показал доминирующее положение мезопор (размер от 2 до 50 нм) в измеренных образцах. Основной вклад в объем пор внесли поры размером 4.1 нм (исходный шунгит) и 5.7 и 6.3 нм (УС-Ш) (рис. 4в, 4г). При вытравливании безуглеродных фаз доля микропор увеличилась от 18% для исходного образца до 24% для образца УС-Ш. Удельная площадь поверхности увеличилась при этом от 13 до 276 м2/г.
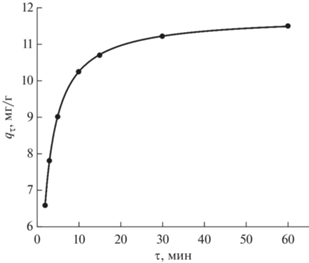
Адсорбция ионов тяжелых металлов на углеродном сорбенте УС-Ш. На примере сорбции U(VI) рассмотрено влияние времени контакта фаз на извлечение ионов металлов в фазу сорбента. Установлено, что извлечение U(VI) в фазу сорбента быстро возрастает в течение первых 10 мин, а затем постепенно приближается к равновесию в течение 2 ч (рис. 5). Время, в течение которого исходная концентрация U(VI) снижается в 2 раза (τ1/2), составляет менее 2 мин. Приблизительно 90% максимальной сорбционной емкости сорбента достигается в течение 15 мин.
Рис. 5.
Влияние времени контакта фаз на адсорбцию U(VI) сорбентом УС-Ш (pH 5.0, V/m = 500 мл/г, исходная концентрация U(VI) 23.8 мг/л, температура 22°C).
Для описания кинетических зависимостей в процессе адсорбции U(VI) использовали уравнения
для псевдопервого и псевдовторого порядков реакции, где k1 и k2 – константы скорости, qe и qτ (мг/г) – концентрация U(VI) в фазе сорбента при равновесии и в момент времени τ (мин) соответственно. Линейный характер отмечен только для зависимости τ/qτ от τ, что соответствует псевдовторому порядку реакции и характерно для процессов хемосорбции [27]. Значения k2 и qe составляют 0.0552 ± 0.0004 г/(мг мин) и 11.7599 ± 0.0487 мг/г соответственно. Вычисленное значение qe хорошо согласуется с экспериментальным (11.52 мг/г).Рассмотрение влияния кислотности водной фазы на адсорбцию ионов тяжелых металлов (Мn+) сорбентом УС-Ш показало, что адсорбция возрастает с ростом рН (рис. 6). Такой же характер зависимости E-рН наблюдался при адсорбции ионов металлов другими сорбентами, содержащими функциональные группы кислотного характера [27–30]. Подавление кислотной диссоциации таких групп с увеличением кислотности водной фазы препятствует взаимодействию их с катионами Мn+. Из данных рис. 6 видно, что наиболее эффективно сорбируются трехзарядные ионы Eu(III), а среди двухзарядных катионов эффективность сорбции возрастает в ряду Zn(II) < Sr(II) < Cd(II) < < Cu(II) < Pb(II) < U(VI).
Рис. 6.
Влияние рН на адсорбцию ионов металлов сорбентом УС-Ш (V/m = 500 мл/г, исходная концентрация ионов металлов 1 × 10–4 моль/л; время контакта фаз 2 ч, температура 22°C).
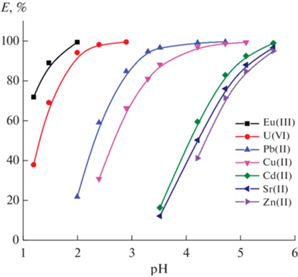
Проведено сравнение эффективности сорбции ионов металлов сорбентом УС-Ш и исходным шунгитом в одинаковых условиях. Установлено, что сорбционная способность УС-Ш существенно выше (табл. 3).
Таблица 3.
Коэффициенты распределения ионов металлов при сорбции УС-Ш и исходным шунгитом (рН 5.1, V/m = 500 мл/г)
| Ион металла | lg Kd | |
|---|---|---|
| УС-Ш | шунгит | |
| Pb(II) | 5.52 | 4.12 |
| Cu(II) | 4.92 | 3.92 |
| Cd(II) | 3.79 | 2.51 |
| Sr(II) | 3.57 | 2.46 |
| Zn(II) | 3.45 | 2.39 |
Практически полная (>99%) десорбция ионов металлов достигается с использованием 1 М раствора HNO3 в течение 30 мин. Для повторного использования сорбента его промывали водой до нейтральной реакции и высушивали на воздухе. При последующем использовании УС-Ш сохраняет свои сорбционные свойства.
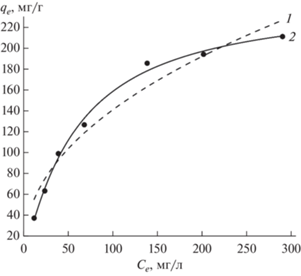
Распределение ионов U(VI) между водным раствором и сорбентом УС-Ш изучено при постоянной температуре в интервале исходной концентрации U(VI) от 1 до 600 мг/л при постоянном рН (рис. 7). Для описания изотермы адсорбции U(VI) использовали уравнение Фрейндлиха
где KF и n – константы, и уравнение Ленгмюра(7)
${{q}_{e}} = {{K}_{L}}{{q}_{{\text{m}}}}_{{{\text{ax}}}}{{C}_{e}}{{\left( {1{\text{ }} + {{K}_{L}}{{C}_{e}}} \right)}^{{--1}}},$Рис. 7.
Распределение U(VI) между равновесной водной фазой и сорбентом УС-Ш (V/m = 500 мл/г, pH 5.0, температура 22°C): описание уравнениями Фрейндлиха (1) и Ленгмюра (2), точки – эксперимент.
Рассмотрение влияния температуры на адсорбцию U(VI) сорбентом УС-Ш показало, что эффективность адсорбции U(VI) возрастает с ростом температуры (рис. 8), т.е. процесс адсорбции является эндотермическим. Изменение стандартной дифференциальной молярной энергии сорбции Гиббса (ΔG0, кДж/моль), стандартные молярные изменения энтальпии (ΔH0, кДж/моль) и энтропии (ΔS0, Дж/(мольК)) при переходе U(VI) из водного раствора в фазу сорбента были вычислены с использованием уравнений
и приведены в табл. 4. Положительное значение ΔH0 отражает эндотермическую природу адсорбции U(VI) на УС-Ш, что характерно для процесса сорбции U(VI) на других сорбентах, содержащих карбоксильные функциональные группы [30]. Отрицательное значение ΔG0 свидетельствует о смещении равновесия в сторону перехода ионов U(VI) из водного раствора в фазу сорбента. Положительное значение ΔS0 означает нерегулярное увеличение хаотичности на границе раздела сорбент–водный раствор в процессе адсорбции U(VI).Рис. 8.
Температурная зависимость коэффициента распределения U(VI) при его сорбции на УС-Ш (pH 5.0, V/m = 500 мл/г, исходная концентрация U(VI) 2.38 мг/л, время контакта фаз 2 ч).
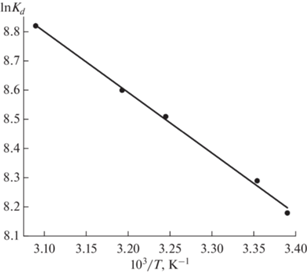
Таблица 4.
Термодинамические параметры адсорбции U(VI) из водных растворов на УС-Ш
| Температура, K | ΔG0, кДж/моль | ΔH0, кДж/моль | ΔS0, Дж/(моль К) |
|---|---|---|---|
| 295 | –20.06 | 17.74 | 128.4 |
| 298 | –20.54 | ||
| 308 | –21.79 | ||
| 313 | –22.38 | ||
| 323 | –23.68 |
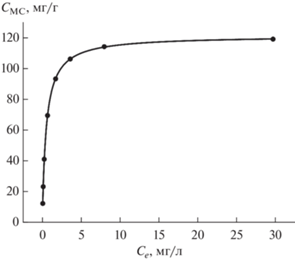
Адсорбция МС на углеродном сорбенте. Исследование сорбции катионных красителей сорбентом УС-Ш проведено на примере МС. Сорбент показал высокую сорбционную способность по отношению к этому красителю. Максимальная концентрация МС в фазе сорбента составляет 120 мг/г (рис. 9). Адсорбционная емкость углеродных нанотрубок, определенная в таких же условиях, существенно ниже и составляет 46.2 мг/г [6].
ЗАКЛЮЧЕНИЕ
Представленные в работе данные показали, что углеродный сорбент, полученный из природного шунгита путем удаления из него неуглеродных компонентов, обладает высокой адсорбционной способностью по отношению к ионам тяжелых металлов и катионным красителям и может использоваться для очистки от них водных растворов.
Список литературы
Johnson B.E., Santschi P.H., Chuang C.-Y., Otosaka S. Collection of Lanthanides and Actinides from Natural Waters with Conventional and Nanoporous Sorbents // Environ. Sci. Technol. 2012. V. 46. № 20. P. 11251–11258. https://doi.org/10.1021/es204192r
Zhang W., Ye G., Chen J. New Insights into the Uranium Adsorption Behavior of Mesoporous SBA-15 Silicas Decorated with Alkylphosphine Oxide Ligands // RSC Adv. 2016. V. 6. № 2. P. 1210–1217. https://doi.org/10.1039/C5RA21636B
Johnson B.E., Santschi P.H., Shane Addleman R., Douglas M., Davidson J.D., Fryxell G.E., Schwantes J.M. Collection of Fission and Activation Product Elements from Fresh and Ocean Waters: a Comparison of Traditional and Novel Sorbents // Appl. Radiat. Isot. 2011. V. 69. № 1. P. 205–216. https://doi.org/10.1016/j.apradiso.2010.07.025
Budnyak T.M., Strizhak A.V., Gladysz-Plaska A., Sternik D., Komarov I.V., Kolodynska D., Majdan M., Tertykh V.A. Silica with Immobilized Phosphinic Acid-Derivative for Uranium Extraction // J. Hazard. Mater. 2016. V. 314. P. 326–340. https://doi.org/10.1016/j.jhazmat.2016.04.056
Atanassova M. Ordered Mesoporous Silicas Containing Imidazolium Substructures for Solid-Liquid Extraction of Metallic Anions ReO–4 // Russ. J. Inorg. Chem. 2021. V. 66. № 1. P. 696–706. https://doi.org/10.1134/S0036023621050028
Yao Y., Xu F., Chen M., Xu Z., Zhu Z. Adsorption Behavior of Methylene Blue on Carbon Nanotubes // Biores. Technol. 2010. V. 101. № 9. P. 3040–3046. https://doi.org/10.1016/j.biortech.2009.12.042
Desouky A.M. Remove Heavy Metals from Groundwater Using Carbon Nanotubes Grafted with Amino Compounds // Sep. Sci. Technol. 2018. V. 53. № 11. P. 1698–1702. https://doi.org/10.1080/01496395.2018.1441304
Pyrzynska K., Stafiej A. Sorption Behavior of Cu(II), Pb(II), and Zn(II) onto Carbon Nanotubes // Solvent Extr. Ion Exch. 2012. V. 30. № 1. P. 41–53. https://doi.org/10.1080/07366299.2011.581056
Tian K., Wu J.L., Wang J.L. Adsorptive Extraction of Uranium(VI) from Seawater Using Dihydroimidazole Functionalized Multiwalled Carbon Nanotubes // Radiochim. Acta. 2018. V. 106. № 9. P. 719–731. https://doi.org/10.1515/ract-2017-2913
Peng W.J., Li H.Q., Liu Y.Y., Song S.X. A Review on Heavy Metal Ions Adsorption from Water by Graphene Oxide and Its Composites // J. Mol. Liq. 2017. V. 230. P. 496–504. https://doi.org/10.1016/j.molliq.2017.01.064
Zhao Y., Guo C., Fang H., Jiang J. Competitive Adsorption of Sr(II) and U(VI) on Graphene Oxide Investigated by a Batch and Modeling Techniques // J. Mol. Liq. 2016. V. 222. P. 263–267. https://doi.org/10.1016/j.molliq.2016.07.032
Gorka J., Mayer R.T., Baggetto L., Veith G.M., Dai S. Sonochemical Functionalization of Mesoporous Carbon for Uranium Extraction from Seawater // J. Mater. Chem. A. 2013. V. 1. № 9. P. 3016–3026. https://doi.org/10.1039/C2TA01008A
Cai H., Lin X., Qin Y., Luo X. Hydrothermal Synthesis of Carbon Microsphere from Glucose at Low Temperature and Its Adsorption Property of Uranium(VI) // J. Radioanal. Nucl. Chem. 2017. V. 311. № 1. P. 695–705. https://doi.org/10.1007/s10967-016-5106-9
Hadjittofi L., Pashalidis I. Uranium Sorption from Aqueous Solutions by Activated Biochar Fibres Investigated by FTIR Spectroscopy and Batch Experiments // J. Radioanal. Nucl. Chem. 2015. V. 304. № 2. P. 897–904. https://doi.org/10.1007/s10967-014-3868-5
Калинин Ю.К., Ковалевский В.В. Шунгитовые породы и базиты: особенности совместного генезиса // Геология и полезные ископаемые Карелии. 2014. Т. 17. С. 94–102.
Ковалевский В.В. Структурное состояние шунгитового углерода // Журн. неорган. химии. 1994. Т. 39. № 1. С. 31–35.
Калинин Ю.К. Углеродсодержащие шунгитовые породы и их практическое использование: дис. … докт. техн. наук. 2002.
Rozhkova N.N. Role of Fullerene-like Structures in the Reactivity of Shungite Carbon as Used in New Materials with Advanced Properties // Perspectives of Fullerene Nanotechnology / Ed. Osawa E. Dordrecht, 2002. P. 237–251.
Sheka E.F., Rozhkova N.N. Shungite as the Natural Pantry of Nanoscale Reduced Graphene Oxide // Int. J. Smart Nano Mater. 2014. V. 5. № 1. P. 1–16. https://doi.org/10.1080/19475411.2014.885913
Шалимов А.С., Ковалевский В.В., Обрезков О.Н., Ярославцев А.Б. Сорбционные свойства шунгита // Неорган. материалы. 2004. Т. 40. № 4. С. 430–434.
Rozhkova V.S., Kovalevskii V.V. Determination of Adsorption of Cationic and Anionic Dyes onto Shungite by Raman Spectroscopy // Spectroscopy. 2019. V. 34. № 7. P. 45–54.
Semenkova A., Belousov P., Rzhevskaia A., Izosimova Y., Maslakov K., Tolpeshta I., Romanchuk A., Krupskaya V. U(VI) Sorption onto Natural Sorbents // J. Radioanal. Nucl. Chem. 2020. V. 326. № 1. P. 293–301. https://doi.org/10.1007/s10967-020-07318-y
Kovalevski V.V., Rozhkova N.N., Zaidenberg A.Z., Yermolin A.N. Fullerene-Like Structures in Shungite and Their Physical Properties // Mol. Mater. 1994. V. 4. P. 77–80.
Zaidenberg A.Z., Rozhkova N.N., Kovalevski V.V., Lorents D.S., Chevallier D. Physical Chemical Model of Fullerene-Like Shungite Carbon // Mol. Mater. 1996. V. 8. P. 107–110.
Brunauer S., Emmett P.H., Teller E. Adsorption of Gases in Multimolecular Layers // J. Am. Chem. Soc. 1938. V. 60. P. 309–319.
Gor G.Yu., Thommes M., Cychosz K.A., Neimark A.V. Quenched Solid Density Functional Theory Method for Characterization Of Mesoporous Carbons by Nitrogen Adsorption // Carbon. 2012. V. 50. № 4. P. 1583–1590. https://doi.org/10.1016/j.carbon.2011.11.037
Song Q., Ma L., Liu J., Bai C., Geng J., Wang H., Li B., Wang L., Li S. Preparation and Adsorption Performance of 5-Azacytosine-Functionalized Hydrothermal Carbon for Selective Solid-Phase Extraction of Uranium // J. Colloid Interface Sci. 2012. V. 386. № 1. P. 291–299. https://doi.org/10.1016/j.jcis.2012.07.070
Zhang Y.-Z., Jin Y.-Q., Lu Q.-F., Cheng X.-S. Removal of Copper Ions and Methylene Blue from Aqueous Solution Using Chemically Modified Mixed Hardwoods Powder as a Biosorbent // Ind. Eng. Chem. Res. 2014. V. 53. № 11. P. 4247–4253. https://doi.org/10.1021/ie402370d
Zhao Y., Li J., Zhang S., Wang X. Amidoxime-Functionalized Magnetic Mesoporous Silica for Selective Sorption of U(VI) // RSC Adv. 2014. V. 4. № 62. P. 32710–32717. https://doi.org/10.1039/C4RA05128A
Zhang X., Wang J., Li R., Liu Q., Li L., Yu J., Zhang M., Liu L. Efficient Removal of Uranium(VI) from Aqueous System by Heat-Treated Carbon Microspheres // Environ. Sci. Pollut. Res. 2013. V. 20. № 11. P. 8202–8209. https://doi.org/10.1007/s11356-013-1788-5
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы