Неорганические материалы, 2022, T. 58, № 11, стр. 1177-1183
Плазменно-растворный синтез слоистых двойных гидроксидов Zn-Al
А. В. Агафонов 1, Н. А. Сироткин 1, В. А. Титов 1, А. В. Хлюстова 1, *
1 Институт химии растворов им. Г.А. Крестова Российской
академии наук
153045 Иваново, ул. Академическая, 1, Россия
* E-mail: kav@isc-ras.ru
Поступила в редакцию 19.04.2022
После доработки 01.06.2022
Принята к публикации 16.06.2022
- EDN: KJERLI
- DOI: 10.31857/S0002337X2211001X
Аннотация
Слоистые двойные гидроксиды, содержащие цинк в положении двухзарядного катиона и алюминий в положении трехзарядного катиона в бруситоподобных структурах, синтезировали новым методом с использованием низкотемпературной подводной плазмы. В качестве прекурсоров использовались материалы электродов. Показано, что формируются хорошо окристаллизованные слоистые двойные гидроксиды и примесные фазы. Определено, что именно наличие примесных фаз обуславливает термическую стабильность образцов. Показано, что полученные слоистые структуры имеют высокую удельную поверхность, что позволяет использовать их в качестве наполнителя для полимерных композитов.
ВВЕДЕНИЕ
Возможности создания термически стойких и механически прочных полимерных композитов рассматривается на примере полимерной матрицы и слоистых двойных гидроксидов (СДГ) [1, 2]. Вследствие своей характерной структуры – гидрофильных положительно заряженных слоев ${{{\text{[M}}_{{1 - x}}^{{{\text{2}} + }}{\text{M}}_{x}^{{3 + }}{{({\text{OH}})}_{2}}]}^{{n + }}}$ и отрицательно заряженных межслоевых анионов и молекул воды – такие структуры хорошо диспергируются в полимерной матрице. В настоящее время в качестве M2+ используются ионы Cu2+, Mg2+, Ni2+, Zn2+, а в качестве M3+ – Al3+, Cr3+, Fe3+. Также встречаются исследования возможности синтеза монометаллических [3–5] и тетраметаллических СДГ [6, 7]. В качестве межслоевых анионов используют хлориды, бикарбонаты, нитраты, сульфаты и органические соединения. Варьируя М2+ или межслоевые анионы, можно получать слоистые структуры с заданными характеристиками [8].
Основными методами синтеза слоистых структур являются соосаждение, гидротермальный и золь–гель [9]. Также успешно были применены методы механической активации и плазмы в контакте с жидкостью [10, 11]. Все эти методы используют химические реагенты в качестве прекурсоров, которые иногда являются токсичными. Одним из безреагентных методов получения структур является метод лазерной абляции в воде [12]. Другим безреагентным методом является низкотемпературная подводная плазма, возбуждаемая между двумя металлическими электродами в объеме воды [13]. При помещении плазменной зоны в жидкость создаются условия для упрочнения синтезированного материала, т.к. средняя температура жидкости значительно меньше температуры в плазменной зоне.
Целью данной работы было исследование возможности плазмохимического синтеза слоистых двойных гидроксидов Zn-Al в условиях подводной плазмы постоянного тока. Новизна работы по сравнению с ранее опубликованными результатами заключается в использовании металлических электродов в качестве прекурсоров СДГ без использования химических реагентов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез СДГ проводили в стеклянной ячейке. В качестве электродов использовались алюминиевая и цинковая проволоки диаметром 1 мм (ООО “Цветметсплав”), помещенные в керамическую трубку. Длина неизолированной части электродов составляла 3 мм, а расстояние между ними – 2 мм. Трубку погружали в дистиллированную воду. Подводная плазма постоянного тока возбуждалась между электродами в жидкости. Полярность алюминиевых и цинковых электродов варьировалась. Эксперименты проводились при двух токах плазмы: 0.25 и 0.8 А. Выбор значений тока плазмы объяснялся условиями стабильного горения плазмы: 0.25 А – это минимальное значение, при котором стабильно горит плазма, 0.8 А соответствовало максимальному значению, которое может поддерживать источник питания. После каждого опыта полученные суспензии центрифугировали. Осадки сушили при 100°С в течение 3 ч. Были получены четыре серии образцов (табл. 1).
Таблица 1.
Условия экспериментов и изменение масс электродов в процессе горения плазмы
| Образец | Условия эксперимента | Δm(Al), г | Δm(Zn), г |
|---|---|---|---|
| 1 | Al-анод, Zn-катод, I = 0.25 A | 0.0048 | 0.0031 |
| 2 | Al-анод, Zn-катод, I = 0.8 A | 0.0124 | 0.0098 |
| 3 | Zn-анод, Al-катод, I = 0.25 A | 0.0239 | 0.0026 |
| 4 | Zn-анод, Al-катод, I = 0.8 A | 0.0322 | 0.0058 |
Морфологию поверхности образцов исследовали с помощью просвечивающего электронного микроскопа (ПЭМ) (JEM 2100, JEOL). Элементный анализ поверхности изучался с помощью энергодисперсионной рентгеновской спектроскопии (ЭДС) (Thermo Fisher Scientific). Рентгенофазовый анализ выполняли с использованием дифрактометра D2 PHASER (CuKα-излучение, λ = 1.54 Å, размер шага сканирования 0.02°, точность измерений ±0.02°) в диапазоне значений 2θ 5°–60°.
ИК-спектры образцов регистрировали на спектрометре VERTEX 80v в диапазоне 400–4000 см–1 с разрешением 0.2 см–1 в таблетках с KBr.
Термический анализ образцов проводили на термомикровесах TG 209 F1 Iris в непрерывном токе аргона (30 мл/мин) и нагреве от 25 до 900°С со скоростью 10°С/мин.
Удельные поверхности порошков рассчитывали по изотермам адсорбции–десорбции азота при 77 К (NOVAtouch NT LX, аппаратура Quantachrome). Перед измерениями порошки дегазировали в вакууме в течение 2 ч при 150°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Низкотемпературная плазма возбуждается в объеме воды, следовательно, можно предположить, что будут формироваться слоистые структуры типа мейкснерита с ионами ОН– в качестве межслоевых анионов [14]. Ранее было показано, что такие структуры могут быть неустойчивы и в процессе сушки гидроксил-ионы могут замещаться карбонат- или нитрат-ионами [15].
ЭДС показала присутствие пиков, относящихся к Al, Zn и O. Сигналы посторонних элементов отсутствуют. В табл. 2 представлены атомные доли катионов металлов, рассчитанные по данным ЭДС. Из соотношений M2+/M3+ следует, что в образце 1 содержание трехзарядного катиона выше. Небольшая разница в содержании двух- и трехзарядных катионов фиксируется в образце 2.
Таблица 2.
Атомные доли катионов металлов и параметры кристаллической решетки синтезированных структур
| Образец | Атомные доли катионов | M2+/M3+ | c, Å | Gh, Å | |
|---|---|---|---|---|---|
| Zn2+ | Al3+ | ||||
| 1 | 0.147 | 0.311 | 0.47 | 26.40 | 4.03 |
| 2 | 0.24 | 0.209 | 1.15 | 24.60 | 3.43 |
| 3 | 0.371 | 0.11 | 3.37 | 22.53 | 2.73 |
| 4 | 0.347 | 0.076 | 4.65 | 26.40 | 4.03 |
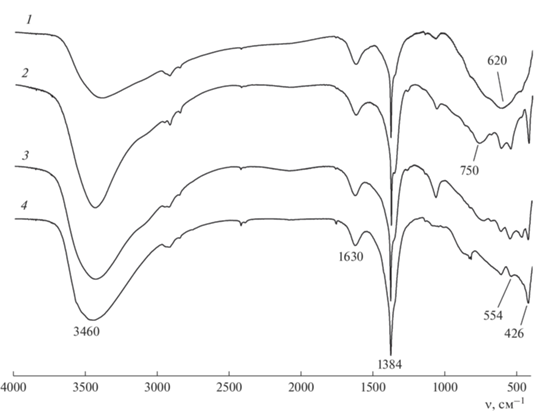
ИК-спектры образцов представлены на рис. 1. На всех спектрах присутствует характерная полоса в диапазоне 3200–3600 см–1, связанная с валентными колебаниями группы ОН в слоях СДГ и межслоевых молекул воды. Пик при 1630 см–1 приписывается деформационным колебаниям межслоевых молекул воды. Пик при 1384 см–1 подтверждает наличие нитрат-ионов в слоистой структуре. Для образца 1 регистрируется неразрешенный пик с центром при 620 см–1, который относится к модам колебаний O–M–O. Для других образцов пики при 750, 554 и 426 см–1 относятся к колебаниям Zn–O, Zn–Al–OH и Al–O соответственно.
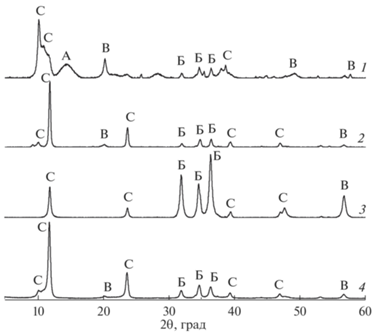
Данные рентгенофазового анализа представлены на рис. 2. На всех рентгенограммах видны характерные пики плоскостей слоистости материала: 003, 006, 015 и 018. Для образца 1 наблюдаются пики, относящиеся к γ-AlOOH. Рентгенограммы всех образцов имеют пики ZnO. Наличие пиков ZnO можно объяснить тем, что в условиях плазменной обработки обеспечивается необходимая энергия для формирования оксида. В этом случае катион металла располагается в октаэдрической оксидной структуре, как в структуре цинковой обманки или вюрцита. В этом состоянии он более устойчив, чем октаэдрическая структура в бруситоподобных слоях. Наличие рефлексов, связанных с оксидом цинка, зафиксировано также в ряде работ [16–20]. Кроме того, все рентгенограммы имеют пик при 2θ = 56.7°, относящийся к Zn(OH)2. На рентгенограммах образцов 1, 2 и 4 присутствуют два пика: при 2θ = 10° и 11.8°, что указывает на возможность получения двух фаз СДГ с различной ориентацией нитрат-ионов в качестве межслоевых анионов [19].
Рассчитанные параметры решетки слоистых структур и межслоевое расстояние представлены в табл. 2. Вариации параметра с могут быть связаны с разным содержанием межслоевой воды или разными межслойными анионами. Также параметр c показывает силу электростатического взаимодействия между межслоевым анионом и положительно заряженными слоями. В образце 3 это взаимодействие слабее, чем в образцах 2 и 4. Согласно Кавани и др. [21], базальное расстояние в слоистых структурах с гидроксил-ионом в качестве межслоевого аниона составляет 7.55 Å. Это близко к нашему значению 7.51 Å. Следовательно, в условиях подводной плазмы возможно получение СДГ Zn-Al с OH– в качестве межслойного аниона. С учетом размера гидроксильного иона (диаметр составляет 3.04 Å) [22] и межслоевого расстояния (Gh) расположение аниона будет горизонтальным. Для образцов 1 и 4 базальные расстояния равны 8.8 Å. Такие значения соответствуют слоистым структурам с нитрат-ионами в качестве межслоевых анионов (8.79 Å) [21]. Это согласуется с данными ИК-спектров. Для этих образцов можно предположить вертикальное расположение нитрат-ионов (диаметр 4 Å) [22]. Базальное расстояние для образца 2 составляет 8.2 Å. Данное значение меньше, чем для нитрат-содержащих слоистых структур. Вероятнее всего, в данной структуре одновременно содержатся гидроксил- и карбонат-ионы, так как карбонат-ион может легко заместить гидроксил-ион [23]. Можно предположить, что для образцов 1, 2 и 4 в процессе сушки ион гидроксила замещается нитрат-ионом из-за нестабильности групп ОНˉ при контакте с воздухом. Вероятно, это может быть связано с низким содержанием ZnO.
Для получения информации о структуре образцов использовался метод электронной микроскопии. Для всех образцов регистрировались пластинчатые частицы гексагональной формы (рис. 3). Также присутствуют частицы других форм. Дифракция выделенных областей показала, что СДГ Zn-Al хорошо окристаллизованы: пятна могут быть индексированы в гексагональной структуре: плоскости (110) и (111) (рис. 3и). На рис. 3к видна четкая кристаллическая структура ZnO шестиугольной формы, что подтверждает наличие примеси. Для образцов 3 и 4 на изображениях дифракции выделенных областей видны диффузные кольца, обусловленные присутствием ZnO, а также яркие пятна, обусловленные СДГ Zn-Al, имеющие вид искаженных шестиугольников (рис. 3л, 3м).
Рис. 3.
ПЭМ-снимки (а–з) и изображения дифракции выделенных областей (и–м) образцов 1 (а, д, и), 2 (б, е, к), 3 (в, ж, л), 4 (г, з, м).

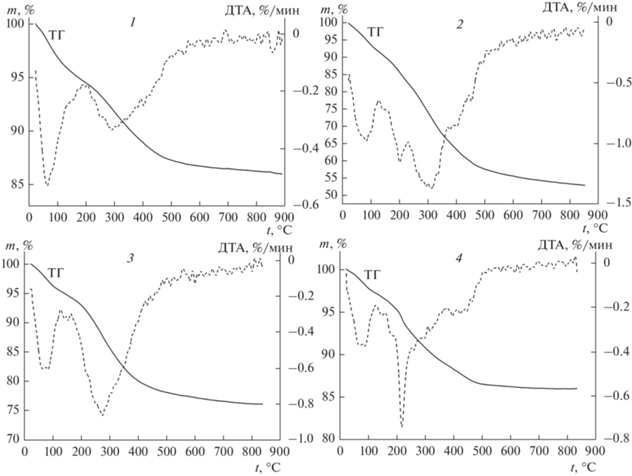
Образцы были подвергнуты термическому анализу для определения их стабильности. Кривые ТГ и ДТА для всех образцов представлены на рис. 4. Все кривые имеют минимум эндоэффекта при температуре ниже 100°С, который соответствует потере физически сорбированной воды. Для образца 2 присутствует эндоэффект при 200°С, который можно отнести к разложению межслоевого бикарбонат-иона. Эндоэффект при 200–300°С соответствует удалению структурной (химически сорбированной) воды и разложению межслойных нитрат-ионов. Изменение массы образцов при температуре выше 300°С относится к дегидратации металл-гидроксидных слоев. Данные термического анализа чистых СДГ Zn-Al показали, что они имеют одну стадию разложения от 50 до 600°С с потерей массы до 36% и без возможности перестройки при охлаждении [24]. Поэтому такие структуры считаются термически нестабильными. Наличие примесей оксида цинка увеличивает число стадий разложения, повышая их термическую стабильность [16, 17, 19, 20].
Анализ изотерм сорбции–десорбции молекулярного азота показал, что полученные структуры мезопористые с цилиндрическими порами (образцы 1 и 4) и клиновидные с открытыми щелевидными порами (образцы 2 и 3) [25]. Удельные поверхности, рассчитанные методами БЭТ и БДХ, приведены в табл. 3. Более высокая удельная поверхность для образца 1 может быть связана с присутствием других фаз (γ-AlOOH и ZnO) вместе с СДГ. Значения SБЭТ выше, чем для структур, полученных гидротермальным методом с использованием аминов [19].
Таблица 3.
Характеристики поверхности синтезированных образцов
| Образец | SБЭT, м2/г | SБДХ, м2/г | Sмикр, м2/г | Sэкс, м2/г | Vпор, см3/г | Dпор, нм |
|---|---|---|---|---|---|---|
| 1 | 143.34 | 152.32 | 34.42 | 108.92 | 0.186 | 3.83 |
| 2 | 40.15 | 33.66 | 1.67 | 38.47 | 0.065 | 4.28 |
| 3 | 126.87 | 103.04 | 32.41 | 94.46 | 0.158 | 3.82 |
| 4 | 82.04 | 82.12 | 15.82 | 66.21 | 0.112 | 4.28 |
Согласно данным, представленным в табл. 1, в процессе воздействия плазмы происходит распыление электродов. Увеличение тока плазмы приводит к росту скорости распыления электродов. Изменение полярности электродного материала также влияет на скорость распыления. Материал анода распыляется больше, что можно объяснить сопутствующим процессом анодного окисления электродов. В опытах с алюминиевым анодом отношения скоростей распыления анода и катода составляют 1.55 и 1.27 для 0.25 и 0.8 А соответственно. В экспериментах с цинковым анодом отношения составили 9.2 и 5.55 для 0.25 и 0.8 А соответственно. В этом случае основную роль в процессе распыления может играть температура плавления (440°С для Zn и 660°С для Al). В низкотемпературной плазме увеличение тока не влияет на температуру плазмы [26]. Визуальные наблюдения за поведением плазмы показали, что зона плазмы подвижна, поэтому в нашем случае правильно учитывать время контакта напыляемых материалов с плазмой. Скорость распыления электродов при токе 0.8 А выше, чем при 0.25 А. Это соответствует меньшему времени контакта материала с плазмой. Неравновесная плазма в зоне контакта с металлическим электродом вызывает распыление материала электрода. Благодаря большому градиенту температур в растворе (~340 К) и зоне плазмы (1600–2000 К) распыляемый материал втягивается в зону плазмы, где происходят его атомизация и окисление. По данным РФА, образуется γ-AlOOH, который является предшественником оксидных алюминиевых структур. Распыленные атомы Zn сорбируются на поверхности бемита. Включение цинка в слоистую структуру γ-AlOOH предотвращает его превращение в γ-Al2O3 [27]. Слоистые структуры формируются с гидроксильными ионами в качестве межслоевых анионов, поскольку плазма не контактирует с воздухом. В процессе сушки нитрат- и карбонат-ионы образуются из воздуха и, замещая гидроксильные ионы, образуют более стабильные СДГ-структуры.
ЗАКЛЮЧЕНИЕ
Синтез СДГ на основе Zn-Al возможен с использованием низкотемпературной плазмы в объеме воды. Продукт не требуют очистки, т.к. при его получении не использовались химические реактивы. Плазмохимический синтез формирует слоистые структуры типа мейкснерита, но в процессе сушки гидроксил-ионы могут замещаться нитрат-ионами в качестве межслойных анионов. Установлено, что условия эксперимента (ток плазмы, полярность материала электрода) влияют на фазовый состав, морфологию и удельную поверхность синтезируемых структур. Термическая стабильность получаемых материалов обусловлена наличием примеси ZnO.
Список литературы
Берлин А.А., Пахомова Л.К. Полимерные матрицы для высокопрочных армированных композитов (обзор) // Высокомолекулярные соединения. Серия А. 1990. Т. 32. № 7. С. 1347–1382.
Помогайло А.Д. Синтез и интеркаляционная химия гибридных органо-неорганических нанокомпозитов // Высокомолекулярные соединения. Серия С. 2006. Т. 48. № 7. С. 1317–1351.
Ma R., Takada K., Fukuda K., Iyi N., Bando Y., Sasaki T. Topochemical Synthesis of Monometallic (Co2+–Co3+) Layered Double Hydroxide and its Exfoliation into Positively Charged Co(OH)2 Nanosheets // Angew. Chem. Int. Ed. 2008. V. 47. № 1. P. 86–89. https://doi.org/10.1002/anie.200703941
Gu F., Cheng X., Wang S., Wang X., Lee P.S. Oxidative Intercalation for Monometallic Ni2+–Ni3+ Layered Double Hydroxide and Enhanced Capacitance in Exfoliated Nanosheets // Small. 2015. V. 11. № 17. P. 2044–2050. https://doi.org/10.1002/smll.201402603
Nagarajan R., Gupta P., Singh P., Chakraborty P. An Ethylene Glycol Intercalated Monometallic Layered Double Hydroxide Based on Iron as an Efficient Bifunctional Catalyst // Dalt. Trans. 2016. V. 45. № 43. P. 17508–17520. https://doi.org/10.1039/C6DT03129C
Sertsova A.A., Subcheva E.N., Yurtov E.V. Synthesis and Study of Structure Formation of Layered Double Hydroxides Based on Mg, Zn, Cu, and Al // Russ. J. Inorg. Chem. 2015. V. 60. P. 23–32. https://doi.org/10.1134/S0036023615010167
Nestroinia O.V., Ryl’tsova I.G., Yapryntsev M.N., Lebedeva O.E. Effect of the Synthesis Method on the Phase Composition and Magnetism of Layered Double Hydroxides // Inorg. Mater. 2020. V. 56. P. 747–753. https://doi.org/10.1134/S0020168520070109
Zhao Y., Hu H., Yang X., Yan D., Dai Q. Tunable Electronic Transport Properties of 2D Layered Double Hydroxide Crystalline Microsheets with Varied Chemical Compositions // Small. 2016. V. 12. № 33. P. 4471–4476. https://doi.org/10.1002/smll.201601354
Bukhtiyarova M.V. A Review on Effect of Synthesis Conditions on the Formation of Layered Double Hydroxides // J. Solid State Chem. 2019. V. 269. P. 494–506. https://doi.org/10.1016/j.jssc.2018.10.018
Qu J., Zhang Q., Li X., He X., Song S. Mechanochemical Approaches to Synthesize Layered Double Hydroxides: a Review // Appl. Clay Sci. 2016. V. 119. P. 185–192. https://doi.org/10.1016/j.clay.2018.10.018
Chen H., Zhao Q., Gao L., Ran J., Hou Y. Water-Plasma Assisted Synthesis of Oxygen-Enriched Ni–Fe Layered Double Hydroxide Nanosheets for Efficient Oxygen Evolution Reaction // ACS Sustain. Chem. Eng. 2019. V. 7. № 4. P. 4247–4254. https://doi.org/10.1021/acssuschemeng.8b05953
Hur T.B., Phuoc T.X., Chyu M.K. Synthesis of Mg-Al and Zn-Al-Layered Double Hydroxide Nanocrystals Using Laser Ablation in Water // Opt. Lasers Eng. 2009. V. 47. № 6. P. 695–700. https://doi.org/10.1016/j.optlaseng.2008.11.006
Agafonov A.V., Sirotkin N.A., Titov V.A., Khlyustova A.V. Low-Temperature Underwater Plasma as an Instrument to Manufacture Inorganic Nanomaterials // Russ. J. Inorg. Chem. 2022. V. 67. P. 253–261. https://doi.org/10.1134/S0036023622030020
Mascolo G., Marino O. A New Synthesis and Characterization of Magnesium-Aluminium Hydroxides 1 // Mineral. Mag. 1980. V. 43. № 329. P. 619–621. https://doi.org/10.1180/minmag.1980.043.329.09
Hur T.B., Phuoc T.X., Chyu M.K. New Approach to the Synthesis of Layered Double Hydroxides and Associated Ultrathin Nanosheets in De-Ionized Water by Laser Ablation // J. Appl. Phys. 2010. V. 108. № 11. P. 114312. https://doi.org/10.1063/1.3518510
Ahmed A.A.A., Talib Z.A., bin Hussein M.Z. Thermal, Optical and Dielectric Properties of Zn-Al Layered Double Hydroxide // Appl. Clay Sci. 2012. V. 56. P. 68–76. https://doi.org/10.1016/j.clay.2011.11.024
Abderrazek K., Frini Srasra N., Srasra E. Synthesis and Characterization of [Zn-Al] Layered Double Hydroxides: Effect of the Operating Parameters // J. Chin. Chem. Soc. 2017. V. 64. № 3. P. 346–353. https://doi.org/10.1002/jccs.201600258
Rodriguez-Rivas F., Pastor A., Barriga C., Cruz-Yusta M., Sánchez L., Pavlovic I. Zn-Al Layered Double Hydroxides as Efficient Photocatalysts for NOx Abatement // Chem. Eng. J. 2018. V. 346. P. 151–158. https://doi.org/10.1016/j.cej.2018.04.022
Misol A., Labajos F.M., Morato A., Rives V. Synthesis of Zn, Al Layered Double Hydroxides in the Presence of Amines // Appl. Clay Sci. 2020. V. 189. P. 105539. https://doi.org/10.1016/j.clay.2020.105538
Salih E.Y., Sabri M.F.M., Eisa M.H., Sulaiman K., Ramizy A., Hussein M.Z., Said S.M. Mesoporous ZnO/ZnAl2O4 Mixed Metal Oxide-Based Zn/Al Layered Double Hydroxide as an Effective Anode Material for Visible Light Photodetector // Mater. Sci. Semicond. Process. 2021. V. 121. P. 105370. https://doi.org/10.1016/j.mssp.2020.105370
Cavani F., Trifiro F., Vaccari A. Hydrotalcite-Type Anionic Clays: Preparation, Properties and Applications // Catal. Today. 1991. V. 11. № 2. P. 173–301. https://doi.org/10.1016/0920-5861(91)80068-K
Roobottom H.K., Jenkins H.D.B., Passmore J., Glasser L. Thermochemical Radii of Complex Ions // J. Chem. Educat. 1999. V. 76. № 11. P. 1570–1573. https://doi.org/10.1021/ed076p1570
Carrado K., Kostapapas A., Suib S. Layered Double Hydroxides (LDHs) // Solid State Ion. 1988. V. 26. № 2. P. 77–86. https://doi.org/10.1016/0167-2738(88)90018-5
Puttaswamy N.S., Kamath P.V. Reversible Thermal Behaviour of Layered Double Hydroxides: a Thermogravimetric Study // J. Mater. Chem. 1997. V. 7. № 9. P. 1941–1945. https://doi.org/10.1039/A701911D
Sing K.S., Everett D.H., Haul R.A.W., Moscou L., Pierotti R.A., Rouquérol J., Siemieniewska T. Reporting Physisorption Data for Gas/Solid Systems with Special Reference to the Determination of Surface Area and Porosity // Pure Appl. Chem. 1985. V. 57. № 4. P. 603–619. https://doi.org/10.1351/pac198557040603
Bruggeman P., Ribežl E., Maslani A., Degroote J., Malesevic A., Rego R., Vierendeels J., Leys C. Characteristics of Atmospheric Pressure Air Discharges with a Liquid Cathode and a Metal Anode // Plasma Sources Sci. Technol. 2008. V. 17. № 2. P. 025012. https://doi.org/10.1088/0963-0252/17/2/025012
Khlyustova A., Sirotkin N., Kraev A., Titov V., Agafonov A. Parameters of Underwater Plasma as a Factor Determining the Structure of Oxides (Al, Cu, and Fe) // Materialia. 2021. V. 16. P. 101081. https://doi.org/10.1016/j.mtla.2021.101081
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы