Неорганические материалы, 2022, T. 58, № 12, стр. 1342-1352
Метастабильные висмутсодержащие катализаторы Bi2O3 : GeO2 и Bi2O3 : SiO2 в реакции окислительной димеризации метана
Т. В. Бермешев 1, *, В. П. Жереб 1, 2, Е. В. Рабчевский 3, В. А. Зверев 4, Д. С. Ворошилов 1, А. С. Ясинский 1, Е. В. Мазурова 3, М. П. Бундин 1, А. С. Самойло 1, В. М. Беспалов 1, О. В. Юшкова 1, Е. Ю. Подшибякина 1, Д. В. Хлыстов 1
1 Сибирский федеральный университет
660041 Красноярск, пр. Свободный, 79, Россия
2 Сибирский университет науки и технологий им. академика М.Ф. Решетнева
660037 Красноярск, пр. им. газеты “Красноярский рабочий”, 31, Россия
3 Институт химии и химической технологии СО Российской академии наук
660036 Красноярск, Академгородок, 50, стр. 24, Россия
4 ООО “РУСАЛ ИТЦ”
660111 Красноярск, ул. Пограничников, 37, стр. 1, Россия
* E-mail: irbis_btv@mail.ru
Поступила в редакцию 14.04.2022
После доработки 30.05.2022
Принята к публикации 15.06.2022
- EDN: YCWGVX
- DOI: 10.31857/S0002337X22120016
Аннотация
Исследовано влияние исходного состояния поликристаллов метастабильных соединений Bi2GeO5 и Bi2SiO5 со структурой типа Ауривиллиуса и стекловидной фазы эквимолярного состава Bi2O3 : SiO2 на характеристики катализаторов реакции окислительной димеризации метана (ОДМ), образующихся in situ. Полученные результаты подтверждают влияние газовой среды, состоящей из исходных компонентов катализируемой реакции, на улучшение характеристик катализатора, полученного в процессе термического распада его исходного метастабильного состояния – “эффект самонастраивания” катализатора in situ. Лучшие каталитические свойства в реакции ОДМ проявили продукты распада силиката висмута (Bi2SiO5), а наилучшую активность имел катализатор, образующийся при кристаллизации стекловидной фазы. Показано, что образцы оксидных висмутсодержащих катализаторов проявляют наилучшие свойства при использовании в синтезе исходных реагентов высокой чистоты.
ВВЕДЕНИЕ
Природный газ является не только одним из основных энергетических ресурсов, но и важным химическим сырьем. Однако конверсия основного компонента природного газа метана в другие продукты требует больших энергетических затрат и организации сложных технологических процессов из-за высокой прочности углеродно-водородных связей в его молекуле. К настоящему времени предложен ряд альтернативных процессов превращения природного газа [1], одним из которых является окислительная димеризация метана (ОДМ), запатентованная в 1980 г. [2] и позволяющая получать из метана этан и этилен. В последующие годы были выполнены исследования, направленные на реализацию этого процесса в промышленных масштабах [3]. Важную роль в реакции ОДМ играет катализатор, который должен обладать высокими селективностью и скоростью реакции, а также величиной выхода продукта. При этом катализатор должен иметь хорошую стабильность и стойкость в условиях реакции. Максимальных показателей, которых удалось добиться, это селективность около 60–80% и выход около 25%.
Метастабильный силикат висмута Bi2SiO5 со слоистой кристаллической структурой типа Ауривиллиуса (КСА) является не содержащим свинца экологически приемлемым сегнетоэлектриком и ионным проводником, а также перспективным фотокатализатором. Он более предпочтителен, чем германат висмута Bi2GeO5, ввиду того, что для его получения используется более дешевый оксид кремния. Во всех указанных применениях большую роль играет состояние поверхности материала, его микроструктура, а также площадь поверхности [4], определяемые в основном условиями кристаллизации.
Также следует отметить, что большинство способов получения Bi2GeO5 и Bi2SiO5, имеющих вполне определенные достоинства и преимущества (химический [5], гидротермальный [6], метод осаждения [7], сольвотермальный [8], закалка с отжигом [9], твердофазный [10], золь–гель [11] и др.), все же довольно трудоемкие и длительные процессы, требующие значительных затрат, дополнительного оборудования и других компонентов реакции.
В работах [12, 13] нам удалось надежно показать, что синтез из расплава данных слоистых соединений не только возможен, но и максимально прост и удобен в исполнении с помощью простой термической обработки расплава.
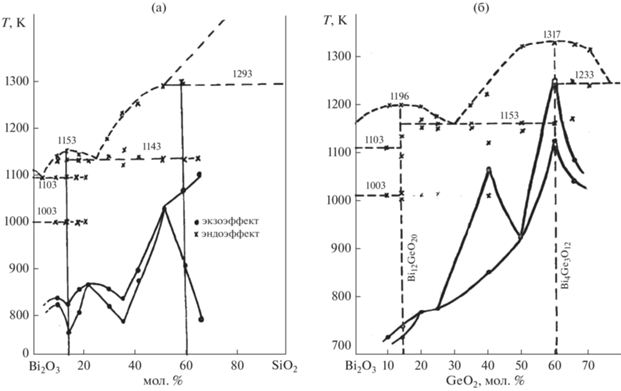
Условия термического распада на воздухе метастабильных соединений, полученных кристаллизацией из расплава в системах Bi2O3–GeO2 и Bi2O3–SiO2, изучены в [14] (рис. 1). Было показано, что на температуры и последовательность перехода метастабильных фаз в стабильное состояние влияют скорость нагревания и состав метастабильных образцов.
Рис. 1.
Влияние фазового и компонентного состава метастабильных образцов на температуру их распада в системах Bi2O3–SiO2 (а) и Bi2O3–GeO2 (б) (скорость нагревания 6 К/мин) [34 ] .
В качестве катализатора для ОДМ силикат висмута Bi2SiO5 рассматривали в работах [1, 15] вместе с такими соединениями, как Bi2GeO5, Bi2Ti3O12 и BiCaSrCuO6, где слоистые структуры показали высокие значения активности и селективности. В [16, 17] впервые было экспериментально показано, что повышение каталитических свойств германатов и силикатов висмута происходит в процессе распада метастабильного состояния слоистых структур Bi2SiO5 и Bi2GeO5 с КСА при температурах и в условиях протекания реакции ОДМ. Также было высказано предположение о влиянии газовой фазы на формирование оптимальных характеристик катализатора в момент его распада, однако для надежного подтверждения этого эффекта было недостаточно экспериментальных данных.
Цель данной работы состояла в исследовании влияния условий распада метастабильных соединений Bi2SiO5, Bi2GeO5, полученных аналогично [12, 13], на формирование каталитических характеристик продуктов реакции окислительной димеризации метана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Поликристаллические образцы Bi2GeO5 были синтезированы из расплава по следующей методике: нагрев исходных компонентов (Bi2O3, GeO2) до 1160°С с выдержкой 1 ч, затем охлаждение с печью до 1100°С (зона В), выдержка 1 ч и последующее охлаждение на воздухе. Поликристаллические образцы Bi2SiO5 – нагрев исходных компонентов (Bi2O3, аморфный SiO2) до 1180°С с выдержкой 1 ч и последующее охлаждение с печью. Аморфные материалы состава 1 : 1 (мол. %) системы Bi2O3–SiO2 – предварительное сплавление при температуре 1180°С в течение 1 ч, затем охлаждение расплава с печью до 1040°С для предотвращения его расслаивания, выдержка при данной температуре 40 мин и закалка с тиглем в воду. Нагрев осуществлялся в электрической печи сопротивления LMV 02/12 на воздухе со скоростью ~20°С/мин. Все вышеперечисленные методики синтеза подробно рассмотрены в работах [17, 18 ] .
Уточняющие отжиги. Отжиги для уточнения процессов распада в стекле проводились в уже разогретых печах сопротивления при температурах 700–850°С, охлаждение велось на воздухе. Образцы использовались в кусковом виде, без перетирания в порошок.
Изучение структуры и свойств. Исследование микроструктуры выполняли с использованием оптического микроскопа Carl Zeiss Axio Observer A1m на микрошлифах, полученных после шлифовки, полировки и химического травления. Термический анализ проводили на синхронном термическом анализаторе STA 449C Jupiter (Netzsch): нагрев со скоростью 10°С/мин, динамическая атмосфера (продувка воздухом) со скоростью 15 мл/мин. Растровую электронную микроскопию (РЭМ) и локальный рентгеноспектральный анализ проводили на настольном растровом электронном микроскопе HITACHI TM3000. Рентгенофазовый анализ (РФА) порошка проводили на дифрактометре Shimadzu XRD 6000 (CuKα-излучение).
Чистота исходных компонентов для образцов сравнения (первая серия): Bi2O3 квалификации “ч.”, GeO2 “ч. д. а.” и SiO2 “ч. д. а.” в аморфном состоянии. Для сравнения влияния чистоты исходных компонентов на примере оксида висмута (вторая серия) применялся Bi2O3 квалификаций “ос. ч.” и “ч.”.
Скорость образования CO2, CO и C2-углеводородов определяли на проточной каталитической установке ПКУ-1 (фирма ООО “Современное лабораторное оборудование”, Россия) в смеси CH4 : O2 : He = 82 : 9 : 9 об. %. Материал реактора – кварц, внутренний диаметр реактора 4 мм, фракция образца 0.1–0.2 мм, масса загрузки 0.46 ± 0.01 г, образец фиксировался в реакторе при помощи кварцевой ваты. Время контакта смеси с катализатором выбирали с учетом конверсии O2 не более 5%. Анализ исходной реакционной смеси и полученных продуктов проводился на хроматографе Agilent 7890A GC (фирма Agilent, США), укомплектованном колонками HP Plot Al2O3, DB-1 и Haysep Q (Molecular Sieve 5A).
Для образцов первой серии нагрев до температуры реакции (780 ± 0.5°С) проводился со скоростью 40°C/мин, после чего катализатор выдерживался при температуре реакции 4 ч до стационарного состояния; для образцов второй серии – при повышении температуры от 600 до 780°С со скоростью 1°С/мин, ожидание выхода на квазистационарный режим работы катализатора составляло 1 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Термический анализ. Температуру проведения эксперимента по определению каталитических свойств образцов в реакции ОДМ выбирали согласно температурам распада метастабильных соединений. Исходя из данных термического анализа (рис. 2) при указанных скоростях нагрева распад германата висмута начинается при 806°С, а силиката висмута – при 804°С. Аморфный силикат висмута имеет более сложную последовательность фазовых превращений: кристаллизация метастабильных δ*-Bi2O3 + Bi2SiO5 (начало при 488°С), распад δ*-Bi2O3 с переходом образца в смесь Bi2SiO5 + SiO2 (начало при 598°С) и последующее взаимодействие SiO2 + Bi2SiO5 с общим распадом Bi2SiO5 на Bi12SiO20 + Bi4Ge3O12. Данные процессы будут подробно рассмотрены ниже.
Рис. 2.
Результаты термического анализа при нагреве образцов Bi2GeO5 (а), Bi2SiO5 (б), а также висмут-силикатного стекла (в); скорость нагревания германата висмута 6 К/мин, силикатов висмута – 10 К/мин.
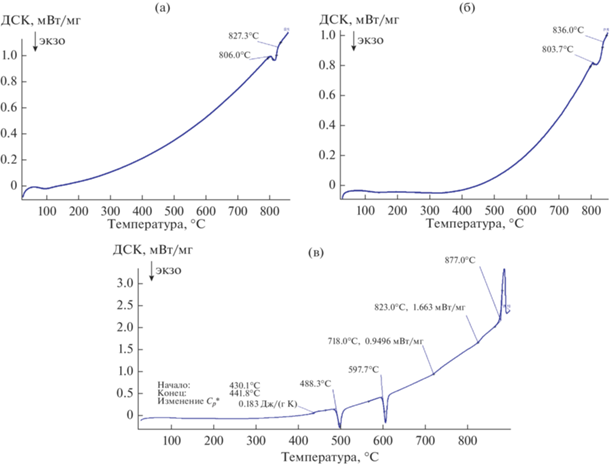
На температуру распада влияет скорость нагревания: с уменьшением скорости нагревания температура распада понижается. Кроме того, метастабильные фазы распадаются со значительным экзотермическим эффектом, который вызывает дополнительное повышение температуры образцов.
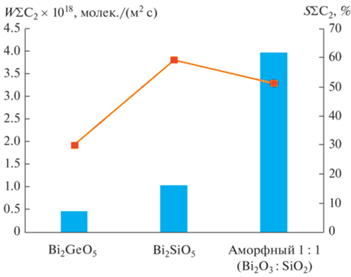
Каталитические испытания. Как следует из табл. 1, силикат висмута имеет более высокую активность и селективность в реакции ОДМ, чем аналогичный германат. При этом в случае использования аморфного силиката висмута активность возрастает в разы (рис. 3), а селективность снижается.
Таблица 1.
Результаты сравнения селективности (S) и скорости (W) процесса в реакции ОДМ образцов катализаторов
| Катализатор | S ∑С2, % | W ∑С2, молек./(м2 с) |
|---|---|---|
| Bi2GeO5 | 30.15 | 4.83 × 1017 |
| Bi2SiO5 | 59.36 | 1.05 × 1018 |
| Аморфный 1 : 1 (Bi2O3 : SiO2) | 51.37 | 3.97 × 1018 |
Также замечено (табл. 2), что образец, полученный с использованием Bi2O3 высокой чистоты, по всем показателям существенно превосходит образец, полученный с использованием оксида висмута более низкого уровня квалификации.
Таблица 2.
Результаты сравнения селективности и активности катализаторов* в реакции ОДМ при использовании исходного оксида висмута разной чистоты
| Температура реактора, °С | S ∑С2, % | W ∑С2, моль/(г с) | Температура реактора, °С | S ∑С2, % | W ∑С2, моль/(г с) |
|---|---|---|---|---|---|
| Bi2O3 “ос. ч.” | Bi2O3 “ч.” | ||||
| 780.12 | 60.53 | 5.52 × 10–8 | 779.82 | 55.41 | 4.27 × 10–8 |
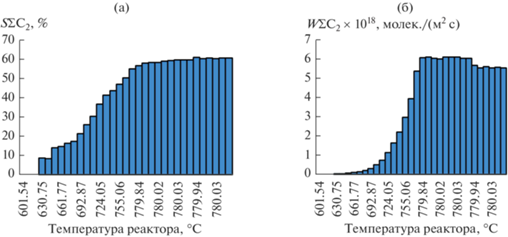
При этом на примере образца, полученного с использованием висмута “ос. ч.” (рис. 4), видно, что улучшение свойств начинается при выходе реактора на рабочие температуры (780°С и выше). Именно при этих температурах начинается распад метастабильных соединений на смесь стабильных фаз – Bi12SiO20 + Bi4Si3O12 для силикатной системы и Bi12GeO20 + Bi4Ge3O12 для германатной системы.
Рис. 4.
Изменения селективности (а) и активности (б) катализатора, полученного с использованием оксида висмута квалификации “ос. ч.”.
Результаты РФА (рис. 5) образцов, извлеченных из реактора после проведения каталитических испытаний, показывают, что все метастабильные фазы претерпели полный распад.
Рис. 5.
Дифрактограммы образцов метастабильных фаз после их распада в процессе проведения каталитических испытаний: Bi2GeO5 = Bi12GeO20 + Bi4Ge3O12 (а), Bi2SiO5 = Bi12SiO20 + Bi4Si3O12 (б), аморфный образец силиката висмута = = Bi12SiO20 + Bi4Si3O12 (в).
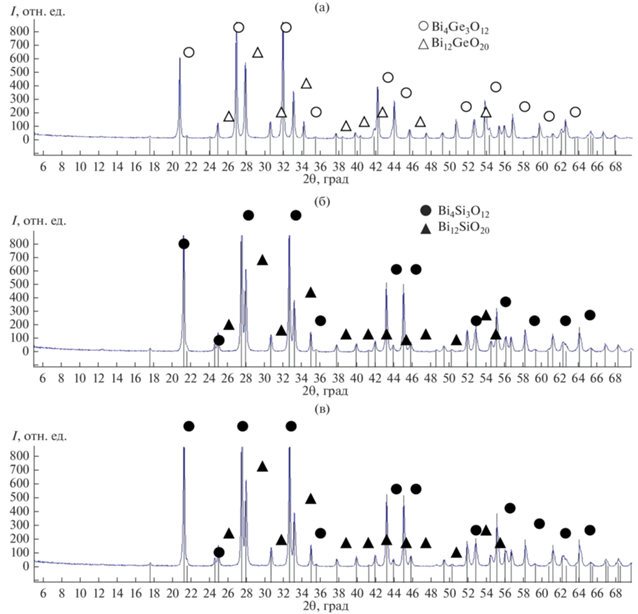
Обсуждение роли распада Bi2GeO5 и Bi2SiO5 в повышении их каталитических свойств в реакции ОДМ. Более высокий уровень каталитических свойств поликристаллического силиката висмута по сравнению с германатом можно объяснить с позиций микроструктуры. Известно, что более развитая поверхность катализатора способствует улучшению его каталитических характеристик. Образцы германата висмута (Bi2GeO5) имеют пластинчатую микроструктуру, сформированную блоками с близкой ориентацией пластин (рис. 6а). Микроструктура силиката висмута (Bi2SiO5) более мелкодисперсная (рис. 6б) благодаря наличию субзеренной структуры, где каждая из пластин метастабильной фазы состоит из множества расположенных под углом к направлению ее роста более мелких пластинок, что характерно для дендритной структуры (явление масштабной инвариантности).
Рис. 6.
Микроструктура образцов поликристаллических соединений: Bi2GeO5, полученного охлаждением расплава на воздухе (а); Bi2SiO5, полученного охлаждением расплава с печью (б).

После полного распада Bi2GeO5 образцы состоят из смеси двух стабильных фаз: Bi12GeO20 + + Bi4Ge3O12. Микроструктура таких образцов представлена крупными светлыми кристаллами, стремящимися к равноосной форме (рис. 7а), и более темной “подложкой”, состоящей из смеси темных и светлых кристаллов. По данным РЭМ (рис. 7в, 7д; табл. 3), светлые кристаллы обогащены оксидом германия в большей степени, чем “подложка”, и имеют невысокий разброс значений концентрации элементов. Это позволяет сделать вывод о том, что данные кристаллы являются соединением Bi4Ge3O12. “Подложка” же, визуально и по концентрации элементов (табл. 3), куда более неоднородна и, согласно диаграмме состояния (рис. 1б), представляет собой смесь, состоящую из смеси Bi12GeO20 + Bi4Ge3O12. Таким образом, конечными продуктами распада метастабильного германта висмута состава 1 : 1 будут кристаллы Bi4Ge3O12 и смесь Bi12GeO20 + Bi4Ge3O12.
Рис. 7.
Микроструктура образцов Bi2GeO5 (а) и Bi2SiO5 (б) после полного распада; РЭМ-изображения после распада в общем виде Bi2GeO5 (в), Bi2SiO5 (г) и картирование по распределению Bi и Ge (д), Bi и Si (е).

Таблица 3.
Химический состав образца Bi2GeO5 после полного распада
| Элемент | Концентрация элементов (зерна), ат. % | Концентрация элементов в смеси, ат. % | ||
|---|---|---|---|---|
| среднее значение | диапазон значений | среднее значение | диапазон значений | |
| Bi | 25 ± 1.0 | 23.5–26.3 | 31 ± 3.0 | 26.8–36.2 |
| Ge | 19 ± 1.7 | 16.8–21.3 | 9 ± 2.0 | 6.2–11.6 |
| O | 56 ± 1.4 | 54.4–59.7 | 60 ± 4.0 | 52.3–66.8 |
Видимо, аналогичные процессы будут протекать и при распаде метастабильного силиката висмута Bi2SiO5. При этом микроструктура после распада будет настолько мелкодисперсной (рис. 7б), что точно выявить принадлежность отдельных элементов структуры при помощи РЭМ на приборе HITACHI TM3000 не представляется возможным (рис. 7г, 7е). Однако, зная химический и фазовый составы конечного продукта по диаграмме стабильного равновесия (рис. 1а), несложно выяснить, что основной объем должен занимать Bi4Si3O12, т.е. светлые участки на микроструктуре. Оставшиеся же темные мелкодисперсные участки будут ничем иным, как смесью Bi12SiO20 + Bi4Si3O12.
Стекло состава 1 : 1 (мол. %) при нагреве также в конечном итоге переходит в поликристаллический материал, состоящий из кристаллов Bi4Si3O12 и смеси Bi12SiO20 + Bi4Si3O12, однако претерпевает большее количество превращений, чем исходный поликристаллический Bi2SiO5.
Исходя из данных термического анализа (рис. 2в) и рентгеновской дифрактометрии образцов, полученных на разных стадиях отжига стекла (рис. 9, табл. 4), можно сделать выводы о том, что после стеклования (430–441°С) будет происходить практически одновременная кристаллизация метастабильных фаз δ*-Bi2O3 и Bi2SiO5 из стекла (рис. 8а, 9а). Начало этого процесса установлено при температуре 488°С по сильному экзотермическому пику на ДСК-кривой (рис. 2в). Зафиксировать этот процесс можно кратковременными отжигами с последующим охлаждением на воздухе. Образование указанных фаз будет наблюдаться на дифрактограмме.
Рис. 8.
Превращения, протекающие при нагреве аморфного силиката висмута состава 1 : 1 (мол. %): кристаллизация δ*-Bi2O3 + Bi2SiO5, отжиг 560°С (а); образование Bi2SiO5 + SiO2, отжиг 640°С (б); полный распад Bi2SiO5, отжиг 845°С (в); остатки аморфных включений при распаде Bi2SiO5, отжиг 845°С (г).
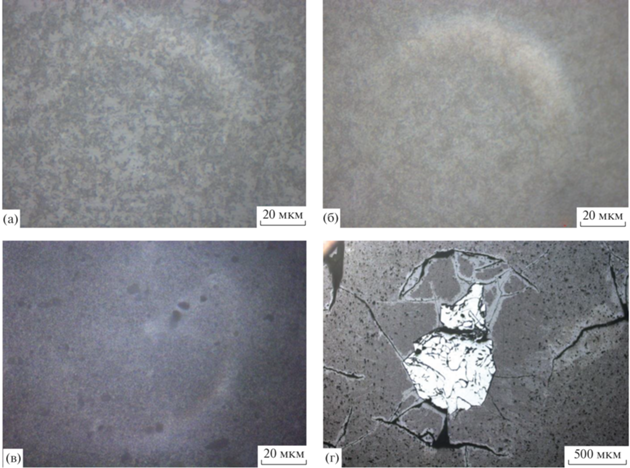
Рис. 9.
Дифрактограммы образцов, полученных отжигом стекла на разных стадиях его превращения: кристаллизация δ*-Bi2O3 + Bi2SiO5, отжиг 560°С (а); переход в Bi2SiO5 + SiO2, 640°С (б); полный распад до Bi12SiO20 + Bi4Si3O12 (в).
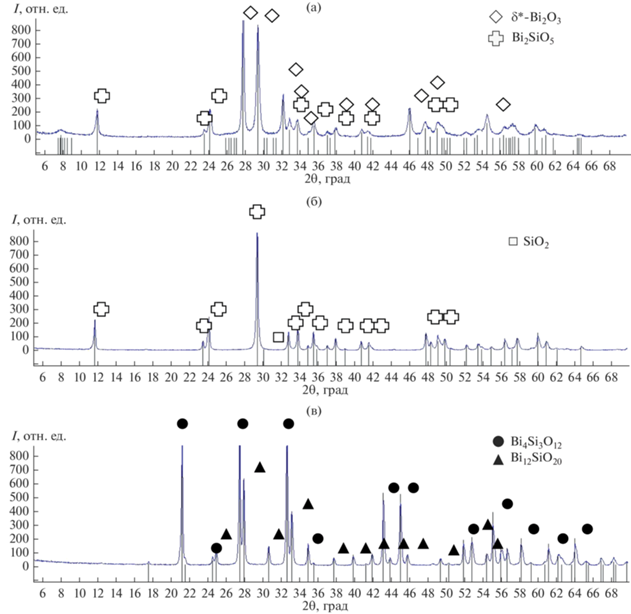
Таблица 4.
Режимы отжигов аморфных образцов состава 1 : 1 (мол. %) и результаты РФА после них
| t, °С | τ, мин | Фазовый состав |
|---|---|---|
| 560 | 25 | δ*-Bi2O3 + Bi2SiO5 |
| 640 | 300 | Bi2SiO5 + SiO2 |
| 845 | 120 | Bi12SiO20 + Bi4Si3O12 |
Второй экзотермический пик на ДСК-кривой – при 597°С (рис. 2в) будет соответствовать распаду δ*-Bi2O3 и переходу образца в Bi2SiO5 + SiO2. Присутствие в образце некоторого избыточного количества оксида кремния, по-видимому, является результатом перестройки кристаллической решетки при распаде δ*-фазы, но образовавшийся SiO2 не вступает до конца в реакцию ввиду недостаточно высокой температуры отжига – 640°С (рис. 8б, 9б).
При повышении температуры нагрева происходит распад Bi2SiO5 и, видимо, взаимодействие оставшейся после распада δ*-фазы SiO2 c окружающими поликристаллами. В результате весь объем образца состоит из кристаллов Bi4Si3O12 и эвтектики Bi12SiO20 + Bi4Si3O12 (рис. 8в, 9в). При этом на ДСК-кривой наблюдаются 2 небольших экзотермических эффекта – около 718 и 823°С (рис. 2в). При 718°С происходит вышеописанный распад Bi2SiO5. Эти результаты термического анализа хорошо согласуются как с данными РФА (рис. 5в), где видно, что после испытаний при 780°С образец полностью перешел в стабильное состояние, так и с результатами каталитических испытаний (рис. 4), которые демонстрируют начало резкого роста свойств около 692–724°С.
Также следует отметить тот факт, что зачастую при отжиге стекла состава 1 : 1 (мол. %) даже до температур полного распада в образцах еще могут оставаться аморфные участки. Это хорошо видно на образце стекла, отожженном при 845°С в течение 2 ч, в котором сохранились довольно крупные аморфные составляющие, хорошо различимые даже при увеличении 50 крат (рис. 8г, табл. 4). Такие участки со временем также претерпевают фазовые превращения, что проявляется как на микроструктуре, так и при термическом анализе. Именно такой эффект можно наблюдать на ДСК-кривой (рис. 2в) в районе 823°С.
Микроструктура исходных аморфных образцов силиката висмута состава 1 : 1 (мол. %) и после кристаллизации, и после распада существенно более мелкодисперсная по сравнению с продуктами распада исходно поликристаллического силиката и тем более германата висмута. При этом по мере приближения к полному распаду микроструктура все более измельчается. После отжига при 560°С (кристаллизация δ*-Bi2O3 + Bi2SiO5) образец состоит из мелких светлых и темных кристаллов в виде многогранников (рис. 8а). При повышении температуры отжига до 640°С, после распада δ*-фазы (Bi2SiO5 + SiO2), светлые кристаллы преобладают в объеме образца, а структура еще больше измельчается. Полный распад при 845°С приводит к максимальному измельчению структуры, которую трудно различить даже при максимальном увеличении нашего оптического микроскопа (×1000).
Таким образом, повышение активности аморфного катализатора связано с многостадийным образованием Bi2SiO5 с ультра-мелкодисперсной структурой, что положительным образом влияет на скорость протекания реакции ОДМ, т.к. зачастую скорость процесса зависит от удельной поверхности катализатора. Во время дальнейшего распада метастабильной фазы Bi2SiO5 в реакторе при температуре 780–800°С и в присутствии метана происходит еще большее измельчение структуры и одновременно “самонастройка” материала под протекающую реакцию. Данное явление происходит потому, что в момент распада структура распадающейся метастабильной фазы становится чрезвычайно подвижной и активно взаимодействует с окружающей ее средой, тем самым адаптируясь под нее. Некоторое же падение селективности аморфных образцов силиката висмута по сравнению с поликристаллическим объясняется плотностью стекла, изначально менее развитой поверхностью и отсутствием дефектов, что затрудняет взаимодействие с ними газов. Поликристаллический же силикат висмута, изобилующий дефектами, трещинами и порами, будет лучше взаимодействовать с газовой средой.
ЗАКЛЮЧЕНИЕ
Исследовано влияние условий распада метастабильных германата и силиката висмута (в аморфном и поликристаллическом состояниях) на формирование высоких каталитических характеристик в реакции ОДМ. Показано, что измельчение структуры материалов при распаде положительно сказывается на их активности в реакции ОДМ.
Продукты распада поликристаллических образцов силиката висмута (Bi2SiO5) демонстрируют более высокие каталитические характеристики в реакции ОДМ по сравнению со стабильными фазами, образующимися после распада метастабильного германата висмута (Bi2GeO5) и аморфного силиката висмута эквимолярного состава (Bi2O3 : SiO2). Однако именно аморфный материал позволяет получить катализатор с наилучшей активностью, в разы превышающей показатели продукта распада поликристаллического Bi2SiO5 и почти на порядок – Bi2GeO5.
Образцы оксидных висмутсодержащих катализаторов показывают наилучшие свойства при использовании в синтезе исходных реагентов высокой чистоты.
Лабильность структуры метастабильных фаз в момент перехода в стабильное состояние проявляется в высокой реакционной способности этих веществ и сильном влиянии состава газовой атмосферы на реальную структуру продуктов распада (стабильных фаз) – явление “самонастраивания” катализатора. Эти особенности позволяют получать катализаторы, адаптирующиеся к реакционной среде.
Список литературы
Арутюнов В.С., Крылов О.В. Окислительные превращения метана. М.: Наука, 1998.
Mitchell M.L., Waghorne R.H. Process for the Conversion of Relatively Low Molecular Weight Hydrocarbons, to Higher Molecular Weight Hydrocarbons, Catalyst-Reagents for Such use in Such Process, and the Regeneration Thereof : Pat. 4205194 (US). Publ. 1980.
Куличков А.В., Сладковский Д.А., Кузичкин Н.В., Лисицын Н.В. Перспективные направления переработки природного газа // Изв. СПбГТИ(ТУ). 2014. Т. 23. С. 48–51.
Topping J.A., Cameron N., Murthy M.K. Properties and Structure of Glasses in the System Bi2O3–SiO2–GeO2 // J. Am. Ceram. Soc. 1974. V. 57. № 12. P. 519–521.
Tanimu G., Aitani A.M., Asaoka S., Alasiri H. Oxidative Dehydrogenation of n-Butane to Butadiene Catalyzed by new Mesoporous Mixed Oxides NiO-(beta-Bi2O3)–Bi2SiO5/SBA-15 System // Mol. Catal. 2020. V. 488. P. 110893. https://doi.org/10.1016/j.mcat.2020.110893
Haldar T., Kumar U., Yadav B.C., Ravi Kanth Kumar V.V. Effect of Direct – Current Biasing On the Adjustable Radio-Frequency Negative Permittivity Characteristics of Bi2SiO5/Multiwall Carbon Nanotube Metacomposites // Ceram. Int. 2021. V. 47. P. 1389–1398. https://doi.org/10.1016/j.ceramint.2020.08.262
Ke Y., Huang W., Thatikonda S.K. et al. Highly Frequency-, Temperature-, and Bias-Stable Dielectric Properties of 500°C Processed Bi2SiO5 Thin Films with Low Dielectric Loss // Curr. Appl. Phys. 2020. V. 20. P. 751–754. https://doi.org/10.1016/j.cap.2020.03.010
Zou C., Liang M., Yang Z. et al. Flower-Like Bi2SiO5/Bi4MoO9 Heterostructures For Enhanced Photocatalytic Degradation of Ciprofloxacin // Nanotechnology. 2020. V. 31. P. 345604. https://doi.org/10.1088/1361-6528/ab912f
Panyata S., Eitssayeam S., Rujijanagul G. et al. Electrical Properties of Bismuth Germanate (Bi2GeO5) Ferroelectric Glass-Ceramics Prepared by Two Different Methods // Integr. Ferroelectr. 2019. V. 195. P. 187–195. https://doi.org/10.1080/10584587.2019.1570032
Денисова Л.Т., Каргин Ю.Ф., Галиахметова Н.А., Белоусова Н.В., Денисов В.М. Синтез и исследование высокотемпературной теплоемкости EuBiGeO5 // Журн. неорган. химии. 2020. Т. 65. № 1. С. 3–7.
Wu Y., Li M., Wang X. et al. Preparation and Fluorescence Property of Pure Bi2SiO5 Powders by Pechini Sol-Gel Method // Mater. Manuf. Processes. 2017. V. 32. P. 480–483. https://doi.org/10.1080/10426914.2016.1221081
Жереб В.П., Бермешев Т.В., Каргин Ю.Ф., Мазурова Е.В., Денисов В.М. Фазовый состав и микроструктура продуктов кристаллизации расплава Bi2O3⋅GeO2 при различных условиях охлаждения // Неорган. материалы. 2019. Т. 55. № 7. С. 782–797. https://doi.org/10.1134/S0002337X19060162
Жереб В.П., Бермешев Т.В., Тас-Оол Р.Н., Мазурова Е.В., Метелица С.И. Расслаивание в системе Bi2O3–SiO2. Влияние условий охлаждения расплава на фазовый состав и микроструктуру продуктов затвердевания // Изв. АН. Сер. хим. 2021. № 8. C. 1462–1470. https://doi.org/10.1007/s11172-021-3240-1
Жереб В.П. Метастабильные состояния в оксидных висмутсодержащих системах. М.: МАКС Пресс, 2003. 162 с.
Lane G.S., Miro E., Wolf E.E. Methane Oxidative Coupling: II. A Study of Lithium-Titania-Catalyzed Reactions of Methane // Ibid. 1989. V. 119. № 1. P. 161–178. https://doi.org/10.1016/0021-9517(89)90143-7
Voskresenskaya E.N., Kurteeva L.I., Zhereb V.P., Anshits A.G. Oxidative Coupling of Methane Over Oxide Catalysts with Layered Structure // Catal. Today. 1992. V. 13. P. 599–602. https://doi.org/10.1016/0920-5861(92)80093-3
Zhereb V.P., Voskresenskaya E.N., Kurteeva L.T., Kargin V.F., Anshits A.G. Role of Phase Boundary in Heterogeneous Oxide Catalysts for Oxidative Coupling of Methane // React. Kinet. Catal. Lett. 1993. V. 50. № 1/2. P. 327–332. https://doi.org/10.1007/BF02062231
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы