Неорганические материалы, 2022, T. 58, № 12, стр. 1353-1360
Кинетика формирования алюмоиттриевого граната из аморфной фазы гидрозолей разного состава
А. Д. Плехович 1, *, Е. Е. Ростокина 1, А. М. Кутьин 1, Е. М. Гаврищук 1
1 Институт химии высокочистых веществ им. Г.Г. Девятых Российской
академии наук
603951 Нижний Новгород, Тропинина ул., 49, БОКС-75, Россия
* E-mail: plekhovich@ihps-nnov.ru
Поступила в редакцию 12.09.2022
После доработки 30.09.2022
Принята к публикации 05.10.2022
- EDN: LFOAFI
- DOI: 10.31857/S0002337X22120090
Аннотация
Методом синхронного термоанализа с рентгенофазовым контролем температурных изменений состава продуктов превращения исследованы условия и кинетика кристаллизации алюмоиттриевого граната (YAG) из рентгеноаморфной смеси гидратированных соединений иттрия и алюминия (стехиометрической по соотношению указанных элементов), содержащих различные функциональные группы. Методика обработки неизотермических ДСК-данных с нахождением кинетических параметров и выявлением деталей механизма формирования YAG может служить основой прогнозирования температурно-временных режимов образования как граната, так и других функциональных кристаллических фаз при создании модифицированных и новых керамических и стеклокерамических материалов.
ВВЕДЕНИЕ
Получаемая твердофазным синтезом керамика на основе алюмоиттриевого граната Y3Al5O12 (YAG), к настоящему времени ставшая эффективным материалом лазерной индустрии, может служить модельной системой для развития золь–гель-метода. Выявление особенностей формирования YAG из различных прекурсоров может способствовать модификации характеристик YAG, в т.ч. в его стеклокристаллических формах [1]. Несмотря на широкое использование YAG, работы по механизму и кинетике его формирования весьма немногочисленны.
Известно, что традиционный твердофазный синтез YAG из стехиометрической смеси оксидов алюминия и иттрия протекает через ряд последовательных промежуточных фаз при высоких температурах: Y4Al2O9 (моноклинная YAM) → YAlO3 (гексагональная/орторомбическая YAH/YAP) → Y3Al5O12 [2–4]. Показано, что с наибольшей скоростью идет реакция синтеза YAG на его заключительной стадии, а скорость суммарного процесса лимитируется образованием YAM и YAP [4].
Формально-кинетический анализ уравнений последовательных твердофазных реакций образования YAG [4, 5] оказывается весьма ограниченным [6, 7]. В большинстве работ кинетическая характеризация синтеза YAG (коэффициенты диффузии и энергия активации) проводилась для твердофазной брутто-реакции 3Y2O3 + 5Al2O3 → 2Y3Al5O12 [8–10].
Использование золь–гель-метода позволяет снизить температуру кристаллизации YAG. При этом кинетические характеристики его формирования непосредственно из аморфной фазы, чаще всего определяемые по данным дифференциального термического анализа (ДТА) и дифференциальной сканирующей калориметрии (ДСК), не учитывают образования промежуточных фаз [11–16].
Работы по кинетике кристаллизации алюмоиттриевого граната в двухфазных гелях практически отсутствуют. Процесс формирования YAG в таких системах протекает через ряд последовательно-параллельных реакций с накоплением и расходованием промежуточных продуктов, а состав и последовательность превращения при последующем образовании кристаллических фаз из аморфного состояния зависят от состава прекурсоров [17]. В работе [18] образование граната в пленках из коллоидных золей происходило при температуре 1323 К через примесную YAM-фазу. Обработка данных процессов зародышеобразования и двумерного роста YAG в таких двухфазных пленках выполнена по формулам Аврами в температурном интервале 1073–1373 К с энергией активации роста зерен ~280 кДж/моль. Cкорость роста YAG возрастает по мере увеличения толщины пленки. В работе [19] термообработке подвергались порошки, полученные высушиванием гелей (алкоксидный подход). Образование YAG в таких порошках сопровождалось наличием YAP-фазы вплоть до температуры отжига 1773 К. Кинетика поверхностного зародышеобразования и роста кристаллов YAG в изотермических условиях описывается уравнением Джонсона–Мейла–Аврами с энергией активации процесса, равной 289 кДж/моль. Синтезированные методом цитратного геля порошки в работе [20, 21] подвергались термообработке в различных атмосферах и с разными скоростями нагревания. При прокаливании на воздухе наблюдалось образование YAG непосредственно из аморфной фазы, которое не сопровождалось образованием промежуточных фаз. В бескислородной атмосфере при высокой скорости нагревания фазообразование происходило по схеме: аморфная фаза → YAH → YAG, при медленном нагревании: аморфная фаза → YAH + YAG → YAG. Выводы относительно механизмов были сделаны на основании совокупности аналитических данных, а также данных термического анализа, ИК-спектроскопии, качественного РФА.
Наиболее последовательное математическое моделирование реакций образования YAG из аморфной золь–гель-фазы, сформированной конкретными прекурсорами, с температурно-временным РФА-контролем состава продуктов, включая промежуточные компоненты YAM и YAP, выполнено в работе [17]. Вместе с тем в литературе отсутствуют количественные исследования влияния различных прекурсоров на условия формирования YAG в рамках золь–гель-метода.
Целью данной работы являлось сравнительное исследование кинетики неизотермической кристаллизации YAG из аморфной фазы, полученной из золь–гель-прекурсоров разного состава. Инструментом анализа ДСК-пиков кристаллизации явилась модель, которая основана на известном варианте фундаментальной теории Колмогорова–Мейла–Джонсона и дополнена полуэмпирическим, но практически действенным подходом Ерофеева (КМДЕ). При обработке данных и нахождении кинетических характеристик заключительной стадии формирования YAG математически последовательно учитывается неизотермичность ДСК-измерений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Порошки состава YAG были синтезированы золь–гель-методом путем высушивания (до температуры 423 К) гидрозолей гидроксидов алюминия-иттрия и последующего диспергирования ксерогелей в планетарной мельнице в течение 10 мин. В качестве исходных компонентов для синтеза золей использовали оксид иттрия Y2O3 (чистота 99.99%, “Полирит”, Россия), изопропилат алюминия Al(i-OC3H7)3 (чистота 99.99%), азотную HNO3 (чистота 99.9999%, “Химреактив”, Россия) и уксусную CH3COOH (чистота 99.9%, “Химреактив”, Россия) кислоты. Гидрозоли гидроксидов алюминия-иттрия получали смешением соответствующих исходных реагентов в соотношении Y : Al = 3 : 5 по ранее разработанным методикам [22]. Дисперсные образцы, полученные на основе гидрозоля состава обозначим: Al5(NO3)3(OH)12⋅3/2 Y2O3 – I, Al5(NO3)3(OH)12⋅3Y(OH)2(OOCCH3) – II, 5AlOOH(NO3)0.07⋅3Y(OH)2(OOCCH3) – III.
Отжиг порошков гидроксидов алюминия-иттрия (для РФА) осуществляли в лабораторной печи SNOL 6.7/1300 в температурном интервале 673–1373 К с изотермической выдержкой 30 мин.
Рентгенофазовый анализ образцов проводили на рентгеновском дифрактометре Bruker D8 Discover c СuКα-излучением (λ = 1.5418 Å). Съемка выполнялась в симметричной θ–2θ-геометрии в диапазоне углов 2θ = 10°–80° с линейным PSD-детектором LynxEye. Все образцы исследовались в идентичных экспериментальных условиях. Качественный фазовый анализ был выполнен в программе Diffrac.EVA 2.0 с использованием баз данных PDF-2 release 2011. Количественный фазовый анализ проводился методом Ритвельда в программе Diffracplus TOPAS 4.2.
Регистрацию тепловых эффектов образования фазы YAG осуществляли на синхронном термоанализаторе STA 409 PC Luxx фирмы Netzsch. Измерения выполняли на образцах массой 50 мг в платиновых тиглях в потоке аргона при скоростях нагревания β 5, 10 и 15 К/мин от комнатной температуры до 1423 К. Температурная калибровка по набору образцов фирмы Netzsch выполнена при скорости нагревания 10 К/мин. Образцы для ДСК-измерений представляли собой компакты диаметром около 5 мм, полученные одноосным прессованием при давлении 2 т/см2 рентгеноаморфных (отожженных при 673 К) золь–гель-порошков разного состава.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рентгенофазовый анализ порошков. На рис. 1 приведены дифрактограммы порошков YAG, полученных из прекурсоров (гидрозолей) разного состава при их последовательной термообработке при различных температурах.
Рис. 1.
Рентгенограммы порошков YAG, полученных из гидрозолей разного состава: образцы I (а), II (б), III (в).
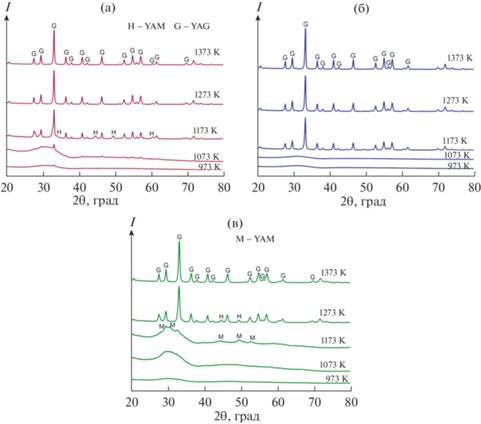
Из приведенных рентгенограмм видно, что процесс формирования фазы алюмоиттриевого граната зависит от состава используемого гидрозоля.
Образец I. Началу образования фазы YAG в образце I способствует повышение температуры отжига порошков до 973–1073 К. При этих температурах образец представляет собой смесь аморфной (Y2O3) и поликристаллической (YAG) фаз, в которой содержание YAG не превышает 6–8 мас. %. Последующее повышение температуры отжига до 1173 К приводит к полной кристаллизации образца, положение дифракционных пиков отвечает кубической фазе алюмоиттриевого граната с небольшой долей гексагональной фазы (YAlO3). При температурах выше 1173 К образец представляет собой 100%-ный YAG.
Образец II. Кристаллизация фазы YAG в образце II происходит из аморфной фазы в интервале температур 1123–1173 К. Промежуточных фаз не наблюдается.
Образец III. Формирование фазы алюмоиттриевого граната в образце III происходит в температурном диапазоне 1223–1273 К через образование промежуточных моноклинной и гексагональной фаз.
Главный фактор различия процессов обусловлен взаимодействием анионных составляющих прекурсоров, а также степенью однородности компонентов на молекулярном уровне. Так, взаимодействие гидроксидов-нитратов алюминия с гидроксидами-ацетатами иттрия при повышении температуры приводит к образованию энергетически выгодных летучих соединений (H2O, N2, CO2) и, возможно, обеспечивает образующийся гранат в образце II достаточным количеством кислорода, что не приводит к образованию промежуточных фаз из оксидов алюминия и иттрия. Наличие в исходной аморфной фазе образца I оксида иттрия, а в образце III оксида-гидроксида алюминия затрудняет преобразование анионных групп соответственно у алюминия и иттрия, приводя к появлению промежуточных фаз.
Таким образом, использование полученных гидрозолей гидроксидов алюминия-иттрия позволило снизить температуру образования фазы алюмоиттриевого граната на 373–773 К относительно метода твердофазного синтеза, а также ряда золь–гель-подходов, основанных на применении коллоидных растворов [23–28]. Отметим, что образец II при одностадийном процессе формирования YAG обеспечивает максимальное снижение температуры его синтеза.
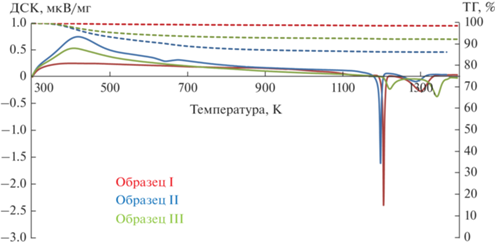
ДСК порошков. Результаты синхронного термоанализа (ДСК и ТГ) трех образцов ксерогелей в дополнение к данным РФА о составе формирующейся фазы граната, включая ее промежуточные формы (рис. 2), уточняют температурные условия образования, выявляя механизм процесса. ДСК-кривые из общего интервала температур 1170–1400 К конкретизируют температурные режимы в зависимости от состава исходных прекурсоров. ТГ-кривые (рис. 2) в вышеуказанном интервале температур определяют области деструкции анионных составляющих до необходимого для YAG кислорода с соответствующей потерей массы. Хорошо выраженные экзотермические пики ДСК-кривых определяют индивидуальные для каждой анионной комбинации образца температуры первичного этапа формирования YAG из аморфной фазы, дополненного возможными промежуточными кристаллическими образованиями из оксидов иттрия и алюминия. Состав последних расшифровывается данными РФА (см. рис. 1).
Рис. 2.
Результаты синхронного термического анализа ксерогелей разных составов (скорость нагревания 15 К/мин).
Характеризацию переходов между состояниями, которые вследствие неизотермичности ДСК-измерений представлены на рис. 3 тремя кривыми, соответствующими трем скоростям нагревания, начнем с образца II. Как было отмечено, оптимальное сочетание анионных составляющих обеспечивает минимальную температуру (1170 К) образования YAG без промежуточных фаз. Существенно более слабые сопутствующие пики при температурах 1250–1330 К могут соответствовать процессам рекристаллизации и спекания высокодисперсной фазы на заключительной стадии формирования YAG.
Рис. 3.
ДСК-кривые формирования кристаллических образцов YAG из ксерогелей разных составов при скоростях нагрева 5 (пунктир), 10 (штрих-пунктир), 15 К/мин (сплошная линия) (рамкой выделен целевой пик формирования YAG).
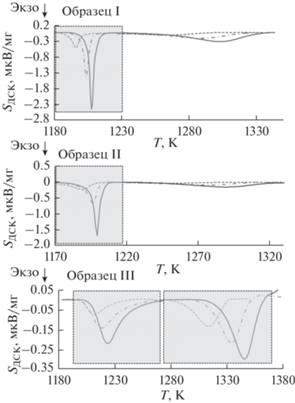
Появление гексагональной фазы (YAlO3 ≡ YAH) в образце I добавляет в процесс формирования YAG экзотермический переход YAH → YAG, что увеличивает сигналы и сдвигает их в область температур 1180–1340 К.
По сравнению с образцами I и II в образце III наблюдаются наиболее существенные изменения как в энергетике, так и в температурных условиях формирования YAG, которые начинаются с образования моноклинной фазы (Y4Al2O9 ≡ YAM) при Т ~ 1200 К, а заканчиваются в интервале температур 1290–1370 К формированием кубического YAG. В последнем, наиболее высокотемпературном, процессе образования YAG также принимает участие промежуточная фаза YAH.
Методика обработки ДСК-кривых и ее применение к процессу кристаллизации YAG. Определение сигнала в ДСК-приборах основано на принятой [29] его пропорциональности удельному тепловому потоку. Применение формул Де Донде к квазихимической реакции кристаллизации А → *А с использованием степени превращения α = ξ/n0 математически последовательно выражает сигнал ДСК в области кристаллизационного пика: ${{S}_{{{\text{ДСК}}}}} = \left( {C{{Q}_{M}}} \right)\dot {\alpha }$ через приборную константу С, удельную теплоту кристаллизации QM = ∆rH/M и скорость кристаллизации $\dot {\alpha } = \frac{{d\alpha }}{{dt}}$. Ввиду сложности задачи определения тепловых эффектов взаимосвязанных реакций кристаллизации в данной работе размерность ДСК-сигнала [SДСК] = мкВ/мг соответствует исходной определяемой величине, а размерность объединенной константы [CN] = = [CQM] = [SДСК/$\dot {\alpha }$] = мкВ с/мг.
Используемая прикладная теория, определяющая температурную и временную зависимости степени кристаллизации $\alpha \left( {t,~T} \right)$, исходит из фундаментального подхода кинетики кристаллизации Колмогорова-Джонсона-Мейла (КДМ) [30–32] в упрощенном варианте Аврами (ДМА)
(1)
$\begin{gathered} \alpha \left( {t,~T} \right) = 1 - \exp \left( { - {{\tau }^{n}}} \right),\,\,\,\,\dot {\alpha } = \frac{{d\alpha }}{{dt}} = \\ = \,\,k\alpha _{\tau }^{'}\left( \alpha \right) = kn{{\left[ { - \ln \left( {1 - \alpha } \right)} \right]}^{{1 - 1/n}}}\left( {1 - \alpha } \right), \\ \end{gathered} $Сохранение первого члена разложения в ряд сомножителя в (1) [–ln(1 – α)]1–1/n ≈ α1–1/n позволило заменить эмпирическую модель (2) теоретически обоснованным упрощением варианта (1) в области развития пика (α < 0.5), а введением дополнительного параметра p в последний сомножитель (2) обеспечить лучшее описание процессов на заключительной стадии кристаллизации
(3)
$\dot {\alpha } = kn{{\alpha }^{{1 - 1/n}}}{{\left( {1 - {{\alpha }^{{1/p}}}} \right)}^{{1 + p/n}}}.$Параметрически расширенная дифференциальная форма (3) имеет аналитическое решение
(4)
$\alpha \left( {t,~T} \right) = \frac{1}{{{{{\left( {1 + 1{\text{/}}{{\tau }^{{~n{\text{/}}p}}}} \right)}}^{p}}}}.$Представленная прикладная теория кристаллизации ((3), (4)) КДМЕ обладает признанными средствами кинетической характеризации процесса. Константа скорости кристаллизации в представлении Аррениуса k = Aexp(–Ea/(RT)) = exp(s − ‒ Ea/(RT)) с предэкспоненциальным множителем A и энергией активации Ea входят в уравнения теории через произведение τ = kt; n – степенной параметр (в химической литературе параметр Аврами), качественно соответствующий т.н. размерному параметру теории КДМ. Параметр p детализирует кристаллизационный процесс на конечной стадии диффузионного формирования фазы, что не обеспечивает модель ДМА. Вместо предэкспоненциального множителя A (с–1) используется удобный для вычислений параметр s = ln A.
Задача характеризации процесса кристаллизации изотермическими кинетическими параметрами по результатам неизотермических измерений при линейном изменении температуры образца со скоростью β решается введением эффективной “неизотермической” константы скорости кристаллизации $\overline {k~} $ путем дифференцирования выражения (4) с учетом зависимости T = T0 + βt
(5)
$\dot {\alpha } = \bar {k}n{{\alpha }^{{1 - 1/n}}}{{\left( {1 - ~{{\alpha }^{{1_{{\text{/}}}^{{}}p}}}} \right)}^{{1 + p/n}}}.$Татим образом обработка “пиковых” значений ДСК-кривых, осуществляемая по уравнениям (4)−(6) при замене уравнения (3) с константой скорости k на уравнение (5) с учитывающей “неизотермичность” формой (6), оказывается зависящей только от искомых изотермических кинетических параметров: Ea, s = ln A, n, p.
(6)
$\overline {k~} = k\left( {1 + \frac{{\left( {1 - ~{{T}_{0}}{\text{/}}T~} \right){{E}_{a}}}}{{RT~}}} \right).$Подчеркнем, что T0 как начальная температура интервала, в пределах которого обрабатывается пик кристаллизации, вместе с приборной константой CN являются вспомогательными параметрами, присущими методу ДСК.
Результат нелинейно регрессионной обработки полученных ДСК-пиков кристаллизации YAG (символы) по уравнениям (4)−(6) разработанной прикладной теории КДМЕ (линии) для трех образцов, отличающихся составами анионной части исходных прекурсоров, представлен на рис. 4.
Рис. 4.
Экспериментальные (значки) и рассчитанные по уравнениям (4)−(6) (линии) ДСК-пики кристаллизации, а также рассчитанные по уравнению (4) степени кристаллизации (α) трех образцов YAG при скоростях нагревания β = 5, 10, 15 К/мин.
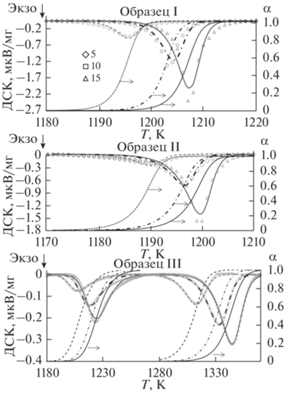
Заметим, что температурно-временная зависимость перехода между состояниями $\alpha \left( {t,~T} \right)$, которая может быть представлена в виде двумерного графика, предсказывает степени перехода между состояниями не только при постоянных скоростях нагревания, но и при произвольных по температуре и времени режимах термообработки. Кинетические параметры кристаллизации образцов приведены в табл. 1.
Таблица 1.
Параметры кинетики кристаллизации фазы YAG в образцах ксерогелей разного состава (I–III)
| СN, мкВ с/мг | Ea, кДж/моль | s = ln(A/с–1) | n | p | T0, К | ||||
|---|---|---|---|---|---|---|---|---|---|
| 5* | 10* | 15* | основные параметры | 5* | 10* | 15* | |||
| Образец I | |||||||||
| 36 | 41 | 48 | 1024 | 96.62 | 3.95 | 0.44 | 1149 | 1160 | 1156 |
| Образец II | |||||||||
| 22 | 31 | 40 | 1151 | 109.17 | 2.83 | 0.33 | 1096 | 1099 | 1090 |
| Образец III | |||||||||
| 22 | 21 | 20 | 729 | 65.70 | 4.00 | 1.99 | 1099 | 1102 | 1096 |
| 40 | 34 | 32 | 495 | 38.33 | 2.25 | 0.47 | 1230 | 1251 | 1261 |
Независимый вариант кинетической характеризации кристаллизации с определением изотермических активационных параметров, в частности энергии активации EK, по максимальным значениям ряда ДСК-пиков (Tmax) при нескольких скоростях нагревания (β, К/мин) предоставляет известное уравнение Киссинджера [34, 35]
(7)
${\text{ln}}\left( {\frac{{{\beta }}}{{T_{{{\text{max}}}}^{2}}}} \right) = - \frac{{{{E}_{K}}}}{R}\left( {\frac{1}{{{{T}_{{{\text{max}}}}}}}} \right) + {\text{ln}}{\kern 1pt} A~.$Рис. 5.
Линейные зависимости Киссинджера исследованных процессов образования YAG для образцов I, II, III.
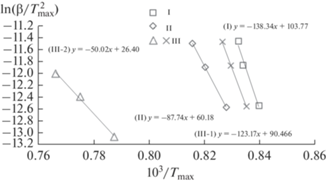
Хорошее соответствие рассчитанных ДСК-кривых с экспериментальными данными (рис. 4) указывает на возможность использования параметров кинетической модели (см. табл. 1) для выявления определенных деталей механизма изучаемого процесса кристаллизации. Так, для образца I, с позиции исходной фундаментальной теории КДМ, близкое к четырем значение параметра n = 3.95 свидетельствует о трехмерном росте YAG на образующихся зародышах промежуточной фазы YAH ≡ YAlO3 (т.н. α-вариант модели [32]). Для образца II при значении n = 2.83, близком к трем, с позиции того же варианта, можно допустить, что фазово-химическая стадия зародышеобразования не является лимитирующей относительно диффузионного роста фазы YAG. Однако КДМ принципиально допускает в образце II менее вероятный процесс формирования двумерных, например чешуйчатых, наночастиц с соответствующим зародышеобразованием по β-варианту [32].
Заметно отличающийся процесс формирования YAG в образце III, по данным РФА, начинается объемной (α-вариант модели КДМ) кристаллизацией из аморфного состояния моноклинной фазы YAM ≡ Y4Al2O9, что соответствует значению параметра n = 4 из табл. 1. Однако этот процесс образования YAG заканчивается при нехватке иттрия. Последующее повышение температуры создает условия, когда на зародышах YAM образуется YAG (вторая группа пиков для образца III на рис. 4) с участием промежуточной фазы YAH ≡ YAlO3 при заметном снижении диффузионно-определяемых активационных параметров. В пользу такого механизма (β-вариант [32] реализации процесса) свидетельствует значение параметра n < 3.
ЗАКЛЮЧЕНИЕ
Обработка кинетических данных кристаллизации алюмоиттриевого граната из рентгеноаморфной фазы, образованной гидрозолями разного состава, по модели КМДЕ позволила для каждой из трех рассмотренных комбинаций прекурсоров предложить соответствующие наборы изотермических параметров. Сечение двумерного графического представления формулы (4) (ТТТ-диаграммы) с найденными параметрами определяет температурно-временной режим термообработки при кристаллизации YAG.
В работе показано, что подбором прекурсоров иттрия и алюминия, анионная часть которых содержит фрагменты “топлива” и “окислителя”, достигается минимальная температура одностадийного, без промежуточных кристаллических фаз, механизма образования YAG.
Список литературы
Alahrache S., Deschamps M., Lambert J., Suchome M.R., Meneses D.D.S., Matzen G., Massiot D., Véron E., Allix M. Crystallization of Y2O3–Al2O3 Rich Glasses: Synthesis of YAG Glass-Ceramics // J. Phys. Chem. 2011. V. 115. № 42. P. 20499–20506. https://doi.org/10.1021/jp207516w
Lee S.-H., Kochawattana S., Messing G.L., Dumm J.Q., Quarles G., Castillo V. Solid-State Reactive Sintering of Transparent Polycrystalline Nd:YAG Ceramics // J. Am. Ceram. Soc. 2006. V. 89. № 6. P. 1945–1950. https://doi.org/10.1111/j.1551-2916.2006.01051.x
Yang H., Qin X., Zhang J., Ma J., Tang D., Wang S., Zhang Q. The Effect of MgO and SiO2 Codoping on the Properties of Nd:YAG Transparent Ceramic // Opt. Mater. 2012. V. 34. P. 940–943. https://doi.org/10.1016/j.optmat.2011.05.029
Нейман А.Я., Ткаченко Е.В., Квичко Л.А., Коток Л.А. Условия и макромеханизм твердофазного синтеза алюминатов иттрия // Журн. неорган. химии. 1980. Т. 25. № 9. С. 2340–2345.
Книга М.В., Михалева Т.Г., Ривкин М.Н. Взаимодействие в системе Y2O3–Al2O3 // Журн. неорган. химии. 1972. Т. XVII. № 6. С. 1744–1746.
Третьяков Ю.Д. Твердофазные реакции: монография. М.: Химия, 1978. 360 с.
Браун М. Реакции твердых тел: пер. с англ. / Под ред. Брауна М. и др. М.: Мир, 1983. 360 с.
Mackevičius M., Ivanauskas F., Kareiva A. Mathematical Approach to Investigation of Synthesis Processes at High Temperatures // Cent. Eur. J. Chem. 2012. V. 10. № 2. P. 380–385. https://doi.org/10.2478/s11532-011-0159-7
Ivanauskas F., Kareiva A., Lapcun B. Computational Modelling of the YAG Synthesis // J. Math. Chem. 2009. V. 46. № 2. P. 427–442. https://doi.org/10.1007/s10910-008-9468-2
Ivanauskas F., Kareiva A., Lapcun B. Diffusion and Reaction Rates of the Yttrium Aluminium Garnet Synthesis Using Different Techniques // J. Math. Chem. 2007. V. 42. № 2. P. 191–199. https://doi.org/10.1007/s10910-006-9092-y
Chen D., Jordan E.H., Gell M. Sol–Gel Combustion Synthesis of Nanocrystalline YAG Powder from Metal-Organic Precursors // J. Am. Ceram. Soc. 2008. V. 91. № 8. P. 2759–2762. https://doi.org/10.1111/j.1551-2916.2008.02505.x
Agular E.A., Drew R.A.L. Kinetic Study of Amorphous Yttria–Alumina Fibers Using Differential Thermal Analysis // J. Am. Ceram. Soc. 2003. V. 86. № 1. P. 43–48. https://doi.org/10.1111/j.1151-2916.2003.tb03275.x
Wang H.M., Simmonds M.C., Huang Y.Z., Rodenburg J.M. Synthesis of Nanosize Powders and Thin Films of Yb-Doped YAG by Sol Gel Methods // Chem. Mater. 2003. V. 15. P. 3474–3480. https://doi.org/10.1021/cm021248l
Gong H., Tang D.-Y., Huang H., Han M.-D., Sun T., Zhang J., Qin X.-P., Ma J. Crystallization Kinetics and Characterization of Nanosized Nd:YAG by a Modified Sol–Gel Combustion Process // J. Cryst. Growth. 2013. V. 362. P. 52–57. https://doi.org/10.1016/j.jcrysgro.2011.12.087
Hou J.G., Kumar R.V., Qu Y.F., Krsmanovic D. Crystallization kinetics and Densification of YAG Nanoparticles from Various Chelating Agents // Mater. Res. Bull. 2009. V. 44. P. 1786–1791. https://doi.org/10.1016/j.materresbull.2009.03.001
Wu Y.-C., Parola S., Marty O., Villanueva-Ibanez M., Mugnier J. Structural Characterizations and Waveguiding Properties of YAG Thin Films Obtained by Different Sol–Gel Processes // Opt. Mater. 2005. V. 27. P. 1471–1479. https://doi.org/10.1016/j.optmat.2005.03.004
Kutyin A.M., Rostokina E.Ye., Gavrishchuk E.M., Drobotenko V.V., Plekhovich A.D., Yunin P.A. Kinetics and Formation Mechanism of Yttrium Aluminum Garnet from an Amorphous Phase Prepared by the Sol–Gel Method // Ceram. Int. 2015. V. 41. P. 10616–10623. https://doi.org/10.1016/j.ceramint.2015.04.161
Hay R.S. Phase Transformations and Microstructure Evolution in Sol-Gel Derived Yttrium-Aluminum Garnet Films // J. Mater. Res. 1993. V. 8. № 3. P. 5780–604. https://doi.org/10.1557/JMR.1993.0578
Lo J.-R., Tseng T.-Y. Phase Development and Activation Energy of the Y2O3–Al2O3 System by a Modified Sol-Gel Process // Mater. Chem. Phys. 1998. V. 56. № 1. P. 56–62. https://doi.org/10.1016/S0254-0584(98)00139-4
Ramanujam P., Vaidhyanathan B., Binner J., Anshuman A., Spacie C. A Comparative Study of the Synthesis of Nanocrystalline Yttrium Aluminium Garnet Using Sol-Gel and Co-Precipitation Methods // Ceram. Int. 2014. V. 40. P. 4179–4186. https://doi.org/10.1016/j.ceramint.2013.08.075
Wang R., Wang Y., Fu Z., Wang H., Wang W., Zhang J., Zhu J. Phase Evolution of YAG Powders Obtained by Gel Combustion Combined with Field-Assisted Rapid Synthesis Technique // Ceram. Int. 2015. V. 41. № 6. P. 7289–7295. https://doi.org/10.1016/j.ceramint.2015.02.009
Балабанов С.С., Гаврищук Е.М., Дроботенко В.В., Плехович А.Д., Ростокина Е.Е. Влияние состава исходных золей гидроксидов алюминия-иттрия на свойства порошков алюмоиттриевого граната // Неорган. материалы. 2014. Т. 50. № 10. С. 1114–1118.
Tanner P.A., Law P.-T., Fu L. Preformed Sol-Gel Synthesis and Characterization of Lanthanide Iondoped Yttria-Alumina Materials // Phys. Status. Solidi A. 2003. V. 199. № 3. P. 403–415. https://doi.org/10.1002/pssa.200306683
King B., Liu Y., Baskaran S., Laine R., Halloran J. Yttrium Aluminate Ceramic Fibers via Pre-Ceramic Polymer and Sol-Gel Routes // Part. Sci. Technol. 1992. V. 10. № 3–4. P. 121–132. https://doi.org/10.1080/02726359208906606
King B.H., Halloran J.W. Polycrystalline Yttrium Aluminum Garnet Fibers from Colloidal Sols // J. Am. Ceram. Soc. 1995. V. 78. № 8. P. 2141–2148. https://doi.org/10.1111/j.1151-2916.1995.tb08626.x
King B.H., Liu Y. et al. Fabrication of Yttrium Aluminate Fibers // Ceram. Eng. Sci. Proc. 1993. V. 14. № 7/8. P. 639–650.
Li C., Zhang Y., Gong H., Zhang J., Nie L. Preparation, Microstructure and Properties of Yttrium Aluminum Garnet Fibers Prepared by Sol–Gel Method // Mater. Chem. Phys. 2009. V. 113. P. 31–35. https://doi.org/10.1016/j.matchemphys.2008.07.025
Han K.R., Koo H.J., Lim C.S. A Simple Way to Synthesize Yttrium Aluminum Garnet by Dissolving Yttria Powder in Alumina Sol // J. Am. Ceram. Soc. 1999. V. 82. № 6. P. 1598–1600. https://doi.org/10.1111/j.1151-2916.1999.tb01966.x
Borchard H.J., Daniels F. The Application of Differential Thermal Analysis to the Study of Reaction Kinetics // J. Am. Chem. Soc. 1957. P. 79. https://doi.org/10.1021/ja01558a009
Колмогоров А.Н. К статистической теории кристаллизации металлов // ИЗВ. АН СССР. Сер. матем. 1937. Т. 1. № 3. С. 355–359.
Johnson W.A., Mehl R.F. Reaction Kinetics in Processes of Nucleation and Growth // Trans. AIME. 1939. V. 135. P. 416.
Беленький В.З. Геометрико-вероятностные модели кристаллизации. М.: Наука, 1980. 84 с.
Янг Д. Кинетика разложения твердых веществ: пер. с англ. Печерской К.А. / Под ред. Ерофеева Б.В. М.: Мир, 1969. С. 263.
Gong H., Tang D.-Y., Huang H., Han M.-D., Sun T., Zhang J., Qin X.-P., Ma J. Crystallization Kinetics and Characterization of Nanosized Nd:YAG by a Modified Sol–Gel Combustion Process // J. Cryst. Growth. 2013. V. 362. P. 52–57. https://doi.org/10.1016/j.jcrysgro.2011.12.087
Llόpiz J., Romero M.M., Jerez A., Laureiro Y. Generalization of the Kissinger Equation for Several Kinetic Models // Thermochim. Acta. 1995. V. 256. P. 205–211. https://doi.org/10.1016/0040-6031(94)02109-2
Wu Y.-C., Parola S., Marty O., Villanueva-Ibanez M., Mugnier J. Structural Characterizations and Waveguiding Properties of YAG Thin Films Obtained by Different Sol–Gel Processes // Opt. Mater. 2005. V. 27. P. 1471–1479. https://doi.org/10.1016/j.optmat.2005.03.004
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


