Неорганические материалы, 2022, T. 58, № 2, стр. 225-232
Характеристики наночастиц металлического иридия, синтезированных в гидротермальных условиях
Р. В. Борисов 1, 2, *, О. В. Белоусов 1, 2, А. М. Жижаев 1, С. Д. Кирик 1, 2, Ю. Л. Михлин 1
1 Институт химии и химической технологии СО Российской академии наук
660036 Красноярск, Академгородок, 50/24, Россия
2 Сибирский федеральный университет
660041 Красноярск, Свободный пр., 79, Россия
* E-mail: roma_boris@list.ru
Поступила в редакцию 22.11.2021
После доработки 03.12.2021
Принята к публикации 06.12.2021
- EDN: VGOWKZ
- DOI: 10.31857/S0002337X22020038
Аннотация
Рассмотрены процессы получения наноразмерных металлических частиц иридия в гидротермальных условиях. Установлено, что восстановление водных растворов гексахлороиридата(IV) калия тетрагидридоборатом натрия в кислых и щелочных средах при температурах 130–180°С происходит в течение 2–30 мин. При этом образуются высокодисперсные порошки металлического иридия, для которых характерна полиблочная структура. В зависимости от условий синтеза усредненный диаметр наночастиц иридия(0) находится в диапазоне 8–300 нм, а размеры областей когерентного рассеяния – до 10 нм. Методом низкотемпературной газовой адсорбции азота определены удельные поверхности, значения которых для материалов, полученных в кислых средах, лежат в диапазоне 1–10 м2/г, а в щелочных достигают 25 м2/г. Согласно рентгеновской фотоэлектронной спектроскопии, на поверхности наночастиц иридия диаметром 8 нм обнаружены оксидные пленки. Дифференциальной калориметрией с термогравиметрией в атмосфере аргона показано, что доля оксидных соединений иридия в образце с удельной поверхностью 25 м2/г не превышает 5 мас. %.
ВВЕДЕНИЕ
Наночастицы платиновых металлов проявляют физико-химические свойства, отличные от свойств объемных аналогов из-за большого количества поверхностных атомов [1, 2]. Наноматериалы на основе благородных металлов находят широкое применение в разнообразных сферах: в электронике, в водородной энергетике, в медико-биологических и каталитических исследованиях [3–6].
В последние несколько лет значительно вырос интерес к наноматериалам на основе иридия благодаря их применению во многих каталитических процессах: выделения и восстановления кислорода, в гидрировании ненасыщенных соединений, водных электролизерах [7–11]. Функциональные материалы на основе иридия сочетают высокую активность и селективность, проявляют лучшую химическую стабильность по сравнению с другими благородными металлами. Размеры, форма частиц, разнообразная морфология, структура поверхности оказывают существенное влияние на свойства и применение материалов. Высокое отношение поверхности к объему приводит к увеличению количества каталитических активных центров и снижению расхода металла, что можно корректировать и контролировать в процессе синтеза [10–15].
В литературе описаны методы получения наночастиц иридия из растворов путем восстановления комплексных соединений различными восстановителями с использованием поверхностно-активных веществ, препятствующих агрегации частиц [16–23]. Отмечено, что стабилизирующие реагенты адсорбируются на поверхности наночастиц и оказывают влияние на каталитическую активность. Удаление загрязняющих адсорбированных веществ с поверхности – крайне сложная задача. Поэтому разработка эффективных способов получения наночастиц без поверхностно-активных веществ представляет интерес. Например, в работе [23] предложен метод синтеза наночастиц иридия, не содержащих поверхностно-активных веществ.
Процессы восстановления иридия разрешены термодинамически, но затруднены в силу кинетических ограничений. Даже использование сильных восстановителей не всегда приводит к образованию металлических частиц в открытых системах, и зачастую требуется введение многократного избытка реагентов. Интенсифицировать процесс восстановления позволяет проведение реакции при повышенных температурах в закрытых системах (автоклавах). Гидротермальные процессы успешно применяются для синтеза цветных и благородных металлов, а также композитов на их основе [14, 24–27]. Другой подход к получению металлических порошков, в том числе полиметаллических, состоит в разложении двойных комплексных солей [28, 29]. Например, в работе [28] исследовано термическое разложение гексахлориридата(IV) аммония в инертной и восстановительной атмосферах. Продуктами разложения в зависимости от условий могут быть как кубические частицы микрометровых размеров, так и цепочки толщиной около 100 нм с дендритной структурой.
Разработка методик получения наночастиц иридия с заданными формой и размерами и, соответственно, функциональных материалов с контролируемой поверхностью, не загрязненной адсорбированными продуктами синтеза, является актуальной задачей.
Цель настоящего исследования – разработать методику гидротермального синтеза наноразмерных металлических частиц иридия(0) путем химического восстановления растворов гексахлороиридата(IV) калия в кислых и щелочных средах и изучить структурные характеристики полученных продуктов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе использовали: K2IrCl6 (синтезирован по методике, описанной в работе [30]); соляную кислоту – ОСЧ 20-4; гидрат гидразина – “х. ч.”; тетрагидридоборат натрия – “х. ч.”; гидроксид натрия – “х. ч.”; аммиак водный ОСЧ 23-5; аргон газообразный, сорт высший; дистиллированную воду, подготовленную с использованием системы очистки воды Direct-Q3 (Millipore).
Синтез порошков иридия различной дисперсности проводили восстановлением свежеприготовленных растворов гексахлороиридата(IV) калия гидразин-гидратом или тетрагидридоборатом натрия в закрытых системах. Эксперименты проводили в кварцевых автоклавах объемом 45 см3, конструкция которых описана в предыдущих работах [30, 31].
В автоклав помещали требуемую навеску гексахлороиридата(IV) калия (массой 1200.0 мг), взвешенную с точностью 0.1 мг, и добавляли заданной объем (30.0 см3) водного раствора кислоты или щелочи. Во фторопластовую чашечку на внутренней поверхности крышки автоклава помещали навеску тетрагидридобората натрия. Автоклав герметизировали и нагревали в воздушном термостате в вертикальном положении в течение 40 мин до требуемой температуры. После прогрева включали перемешивание, обеспечивая смешение фаз. Наблюдали изменение окраски (обесцвечивание) раствора в первые минуты и фиксировали образование осадка. После термостатирования в течение заданного времени автоклав охлаждали, раствор отфильтровывали и отбирали для определения содержания иридия. Осадок в виде порошка черного цвета отделяли от раствора, обрабатывали горячей 1 М соляной кислотой и затем многократно промывали дистиллированной водой до отрицательной реакции на хлорид-ион. Промывку осадков осуществляли декантированием, предварительно осаждая твердую фазу в течение 15 мин при 4000 об./мин на центрифуге CR4000 (Centurion Scientific, UK). Осадки сушили до постоянной массы в условиях вакуума при температуре 80°С.
Концентрацию иридия в растворе определяли методом масс-спектрометрии с индуктивно связанной плазмой с помощью ICP-MS Agilent 7900 (Agilent, США).
Рентгенограммы регистрировали в диапазоне углов 2θ от 5° до 90° с шагом 0.02° на дифрактометре X’Pert Pro (Panalytical, Нидерланды) c использованием медного излучения (λ = 0.15418 нм).
Морфологические особенности частиц исследовали методами сканирующей электронной микроскопии (СЭМ) на приборах S5500 (Hitachi, Япония) и ТМ4000 (Hitachi, Япония) с системой микроанализа Quantаx 150 (Bruker, Германия) и просвечивающей электронной микроскопии (ПЭМ) на приборе HT7700 (Hitachi, Япония).
Регистрация изотерм адсорбции азота для исследуемых материалов была выполнена с помощью анализатора ASAP-2420 (Micromeritics, США) при 77 К. Расчет удельных поверхностей порошков осуществляли с помощью модели БЭТ. Термогравиметрические (ТГ) кривые и кривые дифференциальной сканирующей калориметрии (ДСК) снимали на приборе синхронного термического анализа NETZSCH STA 449 C/4/G Jupiter с квадрупольным масс-спектрометром QMS 403С Aëolos в проточной атмосфере аргона (30мл/мин) со скоростью нагрева 10 град/мин в платиновых тиглях. Предварительно образцы продували аргоном при 30°С в течение 90 мин.
Рентгеновские фотоэлектронные спектры (РФЭС) были получены на спектрометре SPECS (Германия), укомплектованном полусферическим энергоанализатором PHOIBOS 150 MCD-9 при возбуждении монохроматизированным излучением AlKα анода рентгеновской трубки (1486.7 эВ) при энергии пропускания энергоанализатора 20 эВ для обзорных спектров и 10 эВ для узких сканов. Обработку спектров выполняли с помощью программного пакета CasaXPS.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Стандартный окислительно-восстановительный потенциал полуреакции восстановления иридия(IV) составляет E° = +0.86 В [32]:
(1)
${{[{\text{IrC}}{{{\text{l}}}_{6}}]}^{{2--}}} + 4{{{\text{e}}}^{--}} \to {\text{Ir}} + 6{\text{C}}{{{\text{l}}}^{--}}.$Поэтому восстановление иридия до металлического состояния термодиномически возможно как гидразин-гидратом (E° = –1.16 В), так и тетрагидридоборатом натрия (E° = –1.24 В). Водородный показатель среды оказывает влияние на потенциалы полуреакций окисления ${\text{BH}}_{4}^{ - }$ и N2H4, поэтому в кислых и щелочных средах возможно различное протекание реакций. В случае тетрагидридобората натрия схематично процесс может быть записан следующим уравнением:
(2)
$\begin{gathered} {{{\text{K}}}_{{\text{2}}}}{\text{IrC}}{{{\text{l}}}_{{\text{6}}}} + {\text{NaB}}{{{\text{H}}}_{4}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{Ir}} + {{{\text{H}}}_{{\text{3}}}}{\text{B}}{{{\text{O}}}_{3}} + \\ + \,\,3{\text{HCl}} + 2{\text{KCl}} + {\text{NaCl}} + 2{{{\text{H}}}_{2}}. \\ \end{gathered} $Несмотря на термодинамическую возможность протекания процессов восстановления, синтезировать иридиевую чернь из солянокислых и нейтральных растворов гексахлороиридата(IV) калия в открытой системе при нагревании на водяной бане не удалось. Даже при введении восстановителя в 100-кратном избытке от стехиометрии и продолжительности синтеза более 4 ч выход осадка по Ir не превышал 5%. Смещение рН исходных растворов в щелочную область приводит к образованию твердой фазы, в которой помимо металлического иридия(0) присутствуют аморфные гидрооксиды иридия. Таким образом, проведение экспериментов в открытых системах приводит к высоким расходам реагентов и трудно воспроизводимым результатам. Поэтому дальнейшие эксперименты проводили в автоклавах с использованием восстановителя с 20%-ным избытком от уравнения (2). Некоторый избыток восстановителя от стехиометрии необходим ввиду протекания побочных процессов, например, окисления восстановителя кислородом, который содержится в растворе и газовой фазе автоклава:
(3)
$2{\text{NaB}}{{{\text{H}}}_{4}} + 4{{{\text{O}}}_{2}} = 2{\text{NaOH}} + {{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Установлено, что использование в качестве восстановителя гидразин-гидрата для восстановления свежеприготовленных растворов K2IrCl6 в 0.001–1 М HCl или H2O не приводит к образованию черни вплоть до температуры 180°С. Раствор меняет цвет до темно-вишневого, что, вероятно, связано с образованием нестабильных аминокомплексов иридия(III). Восстановление при температуре 150°С растворов гексахлороиридата(IV) калия, приготовленных в 0.1–1 М KOH, приводит к образованию осадка черного цвета, однако выход не превышает 40%. Электронно-микроскопические исследования с рентгеноспектральным анализом данного образца показали присутствие значительных количеств кислорода, что может говорить о наличии окисленных фаз. Поэтому в дальнейших экспериментах использовали тетрагидридоборат натрия.
Восстановление растворов гексахлороиридата(IV) калия тетрагидридоборатом натрия в автоклаве протекает существенно быстрее, чем в открытой системе. В табл. 1 приведены условия синтеза образцов. Время восстановления составляет от нескольких минут до получаса, а выход металла (α), рассчитанный на основании результатов масс-спектрометрического анализа растворов, практически во всех опытах составил более 99%.
Таблица 1.
Условия синтеза наночастиц иридия тетрагидридоборатом натрия
| Образец | Условия синтеза | α, % | ||
|---|---|---|---|---|
| среда | t, °С | τ, мин | ||
| Ir-1 | 1.0 М HCl | 130 | 30 | >99 |
| Ir-2 | 150 | |||
| Ir-3 | 0.1 М HCl | 130 | ||
| Ir-4 | 0.01 М HCl | 130 | ||
| Ir-5 | 150 | |||
| Ir-6 | 180 | |||
| Ir-7 | H2O | 150 | 10 | |
| Ir-8 | 0.5 М NH4OH | 150 | 30 | 16 |
| Ir-9 | 150 | 60 | 78 | |
| Ir-10 | 1.0 М NaOH | 150 | 2 | >99 |
Исследования структурных характеристик комплексом физико-химических методов показали существенные отличия в размерах частиц и структуре синтезированных материалов (табл. 2) в зависимости от условий получения. Методом электронной микроскопии (ЭМ) (рис. 1) установлено, что частицы иридия имеют сферическую форму и агрегированы в крупные глобулы в виде цепочек. Размеры частиц Dч, полученных в кислых и нейтральных средах, составили от 40 до 300 нм. В щелочных средах образуются частицы иридия диаметром 8–15 нм (табл. 2, рис. 1в, 1г).
Таблица 2.
Структурные характеристики наночастиц иридия(0)
| Образец | Структурные характеристики | |||
|---|---|---|---|---|
| ГА | РФА | ЭМ | ||
| Sуд, м2/г | Dрасч,нм | DОКР, нм | Dч, нм | |
| Ir-1 | 1.2 | 220 | 9.2 | 250–400 |
| Ir-2 | 1.9 | 140 | – | 150–200 |
| Ir-3 | 3.7 | 71 | – | – |
| Ir-4 | 4.9 | 54 | 5.5 | 70–200 |
| Ir-5 | 7 | 38 | 5.0 | 50–80 |
| Ir-6 | 9.4 | 28 | – | 40–50 |
| Ir-7 | 6.3 | 42 | 6.2 | 50–70 |
| Ir-9 | 25.3 | 10 | 3.0 | 8 |
| Ir-10 | 23.4 | 11 | 3.5 | 15 |
Рис. 1.
Электронные микрофотографии синтезированных образцов иридия (табл. 1): а – СЭМ-изображение Ir-4, б – СЭМ-изображение Ir-5, в – ПЭМ-изображение Ir-9, г – СЭМ-изображение Ir-10.

В литературе отмечено [33], что использование тетрагидридобората натрия может приводить к загрязнению синтезированных наноматериалов соединениями бора. В полученных образцах рентгеноспектральным микроанализом бор не обнаружен, вероятно, ввиду качественной промывки образцов и использования близких к стехиометрии количеств восстановителя.
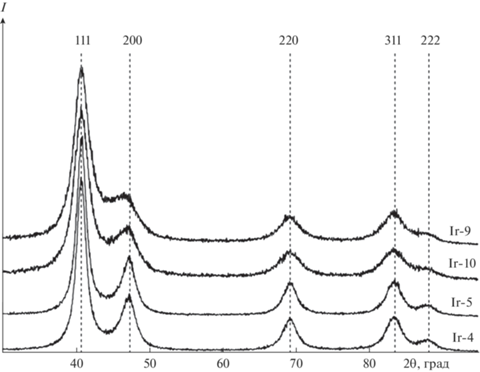
Рентгенофазовый анализ (РФА) порошков показал присутствие пиков, соответствующих фазе металлического иридия (рис. 2) с параметром решетки 3.838 Å. Рефлексы, характерные для оксидов иридия, например IrO2, которые частично перекрываются с линиями Ir(0) [34], не обнаружены. На дифрактограммах фиксируется уширение пиков, одной из причин которого может быть дисперсность материала. Полнопрофильным анализом были рассчитаны размеры областей когерентного рассеяния (ОКР), значения которых приведены в табл. 2. Размеры ОКР оказались значительно меньше диаметров частиц, оцененных из ЭМ-данных. Данный факт говорит о том, что частицы иридия состоят из нескольких ОКР, т.е. для иридия характерно формирование полиблочной структуры. Образование полиблочной структуры подтверждают и результаты низкотемпературной газовой адсорбции (ГА) азота (табл. 2). Удельные поверхности порошков лежат в диапазоне до 25 м2/г. На основании данных об удельных поверхностях, с учетом допущения, что все частицы имеют сферическую форму и монодисперсное распределение по размерам, были рассчитаны средние диаметры частиц (Dрасч, табл. 2), которые удовлетворительно согласуются с данными ЭМ. При переходе от кислой среды синтеза к щелочной наблюдается тенденция к уменьшению размеров металлических частиц, что, скорее всего, связано с образованием в растворах различных форм хлорокомплексов иридия(IV). С другой стороны, можно говорить об уменьшении размеров частиц с ростом температуры синтеза, что отчетливо проявляется в ряду образцов Ir-4–Ir-6 (табл. 1, 2).
Рис. 2.
Фрагменты дифрактограмм продуктов восстановления гексахлороиридата(IV) калия (табл. 1) тетрагидридоборатом натрия.
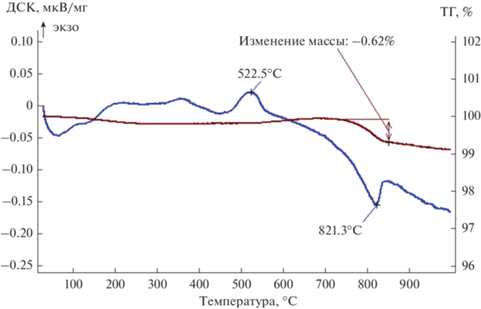
Известно [31, 35, 36], что на поверхности платиновых металлов в дисперсном состоянии возможно присутствие кислорода, который может находиться в хемосорбированном состоянии или в виде оксидных пленок. Количество кислорода коррелирует с удельной поверхностью материалов. На рис. 3 представлены результаты исследований нанопорошка иридия с наибольшей удельной поверхностью (25.3 м2/г, образец Ir-9) методами ДСК и ТГ. На ДСК–ТГ-кривых образца обнаружена незначительная (менее 0.2%) убыль массы при температурах до 200°С, которая связана с удалением воды. В области 520°С обнаружено наличие незначительного экзотермического эффекта, который не сопровождается изменением массы и, по всей видимости, соответствует процессам агрегации наночастиц иридия [36], т.е. переходу в более стабильное состояние. Эндотермический пик при 820°С сопровождается убылью массы 0.6% и, вероятно, обусловлен процессами диссоциации поверхностных оксидов иридия:
(5)
${\text{2I}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{3(поверх)}}}}} = 2{\text{Ir}} + 3{{{\text{O}}}_{2}}.$Данный факт говорит о том, что наночастицы иридия могут быть покрыты несколькими атомными слоями оксидных соединений. Расчет показывает, что данная убыль массы соответствует доле оксидов иридия в материале и составляет менее 5 мас. %. В подтверждение протекания процессов диссоциации говорит и факт удаления кислорода, зафиксированный газоанализатором. Ввиду перекрывания на рентгенограммах рефлексов кристаллических оксидных соединений иридия с основными пиками иридия(0) такие количества оксидных фаз сложно достоверно идентифицировать рентгенографически. К тому же часть оксидов может быть в аморфном состоянии. Для образцов с менее развитыми поверхностями эффекты диссоциации практически не проявляются.
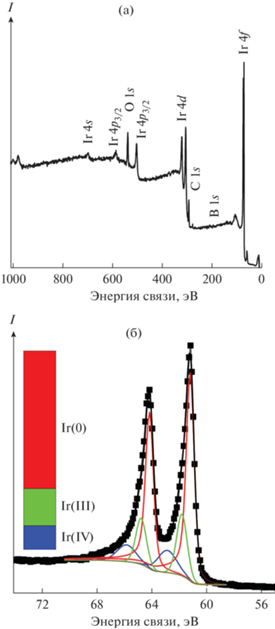
С целью подтверждения присутствия на поверхности иридия (образец Ir-9) оксидных соединений был проведен анализ методом РФЭС. В обзорном спектре (рис. 4а) образца Ir-9 наблюдается набор линий иридия, а также линии кислорода и 1s-углерода. Максимумы бора B 1s в области энергий 185–188 эВ отсутствовали (были ниже предела обнаружения), что подтверждает ранее установленные рентгеноспектральным микроанализом данные об отсутствии загрязнений образцов соединениями бора. Разложение спектров высокого разрешения иридия (дублета 4f7/2, 5/2) (рис. 4б) показывает наличие компонент с энергиями связи Ir 4f7/2 61.0, 61.9 и 62.9 эВ, которые следует отнести к металлическому иридию и соединениям Ir(III) и Ir(IV) соответственно [37–40]. Суммарная доля окисленных форм иридия в поверхностном слое составляет около 25 ат. %. Данное количество окисленных форм в случае материала с размерами частиц 8 нм коррелирует с количеством поверхностных атомов. Некоторое окисление поверхности может быть обусловлено высокой реакционной способностью наночастиц. Таким образом, данные РФЭС подтверждает выводы о наличии нескольких атомных слоев оксидов иридия на поверхности образца.
Рис. 4.
РФЭС (образец Ir-9, табл. 1): а – обзорный, б – узкий скан Ir 4f и разложение на линии Ir(0), Ir(III) и Ir(IV); на диаграмме – рассчитанное соотношение форм иридия.
ЗАКЛЮЧЕНИЕ
Показано, что использование гидразин-гидрата в качестве восстановителя водных растворов гексахлороиридата(IV) калия не приводит к удовлетворительным результатам. При использовании тетрагидридобората натрия восстановление при температурах 130–180°С в нейтральных, кислых и щелочных средах происходит в течение 2–30 мин. Образующиеся осадки, согласно данным РФА, представлены фазой металлического иридия(0) с размерами кристаллитов в диапазоне 3–10 нм в зависимости от условий получения.
Методом низкотемпературной газовой адсорбции азота определены удельные поверхности синтезированных материалов, которые составили до 25 м2/г. Средние размеры наночастиц иридия, согласно данным ЭМ, превышают размеры кристаллитов и находятся в диапазоне 8–300 нм. Данный факт говорит об образовании наночастиц иридия в полиблочном состоянии.
Методом ДСК и ТГ установлено, что в осадке с наименьшими размерами частиц (максимальная удельная поверхность) возможно наличие незначительных количеств оксидных фаз (до 5 мас. %), что обусловлено высокой реакционной способностью наночастиц. С помощью РФЭС установлено строение таких частиц: ядро иридия(0) покрыто несколькими атомными слоями оксидов IrO2 и Ir2O3.
Установленные зависимости открывают возможности гидротермального синтеза иридийсодержащих функциональных материалов без использования стабилизирующих реагентов.
Список литературы
Chen A., Ostrom C. Palladium-Based Nanomaterials: Synthesis and Electrochemical Applications // Chem. Rev. 2015. V. 115. P. 11999–12044. https://doi.org/10.1021/acs.chemrev.5b00324
Axet M.R., Philippot K. Catalysis with Colloidal Ruthenium Nanoparticles // Chem. Rev. 2020. V. 120. P. 1085–1145. https://doi.org/10.1021/acs.chemrev.9b00434
Xu H., Shang H., Wang C., Du Y. Low-Dimensional Metallic Nanomaterials for Advanced Electrocatalysis//Adv. Funct. Mater. 2020. V. 30. № 50. P. 2006317. https://doi.org/10.1002/adfm.202006317
Maduraiveeran G., Sasidharan M., Ganesan V. Electrochemical Sensor and Biosensor Platforms Based on Advanced Nanomaterials for Biological and Biomedical Applications // Biosens. Bioelectron. 2018. V. 103–129. P. 113. https://doi.org/10.1016/j.bios.2017.12.031
He L., Weniger F., Neumann H., Beller M. Synthesis, Characterization, and Application of Metal Nanoparticles Supported on Nitrogen-Doped Carbon: Catalysis beyond Electrochemistry // Angew. Chem. Int. Ed. 2016. V. 55. № 41. P. 12582–12594. https://doi.org/10.1002/anie.201603198
Alekseev E.S., Alentiev A.Y., Belova A.S. et al. Supercritical Fluids in Chemistry // Russ. Chem. Rev. 2020. V. 89. P. 1337–1427. https://doi.org/10.1070/RCR4932
Jovanovič P., Hodnik N., Ruiz-Zepeda F., Arčon I., Jozinovič B., Zorko M., Bele M., Šala M., Šelih V.S., Hočevar C., Gaberšček M. Electrochemical Dissolution of Iridium and Iridium Oxide Particles in Acidic Media: Transmission Electron Microscopy, Electrochemical Flow Cell Coupled to Inductively Coupled Plasma Mass Spectrometry, and X-ray Absorption Spectroscopy Study // J. Am. Chem. Soc. 2017. V. 139. № 36. P. 12837–12846. https://doi.org/10.1021/jacs.7b08071
Lv F., Feng J., Wang K., Dou Z., Zhang W., Zhou J., Yang C., Luo M., Yang Y., Li Y., Gao P., Guo S. Iridium–Tungsten Alloy Nanodendrites as pH-Universal Water-Splitting Electrocatalysts // ACS Central Sci. 2018. V. 4. № 9. P. 1244–1252. https://doi.org/10.1021/acscentsci.8b00426
Over H. Fundamental Studies of Planar Single-Crystalline Oxide Model Electrodes (RuO2, IrO2) for Acidic Water Splitting // ACS Catal. 2021. V. 11. № 14. P. 8848–8871. https://doi.org/10.1021/acscatal.1c01973
Wang F., Kusada K., Wu D., Yamamoto T., Toriyama T., Matsumura S., Kitagawa H. Solid-Solution Alloy Nanoparticles of the Immiscible Iridium–Copper System with a Wide Composition Range for Enhanced Electrocatalytic Applications // Angew. Chem. Int. Ed. 2018. V. 57. P. 4505–4509. https://doi.org/10.1002/anie.201800650
Liu D., Chen X., Xu G., Guan J., Cao Q., Dong B., Mu X. Iridium Nanoparticles Supported on Hierarchical Porous N-Doped Carbon: an Efficient Water-Tolerant Catalyst for Bio-Alcohol Condensation in Water // Sci. Rep. 2016. V. 6. P. 21365. https://doi.org/10.1038/srep21365
Hara M., Badam R., Wang G.J., Huang H.-H., Yoshimura M. Synthesis and Evaluation of Iridium Oxide Nanoparticle Catalysts Supported on Nitrogen-Doped Reduced Graphene Oxides // ECS Trans. 2018. V. 85. № 11. P. 27–35. https://doi.org/10.1149/08511.0027ecst
Rueping M., Koenigs R.M., Borrmann R., Zoller J., Weirich T.E., Mayer J. Size-Selective, Stabilizer-Free, Hydrogenolytic Synthesis of Iridium Nanoparticles Supported on Carbon Nanotubes // Chem. Mater. 2011. V. 23. № 8. P. 2008–2010. https://doi.org/10.1021/cm1032578
Belousov O.V., Tarabanko V.E., Borisov R.V., Simakova I.L., Zhyzhaev A.M., Tarabanko N., Isakova V., Parfenov V., Ponomarenko I.V. Synthesis and Catalytic Hydrogenation Activity of Pd and Bimetallic Au–Pd Nanoparticles Supported on High-Porosity Carbon Materials // React. Kinet. Mech. Cat. 2019. V. 127. № 1. P. 25–39. https://doi.org/10.1007/s11144-018-1430-0
Rodrigues T.S., da Silva A.G., Camargo P.H. Nanocatalysis by Noble Metal Nanoparticles: Controlled Synthesis for the Optimization and Understanding of Activities // J. Mater. Chem. A. 2019. V. 7. P. 5857–5874. https://doi.org/10.1039/C9TA00074G
Zahmakiran M. Iridium Nanoparticles Stabilized by Metal Organic Frameworks (IrNPs@ZIF-8): Synthesis, Structural Properties and Catalytic Performance // Dalton Trans. 2012. V. 41. P. 12690–12696. https://doi.org/10.1039/C2DT31779F
Cui M., Zhou J., Zhao Y., Song Q. Facile Synthesis of Iridium Nanoparticles with Superior Peroxidase-Like Activity for Colorimetric Determination of H2O2 and Xanthine // Sens. Actuators, B. 2017. V. 43. P. 203–210. https://doi.org/10.1016/j.snb.2016.11.145
Brown A.L., Winter H., Goforth A.M., Sahay G., Sun C. Facile Synthesis of Ligand-Free Iridium Nanoparticles and Their In Vitro Biocompatibility // Nanoscale Res. Lett. 2018. V. 13. № 208. P. 1. https://doi.org/10.1186/s11671-018-2621-3
Kundu S., Liang H. Shape-Selective Formation and Characterization of Catalytically Active Iridium Nano-particles // J. Colloid. Interface. Sci. 2011. V. 354. P. 597–606. https://doi.org/10.1016/j.jcis.2010.11.032
Hu H., Xin J.H., Wang X., Miaoa D., Liua Y. Synthesis and Stabilization of Metal Nanocatalysts for Reduction Reactions – a Review // J. Mater. Chem. A. 2015. V. 3. № 21. P. 11157–11182. https://doi.org/10.1039/C5TA00753D
Goel A., Rani N. Effect of PVP, PVA and POLE Surfactants on the Size of Iridium Nanoparticles // Open J. Inorg. Chem. 2012. V. 2. № 3. P. 67–73. https://doi.org/10.4236/ojic.2012.23010
Bonet F., Delmas V., Grugeon S., Urbina R.H., Silvert P.-Y., Tekaia–Elhsissen K. Synthesis of Monodisperse Au, Pt, Pd, Ru and Ir Nanoparticles in Ethylene Glycol // Nanostruct. Mater. 1999. V. 11. P. 1277–1284. https://doi.org/10.1016/S0965-9773(99)00419-5
Zhang R., Liu X., Shi L., Jin X., Dong Y., Li K., Zhao X., Li Q., Deng Y. A Simple and Fast Method to Synthesize Cubic Iridium Nanoparticles with Clean Surface Free from Surfactants // Nanomaterials. 2019. V. 9. № 1. P. 76. https://doi.org/10.3390/nano9010076
Решетникова Е.А., Лисневская И.В., Терехин А.И. Синтез сегнетоэлектрика титаната натрия-висмута в гидротермальных условиях // Неорган. материалы. 2020. Т. 56. № 1. С. 87–95. https://doi.org/10.31857/S0002337X20010133
Фесик Е.В., Буслаева Т.М., Мельникова Т.И., Тарасова Л.С., Лаптенкова А.В. Особенности термолиза смеси [Pd(NH3)4]Cl2–(NH4)2Cr2O7 в инертной атмосфере // Журн. физ. химии. 2019. Т. 93. № 6. С. 803–809. https://doi.org/10.1134/S0044453719060098
Зимбовский Д.С., Чурагулов Б.Р., Баранов А.Н. Гидротермальный синтез пленок Cu2O на поверхности металлической меди в растворе NaOH // Неорган. материалы. 2019. Т. 55. № 6. С. 623–627. https://doi.org/10.1134/S0002337X19060174
Борисов Р.В., Белоусов О.В., Жижаев А.М., Белоусова Н.В., Кирик С.Д. Биметаллические дисперсные системы палладий–золото на углеродном носителе в водных растворах при 110°С // Журн. неорган. химии. 2018. Т. 63. № 3. С. 289–295. https://doi.org/10.7868/S0044457X18030030
Asanova T.I., Asanov I.P., Maksimovsky E.A., Vasilchen-ko D.B., Korenev S.V. Studying the Process of (NH4)2[IrCl6] Thermal Decomposition by X-Ray Photoelectron Spectroscopy and Electron Microscopy // J. Struct. Chem. 2020. V. 61. № 3. P. 388–399. https://doi.org/10.1134/S0022476620030063
Плюснин П.Е., Байдина И.А., Шубин Ю.В., Коренев С.В. Синтез, кристаллическая структура и термические свойства [Pd(NH3)4][AuCl4]2 // Журн. неорган. химии. 2007. Т. 52. № 3. С. 421–427.
Borisov R.V., Belousov O.V., Dorokhovaa L.I., Zhizhaev A.M. Features of Fine Iridium Powders Dissolution in Acidic Media // J. Sib. Fed. Univ. Chem. 2017. V. 10. № 3. P. 325–332. https://doi.org/10.17516/1998-2836-0029
Борисов Р.В., Белоусов О.В., Жижаев А.М., Лихацкий М.Н., Белоусова Н.В. Синтез биметаллических наночастиц Pd–Au и Pt–Au на углеродных нанотрубках в автоклаве // Изв. АН. Сер. хим. 2021. Т. 70. № 8. С. 1474–1482.
Goldberg R.N., Hepler L.G. Thermochemistry and Oxidation Potentials of the Platinum Group Metals and Their Compounds // Chem. Rev. 1968. V. 68. № 2. P. 229–252.
Zakharov Y.A., Pugachev V.M., Bogomyakov A.S., Ovcharenko V.I., Korchuganova K.A., Russakov D.M., Kolmykov R.P. Influence of NicoreAushell Nanoparticles’ Morphology on Their Magnetic Properties // J. Phys. Chem. C. 2019. V. 124. № 1. P. 1008–1019. https://doi.org/10.1021/acs.jpcc.9b07897
Kim H.W., Shim S.H., Myung J.H., Lee C. Annealing Effects on the Structural Properties of IrO2 Thin Films // Vacuum. 2008. V. 82. № 12. P. 1400–1403. https://doi.org/10.1016/j.vacuum.2008.03.004
Buyanova N.E., Karnaukhov A.P. Adsorbtsiya i poristost´[Adsorption and Porosity] / Ed. by Dubinin M.M. M.: Nauka, 1976. 131 p.
Борисов Р.В., Белоусов О.В., Иртюго Л.А. Термостимулированные превращения высокодисперсных порошков металлов платиновой группы в атмосфере аргона // Журн. физ. химии. 2014. Т. 88. № 10. С. 1544–1550. https://doi.org/10.7868/S0044453714100082
Fonseca G.S., Machado G., Teixeira S.R., Fecher G.H., Morais J., Alves M.C., Dupon J. Synthesis and Characterization of Catalytic Iridium Nanoparticles in Imidazolium Ionic Liquids // J. Colloid. Interface Sci. 2006. V. 301. № 1. P. 193–204. https://doi.org/10.1016/j.jcis.2006.04.073
Freakley S.J., Ruiz-Esquius J., Morgan D.J. The X-ray Photoelectron Spectra of Ir, IrO2 and IrCl3 Revisited // Surf. Interface Anal. 2017. V. 49. № 8. P. 794–799. https://doi.org/10.1002/sia.6225
Claudel F., Dubau L., Berthomé G., Sola-Hernandez L., Beauger C., Piccolo L., Maillard F. Degradation Mechanisms of Oxygen Evolution Reaction Electrocatalysts: A Combined Identical-Location Transmission Electron Microscopy and X-ray Photoelectron Spectroscopy Study // ACS Catal. 2019. V. 9. № 5. P. 4688–4698. https://doi.org/10.1021/acscatal.9b00280
Лозанов В.В., Ильин И.Ю., Морозова Н.Б., Трубин С.В., Бакланова Н.И. Химическое осаждение из газовой фазы иридия на карбиды гафния и тантала // Журн. неорган. химии. 2020. Т. 65. № 11. С. 1570–1578. https://doi.org/10.31857/S0044457X20110100
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы