Неорганические материалы, 2022, T. 58, № 4, стр. 351-366
Направления развития низкотемпературных натрий-серных аккумуляторов
С. А. Новикова 1, Д. Ю. Воропаева 1, А. Б. Ярославцев 1, *
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
* E-mail: yaroslav@igic.ras.ru
Поступила в редакцию 02.11.2021
После доработки 07.12.2021
Принята к публикации 08.12.2021
- EDN: UHIEIU
- DOI: 10.31857/S0002337X22040121
Аннотация
Рассмотрены опубликованные в последнее десятилетие исследования в области создания аккумуляторов на основе систем натрий–сера, работоспособных при температуре окружающей среды (низкотемпературные натрий-серные аккумуляторы (НСА)). Такие аккумуляторы отличаются от распространенных в настоящее время литий-ионных или литий-серных аналогов меньшей стоимостью и доступностью исходных материалов. Одной из главных проблем на пути создания низкотемпературных НСА с высокой удельной энергоемкостью и длительным циклированием является перенос продуктов токообразующей реакции (полисульфидов натрия) на противоположный электрод, приводящий к значительному саморазряду аккумулятора и потере активных материалов в результате окислительно-восстановительных реакций, не сопровождающихся генерацией энергии. Данный обзор направлен на рассмотрение подходов к улучшению электрохимических характеристик низкотемпературных НСА. Особое внимание уделено перспективам использования катионообменных материалов, способных к подавлению переноса полисульфид-анионов при сохранении высокой скорости переноса катионов натрия.
ВВЕДЕНИЕ
Разработка накопителей электрической энергии, в т. ч. вырабатываемых установками, использующими источники возобновляемой энергии, является крайне актуальной задачей. В последние два десятилетия литий-ионные аккумуляторы стали основными источниками энергии для портативной электроники и систем стационарного накопления энергии. Однако из-за высокой стоимости и негативного прогноза по запасам литийсодержащих соединений их использование в системах крупномасштабного стационарного хранения энергии представляется сомнительным [1]. В связи с этим в последнее время большое внимание уделяется разработке материалов для натрий-серных аккумуляторов (НСА), способных работать при комнатной температуре [2–9]. Интерес к таким системам обусловлен потребностью создания относительно дешевых, высокоемких накопителей энергии, характеризующихся безопасностью и стабильностью [10, 11]. Натрий является одним из наиболее распространенных элементов в земной коре. Это позволяет рассматривать натрий-ионные аккумуляторы и аккумуляторы с натриевым анодом в качестве перспективных для крупномасштабного хранения энергии [1, 12]. НСА являются особо привлекательными из-за ряда преимуществ (табл. 1), включая высокую плотность энергии и распространенность натрия и серы.
Таблица 1.
| Распространенность в земной коре Na | 2.3 мас. % |
| Распространенность в земной коре S | 0.042 мас. % |
| Теоретическая удельная емкость Na | 1165 мАч/г |
| Теоретическая удельная емкость S | 1672 мАч/г |
| Теоретическая удельная энергия Na–S-аккумулятора (при конверсии до Na2S3) | 760 Вт ч/кг |
| Теоретическая удельная энергия Na–S-аккумулятора (при конверсии до Na2S) | 1274 Вт ч/кг |
Однако существует несколько проблем, ограничивающих применение Na–S-аккумуляторов. Среди них следует отметить:
– низкую электропроводность серы;
– значительное изменение объема катода (около 160%) в процессе разряда/заряда из-за разной плотности серы и сульфида натрия;
– плохую кинетику превращения короткоцепочечных полисульфидов натрия или Na2S в полисульфиды с длинной цепью;
– миграцию растворимых полисульфидов натрия между электродами, которая приводит к саморазряду аккумулятора и потере активных материалов в результате окислительно-восстановительных реакций, не сопровождающихся генерацией энергии;
– образование дендритов натрия [2, 4, 5, 7, 13].
Среди вышеперечисленных проблем устранение миграции продуктов катодных процессов в сторону анода является наиболее важной, поскольку это напрямую влияет на общую плотность энергии и срок службы НСА. Процесс диффузии полисульфидов можно разделить на четыре этапа: 1) образование длинноцепочечных полисульфидов, 2) отделение полисульфидов от основного материала, 3) диффузия полисульфидов в жидкий электролит и их миграция к аноду и 4) взаимодействие полисульфидов с натриевым анодом [13].
Для создания низкотемпературных НСА с высокой удельной энергоемкостью и длительным циклированием проводятся работы по модификации катода, анода и электролита.
В данном обзоре рассмотрены основные подходы, позволяющие снизить диффузию полисульфидов натрия в процессе работы НСА, способы нанесения защитных слоев на аноды. Особое внимание уделено использованию катионообменных мембран с высокой скоростью переноса катионов натрия и низкой диффузионной проницаемостью полисульфидов через них.
ПРИНЦИП РАБОТЫ НИЗКОТЕМПЕРАТУРНОГО НСА
Как правило, ячейка НСА состоит из анода из металлического натрия, электролита с проводимостью по катионам натрия и композиционного серного катода [15]. Обычно НСА собирается в заряженном состоянии. Во время цикла разряда металлический натрий окисляется и генерирует электроны, уходящие во внешнюю цепь, и катионы натрия, которые перемещаются к серному катоду через электролит в ячейке. На стороне серного катода происходят интеркаляция катионов натрия и электронов и восстановление серы до полисульфидов (Na2Sn) или сульфида натрия (Na2S) [4, 16]. Во время заряда обратимая реакция конверсии начинается с окисления сульфидов натрия и переходит к образованию его полисульфидов. В результате общие обратимые окислительно-восстановительные реакции можно описать следующим образом [16]:
(1)
${\text{суммарный процесс }}--{\text{ S}} + 2{\text{Na}} \leftrightarrow {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}},$(2)
${\text{анод}}--{\text{ }}2{\text{Na}} \leftrightarrow 2{\text{N}}{{{\text{a}}}^{ + }} + 2{{{\text{e}}}^{--}},$Историческими предшественниками низкотемпературных НСА являются НСА, работающие при высоких температурах (300–350°С) с расплавленными электродами и твердым электролитом из β-глинозема [3, 5, 7]. Разработки таких аккумуляторов интенсивно проводились в 60–70-х годах ХХ века, и к настоящему времени в ряде стран налажено их коммерческое производство. Теоретическая удельная энергия высокотемпературных НСА составляет 760 Вт ч/кг. Конечным продуктом разряда является Na2S3, что не позволяет достигать полной конверсии до Na2S из-за перехода продуктов разряда в твердое состояние (tпл(Na2S3) = 235°С, tпл(Na2S2) = 475°С) [7] в интервале рабочих температур высокотемпературного НСА. При этом достигнутые на практике показатели удельной энергии не превышают 200–300 Вт ч/кг [3, 6]. Однако главным недостатком является высокая рабочая температура, связанная с температурой плавления образующихся полисульфидов и недостаточно высокой проводимостью β-глинозема при более низких температурах [3, 6]. Высокая рабочая температура делает НСА небезопасными, дорогими в эксплуатации; кроме того, часть генерируемой электроэнергии используется для нагрева самого аккумулятора, что приводит к снижению эффективности.
Создание и исследование лабораторных макетов НСА, способных работать при комнатной температуре, имеет сравнительно короткую историю, но весьма активно развивается в последние годы. Начиная с первого десятилетия XXI века пристальное внимание уделяется разработке материалов для НСА, способных работать при комнатной температуре и с повышенной безопасностью [2–5, 7, 17, 18].
Типичные разрядные кривые НСА имеют два плато при потенциалах ~2.2 и ~1.7 В, а также два наклонных положения в диапазонах потенциалов ~2.2–~1.7 и ~1.7–1.0 В [7, 19–22]. На циклических вольтамперограммах имеются два основных пика восстановления при потенциалах ~2.2 и ~1.7 В и небольшой пик примерно при 1.9 В. Три соответствующих пика окисления также появляются в процессе заряда, что указывает на обратимость процесса окисления-восстановления серного электрода [20, 21].
Промежуточные продукты заряда/разряда НСА исследовать весьма затруднительно из-за их чрезвычайной чувствительности к воздуху и отсутствия надежных способов in situ характеризации. Электрохимическое восстановление элементарной серы приводит к образованию цепочечных полисульфидов ${\text{S}}_{n}^{{2 - }}.$ Этот процесс, продукты которого обнаруживают полосы поглощения в УФ-области, был исследован в различных апротонных растворителях [23–26]. В работах [21, 27] показано, что в процессе заряда/разряда НСА образуются полисульфиды состава Na2S8, Na2S6, Na2S5, Na2S4, Na2S3 и Na2S2, которые сосуществуют в зависимости от стадии разряда. В зависимости от содержания серы полисульфиды имеют разную растворимость в апротонных органических растворителях. Например, Na2Sn (4 ≤ n ≤ 8) растворимы в тетраглиме, а Na2Sn (1 ≤ n < 4) формируют твердое покрытие на поверхности электродов [21]. В качестве продуктов разряда часто рассматривают Na2Sn (1 ≤ n ≤ 3) [19, 27, 28]. При этом полисульфиды натрия могут не восстанавливаться полностью до элементарной серы [27, 28]. В работе [21] c помощью рентгеновской фотоэлектронной спектроскопии среди продуктов разряда/заряда в смеси полисульфидов Na2Sn зафиксированы и конечные члены реакции окисления/восстановления серы (Na2S и S). Авторами [29] c помощью in situ рентгенофлуоресцентного анализа показано, что в процессе насыщения серы натрием сначала формируются промежуточные продукты Na2Sn (n = 8, 6 и 5), потом Na2S4 и Na2S, а в процессе циклирования ячейки наблюдаются обратимые реакции окисления/восстановление между Na2S4 и S8. В работах [2, 8] суммированы возможные промежуточные реакции и продукты разряда НСА (табл. 2).
Таблица 2.
| Диапазон потенциалов, В | Реакция |
|---|---|
| ~2.2 | S8 + 2Na+ + 2e–→Na2S8 |
| 2.2–1.65 | Na2S8 + 2Na+ + 2e– → Na2S4 Na2S8 + 2/5 Na+ + 2/3 e– → 4/3 Na2S6 Na2S6 + 2/5 Na+ + 2/5 e– → 6/5 Na2S5 Na2S5 + 1/2 Na+ + 1/2 e– → 5/4 Na2S4 |
| ~1.65 | Na2S4 + 2/3 Na+ + 2/3 e– → 4/3 Na2S3 Na2S4 + 2Na+ + 2e– → 5/4 Na2S2 Na2S4 + 6Na+ + 6e– → 4Na2S |
| 1.65–1.20 | Na2S2 + 2Na+ + 2e– → 2Na2S |
Следует отметить, что в зависимости от используемых материалов катода и электролита и, следовательно, промежуточных и конечных продуктов заряда/разряда и их растворимости в электролите профили экспериментальных зарядно-разрядных кривых и вольтамперограмм могут существенно различаться [30]. Например, в работе [31] для ячейки с композиционным катодом на основе серы и микропористого углерода, электролитом на основе 1.0 M раствора NaClO4 в смеси этиленкарбонат/пропиленкарбонат и натриевым анодом на вольтамперограмме при натрировании наблюдается только один пик при 0.7 В на первом цикле и 1.1 В при последующих, что свидетельствует о прямом образовании Na2S. При деинтеркаляции натрия наблюдается один пик при 1.9 В. Полученные результаты объясняются тем, что в порах углеродной матрицы катодного материала с размером 0.5 нм могут содержаться лишь небольшие молекулы серы (S2–4), что препятствует образованию растворимых полисульфидов.
ЭЛЕКТРОДНЫЕ МАТЕРИАЛЫ
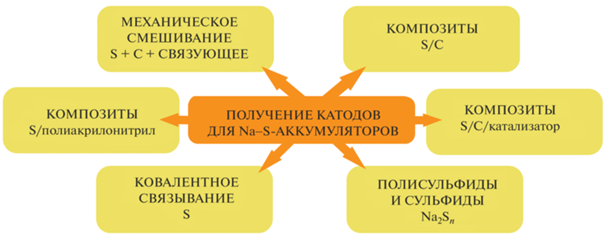
Катодные материалы. Множество работ направлено на оптимизацию состава и микроструктуры катодного материала с целью улучшения его электропроводности, предотвращения проблем, связанных с изменением объема серы при интеркаляции/деинтеркаляции натрия, и уменьшения миграции полисульфидов [6, 8, 32]. Наиболее часто встречающиеся подходы представлены на рис. 1.
Как и в случае литий-ионных аккумуляторов, основным способом улучшения работы катодных материалов является формирование композитов с углеродом, что обеспечивает быстрый подвод электронов и катионов щелочного металла к частицам активного материала и снижает изменение его объема [33]. Согласно литературным данным, катоды, изготовленные путем физического перемешивания порошка серы (содержание серы в таких композитах составляло порядка 50–70 мас. %), проводящей матрицы на основе углерода и связующего материала, характеризовались относительно низкими значениями емкости и ее быстрым падением при циклировании из-за плохого контакта серы с проводящей матрицей, низкой электропроводности микронных частиц серы и растворения полисульфидов [27, 32, 34, 35].
Перспективным подходом является получение композиционных материалов на основе серы и различных форм углерода, особенно мезо- и микропористых углеродных материалов, материалов с иерархической пористой структурой, способных как обеспечивать перенос электронов, так и инкапсулировать серу, тем самым подавляя растворение и миграцию полисульфидов [6, 8, 29, 36, 37]. Получение таких композитов осуществляется, как правило, при длительном выдерживании смеси углеродного материала и серы выше температуры плавления серы (melt-infiltration) [29, 38–42] или осаждением серы на углеродный материал из паровой фазы (isothermal vapor phase infiltration) [37, 43, 44]. В работах [41, 45] предложили использовать для получения композита S/C углеродный материал с коаксиальной структурой: с углеродными нанотрубками в качестве ядра и микропористым углеродом (средний диаметр пор 0.5 нм) в качестве оболочки для размещения серы (содержание серы в композите составило 40 мас. %). Из-за ограниченного пространства микропор в композите Sn присутствует в виде более мелких молекул S2–4 и образования растворимых длинноцепочечных полисульфидов не происходит. При использовании полученного композита S/C в качестве катодного материала в НСА c жидким электролитом на основе органических карбонатов и натриевым анодом ячейка показала обратимую удельную емкость более 1000 мАч/г (в расчете на серу) при скорости С/10 и ~580 мАч/г после 200 циклов при скорости 2 C в диапазоне потенциалов 0.8–2.7 В. Наблюдаемые на гальваностатических кривых наклонные плато разряда выше и ниже 1.4 В были отнесены к процессам формирования Na2S2 и Na2S соответственно [45]. Примером успешного применения этого подхода может служить работа [46], в которой использовали композиционный катод S/C на основе микропористого углерода, полученного из металлоорганического каркаса (содержание серы составило 47 мас. %) по методике [47], и жидкий электролит на основе органических карбонатов, содержащий ионную жидкость, связанную с наночастицами SiO2, и Na-анод. Эта аккумуляторная ячейка показала обратимую емкость 600 мАч/г и почти 100%-ную кулоновскую эффективность при скорости C/2 в течение 100 циклов в диапазоне потенциалов 0.6–2.6 В. Было показано, что сера остается в порах углерода.
В качестве перспективных матриц для иммобилизации полисульфидов в катодном пространстве предложены углеродные материалы с полярными компонентами, например, допированные гетероатомами (N, S) [28, 44, 48, 49].
Добавление к катодам на основе S/C неорганических наночастиц (Co, Cu, Fe, Ni, MnO2, VO2, AlOOH и др.) способствует иммобилизации полисульфидов и может оказывать каталитическое воздействие на реакции превращения между серой, полисульфидами и сульфидом натрия [9, 40, 50–55]. Например, в работе [40] показано, что аккумуляторная ячейка с катодом на основе серы и восстановленного оксида графена с добавлением наночастиц VO2 с электролитом на основе тетраглима и натриевым анодом показала разрядную емкость 400 мАч/г после 200 циклов при скорости С/5 и емкость 156.1 мАч/г после 1000 циклов при 2 C (диапазон потенциалов составил 0.5–2.8 B). В то время как ячейка с аналогичным катодом без VO2 характеризовалась быстрым падением емкости при циклировании. Таким образом, каталитическое действие VO2 ускоряет превращение между длинноцепочечными полисульфидами натрия и Na2S2 (или Na2S).
Эффективным подходом к решению проблемы образования растворимых полисульфидов является ковалентное связывание серы с полимерной или углеродной матрицей [5, 56, 57]. Например, авторами [5] был получен полимерный серный катод с использованием звездообразных сшивающих мономеров тетраакрилата пентаэритрита. Содержание серы в полученном материале составило 97.1 мас. %. Ячейка НСА с таким катодом, гель-полимерным электролитом и натриевым анодом характеризовалась высокой удельной емкостью 877 мАч/г при C/10 и стабильным циклированием (736 мАч/г после 100 циклов).
Одними из популярных катодных материалов являются композиты, полученные термической реакцией в инертной среде между полиакрилонитрилом (ПАН) и элементарной серой, в результате которой происходит циклизация ПАН с последующим его дегидрогенированием серой [58, 59]. Сульфидированный ПАН (СПАН) (Sulfurized polyacrylonitrile, SPAN) содержит нанодомены серы, связанные c проводящей углеродной матрицей [59], и показывает стабильную работу при циклировании в НСА [59–65]. Использование электроспининга для получения нановолокон ПАН позволяет получать катодные материалы различной морфологии, например, с сетчатой [64] или с полой структурой [65].
В ряде работ в качестве активного материала используются химически синтезированные жидкофазные полисульфиды (католиты) для предотвращения большого объемного расширения при превращении S8 в Na2S, которое может приводить к разрушению углеродной матрицы [66–68]. Также ведутся работы с использованием в качестве катода Na2S [69, 70].
Анодные материалы. Проблемы, связанные с металлическим натриевым анодом в НСА, аналогичны проблемам в других натриевых аккумуляторах, основные из которых – это пассивация поверхности анода электролитами и образование дендритов натрия [8, 71, 72]. Эти проблемы снижают производительность аккумуляторов и делают их небезопасными. Разработано множество способов модификации анодов, ряд из которых заимствован из опыта разработки других натриевых аккумуляторов, а некоторые специально разработаны для НСА. Основные направления разработки анодных материалов для НСА включают нанесение защитных покрытий, а также формирование композиционных анодов.
Следует отметить, что во время работы металл-ионных аккумуляторов за счет электрохимического восстановления растворителя электролита на поверхности анодных материалов формируется проводящее покрытие, которое называют SEI (solid electroyte inerphase). Этот кажущийся негативным эффект наблюдается и в натрий-ионных аккумуляторах, но реально он способствует стабилизации анода после нескольких циклов заряда и разряда [39, 73–75]. Ведется поиск новых жидких электролитов, способствующих in situ формированию стабильного и высокопроводящего SEI на электродах [39, 73, 75–78]. Например, показано положительное влияние на электрохимические характеристики аккумулятора формирующихся поверхностных слоев на электродах при использовании электролита на основе этиленкарбоната (ЭК) и пропиленкарбоната (ПК) с добавкой фторэтиленкарбоната (ФЭК) [75], ионных жидкостей [39] и др. Авторами [79] показано, что использование электролита на основе ПК и ФЭК в качестве сорастворителей, соли NaTFSI с высокой концентрацией и трииодида индия в качестве добавки не только уменьшает растворение полисульфидов натрия, но и способствует формированию на натриевом аноде стабильного обогащенного фтором SEI. Это позволило изготовить НСА, характеризующиеся высокими значениями емкости и хорошей циклируемостью (разрядная емкость более 1000 мАч/г при C/10 после 150 циклов).
Разработаны различные методы ex situ покрытия анодов защитными материалами [74, 80–83]. Из-за высокой активности и низкой температуры плавления натрия методы нанесения защитных материалов на поверхность металла ограничены [84]. Среди них можно отметить атомно-слоевое осаждение (atomic layer deposition, ALD) [82, 85] или молекулярное наслаивание (molecular layer deposition, MLD) [83, 85], электрополимеризацию [81], роликовое прессование [86, 87], осаждение из паровой фазы [88]. Методом ALD можно получить наноразмерное покрытие при низких температурах с сохранением морфологии подложки. Например, нанесение оксида алюминия методом ALD позволяет получить покрытие толщиной около 3 нм, которое препятствует прорастанию дендритов натрия [89]. Показано, что нанесение слоя графена толщиной 5 нм обеспечивает стабильное циклирование НСА, содержащего электролит на основе органических карбонатов, в течение 100 циклов при плотности тока 2 мА/см2 [88]. Нанесение покрытия NaF/Na3Sb толщиной 11 мкм на металлический натрий путем обмена с раствором SbF3 формирует прочный SEI, подавляющий рост дендритов и транспорт полисульфидов [90]. Ячейка с полученным анодом, электролитом на основе NaClO4/ЭК–ПК–2% ФЭК и катодом СПАН демонстрирует высокую емкость 1250 мАч/г с сохранением 95% в течение 500 циклов.
В ряде работ предложено использование композиционных анодных материалов [91–94]. Композиционный анод, полученный путем абсорбции расплавленного Na в пространство между листами восстановленного оксида графена, демонстрировал повышенную твердость, прочность, формуемость и устойчивость к коррозии при контакте с полисульфидами натрия. Электрохимическое тестирование в различных электролитах (в растворителях на основе как эфиров, так и органических карбонатов) показало уменьшение дендритообразования по сравнению с металлическим натрием [93]. Интересным подходом, способным облегчить проблему дендритообразования в НСА, является допирование композита Sn/C натрием. Восстановительный потенциал анода Na–Sn/C составляет 0.3 В относительно пары Na+/Na, а электрохимическая емкость – ≈180 мАч/г [91].
ЭЛЕКТРОЛИТЫ
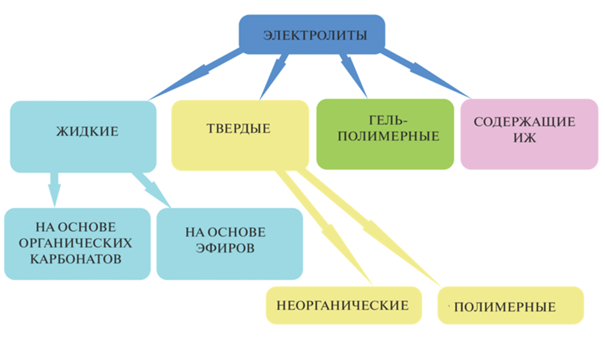
В соответствии с физическим состоянием электролиты для низкотемпературных НСА можно разделить на жидкие, твердые и содержащие обе фазы [95]. Помимо традиционных электролитов с натриевой солью, растворенной в органических растворителях, были исследованы твердые керамические или гель-полимерные электролиты и электролиты на основе ионных жидкостей (ИЖ) (рис. 2) [6–8]. В этом разделе представлено краткое описание этих электролитов и более подробно рассмотрены перспективы использования катионообменных материалов, способных к подавлению переноса полисульфид-анионов при сохранении высокой скорости переноса катионов натрия.
Жидкие электролиты. Традиционные жидкие электролиты в настоящее время наиболее широко используются в НСА. Они представляют собой растворы солей натрия с крупным однозарядным анионом (NaPF6, NaClO4, NaCF3SO3 и др.) в различных апротонных растворителях. Их чаще всего разделяют на электролиты на основе органических карбонатов и на основе эфиров [8, 9]. Использование жидких электролитов подразумевает наличие пористых сепараторов, разделяющих электроды и удерживающих их на определенном расстоянии.
Органические карбонаты, такие как ПК, ЭК, диметилкарбонат, чаще всего используют в НСА в виде смеси из двух или более растворителей [31]. Согласно опыту исследований материалов для Li–S-аккумуляторов, электролиты на основе органических карбонатов необратимо реагируют с полисульфидами [96]. Однако проблемы совместимости между карбонатными растворителями и полисульфидами можно избежать или свести к минимуму с помощью специальных катодов, препятствующих образованию растворимых полисульфидов: на основе низкомолекулярной серы S2–4 [31, 37, 45], ковалентно-связанной серы [5, 57] или композитов S/C с добавлением катализатора [50, 54].
Кроме органических карбонатов, часто используемыми растворителями для электролитов в НСА являются эфиры, особенно диметиловый эфир тетраэтиленгликоля (тетраглим) [66–68, 91, 97]. Интерес к таким электролитам обусловлен их успешным применением в Li–S-аккумуляторах [98, 99]. В работах [96, 100] отмечается, что в отличие от органических карбонатов эфиры и сульфоны не взаимодействуют с полисульфидами. Однако, согласно литературным данным, растворимость полисульфидов натрия в тетраглиме существенно выше по сравнению с органическими карбонатами, что обостряет необходимость предотвращения их миграции [7].
Твердые электролиты. Особое внимание привлекает такой подход, как замена жидкого электролита на твердый, что не только препятствует миграции полисульфидов и образованию дендритов натрия, но делает аккумулятор более безопасным из-за отсутствия жидкой фазы. Кроме того, эти электролиты не предполагают использования сепаратора, что должно привести к увеличению плотности энергии аккумулятора. Твердые электролиты можно условно разделить на два класса: неорганические и полимерные. Твердые неорганические электролиты представляют собой материалы, в которых катион натрия является подвижным, например β"-глинозем, сульфиды состава Na3PS4 [101–104], фосфаты со структурой NASICON состава Na1 +xZr2SixP3 –xO12 (0 ≤ x ≤ 3) и др. [105–107]. Однако для большинства твердых электролитов характерен плохой контакт с электродными материалами. Кроме того, сформировать непористую керамическую пластинку с достаточной прочностью обычно удается лишь при ее значительной толщине, что повышает сопротивление электролита.
В то же время пластичность полимеров позволяет изготовить из них тонкую и прочную пленку, которая обеспечивает существенные преимущества в проводимости и в конструкции аккумулятора [5, 7]. Электролиты типа полимер/соль являются наиболее распространенным классом полимерных электролитов [17, 61, 108–111]. Их ионная проводимость в значительной степени определяется долей аморфной фазы полимера, концентрацией соли, а также связанностью катиона с полимерной матрицей и анионом. Для увеличения ионной проводимости полимерных электролитов, а также для улучшения их механических характеристик применяют ряд подходов, таких как формирование разветвленной структуры, введение объемных боковых заместителей, получение блок-сополимеров, химическая сшивка цепей полимера для получения сетчатой трехмерной структуры, а также введение неорганических частиц [95, 112].
Исследования низкотемпературных НСА с твердыми электролитами сравнительно немногочисленны [92, 102–104, 107]. Например, ячейка с электролитом состава Na3PS4 (ϭ = 1.3 × 10–4 См/см при комнатной температуре) показала значение разрядной емкости на первом цикле ~1500 мАч/г, однако ее емкость впоследствии быстро падала из-за высокого сопротивления границ раздела между активным материалом катода и твердым электролитом [102]. Для решения проблемы контакта твердого электролита с катодом в качестве материала катода предложено использовать нанокомпозит состава Na3PS4/Na2S/C. Аккумуляторная ячейка с катодом Na3PS4/Na2S/C, твердым электролитом Na3PS4 и композиционным анодом Na–Sn/С характеризовалась значением разрядной емкости 869 и 438 мАч/г после 1 и 50 циклов соответственно при 60°C (диапазон потенциалов 0.5–3 В) [92]. Наиболее изученными среди твердых полимерных электролитов являются электролиты на основе полиэтиленоксида, для которых выше температуры плавления кристаллитов (60–80°C) достигаются значения ϭ ≥ 10–4 См/см [17, 61, 113].
Гель-полимерные электролиты. Добавление к твердым полимерным электролитам жидких низкомолекулярных растворителей (пластификаторов) является наиболее эффективным способом увеличения их ионной проводимости и снижения сопротивления на границе электрод/электролит. Такие гель-полимерные электролиты могут обладать повышенной ионной проводимостью при комнатной температуре (σ ≥ 10–4–10–3 См/см) по сравнению с твердыми, высокой химической и электрохимической стабильностью, улучшенными механическими свойствами по сравнению с жидкими электролитами [114–119] и препятствовать миграции полисульфидов натрия между электродами [5, 120]. Несмотря на высокие значения проводимости полученных электролитов, циклируемость НСА на их основе часто оставляет желать лучшего [7, 35, 114, 117, 121–123], что связывают с необратимыми реакциями полисульфидов натрия, образованием пассивирующих слоев на аноде, недостаточно хорошими контактами электрод/электролит. Некоторым авторам удалось частично решить эти проблемы. Например, разрядная емкость НСА с электролитом из нановолокон ПАН, с сорбированным раствором NaCF3SO3 в диметиловом эфире полиэтиленгликоля и катодом из композита S/углеродные нанотрубки составила ≈500 мАч/г в течение 40 циклов (C/20). Авторы объясняют полученные результаты поглощением большого количества жидкого электролита, что не только обеспечивает быстрый перенос ионов натрия, но и способствует смачиванию катода и хорошему контакту электрод/электролит, а большая вязкость диметилового эфира полиэтиленгликоля уменьшает миграцию полисульфидов [120]. Использование сшитого гель-полимерного электролита, полученного in situ полимеризацией пентаэритритолтетраакрилата и трис-[2-(акрилоилокси)этил] изоцианурата в присутствии 1 М раствора Na(CF3SO2)2N в смеси ПК/ФЭК, катода на основе S-пентаэритритолтетраакрилата и анода из металлического натрия позволило получить разрядную емкость 736 мАч/г после 100 циклов при С/10 [5]. Результат объясняется комбинацией использования сшитого электролита и создания хороших контактов на границе электрод/электролит. Однако, несмотря на значительный прогресс в разработке электролитов типа полимер/соль, проблема селективности переноса катиона в них представляется наиболее острой. Подвижность аниона может быть существенно снижена, но не ликвидирована полностью. Это вызывает концентрационную поляризацию на электродах, приводящую к падению напряжения и снижению эффективности работы аккумулятора.
Электролиты на основе ИЖ привлекают большое внимание для применения в различных электрохимических устройствах благодаря таким уникальным свойствам, как нелетучесть, невоспламеняемость, низкая температура плавления, низкая токсичность, малое давление пара, химическая, электрохимическая, термическая и механическая стабильность [124, 125]. Исследований по применению электролитов на основе ИЖ для НСА на данный момент сравнительно мало, хотя они представляются весьма перспективными [46]. Успешным примером является электролит на основе ЭК/ПК, содержащий ИЖ хлорат 1-метил-3-пропилимидазолия, связанную с наночастицами SiO2 [46]. Полученный электролит способствует стабилизации осаждения Na и уменьшает образование дендритов. Другой пример – использование гель-полимерного электролита на основе сополимера поливинилиденфторид-гексафторпропилена и ИЖ трифторметансульфоната 1-этил-3-метилимидазолия [117].
Использование катионообменных мембран. Перспективным классом полимерных электролитов являются материалы на основе катионообменных мембран [95, 126]. В этих материалах анионы ковалентно связаны с полимерной матрицей, вследствие чего такие электролиты обладают лишь катионной проводимостью. Отсутствие подвижности анионов предотвращает дендритообразование при циклировании аккумуляторов с анодом из щелочного металла [126]. Основными сферами применения таких мембран являются водоочистка и топливные элементы [127–130]. При этом функциональные группировки содержат влагу и формируют систему пор и каналов, наполненную водным раствором, содержащим катионы, отщепляющиеся от функциональных групп при их диссоциации. В отсутствие воды проводимость мембран оказывается крайне низкой, но существенно возрастает при их сольватации апротонными растворителями, что делает возможным их применение в качестве электролитов в металл-ионных аккумуляторах [118, 131–140]. Однако с ростом степени сольватации понижается их селективность [141]. В то же время при применении катионообменных мембран в НСА подавление переноса полисульфид-анионов при сохранении высокой скорости переноса катионов натрия является крайне важным.
Среди подходов, позволяющих улучшить селективность катионного переноса ионообменных мембран, не оказывающих существенного влияния на их проводимость или даже повышающих ее, следует в первую очередь отметить интеркаляцию в их структуру наночастиц [127, 142–145]. Введение жидкой фазы приводит к снижению прочности полимеров [146, 147]. Этот недостаток может быть преодолен, например, с использованием таких подходов, как нанесение гелевого электролита на пористую подложку [18, 111, 148] или добавление неорганических частиц с получением композиционных полимерных электролитов.
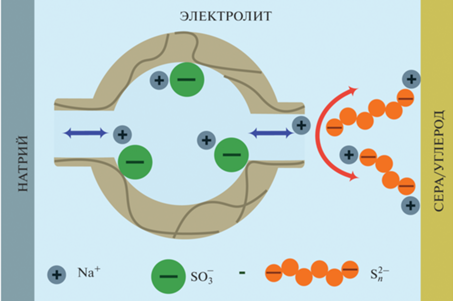
В литературе описаны примеры совместного использования катионообменных мембран в сочетании с жидкими электролитами для обеспечения переноса катионов натрия и предотвращения диффузии полисульфид-анионов к аноду НСА. В мембранах Nafion катионы переносятся в тонком дебаевском слое около стенок пор за счет электростатического притяжения к отрицательно заряженным стенкам (фиксированным $--{\text{SO}}_{3}^{ - }$-группам), а неселективный перенос анионов осуществляется в т. н. электронейтральном растворе, локализованном в центре пор [149]. Поэтому увеличения селективности и, следовательно, подавления переноса полисульфидов можно добиться за счет внедрения в поры мембран неорганических частиц. Схема селективного переноса катионов через сульфокатионитовую мембрану типа Nafion представлена на рис. 3.
Использование катионообменных мембран дает существенные преимущества по сравнению с жидким электролитом с полиолефиновым сепаратором. В работе [150] сравнили работу НСА с композиционным катодом на основе углеродного материала, пропитанного жидким полисульфидным католитом, электролитом на основе тетраглима и натриевым анодом с полипропиленовым сепаратором (Celgard) и с мембраной Nafion, которая была предварительно выдержана в растворах солей натрия в тетраглиме. Проводимость такой мембраны в Na+-форме составила порядка 10–5 См/см. Емкость НСА после первого цикла увеличилась с 500 до 750 мАч/г при замене полипропиленового сепаратора на Nafion. Диффузионные эксперименты показали, что Nafion может эффективно задерживать полисульфиды. Введение при сборке ячейки дополнительного слоя из углеродного нановолокна позволило получить разрядную емкость 550 мАч/г после 100 циклов при скорости C/5. НСА с композиционным катодом Na2S/C и с нанесенным на поверхность мембраны Nafion слоем углерода показали разрядную емкость ~800, ~680 и ~640 мАч/г при С/10, С/5 и С/3 соответственно, а также стабильную работу в течение 100 циклов [97]. В работе обсуждены причины эффективности мембран Nafion для подавления диффузии полисульфидов. Это реализуется за счет пор небольшого размера (<5 нм) и “отталкивания зарядов” отрицательно заряженных сульфо-групп мембраны и полисульфид-анионов.
Недостатком описанных выше перфторированных мембран Nafion является высокая стоимость и недостаточно высокая проводимость в сольватированном апротонным растворителем состоянии. Использование сепараторов с поверхностью, модифицированной катионообменной мембраной, дает существенные преимущества по сравнению с обычными полиолефиновыми сепараторами и удешевляет материал по сравнению с мембраной Nafion. Авторы [151] впервые предложили низкотемпературный НСА с использованием полипропиленового сепаратора с нанесенной на поверхность мембраной Nafion в Na+-форме, смоченной 1 M раствором NaClO4 в тетраглиме. НСА с S/C-катодом и Na-анодом после 20 циклов характеризовался значением разрядной емкости на 75% выше по сравнению с ячейкой с полипропиленовым сепаратором.
Использование сепаратора из стекловолокна с нанесенным слоем сульфокатионитовой перфторированной мембраны Nafion, модифицированной Al2O3, позволило эффективно предотвращать перенос полисульфидов и получить стабильные значения разрядной емкости (~250 мАч/г в течение 100 циклов при скорости C/10) [67]. Следует заметить, что использование сепараторов из стекловолокна или коммерческого электролита из β"-глинозема [22, 34, 152] в промышленно выпускаемых аккумуляторах затруднительно из-за их сравнительно большой толщины [7, 22].
Также была исследована возможность использования в НСА сепаратора со слоем полибензимидазола (ПБИ) [153]. Показано, что полисульфиды связываются с ПБИ, формируя ионселективную границу катод/сепаратор, и препятствуют дальнейшей диффузии полисульфидов. В результате в ячейке со слоем ПБИ (со стороны анода) в течение 50 циклов при С/5 емкость сохранялась на уровне 92.5% от исходной.
ЗАКЛЮЧЕНИЕ
Из приведенного обзора можно заключить, что в настоящее время активно ведется разработка материалов для НСА, способных работать при комнатной температуре. Создание композиционных материалов на основе серы и углерода позволяет улучшить электропроводность катодного материала, предотвратить проблемы, связанные с изменением объема серы при интеркаляции/деинтеркаляции натрия, и уменьшить миграцию полисульфидов. Предложены подходы к созданию катодных материалов, способных эффективно удерживать серу за счет помещения ее в микро- и мезопористые углеродные матрицы или ковалентного связывания. Разрабатываются способы нанесения защитных покрытий на анодные материалы с целью предотвращения нежелательных химических реакций на поверхности и дендритообразования. Исследуется возможность применения твердых неорганических или полимерных электролитов.
Перспективными материалами для низкотемпературных НСА являются катионообменные мембраны в натриевой форме с интеркалированными органическими апротонными растворителями, способные минимизировать перенос полисульфид-анионов при сохранении высокой скорости переноса катионов натрия.
Список литературы
Кулова Т.Л., Скундин А.М. От литий-ионных к натрий-ионным аккумуляторам // Изв. АН. Сер. хим. 2017. № 8. С. 1329–1335. https://doi.org/10.18500/1608-4039-2016-3-122-150
Manthiram A., Yu X.W. Ambient Temperature Sodium-Sulfur Batteries // Small. 2015. V. 11. № 18. P. 2108–2114. https://doi.org/10.1002/smll.201403257
Морачевский А.Г., Попович А.А., Демидов А.И. Натрий-серный аккумулятор: Новые направления развития // Научно-технические ведомости СПбПУ. Естественные и инженерные науки. 2017. Т. 23. № 4. С. 110–117.
Wang Y.-X., Zhang B., Lai W., Xu Y., Chou S.-L., Liu H.-K., Dou S.-X. Room-Temperature Sodium-Sulfur Batteries: A Comprehensive Review on Research Progress and Cell Chemistry // Adv. Energy Mater. 2017. V. 7. № 24. P. 1602829. https://doi.org/10.1002/aenm.201602829
Zhou D., Chen Y., Li B., Fan H., Cheng F., Shanmukaraj D., Rojo T., Armand M., Wang G. A Stable Quasi-Solid-State Sodium-Sulfur Battery // Angew. Chem. Int. Ed. Engl. 2018. V. 57. № 32. P. 10168–10172. https://doi.org/10.1002/anie.201805008
Li T.X., Xu J., Wang C.Y., Wu W.J., Su D.W., Wang G.X. The Latest Advances in the Critical Factors (Positive Electrode, Electrolytes, Separators) for Sodium-Sulfur Battery // J. Alloys Compd. 2019. V. 792. P. 797–817. https://doi.org/10.1016/j.jallcom.2019.03.343
Syali M.S., Kumar D., Mishra K., Kanchan D.K. Recent Advances in Electrolytes for Room-Temperature Sodium-Sulfur Batteries: A Review // Energy Stor. Mater. 2020. V. 31. P. 352–372. https://doi.org/10.1016/j.ensm.2020.06.023
Yu X.W., Manthiram A. A Progress Report on Metal-Sulfur Batteries // Adv. Funct. Mater. 2020. V. 30. № 39. P. 2004084. https://doi.org/10.1002/adfm.202004084
Wang Y.J., Zhang Y.J., Cheng H.Y., Ni Z.C., Wang Y., Xia G.H., Li X., Zeng X.Y. Research Progress toward Room Temperature Sodium Sulfur Batteries: A Review // Molecules. 2021. V. 26. № 6. https://doi.org/10.3390/molecules26061535
Branco H., Castro R., Setas Lopes A. Battery Energy Storage Systems as a Way to Integrate Renewable Energy in Small Isolated Power Systems // Energy Sustain. Dev. 2018. V 43. P. 90–99. https://doi.org/10.1016/j.esd.2018.01.003
Hu H., Xie N., Fang D., Zhang X. The Role of Renewable Energy Consumption and Commercial Services Trade in Carbon Dioxide Reduction: Evidence from 25 Developing Countries // Appl. Energy. 2018. V. 211. P. 1229–1244. https://doi.org/10.1016/j.apenergy.2017.12.019
Скундин А.М., Кулова Т.Л., Ярославцев А.Б. Натрий-ионные аккумуляторы (обзор) // Электрохимия. 2018 Т. 54. № 2. С. 131–174. https://doi.org/10.7868/S0424857018020019
Tang W.W., Aslam M.K., Xu M.W. Towards High Performance Room Temperature Sodium-Sulfur Batteries: Strategies to Avoid Shuttle Effect // J. Colloid Interface Sci. 2022. V. 606. P. 22–37. https://doi.org/10.1016/j.jcis.2021.07.114
https://periodictable.com/Properties/A/CrustAbundance.an.html
Yu X., Manthiram A. Capacity Enhancement and Discharge Mechanisms of Room-Temperature Sodium-Sulfur Batteries // ChemElectroChem. 2014. V. 1. № 8. P. 1275–1280. https://doi.org/10.1002/celc.201402112
Chung S.H., Manthiram A. Current Status and Future Prospects of Metal-Sulfur Batteries // Adv. Mater. 2019. V. 31. № 27. 1901125 https://doi.org/10.1002/adma.201901125
Park C.-W., Ryu H.-S., Kim K.-W., Ahn J.-H., Lee J.-Y., Ahn H.-J. Discharge Properties of All-Solid Sodium–Sulfur Battery Using Poly (Ethylene Oxide) Electrolyte // J. Power Sources. 2007. V. 165. № 1. P. 450–454. https://doi.org/10.1016/j.jpowsour.2006.11.083
Zhou D., Tang X., Guo X., Li P., Shanmukaraj D., Liu H., Gao X., Wang Y., Rojo T., Armand M., Wang G. Polyolefin-Based Janus Separator for Rechargeable Sodium Batteries // Angew. Chem. Int. Ed. Engl. 2020. V. 59. № 38. P. 16725–16734. https://doi.org/10.1002/anie.202007008
Kim I., Kim C., Kim H., Kim K.W., Ahn J.H., Ahn H.J. Initial Discharge Behavior of an Ultra High Loading 3d Sulfur Cathode for a Room-Temperature na/s Battery // J. Nanosci. Nanotechnol. 2018. V. 18. № 9. P. 6524–6527. https://doi.org/10.1166/jnn.2018.15678
Yu X.W., Manthiram A. Capacity Enhancement and Discharge Mechanisms of Room-Temperature Sodium-Sulfur Batteries // Chemelectrochem. 2014. V. 1. № 8. P. 1275–1280. https://doi.org/10.1002/celc.201402112
Kim I., Park J.Y., Kim C., Park J.W., Ahn J.P., Ahn J.H., Kim K.W., Ahn H.J. Sodium Polysulfides during Charge/Discharge of the Room-Temperature na/s Battery Using Tegdme Electrolyte // J. Electrochem. Soc. 2016. V. 163. № 5. P. A611–A616. https://doi.org/10.1149/2.0201605jes
Kim I., Park J.-Y., Kim C.H., Park J.-W., Ahn J.-P., Ahn J.-H., Kim K.-W., Ahn H.-J. A Room Temperature na/s Battery Using a β″ Alumina Solid Electrolyte Separator, Tetraethylene Glycol Dimethyl ether Electrolyte, and a s/c Composite Cathode // J. Power Sources. 2016. V. 301. P. 332–337. https://doi.org/10.1016/j.jpowsour.2015.09.120
Paris J., Plichon V. Electrochemical Reduction of Sulfur in Dimethylacetamide // Electrochim. Acta. 1981. V. 26. № 12. P. 1823–1829. https://doi.org/10.1016/0013-4686(81)85170-5
Kim B.S., Park S.M. Insitu Spectroelectrochemical Studies on the Reduction of Sulfur in Dimethyl-Sulfoxide Solutions // J. Electrochem Soc. 1993. V. 140. № 1. P. 115–122. https://doi.org/10.1149/1.2056070
Gaillard F., Levillain E., Lelieur J.P. Polysulfides in Dimethylformamide: Only the Radical Anions s-3(-) and s-4(-) are Reducible // J. Electroanal. Chem. 1997. V. 432. № 1–2. P. 129–138. https://doi.org/10.1016/s0022-0728(97)00192-7
Gaillard F., Levillain E. Visible Time-Resolved Spectroelectrochemistry – Application to Study of the Reduction of Sulfur (s-8) in Dimethylformamide // J. Electroanal. Chem. 1995. V. 398. № 1–2. P. 77–87. https://doi.org/10.1016/0022-0728(95)04144-1
Ryu H., Kim T., Kim K., Ahn J.H., Nam T., Wang G., Ahn H.J. Discharge Reaction Mechanism of Room-Temperature Sodium-Sulfur Battery with Tetra Ethylene Glycol Dimethyl ether Liquid Electrolyte // J. Power Sources. 2011. V. 196. № 11. P. 5186–5190. https://doi.org/10.1016/j.jpowsour.2011.01.109
Qiang Z., Chen Y.M., Xia Y.F., Liang W.F., Zhu Y., Vogt B.D. Ultra-Long Cycle Life, Low-Cost Room Temperature Sodium-Sulfur Batteries Enabled by Highly Doped (n,s) Nanoporous Carbons // Nano Energy. 2017. V. 32. P. 59–66. https://doi.org/10.1016/j.nanoen.2016.12.018
Wang Y.X., Yang J.P., Lai W.H., Chou S.L., Gu Q.F., Liu H.K., Zhao D.Y., Dou S.X. Achieving High-Performance Room-Temperature Sodium Sulfur Batteries with S@Interconnected Mesoporous Carbon Hollow Nanospheres // JACS. 2016. V. 138. № 51. P. 16576–16579. https://doi.org/10.1021/jacs.6b08685
Adelhelm P., Hartmann P., Bender C.L., Busche M., Eufinger C., Janek J. From Lithium to Sodium: Cell Chemistry of Room Temperature Sodium-Air and Sodium-Sulfur Batteries // Beilstein J. Nanotechnol. 2015. V. 6. P. 1016–1055. https://doi.org/10.3762/bjnano.6.105
Guo Q.B., Li S., Liu X.J., Lu H.C., Chang X.Q., Zhang H.S., Zhu X.H., Xia Q.Y., Yan C.L., Xia H. Ultrastable Sodium-Sulfur Batteries without Polysulfides Formation Using Slit Ultramicropore Carbon Carrier // Adv. Sci. 2020. V. 7. № 11. https://doi.org/10.1002/advs.201903246
Kumar D., Kanchan D.K., Kumar S., Mishra K. Recent Trends on Tailoring Cathodes for Room-Temperature na-s Batteries // Mater. Sci. Technol. 2019. V. 2. № 1. P. 117–129. https://doi.org/10.1016/j.mset.2018.11.007
Yaroslavtsev A.B., Stenina I.A. Carbon Coating of Electrode Materials for Lithium-Ion Batteries // Surf. Innov. 2021. V. 9. № 2–3. P. 92–110. https://doi.org/10.1680/jsuin.20.00044
Wenzel S., Metelmann H., Raiß C., Dürr A.K., Janek J., Adelhelm P. Thermodynamics and Cell Chemistry of Room Temperature Sodium/Sulfur Cells with Liquid and Liquid/Solid Electrolyte // J. Power Sources. 2013. V. 243. P. 758–765. https://doi.org/10.1016/j.jpowsour.2013.05.194
Kim J.S., Ahn H.J., Kim I.P., Kim K.W., Ahn J.H., Park C.W., Ryu H.S. The Short-Term Cycling Properties of na/pvdf/s Battery at Ambient Temperature // J. Solid State Electrochem. 2008. V. 12. № 7–8. P. 861–865. https://doi.org/10.1007/s10008-008-0504-8
Liu D.Z., Li Z., Li X., Cheng Z.X., Yuan L.X., Huang Y.H. Recent Advances in Cathode Materials for Room-Temperature Sodium-Sulfur Batteries // Chemphyschem. 2019. V. 20. № 23. P. 3164–3176. https://doi.org/10.1002/cphc.201900595
Carter R., Oakes L., Douglas A., Muralidharan N., Cohn A.P., Pint C.L. A Sugar-Derived Room-Temperature Sodium Sulfur Battery with Long Term Cycling Stability // Nano Lett. 2017. V. 17. № 3. P. 1863–1869. https://doi.org/10.1021/acs.nanolett.6b05172
Hu L., Lu Y., Zhang T.W., Huang T., Zhu Y.C., Qian Y.T. Ultramicroporous Carbon through an Activation-Free Approach for li-s and na-s Batteries in Carbonate-Based Electrolyte // ACS Appl. Mater. Interfaces. 2017. V. 9. № 16. P. 13813–13818. https://doi.org/10.1021/acsami.7b01387
Wei S., Xu S., Agrawral A., Choudhury S., Lu Y., Tu Z., Ma L., Archer L.A. A Stable Room-Temperature Sodium-Sulfur Battery // Nat. Commun. 2016. V. 7. P. 11722. https://doi.org/10.1038/ncomms11722
Du W.Y., Wu Y.K., Yang T.T., Guo B.S., Liu D.Y., Bao S.J., Xu M.W. Rational Construction of rgo/vo2 Nanoflowers as Sulfur Multifunctional Hosts for Room Temperature na-s Batteries // Chem. Eng. J. 2020. V. 379. https://doi.org/10.1016/j.cej.2019.122359
Xin S., Gu L., Zhao N.H., Yin Y.X., Zhou L.J., Guo Y.G., Wan L.J. Smaller Sulfur Molecules Promise better Lithium-Sulfur Batteries // JACS. 2012. V. 134. № 45. P. 18510–18513. https://doi.org/10.1021/ja308170k
Guo Q.B., Sun S., Kim K.I., Zhang H.S., Liu X.J., Yan C.L., Xia H. A Novel One-Step Reaction Sodium-Sulfur Battery with High Areal Sulfur Loading on Hierarchical Porous Carbon Fiber // Carbon Energy. 2021. V. 3. № 3. P. 440–448. https://doi.org/10.1002/cey2.86
Oakes L., Carter R., Pint C.L. Nanoscale Defect Engineering of Lithium-Sulfur Battery Composite Cathodes for Improved Performance // Nanoscale. 2016. V. 8. № 46. P. 19368–19375. https://doi.org/10.1039/c6nr06332b
Xiao F.P., Yang X.M., Wang H.K., Xu J., Liu Y.L., Yu D.Y.W., Rogach A.L. Covalent Encapsulation of Sulfur in a Mof-Derived s, n-Doped Porous Carbon Host Realized via the Vapor-Infiltration Method Results in Enhanced Sodium-Sulfur Battery Performance // Adv. Energy Mater. 2020. V. 10. № 23. https://doi.org/10.1002/aenm.202000931
Xin S., Yin Y.X., Guo Y.G., Wan L.J. A High-Energy Room-Temperature Sodium-Sulfur Battery // Adv. Mater. 2014. V. 26. № 8. P. 1261–1265. https://doi.org/10.1002/adma.201304126
Wei S.Y., Xu S.M., Agrawral A., Choudhury S., Lu Y.Y., Tu Z.Y., Ma L., Archer L.A. A Stable Room-Temperature Sodium-Sulfur Battery // Nat. Commun. 2016. V. 7. 11722. https://doi.org/10.1038/ncomms11722
Wu H.B., Wei S.Y., Zhang L., Xu R., Hng H.H., Lou X.W. Embedding Sulfur in Mof-Derived Microporous Carbon Polyhedrons for Lithium-Sulfur Batteries // Chem. Eur. J. 2013. V. 19. № 33. P. 10804–10808. https://doi.org/10.1002/chem.201301689
Chen Y.M., Liang W.F., Li S., Zou F., Bhaway S.M., Qiang Z., Gao M., Vogt B.D., Zhu Y. A Nitrogen Doped Carbonized Metal-Organic Framework for High Stability Room Temperature Sodium-Sulfur Batteries // J. Mater. Chem. A. 2016. V. 4. № 32. P. 12471–12478. https://doi.org/10.1039/c6ta04529d
Mou J.R., Liu T., Li Y.J., Zhang W.J., Li M., Xu Y.T., Huang J.L., Liu M.L. Hierarchical Porous Carbon Sheets for High-Performance Room Temperature Sodium-Sulfur Batteries: Integration of Nitrogen-Self-Doping and Space Confinement // J. Mater. Chem. A. 2020. V. 8. № 46. P. 24590–24597. https://doi.org/10.1039/d0ta08876e
Zhang B.W., Liu Y.D., Wang Y.X., Zhang L., Chen M.Z., Lai W.H., Chou S.L., Liu H.K., Dou S.X. In situ Grown s Nanosheets on cu Foam: An Ultrahigh Electroactive Cathode for Room-Temperature na-s Batteries // ACS Appl. Mater. Interfaces. 2017. V. 9. № 29. P. 24446–24450. https://doi.org/10.1021/acsami.7b07615
Zhang B.W., Sheng T., Wang Y.X., Chou S.L., Davey K., Dou S.X., Qiao S.Z. Long-Life Room-Temperature Sodium-Sulfur Batteries by Virtue of Transition-Metal-Nanocluster-Sulfur Interactions // Angew. Chem. Int. Ed. 2019. V. 58. № 5. P. 1484–1488. https://doi.org/10.1002/anie.201811080
Ghosh A., Kumar A., Dos T., Chakrabory S., Kar M., MacFarlane D.R., Mitra S. Lewis Acid-Base Interactions between Polysulfides and Boehmite Enables Stable Room-Temperature Sodium-Sulfur Batteries // Adv. Funct. Mater. 2020. V. 30. № 50. https://doi.org/10.1002/adfm.202005669
Mou J.R., Li Y.J., Liu T., Zhang W.J., Li M., Xu Y.T., Zhong L., Pan W.H., Yang C.H., Huang J.L., Liu M.L. Metal-Organic Frameworks-Derived Nitrogen-Doped Porous Carbon Nanocubes with Embedded co Nanoparticles as Efficient Sulfur Immobilizers for Room Temperature Sodium-Sulfur Batteries // Small Methods. 2021. V. 5. № 8. 2100455. https://doi.org/10.1002/smtd.202100455
Yang H.L., Zhou S., Zhang B.W., Chu S.Q., Guo H.P., Gu Q.F., Liu H.W., Lei Y.J., Konstantinov K., Wang Y.X., Chou S.L., Liu H.K., Dou S.X. Architecting Freestanding Sulfur Cathodes for Superior Room-Temperature na-s Batteries // Adv. Funct. Mater. 2021. V. 31. № 32. 2102280. https://doi.org/10.1002/adfm.202102280
Zhou J.H., Xu S.M., Yang Y. Strategies for Polysulfide Immobilization in Sulfur Cathodes for Room-Temperature Sodium-Sulfur Batteries // Small. 2021. V. 17. № 32. 2100057. https://doi.org/10.1002/smll.202100057
Ghosh A., Shukla S., Monisha M., Kumar A., Lochab B., Mitra S. Sulfur Copolymer: A New Cathode Structure for Room-Temperature Sodium-Sulfur Batteries // ACS Energy Lett. 2017. V. 2. № 10. P. 2478–2485. https://doi.org/10.1021/acsenergylett.7b00714
Fan L., Ma R.F., Yang Y.H., Chen S.H., Lu B.A. Covalent Sulfur for Advanced Room Temperature Sodium-Sulfur Batteries // Nano Energy. 2016. V. 28. P. 304–310. https://doi.org/10.1016/j.nanoen.2016.08.056
Wang J.L., Yang J., Nuli Y., Holze R. Room Temperature na/s Batteries with Sulfur Composite Cathode Materials // Electrochem. Commun. 2007. V. 9. № 1. P. 31–34. https://doi.org/10.1016/j.elecom.2006.08.029
Hwang T.H., Jung D.S., Kim J.S., Kim B.G., Choi J.W. One-Dimensional Carbon-Sulfur Composite Fibers for na-s Rechargeable Batteries Operating at Room Temperature // Nano Lett. 2013. V. 13. № 9. P. 4532–4538. https://doi.org/10.1021/nl402513x
Kim I., Kim C.H., Choi S.H., Ahn J.P., Ahn J.H., Kim K.W., Cairns E.J., Ahn H.J. A Singular Flexible Cathode for Room Temperature Sodium/Sulfur Battery // J. Power Sources. 2016. V. 307. P. 31–37. https://doi.org/10.1016/j.jpowsour.2015.12.035
Zhu T.C., Dong X.L., Liu Y., Wang Y.G., Wang C.X., Xia Y.Y. An All-Solid-State Sodium-Sulfur Battery Using a Sulfur/Carbonized Polyacrylonitrile Composite Cathode // ACS Appl. Energy Mater. 2019. V. 2. № 7. P. 5263–5271. https://doi.org/10.1021/acsaem.9b00953
Seong M., Kim H., Kim C., Lim H.S., Yoon D.K., Kim T.H., Ahn H.J. Fabrication and Electrochemical Characterization of Sulfurized-Polyacrylonitrile Nanofiber Electrodes for na/s Batteries Using Various Polyacrylonitrile Solutions // J. Nanosci. Nanotechnol. 2020. V. 20. № 11. P. 7092–7095. https://doi.org/10.1166/jnn.2020.18828
Murugan S., Niesen S., Kappler J., Kuster K., Starke U., Buchmeiser M.R. Ultra-Stable Cycling of High Capacity Room Temperature Sodium-Sulfur Batteries Based On Sulfurated Poly(acrylonitrile) // Batteries Supercaps. https://doi.org/10.1002/batt.202100125
Kim H., Sadan M.K., Kim C., Jo J., Seong M., Cho K.-K., Kim K.-W., Ahn J.-H., Ahn H.-J. Enhanced Reversible Capacity of Sulfurized Polyacrylonitrile Cathode for Room-Temperature na/s Batteries by Electrochemical Activation // Chem. Eng. J. 2021. V. 426. 130787. https://doi.org/10.1016/j.cej.2021.130787
Zhang L.L., Zhang W.H., Zhu Z.Y., Huang Q.Q., Liu X.X., Zhang M.C., Pei W.B., Wu J.S. Multi-Channel Sulfurized Polyacrylonitrile with Hollow Structure as Cathode for Room Temperature Sodium-Sulfur Batteries // J. Solid State Chem. 2021. V. 301. 122359. https://doi.org/10.1016/j.jssc.2021.122359
Yu X., Manthiram A. Room-Temperature Sodium–Sulfur Batteries with Liquid-Phase Sodium Polysulfide Catholytes and Binder-Free Multiwall Carbon Nanotube Fabric Electrodes // J. Phys. Chem. C. 2014. V. 118. № 40. P. 22952–22959. https://doi.org/10.1021/jp507655u
Ceylan Cengiz E., Erdol Z., Sakar B., Aslan A., Ata A., Ozturk O., Demir-Cakan R. Investigation of the Effect of Using al2o3–Nafion Barrier on Room-Temperature na–s Batteries // J. Phys. Chem. C. 2017. V. 121. № 28. P. 15120–15126. https://doi.org/10.1021/acs.jpcc.7b04711
Kumar A., Ghosh A., Roy A., Panda M.R., Forsyth M., MacFarlane D.R., Mitra S. High-Energy Density Room Temperature Sodium-Sulfur Battery Enabled by Sodium Polysulfide Catholyte and Carbon Cloth Current Collector Decorated with mno2 Nanoarrays // Energy Stor. Mater. 2019. V. 20. P. 196–202. https://doi.org/10.1016/j.ensm.2018.11.031
Yu X.W., Manthiram A. Na2S-carbon Nanotube Fabric Electrodes for Room-Temperature Sodium-Sulfur Batteries // Chem. Eur. J. 2015. V. 21. № 11. P. 4233–4237. https://doi.org/10.1002/chem.201405344
Wang C.L., Wang H., Hu X.F., Matios E., Luo J.M., Zhang Y.W., Lu X., Li W.Y. Frogspawn-Coral-Like Hollow Sodium Sulfide Nanostructured Cathode for High-Rate Performance Sodium-Sulfur Batteries // Adv. Energy Mater. 2019. V. 9. № 5. 1803251. https://doi.org/10.1002/aenm.201803251
Lee J., Kim J., Kim S., Jo C. A Review on Recent Approaches for Designing the Sei Layer on Sodium Metal Anodes // Mater. Adv. 2020. V. 1. № 9. P. 3143–3166. https://doi.org/10.1039/d0ma00695e
Eng A.Y.S., Kumar V., Zhang Y.W., Luo J.M., Wang W.Y., Sun Y.M., Li W.Y., Seh Z.W. Room-Temperature Sodium-Sulfur Batteries and Beyond: Realizing Practical High Energy Systems through Anode, Cathode, and Electrolyte Engineering // Adv. Energy Mater. 2021. V. 11. № 14. 2003493. https://doi.org/10.1002/aenm.202003493
Seh Z.W., Sun J., Sun Y., Cui Y. A Highly Reversible Room-Temperature Sodium Metal Anode // ACS Cent Sci. 2015. V. 1. № 8. P. 449–455. https://doi.org/10.1021/acscentsci.5b00328
Wei S., Choudhury S., Xu J., Nath P., Tu Z., Archer L.A. Highly Stable Sodium Batteries Enabled by Functional Ionic Polymer Membranes // Adv. Mater. 2017. V. 29. № 12. 1605512. https://doi.org/10.1002/adma.201605512
Zhao X., Zhu Q., Xu S., Chen L., Zuo Z., Wang X.-M., Liu S., Zhang D. Fluoroethylene Carbonate as an Additive in a Carbonates-Based Electrolyte for Enhancing the Specific Capacity of Room-Temperature Sodium-Sulfur Cell // J. Electroanal. Chem. 2019. V. 832. P. 392–398. https://doi.org/10.1016/j.jelechem.2018.11.021
Zhang B.W., Liu Y.D., Wang Y.X., Zhang L., Chen M.Z., Lai W.H., Chou S.L., Liu H.K., Dou S.X. In situ Grown s Nanosheets on cu Foam: An Ultrahigh Electroactive Cathode for Room-Temperature na-s Batteries // ACS Appl. Mater. Interfaces. 2017. V. 9. № 29. P. 24446–24450. https://doi.org/10.1021/acsami.7b07615
Komaba S., Ishikawa T., Yabuuchi N., Murata W., Ito A., Ohsawa Y. Fluorinated Ethylene Carbonate as Electrolyte Additive for Rechargeable na Batteries // ACS Appl. Mater. Interfaces. 2011. V. 3. № 11. P. 4165–4168. https://doi.org/10.1021/am200973k
Wu J., Liu J., Lu Z., Lin K., Lyu Y.-Q., Li B., Ciucci F., Kim J.-K. Non-Flammable Electrolyte for Dendrite-Free Sodium-Sulfur Battery // Energy Stor. Mater. 2019. V. 23. P. 8–16. https://doi.org/10.1016/j.ensm.2019.05.045
Xu X.F., Zhou D., Qin X.Y., Lin K., Kang F.Y., Li B.H., Shanmukaraj D., Rojo T., Armand M., Wang G.X. A Room-Temperature Sodium-Sulfur Battery with High Capacity and Stable Cycling Performance // Nat. Commun. 2018. V. 9. 3870. https://doi.org/10.1038/s41467-018-06443-3
Zhao Y., Goncharova L.V., Lushington A., Sun Q., Yadegari H., Wang B.Q., Xiao W., Li R.Y., Sun X.L. Superior Stable and Long Life Sodium Metal Anodes Achieved by Atomic Layer Deposition // Adv. Mater. 2017. V. 29. № 18. 1606663. https://doi.org/10.1002/adma.201606663
Wei S.Y., Choudhury S., Xu J., Nath P., Tu Z.Y., Archer L.A. Highly Stable Sodium Batteries Enabled by Functional Ionic Polymer Membranes // Adv. Mater. 2017. V. 29. № 12. 1605512. https://doi.org/10.1002/adma.201605512
Zhang J., Zhang G.X., Chen Z.S., Dai H.L., Hu Q.M., Liao S.J., Sun S.H. Emerging Applications of Atomic Layer Deposition for Lithium-Sulfur and Sodium-Sulfur Batteries // Energy Stor. Mater. 2020. V. 26. P. 513–533. https://doi.org/10.1016/j.ensm.2019.11.025
Zhao Y., Zhang L., Liu J., Adair K., Zhao F.P., Sun Y.P., Wu T.P., Bi X.X., Amine K., Lu J., Sun X.L. Atomic/Molecular Layer Deposition for Energy Storage and Conversion // Chem. Soc. Rev. 2021. V. 50. № 6. P. 3889–3956. https://doi.org/10.1039/d0cs00156b
Wang L., Wang T., Peng L., Wang Y., Zhang M., Zhou J., Chen M., Cao J., Fei H., Duan X., Zhu J., Duan X. The Promises, Challenges and Pathways to Room-Temperature Sodium-Sulfur Batteries // Natl. Sci. Rev. 2021. https://doi.org/10.1093/nsr/nwab050
Zhao Y., Goncharova L.V., Zhang Q., Kaghazchi P., Sun Q., Lushington A., Wang B.Q., Li R.Y., Sun X.L. Inorganic-Organic Coating via Molecular Layer Deposition Enables Long Life Sodium Metal Anode // Nano Lett. 2017. V. 17. № 9. P. 5653–5659. https://doi.org/10.1021/acs.nanolett.7b02464
Kim Y.J., Lee H., Noh H., Lee J., Kim S., Ryou M.H., Lee Y.M., Kim H.T. Enhancing the Cycling Stability of Sodium Metal Electrodes by Building an Inorganic-Organic Composite Protective Layer // ACS Appl. Mater. Interfaces. 2017. V. 9. № 7. P. 6000–6006. https://doi.org/10.1021/acsami.6b14437
Zhang D., Li B., Wang S., Yang S.B. Simultaneous Formation of Artificial SEI Film and 3d Host for Stable Metallic Sodium Anodes // ACS Appl. Mater. Interfaces. 2017. V. 9. № 46. P. 40265–40272. https://doi.org/10.1021/acsami.7b12568
Wang H., Wang C.L., Matios E., Li W.Y. Critical Role of Ultrathin Graphene Films with Tunable Thickness in Enabling Highly Stable Sodium Metal Anodes // Nano Lett. 2017. V. 17. № 11. P. 6808–6815. https://doi.org/10.1021/acs.nanolett.7b03071
Luo W., Lin C.F., Zhao O., Noked M., Zhang Y., Rubloff G.W., Hu L.B. Ultrathin Surface Coating Enables the Stable Sodium Metal Anode // Adv. Energy Mater. 2017. V. 7. № 2. 1601526. https://doi.org/10.1002/aenm.201601526
Xu Z.X., Yang J., Zhang T., Sun L.M., Nuli Y., Wang J.L., Hirano S. Stable Na Metal Anode Enabled by a Reinforced Multistructural SEI Layer // Adv. Funct. Mater. 2019. V. 29. № 27. 1901924. https://doi.org/10.1002/adfm.201901924
Lee D.-J., Park J.-W., Hasa I., Sun Y.-K., Scrosati B., Hassoun J. Alternative Materials for Sodium Ion–Sulphur Batteries // J. Mater. Chem. A. 2013. V. 1. № 17. P. 5256–5261. https://doi.org/10.1039/c3ta10241f
Yue J., Han F.D., Fan X.L., Zhu X.Y., Ma Z.H., Yang J., Wang C.S. High-Performance All-Inorganic Solid-State Sodium-Sulfur Battery // Acs Nano. 2017. V. 11. № 5. P. 4885–4891. https://doi.org/10.1021/acsnano.7b01445
Wang A.X., Hu X.F., Tang H.Q., Zhang C.Y., Liu S., Yang Y.W., Yang Q.H., Luo J.Y. Processable and Moldable Sodium-Metal Anodes // Angew. Chem. Int. Ed. 2017. V. 56. № 39. P. 11921–11926. https://doi.org/10.1002/anie.201703937
Fang Y.J., Luan D.Y., Chen Y., Gao S.Y., Lou X.W. Rationally Designed Three-Layered Cu2S@carbon@MoS2 Hierarchical Nanoboxes for Efficient Sodium Storage // Angew. Chem. Int. Ed. 2020. V. 59. № 18. P. 7178–7183. https://doi.org/10.1002/anie.201915917
Воропаева Д.Ю., Новикова С.А., Ярославцев А.Б. Пoлимepныe элeктpoлиты для мeтaлл-иoнныx aккyмyлятopoв // Успехи химии. 2020. Т. 89. № 10. С. 1132–1155. https://doi.org/10.1070/RCR4956
Gao J., Lowe M.A., Kiya Y., Abruña H.D. Effects of Liquid Electrolytes on the Charge–Discharge Performance of Rechargeable Lithium/Sulfur Batteries: Electrochemical and in-situ X-ray Absorption Spectroscopic Studies // J. Phys. Chem. C. 2011. V. 115. № 50. P. 25132–25137. https://doi.org/10.1021/jp207714c
Yu X., Manthiram A. Performance Enhancement and Mechanistic Studies of Room-Temperature Sodium–Sulfur Batteries with a Carbon-Coated Functional Nafion Separator and a Na2S/Activated Carbon Nanofiber Cathode // Chem. Mater. 2016. V. 28. № 3. P. 896–905. https://doi.org/10.1021/acs.chemmater.5b04588
Колосицын B.C., Карасева Е.В., Сынг Д.Ю., Чо М.Д. Влияние природы эфиров на циклирование серного электрода в смешанных электролитах на основе сульфолана // Электрохимия. 2002. Т. 38. № 12. С. 1452–1456.
Yu X., Manthiram A. A Progress Report on Metal–Sulfur Batteries // Adv. Funct. Mater. 2020. V. 30 № 39. 2004084. https://doi.org/10.1002/adfm.202004084
Yim T., Park M.-S., Yu J.-S., Kim K.J., Im K.Y., Kim J.-H., Jeong G., Jo Y.-N., Woo S.-G., Kang K.-S., Lee I., Kim Y.-J. Effect of Chemical Reactivity of Polysulfide toward Carbonate-Based Electrolyte on the Electrochemical Performance of Li–S Batteries // Electrochim. Acta. 2013. V. 107. P. 454–460. https://doi.org/10.1016/j.electacta.2013.06.039
Hayashi A., Noi K., Sakuda A., Tatsumisago M. Superionic Glass-Ceramic Electrolytes for Room-Temperature Rechargeable Sodium Batteries // Nat. Commun. 2012. V. 3. P. 856. https://doi.org/10.1038/ncomms1843
Nagata H., Chikusa Y. An All-Solid-State Sodium-Sulfur Battery Operating at Room Temperature Using a High-Sulfur-Content Positive Composite Electrode // Chem. Lett. 2014. V. 43. № 8. P. 1333–1334. https://doi.org/10.1246/cl.140353
Tanibata N., Deguchi M., Hayashi A., Tatsumisago M. All-Solid-State na/s Batteries with a Na3PS4 Electrolyte Operating at Room Temperature // Chem. Mater. 2017. V. 29. № 12. P. 5232–5238. https://doi.org/10.1021/acs.chemmater.7b01116
An T., Jia H.H., Peng L.F., Xie J. Material and Interfacial Modification toward a Stable Room-Temperature Solid-State Na-S Battery // ACS Appl. Mater. Interfaces. 2020. V. 12. № 18. P. 20563–20569. https://doi.org/10.1021/acsami.0c03899
Song S.F., Duong H.M., Korsunsky A.M., Hu N., Lu L. A Na+ Superionic Conductor for Room-Temperature Sodium Batteries // Sci. Rep. 2016. V. 6. 32330. https://doi.org/10.1038/srep32330
Oh J.A.S., He L.C., Plewa A., Morita M., Zhao Y., Sakamoto T., Song X., Zhai W., Zeng K.Y., Lu L. Composite NASICON (Na3Zr2Si2PO12) Solid-State Electrolyte with Enhanced Na+ Ionic Conductivity: Effect of Liquid Phase Sintering // ACS Appl. Mater. Interfaces. 2019. V. 11. № 43. P. 40125–40133. https://doi.org/10.1021/acsami.9b14986
Yu X.W., Manthiram A. Sodium-Sulfur Batteries with a Polymer-Coated NASICON-Type Sodium-Ion Solid Electrolyte // Matter. 2019. V. 1. № 2. P. 439–451. https://doi.org/10.1016/j.matt.2019.03.008
Armand M.B. Polymer Electrolytes // Annu. Rev. Mater. Sci. 1986. V. 16. № 1. P. 245–261. https://doi.org/10.1146/annurev.ms.16.080186.001333
Yaroslavtseva T.V., Reznitskikh O.G., Sherstobitova E.A., Erkabaev A.M., Brezhestovsky M.S., Bushkova O.V. Solid Polymer Electrolytes in a Poly(butadiene-acrylonitrile)-LiBr System // Ionics. 2017. V. 23. № 12. P. 3347–3363. https://doi.org/10.1007/s11581-017-2149-z
Zhang Q.Q., Liu K., Ding F., Liu X.J. Recent Advances in Solid Polymer Electrolytes for Lithium Batteries // Nano Res. 2017. V. 10. № 12. P. 4139–4174. https://doi.org/10.1007/s12274-017-1763-4
Zhou D., Shanmukaraj D., Tkacheva A., Armand M., Wang G.X. Polymer Electrolytes for Lithium-Based Batteries: Advances and Prospects // Chem. 2019. V. 5. № 9. P. 2326–2352. https://doi.org/10.1016/j.chempr.2019.05.009
Bushkova O.V., Animitsa I.E., Lirova B.I., Zhukovsky V.M. Lithium Conducting Solid Polymer Electrolytes Based on Polyacrylonitrile Copolymers: Ion Solvation and Transport Properties // Ionics. 1997. V. 3. № 5–6. P. 396–404. https://doi.org/10.1007/bf02375716
Ge Z., Li J., Liu J. Enhanced Electrochemical Performance of All-Solid-State Sodium-Sulfur Batteries by PEO-NaCF3SO3-MIL-53(al) Solid Electrolyte // Ionics. 2020. V. 26. № 4. P. 1787–1795. https://doi.org/10.1007/s11581-020-03513-9
Park C.W., Ahn J.H., Ryu H.S., Kim K.W., Ahn H.J. Room-Temperature Solid-State Sodium/Sulfur Battery // Electrochem. Solid State Lett. 2006. V. 9. № 3. P. A123–A125. https://doi.org/10.1149/1.2164607
Ярмоленко О.В., Юдина А.В., Евщик Е.Ю., Черняк А.В., Маринин А.А., Волков В.И., Кулова Т.Л. Новые сетчатые гель-электролиты состава диакрилат полиэтиленгликоля-LiBF4-1-бутил-3-метилимидазолий тетрафторборат с введением алкиленкарбонатов: механизм ионного транспорта и свойства // Электрохимия. 2015. Т. 51. № 5. С. 489–496. https://doi.org/10.7868/S0424857015050199
Mauger A., Julien C.M., Paolella A., Armand M., Zaghib K. Building better Batteries in the Solid State: A Review // Materials. 2019. V. 12. № 23. 3892. https://doi.org/10.3390/ma12233892
Kumar D., Kanchan D.K. Dielectric and Electrochemical Studies on Carbonate Free Na-Ion Conducting Electrolytes for Sodium-Sulfur Batteries // J. Energy Storage. 2019. V. 22. P. 44–49. https://doi.org/10.1016/j.est.2019.01.020
Qiao L.X., Judez X., Rojo T., Armand M., Zhang H. Polymer Electrolytes for Sodium Batteries // J. Electrochem. Soc. 2020. V. 167. № 7. 070534. https://doi.org/10.1149/1945-7111/ab7aa0
Lonchakova O.V., Semenikhin O.A., Zakharkin M.V., Karpushkin E.A., Sergeyev V.G., Antipov E.V. Efficient Gel-Polymer Electrolyte for Sodium-Ion Batteries Based on Poly(acrylonitrile-co-methyl Acrylate) // Electrochim. Acta. 2020. V. 334. 135512. https://doi.org/10.1016/j.electacta.2019.135512
Lim D.H., Agostini M., Ahn J.H., Matic A. An Electrospun Nanofiber Membrane as Gel-Based Electrolyte for Room-Temperature Sodium-Sulfur Batteries // Energy Technol. 2018. V. 6. № 7. P. 1214–1219. https://doi.org/10.1002/ente.201800170
Kumar D., Suleman M., Hashmi S.A. Studies on Poly(vinylidene fluoride-co-hexafluoropropylene) Based Gel Electrolyte Nanocomposite for Sodium-Sulfur Batteries // Solid State Ionics. 2011. V. 202. № 1. P. 45–53. https://doi.org/10.1016/j.ssi.2011.09.001
Singh R., Maheshwaran C., Kanchan D.K., Mishra K., Singh P.K., Kumar D. Ion-Transport Behavior in Tetraethylene Glycol Dimethyl Ether Incorporated Sodium Ion Conducting Polymer Gel Electrolyte Membranes Intended for Sodium Battery Application // J. Mol. Liq. 2021. V. 336. 116594. https://doi.org/10.1016/j.molliq.2021.116594
Syali M.S., Mishra K., Kanchan D.K., Kumar D. Studies on a Novel Na+ Superionic Conducting Polymer Gel Cocktail Electrolyte Membrane Immobilizing Molecular Liquid Mixture of Carbonates, Tetraglyme and Ionic Liquid // J. Mol. Liq. 2021. V. 341. 116922. https://doi.org/10.1016/j.molliq.2021.116922
Eshetu G.G., Armand M., Scrosati B., Passerini S. Energy Storage Materials Synthesized from Ionic Liquids // Angew. Chem. Int. Ed. 2014. V. 53. № 49. P. 13342–13359. https://doi.org/10.1002/anie.201405910
Eshetu G.G., Elia G.A., Armand M., Forsyth M., Komaba S., Rojo T., Passerini S. Electrolytes and Interphases in Sodium-Based Rechargeable Batteries: Recent Advances and Perspectives // Adv. Energy Mater. 2020. V. 10. № 20. 2000093. https://doi.org/10.1002/aenm.202000093
Zhang H., Li C.M., Piszcz M., Coya E., Rojo T., Rodriguez-Martinez L.M., Armand M., Zhou Z.B. Single Lithium-Ion Conducting Solid Polymer Electrolytes: Advances and Perspectives // Chem. Soc. Rev. 2017. V. 46. № 3. P. 797–815. https://doi.org/10.1039/c6cs00491a
Di Nato V., Bettiol M., Bassetto F., Boaretto N., Negro E., Lavina S., Bertasi F. Hybrid Inorganic-Organic Nanocomposite Polymer Electrolytes Based on Nafion and Fluorinated tio2 for Pemfcs // Int. J. Hydrogen Energy. 2012. V. 37. № 7. P. 6169–6181. https://doi.org/10.1016/j.ijhydene.2011.07.131
Lemay N., Mikhaylin S., Mareev S., Pismenskaya N., Nikonenko V., Bazinet L. How Demineralization Duration by Electrodialysis under High Frequency Pulsed Electric Field Can be the Same as in Continuous Current Condition and that for better Performances? // J. Membr. Sci. 2020. V. 603. 117878. https://doi.org/10.1016/j.memsci.2020.117878
Филиппов С.П., Ярославцев А.Б. Водородная энергетика: перспективы развития и материалы // Успехи химии. 2021. Т. 90. № 6. С. 627–643. https://doi.org/10.1070/RCR5014
Achoh A.R., Zabolotsky V.I., Lebedev K.A., Sharafan M.V., Yaroslavtsev A.B. Electrochemical Properties and Selectivity of Bilayer Ion-Exchange Membranes in Ternary Solutions of Strong Electrolytes // Membr. Membr. Technol. 2021. V. 3. № 1. P. 52–71. https://doi.org/10.1134/s2517751621010029
Sanginov E.A., Kayumov R.R., Shmygleva L.V., Lesnichaya V.A., Karelin A.I., Dobrovolsky Y.A. Study of the Transport of Alkali Metal Ions in a Nonaqueous Polymer Electrolyte Based on Nafion // Solid State Ionics. 2017. V. 300. P. 26–31. https://doi.org/10.1016/j.ssi.2016.11.017
Зюбина Т.С., Зюбин А.С., Добровольский Ю.А., Волохов В.М. Неводный полимерный электролит на основе Li-Нафиона. Квантово-химическое моделирование // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1061–1067. https://doi.org/10.7868/S0044457X17080074
Pan Q.Y., Li Z., Zhang W.C., Zeng D.L., Sun Y.B., Cheng H.S. Single Ion Conducting Sodium Ion Batteries Enabled by a Sodium Ion Exchanged Poly(bis(4-carbonyl benzene sulfonyl)imide-co-2,5-diamino benzesulfonic acid) Polymer Electrolyte // Solid State Ionics. 2017. V. 300. P. 60–66. https://doi.org/10.1016/j.ssi.2016.12.001
Voropaeva D.Y., Novikova S.A., Kulova T.L., Yaroslavtsev A.B. Solvation and Sodium Conductivity of Nonaqueous Polymer Electrolytes Based on Nafion-117 Membranes and Polar Aprotic Solvents // Solid State Ionics. 2018. V. 324. P. 28–32. https://doi.org/10.1016/j.ssi.2018.06.002
Voropaeva D.Y., Novikova S.A., Kulova T.L., Yaroslavtsev A.B. Conductivity of Nafion-117 Membranes Intercalated by Polar Aprotonic Solvents // Ionics. 2018. V. 24. № 6. P. 1685–1692. https://doi.org/10.1007/s11581-017-2333-1
Li Z., Lu W.H., Zhang N., Pan Q.Y., Chen Y.Z., Xu G.D., Zeng D.L., Zhang Y.F., Cai W.W., Yang M., Yang Z.H., Sun Y.B., Ke H.Z., Cheng H.S. Single Ion Conducting Lithium Sulfur Polymer Batteries with Improved Safety and Stability // J. Mater. Chem. A. 2018. V. 6. № 29. P. 14330–14338. https://doi.org/10.1039/c8ta04619k
Voropaeva D., Novikova S., Xu T.W., Yaroslaytsev A. Polymer Electrolytes for Libs Based on Perfluorinated Sulfocationic Nepem-117 Membrane and Aprotic Solvents // J. Phys. Chem. B. 2019. V. 123. № 48. P. 10217–10223. https://doi.org/10.1021/acs.jpcb.9b08555
Зюбина Т.С., Сангинов Е.А., Зюбин А.С., Добровольский Ю.А., Волохов В.М., Ключарев В.В., Букун Н.Г. Полимерный электролит на основе мембраны нафион, пластифицированной диметилсульфоксидом, и особенности транспорта в нем ионов щелочных металлов. Квантово-химическое моделирование // Журн. неорган. химии. 2020. Т. 65. № 3. С. 360–372. https://doi.org/10.31857/S0044457X20030204
Istomina A.S., Yaroslavtseva T.V., Reznitskikh O.G., Kayumov R.R., Shmygleva L.V., Sanginov E.A., Dobrovolsky Y.A., Bushkova O.V. Li-Nafion Membrane Plasticised with Ethylene Carbonate/Sulfolane: Influence of Mixing Temperature on the Physicochemical Properties // Polymers. 2021. V. 13. № 7. https://doi.org/10.3390/polym13071150
Sanginov E.A., Borisevich S.S., Kayumov R.R., Istomina A.S., Evshchik E.Y., Reznitskikh O.G., Yaroslavtseva T.V., Melnikova T.I., Dobrovolsky Y.A., Bushkova O.V. Lithiated Nafion Plasticised by a Mixture of Ethylene Carbonate and Sulfolane // Electrochim. Acta. 2021. V. 373. https://doi.org/10.1016/j.electacta.2021.137914
Golubenko D.V., Pourcelly G., Yaroslavtsev A.B. Permselectivity and Ion-Conductivity of Grafted Cation-Exchange Membranes Based on UV-Oxidized Polymethylpenten and Sulfonated Polystyrene // Sep. Purif. Technol. 2018. V. 207. P. 329–335. https://doi.org/10.1016/j.seppur.2018.06.041
Berezina N.P., Kononenko N.A., Sytcheva A.A.R., Loza N.V., Shkirskaya S.A., Hegman N., Pungor A. Perfluorinated Nanocomposite Membranes Modified by Polyaniline: Electrotransport Phenomena and Morphology // Electrochim. Acta. 2009. V. 54. № 8. P. 2342–2352. https://doi.org/10.1016/j.electacta.2008.10.048
Porozhnyy M., Huguet P., Cretin M., Safronova E., Nikonenko V. Mathematical Modeling of Transport Properties of Proton-Exchange Membranes Containing Immobilized Nanoparticles // Int. J. Hydrogen Energy. 2016. V. 41. № 34. P. 15605–15614. https://doi.org/10.1016/j.ijhydene.2016.06.057
Stenina I.A., Yaroslavtsev A.B. Ionic Mobility in Ion-Exchange Membranes // Membranes. 2021. V. 11. № 3. 198. https://doi.org/10.3390/membranes11030198
Porozhnyy M.V., Shkirskaya S.A., Butylskii D.Y., Dotsenko V.V., Safronova E.Y., Yaroslavtsev A.B., Deabate S., Huguet P., Nikonenko V.V. Physicochemical and Electrochemical Characterization of Nafion-Type Membranes with Embedded Silica Nanoparticles: Effect of Functionalization // Electrochim. Acta. 2021. V. 370. 137689. https://doi.org/10.1016/j.electacta.2020.137689
Quartarone E., Mustarelli P. Electrolytes for Solid-State Lithium Rechargeable Batteries: Recent Advances and Perspectives // Chem. Soc. Rev. 2011. V. 40. № 5. P. 2525–2540. https://doi.org/10.1039/c0cs00081g
Cheng X.L., Pan J., Zhao Y., Liao M., Peng H.S. Gel Polymer Electrolytes for Electrochemical Energy Storage // Adv. Energy Mater. 2018. V. 8. № 7. https://doi.org/10.1002/aenm.201702184
Wang Y., Travas-Sejdic J., Steiner R. Polymer Gel Electrolyte Supported with Microporous Polyolefin Membranes for Lithium Ion Polymer Battery // Solid State Ionics. 2002. V. 148. № 3–4. P. 443–449. https://doi.org/10.1016/s0167-2738(02)00085-1
Stenina I., Golubenko D., Nikonenko V., Yaroslavtsev A. Selectivity of Transport Processes in Ion-Exchange Membranes: Relationship with the Structure and Methods for Its Improvement // Int. J. Mol. Sci. 2020. V. 21. № 15. 5517. https://doi.org/10.3390/ijms21155517
Yu X., Manthiram A. Ambient-Temperature Sodium-Sulfur Batteries with a Sodiated Nafion Membrane and a Carbon Nanofiber-Activated Carbon Composite Electrode // Adv. Energy Mater. 2015. V. 5. № 12. 1500350. https://doi.org/10.1002/aenm.201500350
Bauer I., Kohl M., Althues H., Kaskel S. Shuttle Suppression in Room Temperature Sodium-Sulfur Batteries Using Ion Selective Polymer Membranes // Chem Commun. 2014. V. 50. № 24. P. 3208–3210. https://doi.org/10.1039/c4cc00161c
Wenzel S., Leichtweiss T., Weber D.A., Sann J., Zeier W.G., Janek J. Interfacial Reactivity Benchmarking of the Sodium Ion Conductors Na3PS4 and Sodium Beta-Alumina for Protected Sodium Metal Anodes and Sodium All-Solid-State Batteries // ACS Appl. Mater. Interfaces. 2016. V. 8. № 41. P. 28216–28224. https://doi.org/10.1021/acsami.6b10119
Ren Y.X., Jiang H.R., Zhao T.S., Zeng L., Xiong C. Remedies of Capacity Fading in Room-Temperature Sodium-Sulfur Batteries // J. Power Sources. 2018. V. 396. P. 304–313. https://doi.org/10.1016/j.jpowsour.2018.06.056
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы