Неорганические материалы, 2022, T. 58, № 6, стр. 625-632
Влияние термообработки расплава Bi2O3, содержащего 22 мол. % SiO2, на состояние образующейся при кристаллизации метастабильной δ*-фазы
Т. В. Бермешев 1, *, В. П. Жереб 1, М. П. Бундин 1, А. С. Ясинский 1, 3, О. В. Юшкова 1, Д. С. Ворошилов 1, А. С. Самойло 1, Е. В. Мазурова 2, А. Н. Залога 1, О. В. Якивьюк 1, В. М. Беспалов 1
1 Сибирский федеральный университет
660041 Красноярск, пр. Красноярский рабочий, 95, Россия
2 Институт химии и химической технологии СО Российской академии наук
660036 Красноярск, Академгородок, 50, стр. 24, Россия
3 IME, Institute for Process Metallurgy and Metal Recycling, RWTH Aachen University
52056 Aachen, Intzestraße, 3, Germany
* E-mail: irbis_btv@mail.ru
Поступила в редакцию 15.12.2021
После доработки 15.03.2022
Принята к публикации 17.03.2022
- EDN: GICWKQ
- DOI: 10.31857/S0002337X22060021
Аннотация
Исследовано влияние изотермической выдержки расплава, содержащего 78 мол. % Bi2O3 и 22 мол. % SiО2, и различных режимов его охлаждения на морфологию, микроструктуру и фазовый состав кристаллов метастабильного твердого раствора на основе высокотемпературной δ-формы Bi2O3 (δ*-фазы). Показано, что высокотемпературная выдержка расплава способствует его переохлаждению и кристаллизации δ*-фазы в широком интервале скоростей охлаждения. Исследован перитектоидный распад δ*-фазы в субсолидусной области, продуктами которого являются обедненная диоксидом кремния δ4-фаза и кристаллические формы метастабильного SiO2.
ВВЕДЕНИЕ
Высокотемпературная δ-модификация Bi2O3 с гранецентрированной кубической решеткой и структурой типа флюорита [1–9] является уникальным суперионным проводником, обладающим рекордно высокой кислородно-ионной проводимостью, превышающей проводимость всех известных твердых электролитов [10, 11].
Оксиды со структурой δ-Bi2O3 являются также фотокатализаторами, перспективными для очистки воздуха и сточных вод от токсичных органических соединений. На их основе предложены эффективные и недорогие адсорбенты для нейтрализации изотопов радиоактивного йода [12] и удаления токсичных соединений селена из водных растворов [13], для каталитического преобразования нитробензолов в анилины [14], а также окислители в реакции химического циклического сжигания (CLC) [15]. В последнее время, как показали исследования [16–18], суперионные твердые электролиты перспективны как механокалорические материалы – вещества, которые можно использовать в устройствах твердотельного охлаждения.
Однако δ-модификация Bi2O3 устойчива только в диапазоне температур 730–825°C и до настоящего времени ее не удалось сохранить до комнатной температуры закалкой. Поэтому для сохранения суперионных свойств было предпринято множество попыток стабилизации этой модификации при комнатной температуре с помощью легирования и другими способами. Современное состояние проблемы получения твердых электролитов на основе стабилизированной δ-Bi2O3 кратко представлено в работе [19].
Несмотря на успехи, достигнутые в разработке способов синтеза фаз со структурой δ-Bi2O3 разнообразного состава и морфологии, устойчивых при комнатной температуре [12–15, 20–26], получение твердых растворов со структурой δ-Bi2O3 (δ*-фаз) кристаллизацией метастабильного расплава остается перспективным и наиболее технологичным способом. Основой для него являются фазовые диаграммы стабильного и метастабильного равновесий, а δ*-фаза, стабилизированная диоксидом кремния, является перспективным, но недостаточно исследованным метастабильным силикатом висмута.
Фазовая диаграмма стабильного равновесия системы Bi2O3–SiO2, представленная на рис. 1а, построена по результатам РФА и ДТА нагревания предварительно синтезированных образцов. На формирование метастабильного состояния в этой системе решающее влияние оказывает состояние расплава [30]. В [27–31] показано, что на фазовой диаграмме стабильного равновесия системы Bi2O3–SiО2 в области жидкого состояния можно выделить три интервала температур, соответствующих трем температурным зонам расплава: А, В и С (рис. 1а), в которых состояние расплава отличается не только характером температурных зависимостей свойств, но и фазовым составом кристаллов, образующихся при медленном (5–10°С/мин) охлаждении этих расплавов от температур, относящихся к разным температурным зонам. Фазовая диаграмма метастабильного равновесия построена по результатам ДТА при медленном охлаждении расплава от разных температур, лежащих в зоне В (рис. 1б).
Рис. 1.
Фазовые диаграммы стабильного (а, линии 2) и метастабильного (б) равновесий системы Bi2O3–SiO2; границы (линии 1) температурных зон (А, В, С) в области жидкого состояния (а) построены по результатам вискозиметрии расплава при нагревании [30].
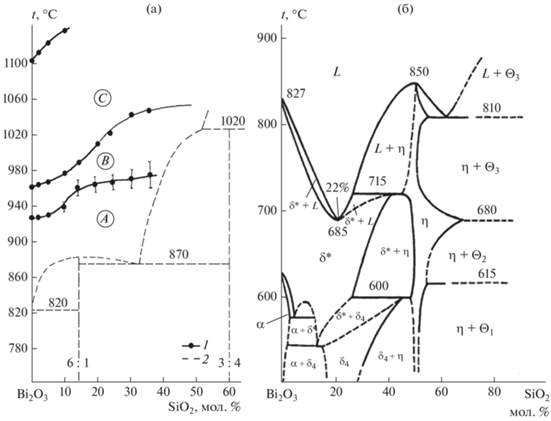
При построении фазовых диаграмм метастабильных равновесий в системах, содержащих Bi2O3, используются в основном результаты ДТА относительно медленно (5–10°С/мин) охлаждаемых расплавов. Закаливание расплавов, как было отмечено в [32, 33], сопровождается экзотермическим эффектом “самораскаливания” и образованием смеси стабильных фаз Bi12GeO20 и Bi4Ge3O12 со структурами силленита и эвлитина соответственно.
Наличие минимума на ликвидусе и солидусе фазовой диаграммы метастабильного равновесия указывает на нулевой температурный интервал кристаллизации метастабильного расплава, что создает условия для получения метастабильных фаз непосредственно из расплава стехиометрического состава. Это преимущество было успешно реализовано при получении монокристалла δ*-фазы в германатной системе аналогичного состава, содержащего 22 мол. % GeO2 [29, 31], что позволило провести нейтронографическое исследование ее структуры [34].
Преимущества, которые имеет синтез метастабильных фаз, делают актуальным еще одно направление исследований, основным содержанием которого является совершенствование процесса формирования метастабильного расплава с помощью его термообработки [35]. До настоящего времени наиболее распространенным процессом получения метастабильных фаз кристаллизацией расплава в оксидных висмут- и свинецсодержащих системах [29, 36–38] является относительно медленное (5–10°С/мин) охлаждение расплавов, нагретых до некоторых критических температур. Конкретное значение этих температур зависит от состава расплава, выявляется экспериментально и определяет температуру начала охлаждения расплава (tнач.охл), обеспечивающую кристаллизацию метастабильных фаз при медленном его охлаждении [27–31, 35]. Закаливание расплавов, как было отмечено выше, без соответствующей термообработки не сохраняет метастабильного состояния.
По этой причине при построении фазовых диаграмм метастабильных равновесий в системах, содержащих Bi2O3, используются в основном результаты ДТА [27–31, 36–39], что, к сожалению, не позволяет получить надежные представления о характере субсолидусных отношений с участием метастабильных фаз. Это ограничение привело, в частности, к появлению диаграмм метастабильного состояния системы Bi2O3–GeO2 [40–42], на которых кристаллизация расплава, содержащего 22 мол. % GeO2, сопровождается формированием не δ*-твердого раствора, а эвтектической смеси. Как показано в [35, 43], изучение с помощью оптической и растровой электронной микроскопии микроструктуры полученных продуктов кристаллизации существенно дополняет результаты их РФА и позволяет надежно определить отсутствие структурных составляющих эвтектики в метастабильных образцах.
Однако следует учитывать отличие δ*-фазы, содержащей 22 мол. % SiO2, от аналогичной фазы в германатной системе, содержащей 22 мол. % GeO2. По данным [30, 31], δ*-фаза в силикатной системе претерпевает эвтектоидный распад при охлаждении в субсолидусной области температур. Присутствие экзотермических эффектов превращения δ*-фазы состава 6Bi2O3 · 1SiO2 при охлаждении обнаружено с помощью термического анализа в [44, 45], хотя в [46] эти процессы не отмечены.
Цель настоящей работы состояла в исследовании влияния различных режимов термообработки расплава, содержащего 78 мол. % Bi2O3 и 22 мол. % SiО2: изотермической выдержки в температурной зоне С, изменения температур начала охлаждения и варьирования скорости охлаждения расплава в разных условиях на фазовый состав, макро- и микроструктуру образующегося δ*-твердого раствора и их изменения в субсолидусной области температур.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные образцы массой 10 г, полученные смешением 78 мол. % оксида висмута(III) в α-модификации квалификации “ос. ч.” и 22 мол. % аморфного оксида кремния(IV) квалификации “ос. ч.”, помещали в платиновый тигель объемом 32 см3, нагревали со скоростью ~20°С/мин в электрической печи сопротивления LMV 02/12 на воздухе до температуры 1100°С, относящейся к зоне С, и выдерживали в изотермических условиях 1 ч.
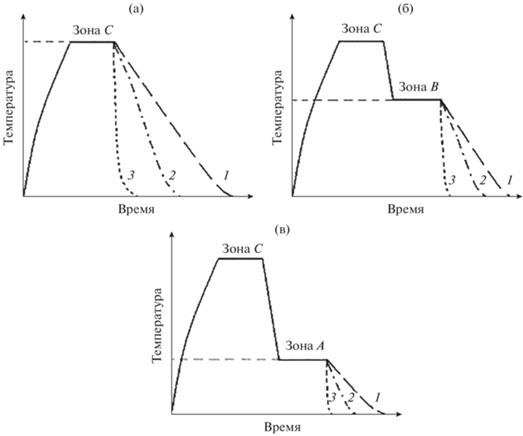
Схемы трех режимов последующей термообработки расплава представлены на рис. 2. В условиях, показанных на рис. 2а, расплав охлаждали различными способами: быстрое извлечение тигля с расплавом из печи и погружение в воду без контакта воды с расплавом – закалка в воду; охлаждение извлеченного из печи тигля с расплавом на воздухе; медленное охлаждение с печью. Для других режимов после изотермической (температура зоны С) выдержки расплав сначала охлаждали до более низкой температуры – зоны В и А, выдерживали определенное время, а затем также охлаждали тремя вышеописанными способами (рис. 2б, 2в). Подобные условия термообработки расплава были использованы в [35].
Рис. 2.
Схема режимов термообработки расплава при различных температурах начала охлаждения (tнач.охл), относящихся к различным температурным зонам (рис. 1): верхняя часть зоны С (а), зона В (б) и зона А (в); 1 – охлаждение с печью, 2 – охлаждение на воздухе, 3 – охлаждение тигля в воде (закалка в воду).
Макроструктуру поверхности образцов наблюдали с помощью стереоскопа Stemi 2000 (Carl Zeiss). Исследование микроструктуры выполняли с использованием оптического микроскопа Carl Zeiss Axio Observer A1m на микрошлифах, полученных после шлифовки, полировки и травления. Растровую электронную микроскопию и локальный рентгеноспектральный анализ (ЛРСА) проводили на настольном микроскопе HITACHI TM3000. Рентгенофазовый анализа (РФА) порошка проводили на дифрактометре Shimadzu XRD 6000 (CuKα-излучение).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
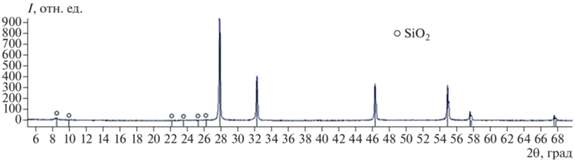
РФА показал (рис. 3), что после термической обработки расплава по всем девяти вариантам охлаждения продуктом его кристаллизации является δ4-Bi2O3 [47] c небольшими примесями (не более 2 мас. %) диоксида кремния в трех модификациях (тетрагональный α-кристобалит, ромбический волокнистый кремнезем и гексагональный β-кварц) [48–50].
Рис. 3.
Дифрактограмма образцов, полученных при кристаллизации расплавов, после термической обработки по всем девяти вариантам из разных температурных зон.
Наибольшее влияние на характер макроструктуры кристаллических образцов оказывает скорость охлаждения. На рис. 4 представлены макроструктуры образцов, полученных кристаллизацией расплавов, охлаждаемых от температуры зоны А. На поверхности образца, полученного при закалке тигля с расплавом (рис. 4а), из-за высоких скоростей охлаждения образуется очень мелкая основная структура, а неоднородности кристаллизации расплава от дна и стенок тигля к центру формируют волнообразный характер текстуры в виде концентрических колец. При охлаждении на поверхности расплава в этих условиях успевают образоваться крупные кристаллы. Эти кристаллы состоят из ромбовидных, расположенных “каскадом”, продольных пластинок.
Рис. 4.
Макроструктура образцов, охлажденных после термической обработки расплава из зоны А: закалкой в воду (а), охлаждением на воздухе (б), охлаждением с печью (в).

Охлаждение на воздухе дает более однородную макроструктуру, но образованную более крупными кристаллами в центральной части тигля и с дендритной ликвацией у его стенок (рис. 4б). Крупные дендриты с хорошо различимыми осями второго порядка образуются и в центральной части. Концентрические кольца в наблюдаемой макроструктуре отсутствуют. При охлаждении расплава с печью в образце формируется макроструктура, состоящая из крупных кристаллов в виде многогранников (рис. 4в). В зависимости от угла освещения и их расположения на фотографии они имеют вид либо черных участков с коричневыми прожилками, либо прозрачных кристаллов. Концентрические кольца также отсутствуют.
Микроструктура образцов, полученных закалкой тигля с расплавом в воду и охлаждением на воздухе, имеет типичный дендритный характер. При закалке в воду (рис. 5а, 5г) из-за высоких скоростей охлаждения дендриты имеют наименьший размер. При охлаждении тигля на воздухе в связи с понижением скорости охлаждения в центре тигля образуются крупные дендриты с хорошо развитыми в стороны осями второго порядка (рис. 5б, 5д). Вблизи стенок тигля дендриты вытянуты в направлении теплоотвода.
Рис. 5.
Микроструктура образцов, полученных охлаждением расплава из зоны С: закалкой тигля с расплавом в воду (а, г), охлаждением на воздухе (б, д), охлаждением с печью (в, е).

При медленном охлаждении с печью (рис. 5в, 5е) микроструктура формируется кристаллитами, стремящимися к равноосной форме, на границах которых наблюдаются широкие участки, образованные продуктами распада. В этих областях распада можно выделить более мелкие, дискретные сферические образования вторичных фаз различных модификаций диоксида кремния, как следует из результатов РФА. Данные образования не видны на микрофотографии при высоких скоростях охлаждения, по-видимому, из-за большей протяженности границ зерен (более мелкая структура), где и будут распределяться вторичные фазы.
При охлаждении расплава от температур других зон наблюдаются аналогичные фазовый состав и характер макро- и микроструктур. Однако в образце, полученном охлаждением с печью из зоны А, заметны сохранившийся дендритный характер микроструктуры и меньшее присутствие вторичных фаз на границах зерен.
Оптическая микроскопия и растровая электронная микроскопия показывают, что границы зерен содержат большое количество трещин и пор (рис. 6а–6в). Результаты ЛРСА (рис. 6г–6е) указывают на то, что мелкие сферические выделения в области границ зерна имеют повышенное содержание кремния при полном отсутствии висмута. Эти элементы микроструктуры и являются модификациями оксида кремния, обнаруженными с помощью РФА и образующимися при распаде δ*-твердого раствора в процессе охлаждения.
Рис. 6.
Результаты растровой электронной микроскопии образца, охлажденного с печью из температурной зоны С (а–в) и результаты картирования – распределения висмута и кремния по площади зерен и на их границах (г–е) (показаны три разных участка образца).

При этом, по результатам ЛРСА, существенного различия по химическому составу между самим зерном и его “широкой” границей не выявлено (табл. 1). Определение элементного состава внутри границы зерна проводилось по площади, как это показано на рис. 6а–6в.
Таблица 1.
Элементный состав зерен и их границ в образце, охлажденном с печью от температуры зоны С, по результатам ЛРСА
| Область | Концентрация, ат. % | |||||
|---|---|---|---|---|---|---|
| среднее значение | диапазон значений | |||||
| Bi | Si | O | Bi | Si | O | |
| Зерно | 43.2 ± 2.8 | 5.4 ± 0.8 | 51.4 ± 2.9 | 37.4–47.0 | 4.3–7.1 | 47.9–57.4 |
| Граница зерна | 41.4 ± 3.1 | 4.1 ± 1.6 | 54.4 ± 3.5 | 36.7–45.9 | 0.6–6.4 | 50.1–60.5 |
Если δ*-фазе, конгруэнтно кристаллизующейся из расплава, содержащего 22 мол. % SiO2, подобрать стехиометрическое соотношение компонентов, то оно будет отвечать составу 7Bi2O3 · 2SiO2, что соответствует формуле Bi14Si2O25. Эта формула имеет элементный состав: Bi – 34 ат. %, Si – 5 ат. %, O – 61 ат. %. Из табл. 1 следует, что элементный состав δ4-фазы, полученный по результатам ЛРСА, лучше соответствует формуле Bi8SiO14, т.е. элементному составу: Bi – 34.7 ат. %, Si – 4.3 ат. %, O – 61 ат. %, что приблизительно соответствует формуле 4Bi2O3 · 1SiO2. Результаты ЛРСА также указывают на перитектоидный характер превращения.
Однако при перитектоидном распаде δ*-фазы SiO2 быть не должно. В соответствии с диаграммой метастабильного равновесия (рис. 1б) при перитектоидном распаде δ*-фазы, содержащей 22 мол. % SiO2, в интервале температур ~580–550°С должно происходить моновариантное превращение
По-видимому, такой же процесс будет происходить и при высоких скоростях охлаждения с образовавшейся из расплава δ*-фазой при закалке тигля с расплавом в воду и при охлаждении его на воздухе (рис 5а, 5б, 5г, 5д).
ЗАКЛЮЧЕНИЕ
Экспериментально установлено, что высокотемпературная изотермическая выдержка расплава, содержащего 78 мол. % Bi2O3 и 22 мол. % SiО2, обеспечивает его перевод при последующем охлаждении в метастабильное состояние вне зависимости от скорости и температуры начала охлаждения, что позволяет надежно обеспечить кристаллизацию метастабильного δ*-твердого раствора со структурой δ-Bi2O3.
Исследован перитектоидный распад δ*-фазы при охлаждении, продуктами которого являются обедненная диоксидом кремния δ4-фаза и кристаллические формы метастабильного SiO2.
Список литературы
Gattow G., Schroder H. Die Kristallstruktur der Hichtemperatur Modification von Wismuth(III)-oxid (δ‑Bi2O3) // Z. Anorg. Allg. Chem. B. 1962. B. 318. № 3–4. S. 172–189.
Harwig H.A. On the Structure of Bismuthsesquioxide: the α, β, γ, and δ Phase // Z. Anorg. Allg. Chem. 1978. B. 444. S. 151–166.
Battle P.D., Catlow C.R.A., Drennan J., Murray A.D. The Structural Properties of the Oxygen Conducting δ Phase of Bi2O3 // J. Phys. C: Solid State Phys. 1983. V. 16. № 17. P. L561–L566.
Jacobs P. Computational Simulations of δ-Bi2O3. I. Disorder // Solid State Ionics. 1987. V. 23. № 4. P. 279–293.
Jacobs P. Computational Simulation of δ-Bi2O3. II. Charge Migration // Solid State Ionics. 1987. V. 23. № 4. P. 295–305.
Jacobs P. Computational Simulation of δ-Bi2O3. III. A Comparative Study of Static Lattice Models // Solid State Ionics. 1987. V. 23. № 4. P. 307–318.
Infante C., Gronemeyer C., Li F. Neutron Diffraction Study of the Oxide Conducting δ*-phase of (Bi2O3)1 − x(Y2O3)x (x = 0.25) // Solid State Ionics. 1987. V. 25. № 1. P. 63–70.
Hull S., Norberg S.T., Tucker M.G., Eriksson S.G., Mohn C.E., Stølen S. Neutron Total Scattering Study of the δ and β Phases of Bi2O3 // Dalton Trans. 2009. V. 40. P. 8737.
Wind J., Mole R.A., Yu D., Ling C.D. Liquid-Like Ionic Diffusion in Solid Bismuth Oxide Revealed by Coherent Quasielastic Neutron Scattering // Chem. Mater. 2017. V. 29. № 17. P. 7408–7415.
Takahashi T., Iwahara H., Nagai Y. High Oxide Ion Conduction in Sintered Bi2O3 Containing SrO, CaO or La2O3 // J. Appl. Electrochem. 1972. V. 2. № 2. P. 97–104.
Takahashi T., Iwahara H. Oxide Ion Conductors Based on Bismuthsesquioxide // Mater. Res. Bull. 1978. V. 13. № 12. P. 1447–1453.
Xiong Y., Dang B., Wang C., Wang H., Zhang S., Sun Q., Xu X. Cellulose Fibers Constructed Convenient Recyclable 3D Graphene-Formicary-like δ-Bi2O3 Aerogels for the Selective Capture of Iodide // ACS Appl. Mater. 2017. V. 9. № 24. P. 20554–20560.
Liu L., Chen N., Lei Y., Xue X., Li L., Wang J., Komarneni S., Zhu H., Yang D. Micro-Nanostructured δ-Bi2O3 with Surface Oxygen Vacancies as Superior Adsorbents for SeOx2− Ions // J. Hazard. Mater. 2018. V. 360. P. 279–287.
Huang C., Hu J., Fan W., Wu X., Qiu X. Porous Cubic Bbismuth Oxide Nanospheres: A Facile Synthesis and Their Conversion to Bismuth During the Reduction of Nitrobenzenes // Chem. Eng. Sci. 2015. V. 131. P. 155–161.
Wang X., Jayathilake R., Taylor D.D., Efrain R.E., Zachariah M.R. Study of C/Doped δ-Bi2O3 Redox Reactions by In-Operando Synchrotron X-ray Diffraction: Bond Energy/Oxygen Vacancy and Reaction Kinetics Relationships // J. Phys. Chem. C. 2018. V. 122. № 16. P. 8796–8803.
Cazorla C., Errandonea D. Giant Mechanocaloric Effects in Fluorite-Structured Superionic Materials // Nano Lett. 2016. V. 16. № 5. P. 3124–3129.
Cazorla C. Novel Mechanocaloric Materials for Solid-state Cooling Applications // Appl. Phys. Rev. 2019. V. 6. P. 041316 (1–16).
Klarbring J. A First-Principles Study of Highly Anharmonic and Dynamically Disordered Solids: Dissertation No. 2072. Linkoping: Linkoping Univ., 2020.
suji K., Herisson de Beauvoir T., Ndayishimiye A., Wang K., Randall C.A. Cold Sintering of Yttria-Stabilized Cubic Bismuth Oxide: Conductivity and Microstructural Evolution of Metastable Grain Boundaries with Annealing // J. Appl. Phys. 2020. V. 128. № 21. P. 215104
Zhang J., Han Q., Wang X., Zhu J., Duan G. Synthesis of δ-Bi2O3 Microflowers and Nanosheets Using CH3COO(BiO) Self-Sacrifice Precursor // Mater. Lett. 2016. V. 162. P. 218–221.
Sudrajat H., Sujaridworakun P. Low-Temperature Synthesis of δ-Bi2O3 Hierarchical Nanostructures Composed of Ultrathin Nanosheets for Efficient Photocatalysis // Mater. Design. 2017. V. 130. P. 501–511.
Xu J., Liu J. Facet-Selective Epitaxial Growth of δ‑Bi2O3 on ZnO Nanowires // Chem. Mater. 2016. V. 28. № 22. P. 8141–8148.
Zhu S., Lu L., Zhao Z., Wang. T., Liu X., Zhang H., Don F., Zhang Y. Mesoporous Ni-Doped δ-Bi2O3 Microspheres for Enhanced Solar-Driven Photocatalysis: A Combined Experimental and Theoretical Tnvestigation // J. Phys. Chem. C. 2017. V. 121. № 17. P. 9394–9401.
Yin Y., Li F, Zhan Q., Jiang D., Chen R. Synthesis of δ-Bi2O3/Bi2MoO6 Composites with Enhanced Photocatalytic Activity by Hydrothermal Method // Mater. Res. Bull. 2018. V. 103. P. 47–54.
Medina J.C., Bizarro M., Silva-Bermudez P., Giorcelli M., Tagliaferro A., Rodil S.E. Photocatalytic Discoloration of Methyl Orange Dye by δ-Bi2O3 thin Films // Thin Solid Films. 2016. V. 612. № 1. P. 72–81.
Fan H.T., Pan S.S., Teng X.M., Ye C., Li G.H., Zhang L.D. δ-Bi2O3 thin Films Prepared by Reactive Sputtering: Fabrication and Characterization // Thin Solid Films. 2006. V. 513. № 1–2. P. 142–147.
Тананаев И.В., Скориков В.М., Каргин Ю.Ф., Жереб В.П. Исследование образования метастабильных фаз в системах Bi2O3–SiO2 (GeO2) // Изв. АН СССР. Неорган. материалы. 1978. Т. 14. № 11. С. 2024–2028.
Жереб В.П., Каргин Ю.Ф., Скориков В.М. Модель строения расплавов в системах Bi2O3–ЭО2 (где Э – Si, Ge) // Изв. АН СССР. Неорган. материалы. 1978. Т. 14. № 11. С. 2028–2032.
Zhereb V.P., Skorikov V.M. Metastable States in Bismuth-Containing Oxide Systems // Inorg. Mater. 2003. V. 39. № l. 2. P. S121–S145.
Каргин Ю.Ф., Жереб В.П., Скориков В.М. Стабильное и метастабильное фазовые равновесия в системе Bi2O3–SiO2 // Журн. неорган. химии. 1991. Т. 36. № 10. С. 2611–2616.
Жереб В.П. Физико-химические исследования метастабильных равновесий в системах Bi2O3–ЭO2, где Э – Si, Ge, Ti: Автореф. дис. … канд. хим. наук. М.: ИОНХ АН СССР, 1980. 22 с.
Сперанская Е.И., Аршакуни А.А. Система окись висмута–двуокись германия // Журн. неорган. химии. 1964. Т. 9. № 2. С. 414–421.
Фомченков Л.П., Майер А.А., Ломонов В.А. Исследование возможности существования силленит-фазы в системах Bi2O3–Me2O3, Bi2O3–P2O5, Bi2O3–MePO4 // Тр. МХТИ им. Д.И. Менделеева. М. 1973. Т. 72. С. 98–101.
Сарин В.А., Жереб В.П., Буш А.А., Каргин Ю.Ф. Нейтроноструктурное исследование строения монокристалла системы Bi2O3–22 мол. % GeO2 // Фундаментальные проблемы радиоэлектронного приборостроения. 2018. Т. 18. № 2. С. 464–466.
Жереб В.П., Бермешев Т.В., Каргин Ю.Ф., Мазурова Е.В., Денисов В.М. Фазовый состав и микроструктура продуктов кристаллизации расплава Bi2O3∙GeO2 при различных условиях охлаждения // Неорган. материалы. 2019. Т. 55. № 7. С. 782–797.
Жереб В.П. Метастабильные состояния в оксидных висмутсодержащих системах. М.: МАКС Пресс, 2003. 162 с.
Denisov V.M., Zhereb V.P., Denisova L.T., El’berg M.S., Storozhenko V.A. Stable and Metastable Phase Equilibria in the Liquid-State and Solid-State PbO–GeO2 System // Inorg. Mater. 2011. V. 47. P. 1428–1449.
Денисова Л.Т., Жереб В.П., Эльберг М.С., Таскин В.Ю. Метастабильные состояния в оксидных свинецсодержащих системах. Красноярск: Научно-инновационный центр, 2019. 118 с.
Corsmit G., Van Driel M.A., Elsenaar R.J., Van De Guchte W., Hoogenboom A.M., Sens J.C. Thermal Analysis of Bismuth Germanate Compounds // J. Cryst. Growth. 1986. V. 75. № 3. P. 551–560.
Tissot P., Lartigue H. Study of the System GeO2–Bi2O3 // Thermochim. Acta. 1988. V. 127. P. 377–383.
Kaplun A.B., Meshalkin A.B. Stable and Metastable Phase Equilibrium in System Bi2O3–GeO2 // J. Cryst. Growth. 1996. V. 167. № 1–2. P. 171–175.
Kaplun A.B., Kidyarov B.I., Meshalkin A.B. Extent of Oxide Compounds Dissociation and Nucleation Kinetics in Melts of the Bi2O3–GeO2 Systems: Experimental Study and Theoretical Analysis // J. Cryst. Growth. 2005. V. 275. № 1–2. P. e169–e175.
Бермешев Т.В., Бабицкий Н.А. Исследование метастабильных фазовых равновесий в субсолидусной области температур системы Bi2O3–GeO2 // Cб. XIV Междунар. науч.-техн. Уральской школы-семинара металловедов – молодых ученых. Екатеринбург: УрФУ им. первого Президента России Б.Н. Ельцина, 2013. С. 50–52.
Fu S., Ozoe H. Solidification Characteristics of Metastable δ-Bi12SiO20 and Stable γ-Bi12SiO20 // J. Phys. D: Appl. Phys. 1996. V. 29. № 7. P. 2032–2043.
Fu S., Ozoe H. Metastable δ-Bi12SiO20 and its Effect on the Quality of Grown Single Crystals of γ-Bi12SiO20 // J. Mater. Res. 1996. V. 11. № 10. P. 2575–2582.
Fei Y.T., Fan S.J., Sun R.Y., Xu J.Y., Ishii M. Crystallizing Behavior of Bi2O3–SiO2 System // J. Mater. Sci. Lett. 2000. V. 19. P. 893–895.
PDF Card – Bi2O3 – 00-027-0052
PDF Card – SiO2 – 01-080-3752
PDF Card – SiO2 – 01-089-8948
PDF Card – Si64O128 – 01-088-1461
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


