Неорганические материалы, 2022, T. 58, № 6, стр. 641-650
Фотокаталитические свойства фосфатов MgHPO4 · 3H2O и MgKPO4 · 6H2O
Д. А. Михайлов 1, *, М. И. Лелет 1, Д. Г. Фукина 1, Ю. Н. Лелет 1
1 Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, пр. Гагарина, 23, Россия
* E-mail: dmitry.mikhailov@mail.ru
Поступила в редакцию 07.10.2021
После доработки 09.02.2022
Принята к публикации 10.02.2022
- EDN: SDQKBP
- DOI: 10.31857/S0002337X22060069
Аннотация
Двойные фосфаты магния, MgHPO4 · 3H2O и MgКPO4 · 6H2O, со структурой минералов ньюберита и струвита-К синтезированы в виде порошка методом соосаждения. Керамика c относительной плотностью ~76% получена методом холодного прессования с последующим отжигом. Максимальная температура спекания составила tmax = 130°С. Методом оптической спектроскопии диффузного отражения поликристаллических образцов были определены ширина запрещенной зоны и энергия поглощения. Для MgHPO4 · 3H2O энергия поглощения составила 3.10 эВ, для MgКPO4 · 6H2O – 3.13 эВ, что соответствует поглощению в областях 400 и 396 нм соответственно. Методом статической вакуумной волюметрии определена удельная поверхность изучаемых порошковых образцов. Полученные значения составили 7.35 и 17.082 м2/г для MgHРO4 · 3H2O и MgKPO4 · 6H2O соответственно. С целью определения фотокаталитической активности исследуемых фосфатов в реакции окисления ароматических углеводородов на примере толуола в парогазовой фазе использовали специально сконструированные испытательные камеры. В ходе испытаний применяли УФ-излучение и излучение в видимом диапазоне спектра. Полученные результаты по фотокаталитическому разложению толуола свидетельствуют о высокой каталитической активности полученных поликристаллических фосфатов. В ходе двухчасового эксперимента с применением облучения видимым светом и УФ-излучения концентрация ароматического углеводорода снизилась на 12.2 и 1.9% для MgHPO4 · 3H2O и на 9.8 и 9.1% для MgКPO4 · 6H2O. Были проведены гидролитические испытания полученных спрессованных образцов в дистиллированной воде при комнатной температуре с целью определения химической устойчивости фосфатов.
ВВЕДЕНИЕ
Фотокаталитические бетоны являются перспективным направлением в строительстве благодаря возможности эффективного решения проблемы загрязнения атмосферного воздуха в городах и самоочистки фасадов зданий [1, 2]. При этом технология изготовления таких бетонов не отличается от обычных бетонов и не требует дополнительного оборудования [1].
Одним из требований ГОСТа на свойства, предъявляемые к фотокаталитическим бетонам [2], является проведение испытаний на их способность к разложению (минерализации) летучих органических веществ на примере, в том числе, толуола. Толуол в данном случае можно рассматривать в качестве модельного вещества при оценке способности фотокаталитических добавок минерализовать полиароматические углеводороды (ПАУ), являющиеся одними из основных компонентов загрязнений атмосферы крупных городов [3, 4]. Они представляют собой органические соединения с двумя и более конденсированными бензольными кольцами в структуре. ПАУ обладают ярко выраженными канцерогенными и мутагенными свойствами [5]. Большое количество ПАУ концентрируется на поверхности мелкодисперсных взвешенных частиц PM2.5, представляющих собой широко распространенный загрязнитель атмосферного воздуха, включающий смесь твердых и жидких частиц размером менее 2.5 мкм, находящихся в воздухе во взвешенном состоянии [6]. При разложении ПАУ в атмосфере могут образовываться органические загрязнители, которые способствуют образованию вторичных аэрозолей, что усугубляет их канцерогенность. По сравнению с распространенными газами-загрязнителями (CO2, NOx) склонность к адсорбции подобных частиц на поверхностях зданий и сооружений намного выше, особенно в больших городах, где их концентрация велика. Именно этот фактор может быть использован при поиске возможных путей уменьшения антропогенного загрязнения, обусловленного повышенными концентрациями ПАУ.
Таким образом, разработка фотокаталитических добавок к бетонам, способных минерализовать различные летучие органические вещества, в том числе ПАУ, на сегодняшний день представляет собой одну из наиболее интересных и востребованных задач для исследователей с точки зрения современного этапа развития экологии и строительных технологий.
В данном ключе перспективными объектами для исследований являются цементы на основе фосфатных связующих и их компоненты, а также добавки к ним. При современном разнообразии строительных материалов они занимают особое место, т.к. служат базой для получения различных видов высокоэффективных жаростойких материалов, отличающихся термостойкостью, прочностью, малой плотностью, стойкостью в агрессивных средах. Одним из преимуществ таких материалов по сравнению с керамическими и огнеупорными является возможность их получения без высокотемпературного обжига [7].
Цементы на основе фосфата магния (MФЦ) получают на основе реакции
(1)
${\text{MgO}} + {\text{K}}{{{\text{H}}}_{2}}{\text{P}}{{{\text{O}}}_{4}} + 5{{{\text{H}}}_{2}}{\text{O}} \to {\text{MgKP}}{{{\text{O}}}_{4}} + 6{{{\text{H}}}_{2}}{\text{O}}{\text{.}}$По сравнению с наиболее распространенным сегодня на рынке портландцементом МФЦ имеют более короткое время схватывания, более высокую прочность на сжатие и адгезию на раннем этапе, а также лучшую долговечность, особенно при низких температурах, что может использоваться при ремонте дорог, взлетно-посадочных полос аэропортов, мостов, туннелей, а также при строительстве в условиях Арктического региона [8].
Цель настоящей работы – исследование порошков и керамики на основе соединений со структурой минералов ньюберита MgHPO4 · 3H2O и струвита-К MgКPO4 · 6H2O, полученных методом соосаждения и холодного прессования, изучение их фотокаталитических характеристик, в том числе способности минерализовать различные летучие органические вещества на примере толуола, а также гидролитической устойчивости.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Фосфат магния MgHPO4 · 3H2O получали методом соосаждения из 12%-ного раствора хлорида магния MgCl2 · 6H2O и 13%-ного раствора гидроортофосфата калия K2HPO4. Раствор хлорида магния объемом 50 мл медленно, по каплям (со скоростью 5 мл/мин через бюретку) добавляли в раствор фосфата калия объемом 50 мл при постоянном перемешивании без нагревания. В результате образовывался белый осадок трехводного гидрофосфата магния MgHPO4 · 3H2O, который оставляли отстаиваться в течение суток, а затем отфильтровывали, промывали бидистиллированной водой, просушивали при 32°С в течение 24 ч.
MgКPO4 · 6H2O получали методом соосаждения из 12%-ного раствора MgCl2 · 6H2O и 13%-ного раствора KH2PO4. Раствор хлорида магния объемом 50 мл медленно, по каплям (со скоростью 5 мл/мин через бюретку) добавляли к раствору фосфата калия объемом 50 мл при постоянном перемешивании без нагревания. Затем в образовавшуюся мутную смесь по каплям добавляли слабоконцентрированный (0.1 М) гидроксид калия до установления pH 7.5. В результате выпадал белый осадок гексагидрата фосфата калия-магния KMgPO4 ∙ 6H2O, который отделяли фильтрованием, промывали бидистиллированной водой и затем сушили при комнатной температуре.
Для синтеза применялись исходные реактивы с квалификацией “х. ч.”.
Получение керамических образцов. Керамические образцы диаметром 10 и высотой 3–5 мм получали методом холодного прессования с последующим спеканием при температуре 130°С. Выдержка при температуре спекания составила 24 ч. Плотность керамических образцов измеряли методом гидростатического взвешивания в дистиллированной воде при помощи весов Sartorius CPA.
Рентгенофазовый анализ. Фазовый состав образцов изучали методом рентгенофазового анализа (РФА) на дифрактометре LabX XRD-6100 (Shimadzu, Япония) и с применением программного обеспечения Match! и PhasanX v.2.0. Для расчета параметров кристаллической решетки и рентгенографической плотности использовали программное обеспечение KRIST. Уточнение структуры проводили по методу Ритвельда с использованием программного обеспечения Topas 3.
Микроструктурный анализ. Микроструктуру и элементный состав образцов исследовали на растровом электронном микроскопе JSM-IT300LV (JEOL, Япония) с энерго- и волнодисперсионным элементным анализаторами.
Определение удельной поверхности. Удельную поверхность порошковых образцов определяли методом статической вакуумной волюметрии с помощью автоматического анализатора площади поверхности Autosorb iQ C (Quantachrome Instruments, США). Перед измерением образцы подвергались дегазации в условиях динамического вакуума (базовое давление 1.33 × 10–4 Па) при температуре 60°C в течение 24 ч с целью предотвращения дегидратации исследуемых кристаллогидратов. Удельную площадь поверхности порошка оценивали по методу БЭТ, используя данные, взятые в диапазоне 0.05 < p/p0 < 0.35.
Измерение спектров диффузного отражения поликристаллических образцов проводили на оптической схеме, включающей в себя галогеновую лампу – источник излучения (2.0–4.5 эВ), монохроматор, систему формирования профиля монохроматизированного светового пучка, интегрирующую сферу и ФЭУ с блоком АЦП. Образец помещался внутрь интегрирующей сферы перпендикулярно падающему пучку. Детектор располагался под углом 90° к линии, соединяющей входное отверстие сферы и образец. Для определения оптической ширины запрещенной зоны кристаллических полупроводников использовалась функция Кубелка-Мунка $F\left( {{{R}_{\infty }}} \right)$, которая пропорциональна коэффициенту поглощения α:
(2)
$F\left( {{{R}_{\infty }}} \right) = \frac{{{{{\left( {1 - {{R}_{\infty }}} \right)}}^{2}}}}{{2{{R}_{\infty }}}} = \frac{k}{s},$k – величина, пропорциональная натуральному коэффициенту экстинкции образца, определяемому законом Ламберта-Бэра;
s – коэффициент рассеяния, который предполагается не зависящим от длины волны.
Коэффициент поглощения $\left( {\alpha \sim \frac{k}{s}} \right)$ для прямозонного полупроводника связан с шириной запрещенной зоны соотношением
где λ – длина волны, h – постоянная Планка, $C{\kern 1pt} '$ – коэффициент пропорциональности (константа), ν – частота падающего света.На графике $F{{\left( {{{R}_{\infty }}} \right)}^{2}}$= f(hν) выделяется линейный участок, который экстраполируется до пересечения с осью абсцисс. Точка пересечения соответствует величине Eg.
Определение фотокаталитической активности исследуемых соединений в реакции окисления ароматических углеводородов (в данной работе – толуола) проводили с применением УФ-излучения и излучения в видимом диапазоне спектра. Для этого авторами были сконструированы и апробированы две испытательные камеры, представляющие собой несколько устройств, объединенных в одну установку, состоящую из следующих основных блоков:
1) рабочей камеры объемом 14.48 дм3 с установленным на крышке светодиодным источником белого света;
2) рабочей камерой объемом 14.84 дм3 с вмонтированным в боковую стенку окном из кварцевого стекла для пропускания жесткого УФ-излучения;
3) понижающего трансформатора (входное напряжение 220 В; выходное – регулируемый диапазон 0–15 В) для управления скоростью вращения конвекционных вентиляторов для эффективного испарения ароматического углеводорода и гомогенизации парогазовой фазы в рабочем объеме;
4) УФ-лампы ДРШ-250-3 в защитном корпусе с блоком розжига (блоком питания) ЛОМО.
На рис. 1 представлен внешний вид установки в сборе с испытательной камерой объемом 14.48 дм3 с установленным на крышке светодиодным источником белого света. Камера состоит из крышки и корпуса, герметизируемых с помощью силиконовых уплотнителей. Материал камеры – силикатное стекло, затемненное металлизированной клейкой лентой с алюминиевым покрытием, не пропускающее видимое и УФ-излучение в камеру и из нее. Излучение в видимой части оптического спектра поступает в рабочую камеру от светодиодной панели, установленной при помощи алюминиевого профиля на крышке камеры, через материал крышки (поликарбонатное стекло). Излучающими элементами одной панели служат 28 светодиодов HPL-H44TU1BA-V2 с суммарной излучаемой мощностью порядка 30 Вт и максимумом излучения 415 нм. На камере смонтированы две панели. Светодиоды смонтированы в герметичном корпусе с радиатором пассивного воздушного конвективного охлаждения, поддерживающего рабочую температуру блока излучения на уровне 28–32°С при нормальных условиях в помещении. Все стыковые и врезные соединения обработаны инертным термостойким силиконовым герметиком. Исследуемое вещество (фотокатализатор) и ароматический углеводород помещаются на дно камеры в чашке Петри из силикатного стекла.
Рис. 1.
Рабочая камера для исследования фотокаталитической активности поликристаллических образцов в видимом диапазоне спектра в парогазовой фазе: а – общий вид установки (рабочая камера, LED-источник света, БП системы циркуляции), б – рабочее пространство камеры (чашка Петри для пробы, чашка Петри для ароматических углеводородов).

На рис. 2 представлен внешний вид установки в сборе с испытательной камерой объемом 14.84 дм3 с вмонтированным в боковую стенку окном из кварцевого стекла для пропускания УФ-излучения. Камера состоит из крышки и корпуса, герметизируемых с помощью силиконовых уплотнителей. Материал камеры – силикатное стекло, затемненное металлизированной клейкой лентой с алюминиевым покрытием, не пропускающее видимое и УФ-излучение в камеру и из нее. УФ-излучение от лампы ДРШ-250-3 поступает в рабочую камеру через отверстие в лицевой части корпуса лампы, затем через отражающий раструб и впускное окно из кварцевого стекла. Подача питания и розжиг лампы осуществляются с использованием блока питания “ЛОМО Блок питания лампы ДРШ-250-3”. Держатель для исследуемого вещества смонтирован на стенке, противоположенной впускному окну.
Рис. 2.
Установка (камера) для исследования фотокаталитической активности поликристаллических образцов в УФ-спектре в парогазовой фазе: а – общий вид установки (рабочая камера, УФ-лампа в корпусе, блок розжига, система охлаждения лампы, БП системы циркуляции), б – рабочее пространство камеры (УФ-прозрачное окно из кварцевого стекла, держатель пробы, чашка Петри для ароматических углеводородов).

Испарение толуола и гомогенизация парогазовой фазы по его концентрации осуществляются с помощью изменения оборотов вращения интегрированного в крышку камеры вентилятора.
Пробоотборный узел с заглушкой, смонтированный на крышке камер, представляет собой герметичный пластиковый канал с установленными сменными хроматографической септой и клапаном (поливинилхлоридная пленка). Пробоотбор осуществляется с применением газоупорных хроматографических шприцов путем прокалывания клапана/септы и забора пробы гомогенизированной парогазовой фазы из испытательной камеры.
Анализ парогазовой фазы, включающий количественное определение содержания толуола, выполняли при помощи газового хроматографа Хромос ГХ-1000 (ЗАО “Химаналитсервис”, Россия) с детектором электронного захвата, позволяющим селективно определять летучие органические компоненты в индивидуальном виде и смесях. Прибор оборудован капиллярным испарителем для ввода жидких и газообразных проб (максимальная температура до 450°С) и обеспечивает термостатирование хроматографических колонок с точностью поддержания температуры ±0.01°С в области рабочих температур от 5 до 450°С. Предел детектирования по Линдану составляет 1.0 × 10–14 г/с. Параметры используемой хратоматографической колонки: RESTEK RtxWax, наполнитель – полиэтиленгликоль, длина 30 м, 0.25 мм ID, 0.25 мкм df.
Гидролитические исследования образцов керамики проводили в деминерализованной воде (степень чистоты 2 в соответствии с ГОСТ Р 52501-2005) при комнатной температуре в течение 14 дней. Анализ воды на содержание ионов K+, Mg2+, P5+ выполняли на атомно-эмиссионном спектрометре с индуктивно связанной плазмой Prodigy High Dispersion ICP (Teledyne Leeman Labs., США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
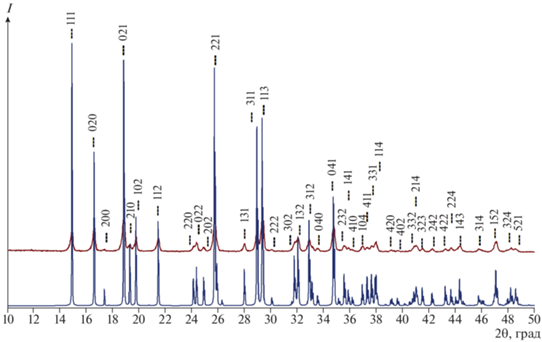
Рентгенофазовый анализ. Согласно данным РФА (рис. 3), полученный поликристаллический образец представлял собой однофазный фосфат магния MgHPO4 · 3H2O со структурой минерала ньюберита (ICDD PDF 2004 #35-0780, пр. гр. Pbca, a = 10.202498 ± 0.000023 Å, b = 10.678481 ± 0.000012 Å, c = 10.014912 ± 0.000024 Å) с рентгенографической плотностью 2.1218 ± 0.0131 г/см3.
Рис. 3.
Результаты РФА порошка MgHPO4 · 3H2O после синтеза в сравнении с расчетной рентгенограммой аналога.
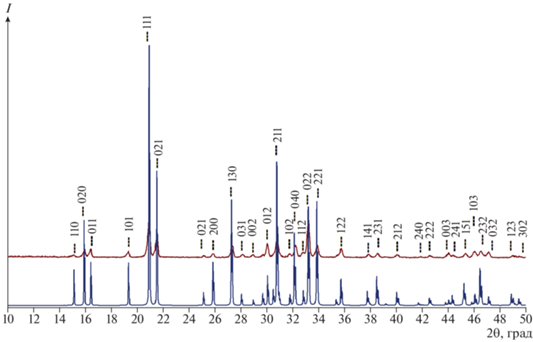
Согласно данным РФА (рис. 4), полученный поликристаллический образец представлял собой однофазный MgKPO4 · 6H2O со структурой минерала струвита-К (ICDD PDF 2004 #35-0812, пр. гр. Pmn21, a = 6.888722 ± 0.000012 Å, b = 6.165956 ± ± 0.000043 Å, c = 11.139896 ± 0.000011 Å) с рентгенографической плотностью 1.8021 ± 0.0098 г/см3.
Рис. 4.
Результаты РФА порошка MgKPO4 · 6H2O после синтеза в сравнении с расчетной рентгенограммой аналога.
Подробное описания уточнения кристаллической структуры и параметров ячейки полученных соединений по методу Ритвельда представлено в работе [9].
Микроструктурный анализ. РЭМ-снимки синтезированных поликристаллических соединений представлены на рис. 5 и 6. Видно, что частицы порошка крупные (75–100 мкм) для MgHPO4 · 3H2O и субмикронного характера (<10 мкм) для MgKPO4 · · 6H2O.
Данные картирования по элементам (рис. 7) свидетельствуют о равномерном распределении и отсутствии примесей в составе полученных фосфатов, что хорошо согласуется с результатами РФА.
Рис. 7.
Данные элементного микроанализатора РЭМ (картирование) для фосфатов MgHPO4 · 3H2O (а) и MgКPO4 · 6H2O (б).

Удельная поверхность. Значения удельной поверхности, определенные методом статической вакуумной волюметрии, составили 7.35 и 17.082 м2/г для фосфатов MgHPO4 · 3H2O и MgКPO4 · 6H2O соответственно, что хорошо согласуется с данными РЭМ. Необходимо отметить, что высокая удельная поверхность является важным требованием для эффективной работы твердотельных фотокатализаторов в парогазовой фазе.
Спектры диффузного отражения. Для определения энергии (ширины) запрещенной зоны Eg полупроводниковых соединений, являющихся фотокатализаторами, были записаны спектры диффузного отражения (рис. 8а, 8б). Путем графического анализа полученных зависимостей коэффициента поглощения для прямозонного полупроводникового материала от длины волны (рис. 8в, 8г) были получены следующие величины энергии запрещенной зоны исследуемых фосфатов: 3.10 и 3.13 эВ для MgHPO4 · 3H2O и KMgPO4 · 6H2O соответственно.
Рис. 8.
Спектры диффузного отражения (функция Кубелки-Мунка) (а, б) и графики $F{{\left( {{{R}_{\infty }}} \right)}^{2}}$ = f(hν) (в, г) KMgPO4 · 6H2O (а, в) MgHPO4 · 3H2O (б, г).
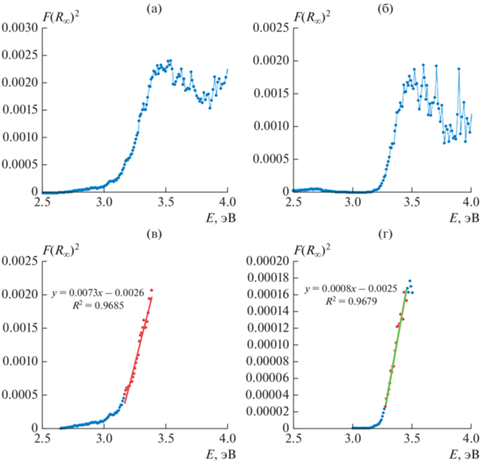
Видно, что соединения MgHPO4 · 3H2O и KMgPO4 · 6H2O имеют край фундаментального поглощения в ближней УФ-области ~ 390–400 нм.
В работах [10–12] показано, что существует линейная корреляция между электроотрицательностью атомов в определении по Пирсону (электрохимический потенциал атомов χ), составляющих оксидные соединения, и сродством к электрону соединения (EA). Если принять, что положение уровня Ферми соединения будет располагаться посередине между уровнем проводимости и краем валентной зоны, то величина сродства к электрону составит [13, 14]:
Электроотрицательность соединения в данном случае рассчитывается по формуле
где p – число атомов, k = 1, 2, 3…, χk – электроотрицательность атома [1].
Таким образом, уровень проводимости и край валентной зоны полупроводников в водном растворе будут равны соответственно
(6)
${{E}_{c}} = - \chi + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}\,{{E}_{g}} - {{E}_{0}},$(7)
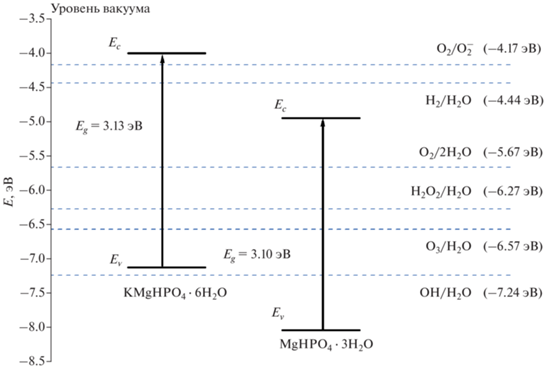
${{E}_{v}} = - \chi - {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}\,{{E}_{g}} - {{E}_{0}},$Схематичная энергетическая зонная диаграмма полученных соединений представлена на рис. 9.
Таким образом, полученные фосфаты будут обладать способностью к фотокаталитическому окислению органических соединений в водной и парогазовой средах, так как стандартные окислительно-восстановительные потенциалы O2/H2O (1.23 В, –5.67 эВ относительно уровня вакуума), H2O2/H2O (1.77 В, –6.27 эВ относительно уровня вакуума) и O3/H2O (2.07 В, –6.57 эВ относительно уровня вакуума) располагаются между уровнем валентной зоны и дном зоны проводимости этих соединений. Однако только фосфат MgKPO4 · 6H2O будет способен к разложению воды до водорода, так как его запрещенная зона перекрывает стандартный окислительно-восстановительный потенциал реакции 2Н+/Н2 (0.00 В, –4.44 эВ относительно уровня вакуума).
Фотокаталитическая активность. Для определения эффективности исследуемых поликристаллических соединений в качестве фотокатализаторов был проведен следующий эксперимент. В испытательную камеру в чашку Петри помещали летучий ароматический углеводород (толуол) и исследуемое поликристаллическое соединение. Масса навески составляла в каждом эксперименте 2.0 г. Весь образец был однородно-тонким слоем распределен по поверхности прободержателя (чашки Петри). После размещения всех компонентов внутри рабочего объема камеры ее герметизировали.
Для осуществления испарения и гомогенизации парогазовой фазы по концентрации толуола использовали вентилятор. Опытным путем устанавливали скорость вращения, регулируя подаваемое напряжение с помощью понижающего трансформатора. По истечении 60 мин после полного испарения толуола (факт полного испарения толуола из прободержателя в течение 60 мин был установлен экспериментально в ходе предварительных испытаний) проводили отбор нулевой пробы и определяли концентрацию толуола в парогазовой фазе. Спустя 2 ч проводили отбор повторной пробы. Эксперимент по определению фотокаталитической активности начинали путем подачи питания на источник УФ-излучения или видимого света. Эксперимент продолжали 2 ч, затем источник излучения отключали, проводили отбор пробы и определяли концентрацию толуола в парогазовой фазе.
После окончания эксперимента испытательные камеры разгерметизировали, осуществляли продувку от паров толуола в вытяжном шкафу. Навески образцов исследуемых соединений взвешивали и устанавливали факт наличия или отсутствия изменения массы.
Результаты испытаний исследуемых образцов на примере толуола свидетельствуют об их относительно высокой фотокаталической активности. В ходе двухчасового эксперимента с применением облучения видимым светом и УФ-излучения концентрация ароматического углеводорода снизилась на 12.2 и 1.9% для MgHPO4 · 3H2O и на 9.8 и 9.1% в случае MgКPO4 · 6H2O.
Гидролитические испытания керамических образцов. Полученные путем отжига при 130°С в течение 24 ч спрессованные керамические образцы отличались низкой относительной плотностью и высокой пористостью. Столь низкая температура термической обработки была обоснована тем фактом, что согласно данным синхронного термического анализа [9], полученные соединения MgHPO4 · 3H2O и MgKPO4 · 6H2O обладают термической и фазовой устойчивостью до 127 и 145°С соответственно. Дальнейшее нагревание приводит к полной дегидратации кристаллогидратов с образованием смеси фосфатов.
Высокая пористость негативно повлияла на ход гидролитических испытаний, результаты которых показали, что исследуемые керамические образцы нестабильны в дистиллированной воде в статических условиях при комнатной температуре. Происходило разрушение образцов и частичное растворение образовавшегося порошка уже после 48 ч эксперимента.
ЗАКЛЮЧЕНИЕ
Двойные фосфаты магния со структурой минералов ньюберита и струвита-К (MgHPO4 · 3H2O и MgКPO4 · 6H2O) были синтезированы в виде однофазного порошка методом соосаждения. Параметры ячейки уточнены методом Ритвельда. Установлены фазовая чистота и элементная однородность порошков.
Керамику c относительной плотностью ~76% получили методом холодного прессования с последующим обжигом при tmax = 130°С. Образцы проявили низкую гидролитическую устойчивость из-за низкой относительной плотности (~76%) и высокой пористости.
Методом статической вакуумной волюметрии определили удельную поверхность порошков. Полученные значения составили 7.35 и 17.082 м2/г для MgHO4 · 3H2O и MgКPO4 · 6H2O соответственно.
Методом оптической спектроскопии диффузного отражения поликристаллических образцов была определена ширина запрещенной зоны: для MgHPO4 · 3H2O – 3.10 эВ, для MgКPO4 · 6H2O – 3.13 эВ, что соответствует поглощению в областях 400 и 396 нм соответственно.
Полученные результаты по фотокаталитическому разложению толуола свидетельствуют о высокой каталитической активности полученных поликристаллических фосфатов. В ходе двухчасового эксперимента с применением облучения видимым светом и УФ-излучения концентрация ароматического углеводорода снизилась соответственно на 12.2 и 1.9% для MgHPO4 · 3H2O и на 9.8 и 9.1% для MgКPO4 · 6H2O.
Список литературы
Слесарев М.Ю., Попов К.В. Исследование эффективности применения фотокаталитических бетонов в городском строительстве // Современное строительство и архитектура. 2017. Т. 3. № 7. С. 18–20. https://doi.org/10.18454/mca.2017.07.4
ГОСТ Р 57255-2016 Бетоны фотокаталитически активные самоочищающиеся. Технические условия. М.: Стандартинформ, 2016. 20 с.
Cabrerizo A., Dachs J., Barceló D., Jones K.C. Influence of Organic Matter Content and Human Activities on the Occurrence of Organic Pollutants in Antarctic Soils, Lichens, Grass, and Mosses // Environ. Sci. Technol. 2012. V. 46. № 3. P. 1396–1405. https://doi.org/10.1021/es203425b
Thongsanit P., Jinsart W., Hooper B., Hooper M., Limpaseni W. Atmospheric Particulate Matter and Polycyclic Aromatic Hydrocarbons for PM10 and Size-Segregated Samples in Bangkok // J. Air Waste Manage. Assoc. 2003. V. 53. № 12. P. 1490–1498. https://doi.org/10.1080/10473289.2003.10466325
Hayakawa K. Environmental Behaviors and Toxicities of Polycyclic Aromatic Hydrocarbons and Nitropolycyclic Aromatic Hydrocarbons // Chem. Pharm. Bull. (Tokyo). 2016. V. 64. № 2. P. 83–94. https://doi.org/10.1248/cpb.c15-00801
Air quality guidelines for particulate matter, ozone, nitrogen dioxide and sulfur dioxide. Global update 2005. Summary of risk assessment. WHO/SDE/PHE/ OEH/06.02. World Heath Organization, 2005. 20 p.
Копейкин В.А., Петрова А.П., Рашкован И.Л. Материалы на основе металлофосфатов. М.: Химия, 1976. 200 с.
Sun D., Wu K., Kang W., Shi H., Li S. Characterisation of Water Stability of Magnesium Phosphate Cement Blended with Steel Slag and Fly Ash // Adv. Cement Res. 2020. V. 32. № 6. P. 251–261. https://doi.org/10.1680/jadcr.18.00067
Lelet M.I., Yakun’kova M.L., Mikhailov D.A., Lelet J.N. An Experimental Calorimetric Study of Thermodynamic Properties of Two Magnesium Phosphates, ${\text{MgHP}}{{{\text{O}}}_{4}} \cdot 3{{{\text{H}}}_{2}}{\text{O}}$ and ${\text{MgKP}}{{{\text{O}}}_{4}} \cdot 6{{{\text{H}}}_{2}}{\text{O}}$ // J. Chem. Eng. Data. 2021. V. 66. №. 7. P. 2723–2732. https://doi.org/10.1021/acs.jced.1c0006710.1021/acs.jced.1c00067
Butler M.A., Ginley D.S. Correlation of Photosensitive Electrode Properties with Electronegativity // Chem. Phys. Lett. 1977. V. 47. № 2. P. 319–321. https://doi.org/10.1016/0009-2614(77)80027-4
Butler M.A. Photoelectrolysis and Physical Properties of the Semiconducting Electrode WO3 // J. Appl. Phys. 1977. V. 48. № 5. P. 1914–1920. https://doi.org/10.1063/1.323948
Butler M.A., Ginley D.S. Prediction of Flatband Potentials at Semiconductor − Electrolyte Interfaces from Atomic Electronegativities // J. Electrochem. Soc. 1978. V. 125. № 2. P. 228–232.
Zahedi E., Hojamberdiev M. A first–Principles Study on Polar Hexagonal Cs2TeM3O12 (M = W, Mo): New Visible–Light Responsive Photocatalyst // J. Solid State Chem. 2017. V. 252. P. 129–137. https://doi.org/10.1016/j.jssc.2017.05.014
Xu Y., Schoonen M.A. The Absolute Energy Positions of Conduction and Valence Bands of Selected Semiconducting Minerals // Am. Mineral. 2000. V. 85. P. 543–556. https://doi.org/10.2138/am-2000-0416
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы