Неорганические материалы, 2022, T. 58, № 9, стр. 998-1016
Кинетика фазообразования и кристаллизации пирохлоров Ln2Ti2O7 (Ln = Gd, Lu) из наноразмерных прекурсоров
А. В. Шляхтина 1, *, **, Г. А. Воробьева 1, А. В. Леонов 2, А. Н. Щеголихин 3, С. А. Черняк 2, Е. Д. Балдин 1, А. Н. Стрелецкий 1
1 Федеральный исследовательский центр химической физики
им. Н.Н. Семенова Российской академии наук
119991 Москва, ул. Косыгина, 4, Россия
2 Московский государственный университет им. М.В. Ломоносова
119991 Москва,
Ленинские горы, 1, Россия
3 Институт биохимической физики им. Н.М. Эмануэля Российской
академии наук
119991 Москва, ул. Косыгина, 4, Россия
* E-mail: annashl@inbox.ru
** E-mail: annash@chph.ras.ru
Поступила в редакцию 05.04.2022
После доработки 07.07.2022
Принята к публикации 07.07.2022
- EDN: FBJHWS
- DOI: 10.31857/S0002337X22090123
Аннотация
Методами рентгеновской дифракции, рамановской спектроскопии и люминесценции, СЭМ, калориметрии (ДСК), масс-спектроскопии и количественной термогравиметрии (ТГ) проанализирована кинетика фазообразования и кристаллизации пирохлоров Ln2Ti2O7 (Ln = Gd, Lu) из наноразмерных прекурсоров, полученных методом соосаждения, и установлено, что фазообразование пирохлоров проходит стадию кристаллизации наноразмерного флюорита. Оказалось, что исходные смеси в значительной мере находятся не в виде оксидов, а в виде гидроксидов и гидроксокарбонатов. Первой стадией синтеза при температурах ниже 550–650°С является разложение исходных соединений до оксида титана и оксикарбоната лютеция (или гадолиния). На второй стадии происходит синтез конечных соединений, сопровождающийся также выделением СО2. Таким образом, “высокотемпературное” выделение СО2 позволяет визуализировать кинетику протекающего синтеза. Специальными опытами по длительному прогреву при низких температурах (540 ч при 550°С и 216 ч при 700°С) показано, что синтез Lu2Ti2O7 из исходных прекурсоров удается провести почти полностью уже при 550°С. Факт высокой степени превращения при 550°С подтвержден методом количественной ТГ. Методами рамановской спектроскопии и люминесценции доказано, что синтезированный при 550°С разупорядоченный нанооксид с размерами ОКР 15 Å является флюоритом. Длительная термообработка при 700°С сопровождается ростом ОКР и переходом флюорита в пирохлор. В условиях прогрева исходного прекурсора с большой скоростью 10°С/мин (ДСК, ТГ) все процессы смещаются в сторону более высоких температур. Процесс формирования конечного пирохлора Ln2Ti2O7 (Ln = Gd, Lu) через стадию наноразмерного флюорита характерен для обеих систем. Таким образом, все пирохлоры типа 3+/4+ Ln2M2O7 (M = Ti, Zr, Hf) образуются в результате перехода типа порядок—беспорядок из наноразмерного флюорита в пирохлор.
ВВЕДЕНИЕ
Сложные оксиды Ln2M2O7 (Ln = La – Lu, M = = Ti, Zr, Hf, Sn) относятся к большому классу соединений со структурой пирохлора и демонстрируют разнообразные структурные, химические и физические свойства. Соединения со структурой пирохлора являются перспективной керамикой для создания твердых электролитов для высокотемпературных твердооксидных топливных элементов [1–6]. Помимо этого, пирохлоры проявляют высокую каталитическую активность [7], люминесцентные свойства [8], высокую устойчивость к радиации [9, 10].
Большинство важных свойств пирохлоров (в общем виде формула может быть записана как A2B2O7) зависит от реализации разной степени структурного порядка в катионной и анионной подрешетках. Последнее связано с тем, что структура пирохлора является производной от базовой структуры флюорита. Образование пирохлора или флюорита зависит от соотношения t(RA/RB) ионных радиусов катионов в А- и В-позициях. Когда t < 1.46, соединения A2B2O7 стабилизируются в структуре дефектного флюорита (пр. гр. Fm3m) или сильно разупорядоченного пирохлора. Когда 1.46 < t < 1.78, происходит стабилизация упорядоченного пирохлора (пр. гр. Fd3m) [11, 12]. Основное структурное отличие между фазами заключается в том, что у пирохлора две различные катионные позиции: A – в центре искаженного куба (скаленоэдра), B – в центре искаженного октаэдра (тригональной антипризмы) – и три различные анионные позиции: 48f (O1), 8a (O2) и 8b (O3). Координационные числа полиэдров в пирохлоре – 8 для AO8-полиэдра и 6 для BO6-полиэдра. Во флюорите все катионные и анионные позиции одинаковы и 1/8 часть анионов в 8b-позиции отсутствует; координационное число становится равным 7 для полиэдров AO7 и BO7. Для Lu2Ti2O7t = 1.46, для Gd2Ti2O7t = 1.40. Следовательно, Lu2Ti2O7 ближе к области упорядоченных пирохлоров, чем Gd2Ti2O7.
Титанаты РЗЭ синтезируют различными методами, в числе которых традиционный твердофазный синтез из оксидов [10, 13], соосаждение [4, 14–16], гидротермальный метод [17], золь—гель-процесс (c последующей высокотемпературной термообработкой) [18].
Прекурсоры, полученные методами “мокрой” химии и некоторыми другими, как правило, являются наноразмерными [19–22]. Известно, что наноматериалы по своей природе неоднородны и состоят из объемных зерен и границ зерен с высокой протяженностью. Высокая доля дефектных межзеренных границ в материале может приводить к усилению таких важных свойств, как ионная проводимость, люминесценция, устойчивость к радиационному излучению [19, 20]. Известно, что в наноразмерном станнате иттрия Y2Sn2O7 связь A–O (Y–O) отличается высокой степенью ковалентности и поэтому наблюдается высокая степень искажения полиэдров BO6 (SnO6) по сравнению с объемным материалом [21]. При сравнении наноразмерного и объемного люминофоров – вольфрамата, легированного европием ZnWO4:Eu3+ – установлено, что первый обладает более высокой термической стабильностью за счет однородности частиц в наноразмерных соединениях [22].
Процесс формирования пирохлоров Ln2M2O7 (Ln = Sm–Lu; M = Ti, Zr, Hf) из рентгеноаморфных прекурсоров широко изучен в связи с тем, что, благодаря формированию упорядоченного пирохлора из рентгеноаморфного состояния через стадию наноразмерного флюорита, появляется возможность исследования свойств материалов, находящихся в наноразмерном состоянии (~10–40 нм), и сравнения их со свойствами тех же материалов с более крупными зернами (до ~200 нм), в которых вклад границ заметно меньше (т.н. объемных материалов).
Процесс кристаллизации упорядоченного пирохлора проходит несколько стадий: рентгеноаморфная фаза → флюорит → пирохлор. Процесс этот сложный, поскольку при повышении температуры происходят одновременно рост наночастиц, формирование фазы флюорита и на ее основе фазы пирохлора (изменения в ближнем (локальном) и дальнем порядке). Структура с ближним порядком может быть пирохлором, а с дальним – флюоритом [23–26], т.е. наряду с ростом кристаллитов происходят изменения локальной структуры (ближняя координационная сфера атомов) и общей структуры (дальний порядок – средняя структура для нескольких тысяч атомных ячеек [26]).
Существуют разногласия авторов о природе образования пирохлора из наноразмерных гомогенных прекурсоров для титанатов, цирконатов и гафнатов РЗЭ [15, 16, 23, 25, 27]. Некоторые авторы [23] считают, что, например, при механосинтезе Gd2Ti2O7 из оксидов уже в процессе помола образуются упорядоченные нанодомены со структурой пирохлора, растворенные в матрице флюорита. В то же время установлено, что при фазообразовании цирконата и гафната гадолиния Gd2M2O7 (M = Zr, Hf) из аморфной фазы сначала образуется флюорит, а затем уже из него формируется пирохлор [16, 25, 27].
Процесс перехода пирохлор–флюорит (порядок–беспорядок) изучали в этих же системах с помощью других методов, среди которых следует выделить метод структурного разупорядочения. При последовательном изовалентном замещении титана цирконием в серии Gd2(Ti1−yZry)2O7 (tсинт = = 1600°С) происходит структурная перестройка типа порядок–беспорядок, при этом первый член Gd2Ti2O7 является упорядоченным пирохлором, а последний Gd2Zr2O7 – флюоритом [28]. Таким же образом исследована серия Y2(Ti1−yZry)2O7, крайние члены которой представляют также собой упорядоченный пирохлор и дефектный флюорит соответственно [24].
Для исследования переходов типа порядок– беспорядок в пирохлорах используют также радиационное излучение. Большое количество работ на эту тему связано с тем, что пирохлор является одним из целого ряда материалов, предложенных для иммобилизации ядерных отходов, в частности Pu [29]. Однако следует подчеркнуть, что механизмы структурного разупорядочения при использовании изовалентного замещения (например, в Gd2(Ti1−yZry)2O7) и радиационного разупорядочения пирохлоров отличаются друг от друга. Весьма показательной является работа [28], авторы которой сопоставили с помощью спектроскопических методов (рамановская спектроскопия, XANES-спектроскопия (тонкая структура ближнего края поглощения рентгеновских лучей)) эффекты композиционного и радиационного разупорядочения в серии Gd2(Ti1−yZry)2O7. Колебательные спектры показывают, что как анионный, так и катионный беспорядок предшествуют фазовому переходу, обусловленному изменением состава, но катионный беспорядок доминирует в случае воздействия радиационного излучения. Прямое заимствование спектроскопических данных, характеризующих переходы порядок–беспорядок при использовании этих методов для изучения процессов кристаллизации пирохлоров из наноразмерных прекурсоров [15, 16, 25], не является корректным, на наш взгляд, поскольку механизм разупорядочения в каждом случае свой [15, 16, 25, 28, 30–33].
Интересно также, что при исследовании процессов упорядочения при кристаллизации в цирконатах и гафнатах РЗЭ из нанопрекурсоров практически все авторы сходятся в том, что переход из аморфной фазы в упорядоченный пирохлор происходит через промежуточную стадию образования дефектного флюорита. Основные противоречия возникают при исследовании кристаллизации пирохлоров – титанатов РЗЭ-методом рамановской спектроскопии. Основной характеристикой разупорядоченного флюорита в этом случае является наличие сильной полосы ~750 см–1 [24, 33], тогда как при образовании пирохлора эта полоса исчезает. Авторы [15, 16, 25] полагают на основе данных не только рамановской, но и XANES-спектроскопии, что это мнение ошибочно.
Важно подчеркнуть, что при исследовании кристаллизации пирохлоров из наноразмерных прекурсоров авторы уделяют незначительное внимание присутствию карбонатов и гидроксидов РЗЭ в прекурсоре и их роли в образовании упорядоченного пирохлора. Мы нашли упоминание об этом в [15], где методами РФА и рамановской спектроскопии показано, что два типа синтезированных разными методами прекурсоров Ln2Ti2O7 (Ln = Gd, Tb, Dy) являются по сути смесью аморфных гидроксокарбонатов Ln-Ti. При этом отмечены нарушение стехиометрии в конечном продукте и наличие до 3 мас. % углерода, причем примесь графита подтверждается данными РФА и РСА [15]. Нарушение стехиометрии и присутствие углерода в образцах, синтезированных методом соосаждения, по-видимому, связаны с тем, что в процессе совместного осаждения гидроксидов РЗЭ и гидроксида титана на воздухе Ln(OH)3 поглощают CO2 и частично превращаются в рентгеноаморфные основные карбонаты РЗЭ Ln2O3⋅2CO2⋅2H2O [34], LnOHCO3⋅nH2O и гидроксокарбонаты Ln2(CO3)2(OH)2(3–x)⋅nH2O [13, 35–37]. Это происходит в системах Ln2O3–H2O–CO2 даже при очень малых парциальных давлениях CO2 [11]. В основных карбонатах легких РЗЭ (Ln = La–Eu) соотношение CO2/Ln2O3 ~ 2, для тяжелых это соотношение в два раза меньше [13, 34]. Основным лигандом в гидроксокарбонатах LnOHCO3⋅nH2O является OH–-группа, а группы ${\text{CO}}_{3}^{{2 - }}$ удерживаются в структуре в значительной степени водородными связями [35]. Процесс превращения гидроксидов РЗЭ в основные карбонаты и гидроксокарбонаты протекает медленно [13]. Поэтому их содержание в соосажденных осадках должно быть невелико, хотя этому противоречат результаты [15]. Процесс разложения основных карбонатов и гидроксокарбонатов РЗЭ многоступенчатый и протекает в широком интервале температур. Так, например, разложение гидроксокарбоната лантана LaOHCO3⋅nH2O происходит следующим образом: сначала до La2O2CO3 при температуре около 500°С, а затем до La2O3 в интервале 750–830°С, согласно [38]:
(1)
${\text{LaOHC}}{{{\text{O}}}_{3}}{\kern 1pt} \cdot {\kern 1pt} n{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} \to {\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{3}}.$Однако следует подчеркнуть, что выделение CO2 при синтезе пирохлоров продолжается и при более высоких температурах (~1200°С и выше) [39]. Возможно, многоступенчатый процесс разложения карбонатов, гидроксокарбонатов РЗЭ, а также наличие рентгеноаморфного углерода препятствуют кристаллизации пирохлоров в интервале температур ~700–1600°С. В результате параметр пирохлоров меняется постепенно вплоть до 1400–1600°С [39].
Целью настоящей работы являлось выяснение механизма кристаллизации пирохлоров Ln2Ti2O7 (Ln = Gd, Lu) из соосажденных наноразмерных прекурсоров, полученных с использованием сублимационной сушки в широком интервале температур 550–1600°С. Особое внимание уделено процессам, происходящим в наноразмерных прекурсорах при длительной выдержке (до 540 ч) при 550°С, чтобы подтвердить или опровергнуть версию о кристаллизации пирохлоров – титанатов Ln2Ti2O7 (Ln = Gd, Lu) – непосредственно из аморфной фазы [15] и показать, что кристаллизация пирохлоров семейства 3+/4+ (цирконатов, гафнатов и титанатов РЗЭ) во всех случаях проходит через стадию образования флюорита. Для этого использован метод рамановской спектроскопии наряду с РФА. Значительное внимание уделено исследованию порошков и керамики методами калориметрии и количественной термогравиметрии для выяснения влияния карбонатов и гидроксокарбонатов на процесс кристаллизации титанатов гадолиния и лютеция Ln2Ti2O7 из наноразмерных прекурсоров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Прекурсоры для образцов номинального состава Gd2Ti2O7 и Lu2Ti2O7 синтезированы с использованием метода совместного осаждения. Для синтеза соединений использованы следующие исходные реактивы: Gd2O3 (99.9%, GdO-I, ТУ 48-4-200-72, Россия), Lu2O3 (99.93%, ТУ 48-4-524-80, Россия), TiCl4 (12-3 ТУ-6-09-2118-77, Россия). Оксиды Ln2O3 (Ln = Gd, Lu) растворяли в соляной кислоте и определяли титры растворов гравиметрическим титрованием. В качестве исходного реактива, содержащего титан, использовали TiCl4, растворенный в концентрированной соляной кислоте. Титр этого раствора также определяли гравиметрически. Соосаждение проводили из солянокислых растворов РЗЭ и титана, используя в качестве осадителя гидроксид аммония при рН 11. Полученные осадки центрифугировали, промывая несколько раз горячей водой. Осадки были заморожены и высушены с использованием сублимационной сушки. Обезвоженные осадки отжигали при следующих условиях: 550°C, 540 ч; 700°C, 216 ч; 1200°C, 113 ч, а спрессованные таблетки (P = 680 МПа) – при 1500 и 1600°C, 10 ч. Полученные из прекурсоров при разных температурах порошки и керамика номинального состава Ln2Ti2O7 (Ln = Gd, Lu) исследовали методами РФА, СЭМ, рамановской спектроскопии и дифференциальной сканирующей калориметрии (ДСК) + термогравиметрии (ТГ) + масс-спектроскопии (МС). Дополнительно были проведены кратковременные отжиги исходных прекурсоров при 350°C, 2 ч; 650°C, 2 ч; 850°C, 5ч; 1000°C, 2 ч.
Образцы анализировали методом порошковой рентгеновской дифракции на приборе ДРОН-3М (CuKα-излучение, 2θ = 10°–75°, шаг 0.1°, τ = 3 с).
Рамановские спектры, так же как и флуоресценция, индуцированная лазером, исследованы с помощью дисперсионного рамановского спектрометра Raman Station-400 (PerkinElmer, США) с оптическим разрешением 2 см–1. Все образцы в виде таблеток или порошков сняты без какой-либо пробоподготовки. Возбуждение осуществлялось рамановским лазером с длиной волны 785 нм и мощностью 30 мВт. Время набора сигнала составляло 30–60 с.
Микроструктуру порошков и керамики исследовали с использованием метода сканирующей электронной микроскопии (JEOL JSM-6390LA). Размер частиц исследован в порошковых прекурсорах как в исходных, так и после длительных изотермических отжигов при 550, 700, 860°C.
Термографические исследования проводили на приборе синхронного термического анализа STA 449C (NETZSCH, Германия), сопряженного с масс-спектрометром Aeolos-32 при температурах до 1200°С. Скорость нагрева образца составляла 10°С/мин. Измерения проводили в атмосфере кислорода или гелия. Используемый гелий содержал небольшую (0.1 мм рт. ст.) примесь кислорода.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование фазообразования и кристаллизации Ln2Ti2O7 (Ln = Gd, Lu) из рентгеноаморфного прекурсора с использованием изотермической выдержки в интервале температур 550–1600°C методом РФА. Прекурсор, полученный в результате соосаждения с последующей сублимационной сушкой осадков, подвергали длительному отжигу при 550°С, 540 ч. Температура выбрана в связи с результатами работы [40], в которой при использовании метода криоосаждения синтез хорошо закристаллизованного Ho2Ti2O7 удалось провести после 10 ч отжига при 650–750°С.
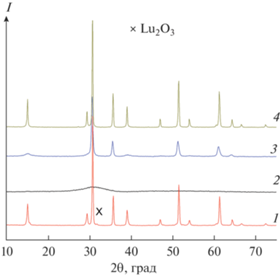
На рис. 1 представлены дифрактограммы прекурсоров для синтеза Ln2Ti2O7 (Ln = Gd, Lu) после изотермической выдержки при 550°С, 540 ч. Отметим появление в обоих случаях очень широкой линии при ~30°, совпадающей по положению с основной линией 111, характерной для структуры флюорита, или линиией 222 структуры пирохлора в случае его кристаллизации. Как будет показано ниже, эти линии можно приписать разупорядоченным флюоритам, а не аморфной фазе. При сравнении дифрактограмм видно, что полуширина основной линии для обеих систем примерно одинакова, а интенсивность линий для Lu2Ti2O7 в 4 раза выше, чем для Gd2Ti2O7. Из ширин основной линии по соотношению Шеррера формально можно оценить размеры областей когерентного рассеяния (ОКР) образовавшихся фаз L. Оказалось, что в обоих случаях L ~ 15 Å. Возможной причиной более низкой интенсивности дифракционных линий Gd2Ti2O7 является существенно более высокое поглощение рентгеновских лучей в диапазоне излучения медного анода атомом гадолиния по сравнению с лютецием. Как следует из [41], массовые коэффициенты ослабления рентгеновских лучей на длине волны CuKα для Gd составляют 470 см2/г, а для Lu – 151 см2/г. В результате более существенного поглощения падающего излучения в гадолинии интенсивность пиков на дифрактограммах в системах с этим элементом становится заметно ниже. Итак, можно предположить, что при длительной выдержке при 550°С начинает происходить формирование продукта реакции в обеих системах, однако невозможно указать, в каком из прекурсоров (гадолиниевом или лютециевом) кристаллизация начинается раньше.
Рис. 1.
Дифрактограммы прекурсоров Lu2Ti2O7 (1) и Gd2Ti2O7 (2) после изотермической выдержки при 550°С, 540 ч.
Рост размера кристаллитов может приводить как к образованию флюорита из аморфного прекурсора, так и к последующему изменению симметрии растущей фазы [42]. Например, низкотемпературный флюорит может перестроиться в более сложную структуру (ромбическую, ромбоэдрическую [42]) или в пирохлор по мере увеличения размера кристаллитов [43]. Увеличения размера кристаллитов можно достичь либо увеличением времени изотермической выдержки, либо повышением температуры синтеза [15, 43].
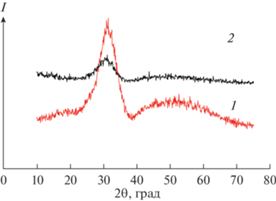
На рис. 2 показаны дифрактограммы прекурсоров обеих систем после изотермической выдержки при 700°С, 216 ч. Видно, что на дифрактограммах появились “сверхструктурные” линии 111, 311, 331, 511, 531, и образовавшиеся соединения можно отнести к Lu2Ti2O7 и Gd2Ti2O7 со структурой пирохлора. Согласно данным [15], температура кристаллизации пирохлора Gd2Ti2O7 составляет 850°С, а пирохлора Lu2Ti2O7 – 800°С, по данным ДТА [43]. В настоящей работе впервые показано, что продолжительная выдержка (216 ч) при температуре 700°С приводит к формированию структуры пирохлора у Gd2Ti2O7, в отличие от данных [15], где при той же температуре после 2-часовой выдержки на дифрактограмме присутствовал только один широкий основной пик при 2θ ~ 30°. Отсутствие кристаллизации в [15] обусловлено, по-видимому, меньшей на два порядка величины продолжительностью выдержки при этой температуре: 2 ч в [15] и 216 ч в нашей работе.
Рис. 2.
Дифрактограммы прекурсоров Lu2Ti2O7 (1) и Gd2Ti2O7 (2) после изотермической выдержки при 700°С, 216 ч.
Можно предположить, что флюорит будет легче кристаллизоваться у титанатов с меньшей разницей в ионных радиусах, что и было показано для Ln2Ti2O7 (Ln = Tm, Yb, Lu) [43], а вот формирование из него пирохлора будет проходить быстрее для титанатов средних РЗЭ Ln2Ti2O7 (Ln = Gd, Dy, Ho), у которых разница в ионных радиусах между Ln и Ti больше, поэтому катионам при перестройке легче занимать две разные катионные позиции в структуре пирохлора. Последнее предположение подтверждается оценкой размеров кристаллитов, которую можно сделать из анализа ширины сверхструктурных дифракционных линий (рис. 2). Видно, что сверхструктурные линии пирохлора у Gd2Ti2O7 (рис. 2, кривая 2) более узкие и хорошо разрешенные, чем у пирохлора Lu2Ti2O7 (рис. 2, кривая 1). Согласно оценкам по формуле Шеррера, для Lu2Ti2O7L ~ 250 Å. Для Gd2Ti2O7 провести оценку невозможно из-за того, что линии узкие, т.е. L > 1000– 1500 Å. Таким образом, размеры кристаллитов пирохлора у Gd2Ti2O7 существенно больше, чем у Lu2Ti2O7.
На рис. 3a и 3б (кривые 1) представлены дифрактограммы прекурсоров Lu2Ti2O7 и Gd2Ti2O7 после изотермической выдержки при 1200°C, 113 ч. Эта температура выше, чем температуры кристаллизации титанатов Ln2Ti2O7 (Ln = Gd, Lu) со структурой пирохлора ~800–850°С по данным [15, 43]. Очевидно, что в результате такого отжига образовались упорядоченные пирохлоры с выраженными сверхструктурными линиями. Кривые 2 (рис. 3а и 3б) соответствуют дифрактограммам керамики, синтезированной отжигом при 1500°С, 10 ч. Видно, что для Ln2Ti2O7 (Ln = Gd, Lu) отжиг при 1500°С не приводит к изменению (в пределах точности измерений) относительной интенсивности сверхструктурных линий. Однако, согласно значению фактора толерантности, Gd2Ti2O7 (t = 1.4) более разупорядочен, чем Lu2Ti2O7 (t = 1.46), поэтому высокотемпературный отжиг (1500°C) может приводить к началу разупорядочения структуры пирохлора у Gd2Ti2O7. Анализ соотношения интенсивностей сверхструктурной линии 111 и максимальной 222 – I(111)/I(222) – для Gd2Ti2O7, синтезированного при 1200 и 1500°С, показал снижение интенсивности единственной сверхструктурной линии 111 с ростом температуры синтеза от 17.3 до 11%. Согласно [26], наибольший вклад в интенсивность этого отражения вносит разупорядочение катионов структуры пирохлора.
Рис. 3.
Дифрактограммы прекурсора Ln2Ti2O7 (порошок), отожженного при 1200°С, 113 ч (1) и керамики, синтезированной при 1500°С, 10 ч (2); Ln = Lu (а), Cd (б).
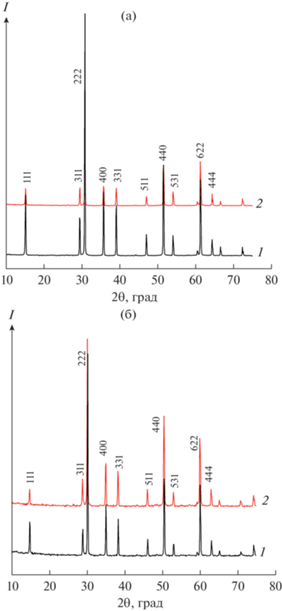
В табл. 1 приведены результаты систематических измерений параметров пирохлоров Ln2Ti2O7 (Ln = Lu, Gd) при отжиге от 700 до 1500°С. Видно, что для Lu2Ti2O7 параметр сохраняется примерно постоянным. Совпадение положения всех линий в этой системе иллюстрирует также рис. 3а. Для Gd2Ti2O7 параметр изменяется сложным образом (табл. 1), что проявляется в сдвиге линий на рис. 3б.
Таблица 1.
Параметр ячейки пирохлоров Ln2Ti2O7 (Ln = Lu, Gd) (метод наименьших квадратов) в зависимости от термической предыстории
| Условия синтеза | 700°C, 216 ч (порошок) |
1200°C, 54 ч (таблетка) | 1200°C, 113 ч (порошок) |
1500°C, 10 ч (таблетка) |
|---|---|---|---|---|
| Параметр ячейки Lu2Ti2O7, Å | – | 10.021(3) | 10.020(2) | 10.022(3) |
| Параметр ячейки Gd2Ti2O7, Å | 10.179(2) | 10.191(2) | 10.182(2) | 10.193(2) |
На основании только дифракционных данных невозможно однозначно определить, является ли продукт, полученный после длительной изотермической выдержки, аморфной фазой или наноразмерным флюоритом. Поэтому были использованы электронно-микроскопические и спектроскопические методы, в частности рамановская спектроскопия и люминесценция.
Микроструктура прекурсоров Lu2Ti2O7 и Gd2Ti2O7 до и после термообработки в интервале 700–860°С, исследованная методом СЭМ. Согласно данным РФА, пирохлоры Gd2Ti2O7 и Lu2Ti2O7 в настоящей работе образовались после изотермической выдержки при 700°С, 216 ч. Поэтому представляется важным определить размер частиц порошков исходной шихты и после отжига при 700 и 860°С. Температура 860°С выбрана в связи с тем, что температура кристаллизации титанатов Ln2Ti2O7 (Ln = Gd, Lu) со структурой пирохлора составляет ~800–850°С [15, 43].
На рис. 4 а, 4б представлена микроструктура исходного прекурсора для синтеза Lu2Ti2O7. Размеры частиц исходной шихты находятся в пределах 20–90 нм, а средний размер составил ~40 нм. После отжига при 700°С, 216 ч средний размер частиц увеличился до 60 нм (рис. 4 в). После отжига при 860°С средний размер частиц в порошке увеличился в 3 раза и составил 116 нм (рис. 4 г). Для гадолиниевого прекурсора наблюдали похожую картину (рис. 5). Средний размер частиц в исходной шихте чуть выше, чем в лютециевой, и составляет 50–77 нм в среднем; после длительного отжига (700°С, 216 ч) средний размер частиц составил 83 нм, т.е. практически не изменился, а после отжига при 860°С вырос до 122 нм. Расхождения в размерах кристаллитов, полученных из данных РФА (определение ОКР (L) по Шереру дает 15 Å) и СЭМ, для прекурсоров при низких температурах 25–500°С может свидетельствовать о том, что методом СЭМ мы наблюдаем агрегаты наночастиц. Результаты измерений для порошков титаната лютеция после термообработки при 850–860°С уже более близкие (L > 25 нм, а согласно СЭМ – 116 нм).
Рис. 4.
Микроструктура исходного прекурсора Lu2Ti2O7 при разных увеличениях (а, б) и после отжига при 700°С, 216 ч (в), при 860°C (г).

Рис. 5.
Микроструктура исходного прекурсора Gd2Ti2O7 для разных участков образца (а, б) и после отжига при 700°С, 216 ч (в), при 860°C (г).

Исследование кинетики кристаллизации прекурсоров Lu2Ti2O7 и Gd2Ti2O7 спектроскопическим методом. Рамановские спектры. Исследование микроструктуры порошков прекурсоров Ln2Ti2O7 методом СЭМ показало, что вплоть до 860°С они являются наноразмерными с большим вкладом дефектных границ зерен. Для того чтобы оценить, идет ли процесс кристаллизации флюорита Ln2Ti2O7 (Ln = Gd, Lu) из рентгеноаморфной смеси при температурах до 700°С (температура кристаллизации пирохлора по данным РФА (рис. 2)), использовали метод рамановской спектроскопии. Для исследования низкотемпературной кристаллизации титанатов мы выбрали температуру 550°С. На рис. 6а и 6б представлены рамановские спектры порошковых прекурсоров для синтеза Lu2Ti2O7 и Gd2Ti2O7 соответственно с различной изотермической выдержкой при 550°С. Наблюдаются 2 широкие полосы при 750 и 350 см–1 и одна узкая полоса при 150 см–1. Для лютециевого прекурсора полосы становятся более интенсивными при увеличении времени отжига до 360 ч и при увеличении времени до 540 ч более не изменяются (рис. 6a). Для гадолиниевого прекурсора после 360 ч отжига интенсивность полос возрастает, а при дальнейшем отжиге слегка уменьшается (рис. 6б). Аналогичный вид рамановских спектров наблюдали авторы [33], исследуя фазообразование Er2Ti2O7 из наноразмерного прекурсора, полученного с использованием золь—гель-метода. Установлено, что наноразмерный флюорит Er2Ti2O7 образуется после отжига при 700°C и основной его характеристикой является появление сильной полосы при 750 см–1 , относящейся к атомам Ti с координационным числом 7 [23, 24, 33]. При дальнейшем нагревании флюорита Er2Ti2O7 до 800°C сильная полоса при 750 см–1 исчезла. Для Er2Ti2O7, отожженного выше 700°C, характерно появление в спектре новых полос при 710, 524, 450 и 310 см–1, которые являются характеристикой структурного упорядочения и формирования пирохлороподобной структуры (табл. 2). О полном фазовом превращении свидетельствуют появление полосы при 450 см–1 и высокая интенсивность полос при 310 и 524 см–1, отмеченных после отжига при 1200°C [28]. Исчезновение широкой и сильной линии 750 см–1 флюорита наряду с появлением основных линий пирохлора (150, 306–312, 519–526, 725 см–1) в рамановском спектре Gd2Ti2O7 после отжига при 800°C следует из данных [15, 16], где прекурсор был синтезирован комбинированным методом: золь–гель + соосаждение (табл. 2).
Рис. 6.
Рамановские спектры наноразмерных прекурсоров Ln2Ti2O7 после отжига при 550°С в течение: 120 (1), 240 (2), 360 (3), 540 ч (4); Ln = Lu (а), Cd (б).
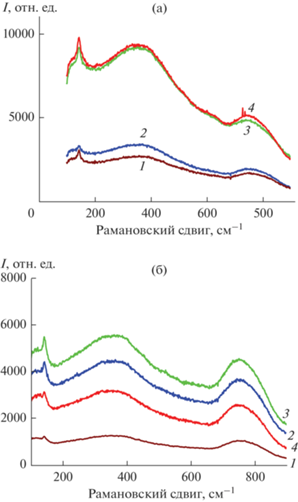
На рис. 7а и 7б представлены рамановские спектры прекурсоров для синтеза Lu2Ti2O7 и Gd2Ti2O7 соответственно, которые отжигали в течение короткого времени (2–5 ч) при различных температурах в сравнении со спектром наноразмерного эталонного прекурсора после выдержки при 550°С, 360 ч (кривые 2). Для того чтобы сравнить рамановские полосы различных по степени кристаллизации образцов, мы использовали шкалу относительных интенсивностей. Сравнительные данные для титанатов РЗЭ со структурой пирохлора, полученные другими авторами и в настоящей работе, представлены в табл. 2. На рис. 7а, 7б, кривые 1 показан результат отжига исходной шихты после термообработки при 350°С, 2 ч. Образец является аморфным, если не учитывать широкую линию с максимумом ~350 см–1. Эталонный образец (кривые 2) отличается от аморфного появлением выраженного максимума при 760–770 см–1, более четким максимумом при 370–380 см–1 и появлением новой узкой полосы при 150 см–1. Все три линии сохраняются и после отжига при 650°С, 2 ч (рис. 7а, 7б, кривые 3). Отметим, что первые две полосы ослабевают, а полоса при 150 см–1 усиливается. Полосы при 380 и 760 см–1 являются характерной особенностью структуры флюорита. Таким образом, изотермическая выдержка при 550°С, 360 ч (эталонный образец) обеспечила кристаллизацию флюорита в большей степени, чем кратковременный отжиг при 650°С, 2 ч (рис. 7а, 7б, кривые 2 и 3). После отжига при 850°С, 5 ч и 1000°С, 2 ч (рис. 7а, кривые 4 и 5; рис. 7б, кривая 4) наблюдаются основные полосы, присущие пирохлору: при 524, 450 и 310 см–1 (табл. 2). Полосы, типичные для флюорита, после отжига при 850°С, 5 ч полностью исчезают. После отжига при 1600°С следует отметить искажение структуры пирохлора Lu2Ti2O7 в ближнем порядке, в отличие от Gd2Ti2O7 (рис 7а, кривая 6 и 7б, кривая 5). Это проявляется в уширении основных линий пирохлора и возникновении новой полосы ~180 см–1 у Lu2Ti2O7. Процесс структурного разупорядочения пирохлора имеет место и у Gd2Ti2O7, но выражен он в меньшей степени, чем у Lu2Ti2O7. Таким образом, полностью упорядочена структура пирохлора Ln2Ti2O7 (Ln = Gd, Lu) в ближнем порядке при t ~ 1000°С, что согласуется с данными [15, 16]. Следует отметить появление значительной кислород-ионной проводимости у дефектного пирохлора Lu2Ti2O7, синтезированного при t ≥ 1600°С [43].
Рис. 7.
Рамановские спектры Lu2Ti2O7 после отжига при 350°C, 2 ч (1); 550°С, 360 ч (эталонный образец) (2); 650°C, 2 ч (3); 850°C, 5 ч (4); 1000°C, 2 ч (5); 1600°C, 10 ч (6) (а) и Gd2Ti2O7 после отжига при: 350°C, 2 ч (1); 550°С, 360 ч (эталонный образец) (2); 650°C, 2 ч (3); 850°C, 5 ч (4); 1500°C, 10 ч (5) (б).
Мы представили рамановские спектры в относительных единицах интенсивности для удобства сравнения положения полос, но следует заметить, что максимальную абсолютную интенсивность спектра в обоих случаях демонстрируют образцы керамики, полученные при высокой температуре (1500 и 1600°С).
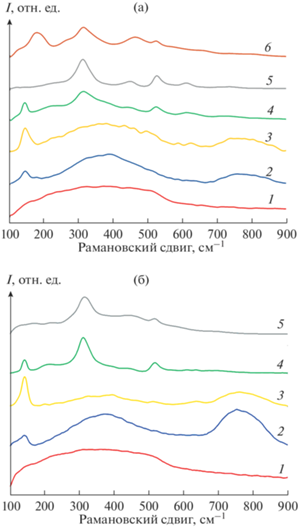
Исследование кинетики кристаллизации прекурсоров Lu2Ti2O7 и Gd2Ti2O7 спектроскопическим методом. Спектры люминесценции. Особое внимание следует обратить на спектры люминесценции наноразмерного прекурсора для синтеза титанатов лютеция и гадолиния после термообработки при 550°С в течение 120, 240, 360 и 540 ч (рис. 8). Отметим, что Lu3+ и Gd3+ не являются оптически активными катионами в титанатах и цирконатах РЗЭ со структурой пирохлора, в отличие, например, от неодима, самария, европия [18, 44–46]. Поэтому люминесцентные свойства изучают обычно на допированных Nd, Sm, Eu пирохлорах, например в [44, 45]. Для наноразмерных прекурсоров после отжига при 550°С с различной длительностью наблюдается широкополосная люминесценция в интервале 1000–2250 см–1. Она достигает максимума после 360 ч выдержки лютециевого прекурсора (рис. 8а, кривая 3) и при увеличении времени изотермической выдержки до 540 ч остается без изменений (рис. 8а, кривая 4). Для гадолиниевого прекурсора она также достигает максимума после 360 ч выдержки (рис. 8б, кривая 3), а после увеличения времени отжига до 540 ч несколько снижается (рис. 8б, кривая 4). Похожая ситуация наблюдалась при синтезе титаната эрбия Er2Ti2O7 из наноразмерного прекурсора, который в форме флюорита может быть использован в качестве нового красителя розового цвета, но при повышении температуры до 800°С после перестройки флюорита в пирохлор окраска полностью исчезала [33].
Рис. 8.
Спектры люминесценции наноразмерных прекурсоров Ln2Ti2O7 после отжига при 550°С в течение 120 (1), 240 (2), 360 (3) и 540 ч (4); Ln = Lu (а), Cd (б).
Известно, что в люминофорах, легированных РЗЭ, интенсивная люминесценция может быть достигнута только в неупорядоченной структуре за счет релаксации f–f-перехода в редкоземельных ионах, который строго запрещен по Лапорту в симметричных и упорядоченных фазах [47]. В связи с этим любопытно было проследить за динамикой изменения спектра люминесценции прекурсоров при других температурах в процессе эволюции структуры: аморфная фаза–флюорит–разупорядоченный пирохлор–упорядоченный пирохлор.
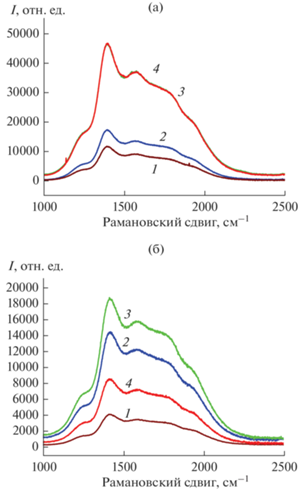
На рис. 9 представлены соотношения реальной интенсивности люминесценции тех же образцов. Интенсивность люминесценции возрастает при переходе от аморфного образца (рис. 9а, 9б, кривые 1) к эталонному образцу со структурой флюорита с длительной выдержкой при 550°С (360 ч) (рис. 9а, 9б, кривые 2). Образцы, полученные кратковременным отжигом при температуре 650°C, демонстрируют близкий по форме спектр люминесценции, но очевидно, что фаза флюорита после такой термообработки еще не сформировалась и люминесценция существенно слабее, чем у эталонного образца (рис. 9а, 9б, кривые 3 и 2). Интенсивность люминесценции не изменяется при образовании разупорядоченного пирохлора после отжига при 850°С, 5 ч (рис. 9а, 9б, кривые 4), однако для обоих прекурсоров она становится более структурированной. Полагаем, что в данном случае люминесценция связана с ростом локальных доменов со структурой пирохлора. Структура пирохлора не полностью упорядочена после отжига при этой температуре и полиэдры структуры пирохлора остаются искаженными, поэтому люминесценция не погасает. После отжига при 1000°С и выше, когда, согласно рамановским данным, образуется упорядоченный пирохлор, люминесценция погасает. Это справедливо для прекурсора Lu2Ti2O7, однако для Gd2Ti2O7 после отжига при 1500°С, 10 ч можно наблюдать 4-кратный рост и появление структурированной узкополосной люминесценции (рис. 9a, кривая 6; 9б, кривая 5). Таким образом, при низких температурах наблюдается возникновение люминесценции, связанной с формированием наноразмерного флюорита из аморфной фазы. Для объяснения природы сильной люминесценции при высоких температурах, в частности в керамике Gd2Ti2O7 после отжига 10 ч при 1500°С, необходимы дополнительные исследования.
Рис. 9.
Люминесценция Lu2Ti2O7 после отжига при 350°C, 2 ч (1); 550°С, 360 ч (эталонный образец) (2); 650°C, 2 ч (3); 850°C, 5 ч (4); 1000°C, 2 ч (5); 1600°C, 10 ч (6) и Gd2Ti2O7 после отжига при 350°C, 2 ч (1); 550°С, 360 ч (эталонный образец) (2); 650°C, 2 ч (3); 850°C, 5 ч (4); 1500°C, 10 ч (5).
Калориметрия и термогравиметрия порошковых прекурсоров Lu2Ti2O7 в атмосфере гелия и кислорода с масс-спектральным контролем выделяющихся газов. Результаты термического анализа Lu2Ti2O7 приведены в табл. 3. В ней собраны результаты экспериментов с исходной шихтой (образцы 1–3) и прекурсором Lu2Ti2O7 после отжига при 550°С, 540 ч (образцы 4–8).
Таблица 3.
Результаты термического анализа и фазовый состав образцов Lu2Ti2O7
| Опыт | Образец | Среда; tmax, °С | Δm, % | Фазовый состав | |||
|---|---|---|---|---|---|---|---|
| 450°С | 650°С | 850°С | 1200°С | ||||
| 1 | Исходная шихта | He; 1200 | –20.22 | –22.77 | –25.1 | Lu2Ti2O7 (P) + + Lu2O3(следы) | |
| 2 | Повторный прогрев образца 1 | He; 1200 | –0.13 | ||||
| 3 | Исходная шихта | O2; 1200 | –20.05 | –24.29 | –24.49 | ||
| 4 | 550°С, 540 ч | О2; 1200 | –1.03 | –1.18 | –2.07 | –2.32 | |
| 5 | Повторный прогрев образца 4 | О2; 1200 | –0.25 | Lu2Ti2O7(P) | |||
| 6 | 550°С, 540 ч | О2; 850 | –3.18 | –3.28 | –4.22 | Lu2Ti2O7* | |
| 7 | 550°С, 540 ч | О2; 650 | –4.12 | –4.37 | Флюорит | ||
| 8 | 550°С, 540 ч | Не; 1200 | –1.18 | –1.93 | –2.22 | Lu2Ti2O7(P) | |
На рис. 10a приведены результаты ДСК, ТГ и ионные токи CO2 и О2 (m/z = 44 и 32 соответственно) при нагреве в Не исходной шихты Lu2Ti2O7 (образец 1, табл. 3). При низких температурах (до 650°С) происходит уменьшение массы образца (рис. 10а, кривая 1') с выделением СО2 (рис. 10а, кривая 1") и воды (первичные данные по Н2О опущены), однако интенсивность ионного тока воды (m/z = 18) примерно в 5–10 раз выше интенсивности ионного тока СО2 (m/z = 44). Максимум выделения этих газов при 150°С сопровождается эндотермическим тепловым эффектом (рис. 10а, кривая 1). К 650°С уменьшение массы составляет 20.2% (см. табл. 3). При ~720°C наблюдается резкое уменьшение массы образца на 2.5%, сопровождающееся пиком выделения СО2 и экзоэффектом. Одновременно происходит уменьшение парциального давления примесного кислорода (рис. 10а, кривая 1'"), т.е. поглощение кислорода. При более высоких температурах наблюдаются еще два участка поглощения кислорода (при 950 и 1100°С) и одновременного выделения СО2.
Рис. 10.
Результаты ДСК (1, 2), ТГ (пунктир, 1', 2') и ионные токи CO2 (1'', 2''), O2 (1''') при первом (1) и повторном (2) прогреве в Не исходной шихты Lu2Ti2O7 (опыты 1 и 2, табл. 3) (а); ДСК (1, 2), ТГ (пунктир, 1', 2') и ионный ток СО2 (1'', 2'') при первом (1) и повторном (2) прогреве в атмосфере О2 прекурсора Lu2Ti2O7 после выдержки 540 ч при 550°С (б).
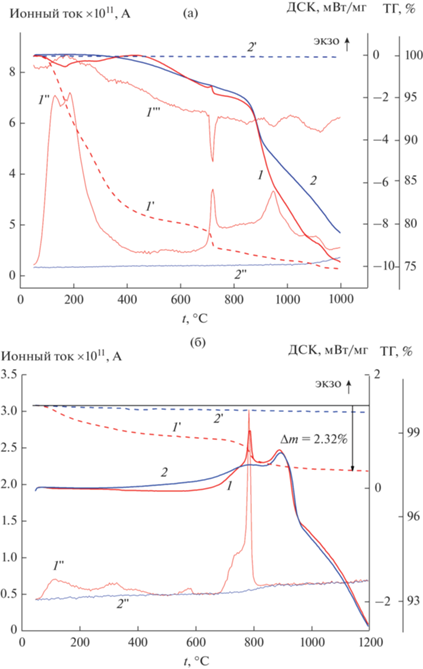
При повторном прогреве того же образца (опыт 2 в табл. 3 и кривые 2, 2', 2'' на рис. 10а) не наблюдаются экзоэффект и поглощение кислорода; зафиксированы очень небольшое падение массы на 0.13% (табл. 3) и незначительное выделение СО2 при t > 1000°С.
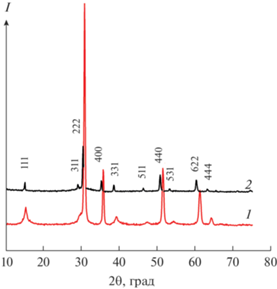
На рис. 11 дифрактограмма 1 соответствует опыту 2 в табл. 3. На ней зафиксированы линии пирохлора Lu2Ti2O7 со следами исходного компонента Lu2O3. Таким образом, при прогреве до 1200°С исходного прекурсора происходит синтез конечного продукта – пирохлора Lu2Ti2O7. В условиях высокой скорости прогрева в ДСК ячейке синтез еще немного не завершен и в смеси сохранились следы исходного компонента. Можно предположить, что до 650°С происходит разложение карбонатов и гидрокарбонатов с выделением воды и СО2, а в диапазоне 650–1200°С – синтез конечного продукта, сопровождающийся выделением СО2. Более детальный анализ данных приведен ниже.
ДСК–ТГ–МС-данные при прогреве исходного прекурсора в среде кислорода (образец 3, табл. 3) аналогичны (первичные данные опущены), однако в присутствии избыточного давления кислорода процесс протекает несколько быстрее и, как видно из табл. 3, уменьшение массы практически завершается при 850°С.
Результаты термического анализа в атмосфере кислорода прекурсора Lu2Ti2O7 после длительной (540 ч) изотермической выдержки при 550°С приведены на рис. 10б. Кривые 1, 1', 1'' и 1''' соответствуют образцу 4 (табл. 3). Так как этот образец уже длительно прогревали при 550°С, то низкотемпературное уменьшение массы (кривая 1') с выделением СО2 (кривая 1'') и Н2О (первичные данные не приведены) в этом случае примерно в 20 раз меньше, чем для исходной смеси, и к 650°С составляет всего 1.18%. В температурном диапазоне 700–850°С наблюдается дополнительное уменьшение массы образца на 0.9%, сопровождаемое двухступенчатым выделением СО2. Второй пик выделения газа совпадает с экзотермическим эффектом. В температурном диапазоне 850–1200°С масса образца уменьшается еще на 0.2%. После повторного нагрева в кислороде (образец 5 в табл. 3 и кривые 2, 2', 2'' на рис. 10б) экзоэффекта при 800°С не наблюдали, а падение массы составило всего 0.25%.
В прекурсоре Lu2Ti2O7 после длительной изотермической выдержки при 550°С (рис. 1, кривая 1) присутствует широкая линия при ~30°, формально соответствующая линии 111 флюорита Lu2Ti2O7. Данные рамановской спектроскопии и люминесценции подтверждают формирование фазы флюорита в этих условиях. Дифрактограммы (рис. 11, кривые 2–4) соответствуют прогретым до разных температур в ячейке ДСК образцам прекурсора Lu2Ti2O7, полученного предварительной изотермической выдержкой 540 ч при 550°С. Нагрев образца до 650°С в атмосфере кислорода не изменяет спектр (рис. 11, кривая 2). После достижения 850°С (рис. 11, кривая 3) в образце формируется фаза пирохлора с очень широкими и не полностью сформированными сверхструктурными линиями. Для упорядочения фазы пирохлора образец необходимо нагреть в ДСК-ячейке до 1200°С (рис. 11, кривая 4).
Сопоставляя эти данные с результатами ДСК, ТГ и МС (рис. 10), можно заключить, что в условиях быстрого прогрева со скоростью 10°С/мин в ДСК-ячейке синтез разупорядоченной фазы пирохлора происходит при температурах 700–800°С. Можно полагать, что кристаллизация пирохлора инициируется разложением карбоната с выделением СО2. Дальнейшее упорядочение пирохлора и повышение интенсивностей сверхструктурных линий в условиях быстрого нагрева происходит при температурах 850–1200°С и сопровождается небольшим уменьшением массы, связанным, возможно, с выделением следов СО2.
Основные положения для количественного анализа ТГ-данных. Проанализируем термического анализа данные (рис. 10) в рамках предположений, что происходит 100%-ное образование гидроксокарбоната лютеция, TiO2 находится в виде гидроксида и протекающие процессы можно описать следующими реакциями [38]:
(2a)
$\begin{gathered} 2{\text{LuOHC}}{{{\text{O}}}_{3}}{\kern 1pt} \cdot {\kern 1pt} n{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{Ti}}{{\left( {{\text{OH}}} \right)}_{4}} \to \\ \to \,\,{\text{L}}{{{\text{u}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} + {\text{C}}{{{\text{O}}}_{2}} + \left( {n + 1} \right){{{\text{H}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,2{\text{Ti}}{{{\text{O}}}_{2}} + 4{{{\text{Н}}}_{{\text{2}}}}{\text{О }}(t < 650^\circ {\text{С}}), \\ \end{gathered} $(2б)
$\begin{gathered} {\text{L}}{{{\text{u}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} + 2{\text{Ti}}{{{\text{O}}}_{2}} \to {\text{L}}{{{\text{u}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + \\ + \,\,{\text{C}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow + \,\,2{\text{Ti}}{{{\text{O}}}_{{\text{2}}}} \to {\text{L}}{{{\text{u}}}_{{\text{2}}}}{\text{T}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{7}}\left( {t > 650^\circ {\text{C}}} \right). \\ \end{gathered} $Из реакции (2б) следует, что уменьшение массы при выделении СО2 может отражать глубину протекания реакции образования конечного продукта Lu2Ti2O7.
Анализ данных для исходного прекурсора Lu2Ti2O7 (образцы 1–3 в табл. 3)
Анализ данных рис. 10а и табл. 3 (образец 1) будет проведен в рамках предположения, что при температурах ниже 650°С протекает реакция (2а) с выделением воды и СО2, а в диапазоне 650–1200°С происходит реакция (2б) с выделением только СО2. Перепишем уравнение (2а), вводя под уравнением молекулярные массы
(3)
$\begin{gathered} 2{\text{LuOHC}}{{{\text{O}}}_{3}}{\kern 1pt} \cdot {\kern 1pt} n{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{Ti(OН}}{{{\text{)}}}_{4}} \to {\text{L}}{{{\text{u}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} + {\text{ }}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{C}}{{{\text{O}}}_{2}} + n{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{Ti}}{{{\text{O}}}_{2}} + 4{{{\text{Н}}}_{{\text{2}}}}{\text{О}}~.~~~~~~~~~~~~~~~ \hfill \\ \,\,\,\,\,\,\,\,\,\,504~~~~~~~~~ + n18~~~~~~\,\,\,\, + 232~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~\,\,\,18~~ + {\text{ }}44~~ + \,\,n18~~~~~~~~~~~~~~\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,~ + 72 \hfill \\ \end{gathered} $Из табл. 3 следует, что к 650°С уменьшение массы, обусловленное выделением воды и СО2, составляет 20.22%. Тогда получаем уравнение, из которого можно найти n,
откуда следует, что n ~ 1.Следовательно, исходная смесь (2LuOHCO3⋅ H2O + 2Ti(OН)4) имеет молекулярную массу 736 + + 18 = 754. Учитывая это, при протекании реакции синтеза (2б) потеря массы за счет выделения СО2 должна быть 44/754 = 5.8%. Из рис. 10а видно, что реакция протекает в широком температурном диапазоне и есть максимумы выделения СО2 и поглощения кислорода при температурах 700, 950 и 1100°С. После прогрева в ДСК-ячейке до 1200°С основной фазой является пирохлор Lu2Ti2O7 со следами Lu2O3 (рис. 11, кривая 1 и табл. 3), т.е. синтез в основном прошел. Общая потеря массы в процессе реакции составляет Δm(1200°С) – Δm(650°С) = 25.1 – 20.2 = 4.9%. С учетом падения массы при повторном прогреве – 5%. В пределах точности оценок экспериментальные и расчетные значения потерь масс достаточно близки. Несколько меньшее экспериментальное уменьшение массы по сравнению с расчетным, может быть связано с тем, что при двух прогревах в ДСК-ячейке реакция еще не совсем завершилась и (или) часть оксида лютеция не была в карбонатной форме.
Таким образом, прогрев исходной смеси с высокой скоростью в ДСК-ячейке сопровождается двумя процессами: при температурах до 650°С – разложением гидроксидов и гидроксокарбонатов по уравнению (2а) с выделением воды и части СО2, а в температурном диапазоне 650–1200°С – разложением оксикарбоната лютеция с выделением СО2, образованием Lu2O3 и одновременным последующим синтезом конечного продукта Lu2Ti2O7 по реакции (2б). Синтез в ДСК-ячейке к 1200°С полностью не завершается, и в конечном образце наблюдаются следы исходного оксида.
Можно обратить внимание на то, что при прогреве в кислороде исходной шихты (табл. 3, образец 3) синтез начинается раньше и почти завершается уже при 800°С, т.е. при заметно более низкой температуре, чем в гелии. Это следует из данных по уменьшению массы.
Анализ данных для прекурсора Lu2Ti2O7 после изотермической выдержки при 550°С в течение 540 ч (образцы 4–8 табл. 3). Эти прекурсоры перед опытами длительное время выдерживали при 550°С, а затем хранили при комнатной температуре на воздухе. Как видно из рис. 10б, кривая 1' и табл. 3, для образца 4 уменьшение массы при прогреве до 650°С составляет всего 1.18%, что примерно в 20 раз меньше, чем для исходного прекурсора (рис. 10а). Не исключено, что наблюдаемое небольшое низкотемпературное выделение СО2 обусловлено реадсорбцией газа при хранении образца на воздухе после отжига.
Согласно дифракционным данным и результатам рамановской спектроскопии и люминесценции, в образце после длительной изотермической выдержки при 550°С образуется некоторое количество конечного продукта Lu2Ti2O7 в форме флюорита. ТГ-данные подтверждают этот вывод.
Действительно, из рис. 10б видно, что при температурах выше 650°С присутствуют признаки частично протекающего синтеза – резкое уменьшение массы с выделением СО2 и экзоэффектом. В связи с тем, что низкотемпературное уменьшение массы в этом случае незначительно, можно полагать, что реакция (2а) полностью или практически полностью прошла при приготовлении прекурсора. При 100%-ном протекании реакции (2б) потеря массы должна быть 44/(442 + 160 = 602) = 7.3%:
(5)
$\begin{gathered} {\text{L}}{{{\text{u}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} + 2{\text{Ti}}{{{\text{O}}}_{2}} \to {\text{L}}{{{\text{u}}}_{{\text{2}}}}{\text{T}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + {\text{C}}{{{\text{O}}}_{2}}. \hfill \\ ~~~~~~442~~~~~~~~~~~~~~~~~~~~\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,~160~~~~~~~~~~~44 \hfill \\ \end{gathered} $Даже если всю потерю массы в процессе ДСК образца 4 из табл. 3 (2.32%) отнести к этой реакции (что заведомо оценка сверху), то мы получим около (2.32/7.3 = 32% превращения). Если взять потерю массу только выше 650°С, то (2.32–1.18 = 1.14%) получаем 1.14/7.3 = 15%, если в диапазоне 650–850°С (2.07–1.18 = 0.89%) – 0.89/7.3 = 12%.
Таким образом, в процессе прогрева в ДСК-ячейке прекурсора, полученного изотермической выдержкой при 550°С, синтезируется только 12–15% конечного продукта. Но из дифракционных данных следует, что выше 1200°С (рис. 11, дифрактограмма 4) существует только одна хорошо разрешенная фаза – пирохлора Lu2Ti2O7. Следовательно, основной синтез прошел при длительном предварительном прогреве при 550°С.
Итак, в процессе длительной изотермической выдержки при 550°С основное количество продукта Lu2Ti2O7 уже синтезировалось, но он находится в состоянии сильно разупорядоченного флюорита с ОКР (L) 15 Å. Дополнительный прогрев этого образца при 650–850°С приводит к завершению синтеза Lu2Ti2O7 (с образованием не более 12–15% продукта) и переходу флюорита в пирохлор. Дальнейшее упорядочение пирохлора происходит при температурах 850–1200°С с небольшими изменениями массы и выделением СО2.
Калориметрия и термогравиметрия порошковых прекурсоров Gd2Ti2O7 в атмосфере гелия и кислорода с масс-спектральным контролем выделяющихся газов. Результаты ДСК Gd2Ti2O7 приведены в табл. 4. Разберем сначала результаты экспериментов с исходной шихтой (образцы 1–3), а затем с прекурсором Gd2Ti2O7 после отжига 540 ч при 550°С (образцы 4, 5).
Таблица 4.
Результаты термического анализа и фазовый состав образцов Gd2Ti2O7
| Опыт | Образец | Среда | Δm, % | Фазовый состав | ||
|---|---|---|---|---|---|---|
| 600°С | 900°С | 1200°С | ||||
| 1 | Исходная шихта | He | –19.47 | –22.3(950) | –26.83 | Gd2Ti2O7 + Gd2O3 (следы) |
| 2 | Повторный прогрев образца 1 | He | –0.43 | |||
| 3 | Исходная шихта | O2 | –18.52 –19.56* |
–25.46 | –25.75 | |
| 4 | 550°С, 540 ч | O2 | –0.87 | –1.99 | –2.27 | |
| 5 | Повторный прогрев образца 4 | O2 | –0.15 | |||
На рис. 12 приведены данные ДСК, ТГ и МС, полученные при прогреве в ДСК-ячейке исходной шихты (табл. 4, образцы 1, 2). Так же как в случае титаната лютеция, для титаната гадолиния можно выделить два участка. До температур около 600°С наблюдается значительное уменьшение массы образца (рис. 12, кривая 1'), обусловленное выделением СО2 (кривая 1'') и воды (кривая 1'''). Следует отметить, что воды выделяется на порядок величины больше, чем СО2. Этот процесс сопровождается эндоэффектом (рис. 12, кривая 1) с максимумом при 150°С. К 600°С потеря массы составляет около 20%. При температурах около 1000°С наблюдается второй участок резкого уменьшения массы примерно на 4% с отчетливо наблюдаемым выделением СО2, поглощением кислорода (рис. 12, кривая 1"") и эндоэффектом. При повторном прогреве того же образца (табл. 4, образец 2) уменьшение массы составляет всего 0.43%, а выделение СО2 фиксируется только при температурах выше 1000°С.
Рис. 12.
Результаты ДСК (1, 2), ТГ (пунктир, 1', 2') и ионные токи от СО2 (1'', 2''), Н2О (1''') и О2 (1'''') при первом (1) и повторном (2) прогревах в Не исходный шихты Gd2Ti2O7.
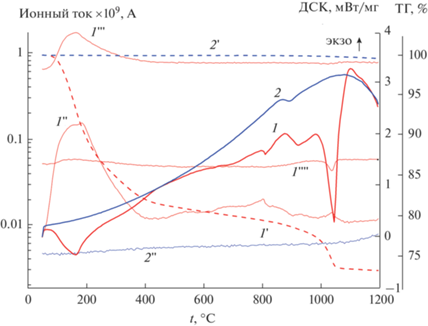
Результаты дифракционного анализа до и после прогрева суммированы также в табл. 4. Видно, что после прогревов в ДСК-ячейке до 1200°С образовался пирохлор Gd2Ti2O7, однако синтез полностью не прошел.
На рис. 13 представлены ДСК–ТГ–МС-результаты, полученные для прекурсора Gd2Ti2O7 после его длительной (540 ч) изотермической выдержки при 550°С (табл. 4, образец 4). При низких температурах (до 500°С) происходит уменьшение массы образца на 0.9% (рис. 13, кривая 1'), т.е. в 20 раз меньше, чем для исходной шихты. Потеря массы обусловлена выделением СО2 (рис. 13, кривая 1'') и воды (первичные данные по Н2О не приведены). В температурном диапазоне 700–900°С наблюдается дополнительное уменьшение массы на 1.36%. При этом зафиксированы три пика выделения СО2. Экзоэффект находится при 800°С, т.е. при точно той же температуре, что и у прекурсора титаната лютеция, и ему также предшествует выделение СО2. На дифрактограмме этого образца до ДСК-опыта (рис. 1, кривая 2) зарегистрирована широкая линия, которую можно отнести к линии 111 флюорита Gd2Ti2O7. По аналогии с титанатом лютеция можно предполагать, что экзоэффект отражает протекание синтеза пирохлора из флюорита, который инициируется разложением карбонатов. При температурах выше 900°С наблюдается постепенное увеличение ионного тока, соответствующего СО2.
Рис. 13.
Результаты ДСК (1, 2), ТГ (пунктир 1', 2') и ионный ток СО2 (1'', 2'') при первом (1) и повторном (2) прогревах в кислороде прекурсора Gd2Ti2O7 после изотермической выдержки 540 ч при 550°С.
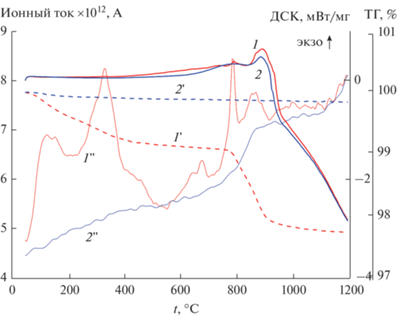
Повторный прогрев этого образца в кислороде сопровождается незначительным образованием СО2 (рис. 13, кривая 2'') при низких температурах, наблюдается практически полное совпадение кривых выделения СО2 при первом и втором прогревах при температурах 900–1200°С. Общее уменьшение массы при повторном прогреве составляет 0.15% (рис. 13, кривая 2').
Таким образом, можно полагать, что процесс кристаллизации пирохлора инициируется разложением карбонатов с выделением СО2 и уровень СО2 в процессе прогрева при температурах выше 600°С может служить “меткой” начала процесса кристаллизации пирохлора. Из сравнения рис. 13 и 10б видно, что в прекурсоре Gd2Ti2O7 выделение СО2 “размазано” в широком температурном диапазоне и даже наблюдается при повторном прогреве, а в Lu2Ti2O7 фиксируются только острые пики СО2 при первом прогреве. Эти данные, возможно, указывают на то, что в Gd2Ti2O7 скорость кристаллизации существенно ниже, чем в Lu2Ti2O7, и при первом прогреве до 1200°С кристаллизация пирохлора Gd2Ti2O7 полностью не завершается.
ЗАКЛЮЧЕНИЕ
Методами рентгеновской дифракции, рамановской спектроскопии и люминесценции, СЭМ, калориметрии (ДСК), МС и ТГ проанализирована кинетика фазообразования и кристаллизации пирохлоров Ln2Ti2O7 (Ln = Gd, Lu) из наноразмерных прекурсоров, полученных методом соосаждения. Установлено, что фазообразование пирохлоров проходит стадию кристаллизации наноразмерного флюорита.
Исходные смеси в значительной мере находятся не в виде оксидов, а в виде гидроксидов и гидроксокарбонатов. Первой стадией синтеза является разложение по реакции (2а) до оксида титана и диоксикарбоната лютеция (или гадолиния), происходящее при температурах ниже 550–650°С. На второй стадии происходит синтез конечных соединений по реакции (2б), сопровождающийся также выделением СО2. Таким образом, “высокотемпературное” выделение СО2 позволяет визуализировать кинетику протекающего синтеза. Можно предположить, что лимитирующим процессом второй стадии синтеза является разложение диоксикарбонатов Ln2O2CO3. В рамках предположения о полном переходе исходных оксидов в гидроксиды и гидроксокарбонаты удалось согласовать все экспериментальные данные по ТГ.
Специальными опытами по длительной термообработке при низких температурах (540 ч при 550°С и 216 ч при 700°С) показано, что синтез Lu2Ti2O7 из исходных смесей удается провести почти полностью уже при 550°С. Методом количественной ТГ определено, что степень превращения при 550°С близка к ~80%. Методами рамановской спектроскопии доказано, что синтезированный при 550°С разупорядоченный нанооксид с размерами ОКР(L) 15 Å является флюоритом. Длительная термообработка при 700°С сопровождается ростом ОКР и переходом флюорита в пирохлор. Образование пирохлоров подтверждено методами рентгеновской дифракции и рамановской спектроскопии. Факт возникновения широкополосной люминесценции при 550°С оптически неактивных катионов РЗЭ в наноразмерных прекурсорах Ln2Ti2O7 (Ln = Gd, Lu) также свидетельствует о кристаллизации фазы флюорита, поскольку только в несимметричных полиэдрах LnO7 возможны f–f-переходы редкоземельных катионов, запрещенные в симметричных полиэдрах LnO8 и LnO6 структуры упорядоченного пирохлора. В то же время структурированная люминесценция, наблюдаемая при более высоких температурах, требует дополнительного исследования.
В условиях прогрева исходных смесей с высокой скоростью 10°С/мин в ДСК-ячейке все процессы сдвинуты в область более высоких температур. Синтез продукта с образованием флюорита происходит, по-видимому, в диапазоне 650–750°С, а формирование пирохлора подтверждено методом рентгеновской дифракции при 850°С.
Процесс формирования пирохлора Ln2Ti2O7 (Ln = Gd, Lu) через стадию наноразмерного флюорита характерен для обеих систем. Сравнение кинетики процессов в двух системах осложняется противоречиями в данных по разным режимам прогревов и требует дальнейшего изучения.
Таким образом, в отличие от существующей в литературе точки зрения, что кристаллизация титанатов Ln2Ti2O7 (Ln = Gd, Dy) происходит непосредственно из аморфной фазы [15, 16], показано, что Gd2Ti2O7, так же как и все пирохлоры 3+/4+ Ln2M2O7 (Ln = La–Lu; M = Ti, Zr, Hf), образуется в результате перехода типа порядок–беспорядок из наноразмерного флюорита в пирохлор.
Список литературы
Anokhina I.A., Animitsa I.E., Voronin V.I., Vykhodets V.B., Kurennykh T.E., Molchanova N.G., Vylkov A.I., Dedyukhin A.E., Zaikov Y.P. The Structure and Electrical Properties of Lithium Doped Pyrochlore Gd2Zr2O7 // Ceram. Int. 2021. V. 47. № 2. P. 1949–1961. https://doi.org/10.1016/j.ceramint.2020.09.025
Omata T., Otsuka-Yao-Matsuo S. Electrical Properties of Proton-Conducting Ca2+-Doped La2Zr2O7 with a Pyrochlore-Type Structure // J. Electrochem. Soc. 2001. V. 148. № 6. P. E252–E261. https://doi.org/10.1149/1.1369370
Antonova E.P., Farlenkov A.S., Tropin E.S., Eremin V.A., Khodimchuk A.V., Ananiev M.V. Oxygen Isotope Exchange, Water Uptake and Electrical Conductivity of Ca-Doped Lanthanum Zirconate // Solid State Ionics. 2017. V. 306. № 1. P. 112–117. https://doi.org/10.1016/j.ssi.2017.03.023
Shlyakhtina A.V., Shcherbakova L.G. Polymorphism and High-Temperature Conductivity of Ln2M2O7 (Ln = Sm-Lu, M= Ti, Zr, Hf) Pyrochlores // Solid State Ionics. 2011. V. 192. № 1. P. 200–204. https://doi.org/10.1016/j.ssi.2010.07.013
Шляхтина А.В. Морфотропия, изоморфизм и полиморфизм сложных оксидов на основе Ln2M2O7 (Ln = La–Lu, Y, Sc; M= Ti, Zr. Hf, Sn) // Кристаллография. 2013. Т. 58. № 4. С. 545–560. https://doi.org/10.7868/S0023476113020252
Shlyakhtina A.V., Pigalskiy K.S., Belov D.A., Lyskov N.V., Kharitonova E.P., Kolbanev I.V., Borunova A.B., Karyagina O.K., Sadovskaya E.M., Sadykov V.A., Eremeev N.F. Proton and Oxygen Ion Conductivity in the Pyrochlore/Fluorite Family of Ln2−xCaxScMO7−δ (Ln = La, Sm, Ho, Yb; M = Nb, Ta; x = 0, 0.05, 0.1) Niobates and Tantalates // Dalton Trans. 2018. V. 47. № 7. P. 2376–2392. https://doi.org/10.1039/C7DT03912C
Sadykov V., Shlyakhtina A., Lyskov N., Sadovskaya E., Cherepanova S., Eremeev N., Skazka V., Goncharov V., Kharitonova E. Oxygen Diffusion in Mg-Doped Sm and Gd Zirconates with Pyrochlore Structure // Ionics. 2020. V. 26. № 1. P. 4621–4633. https://doi.org/10.1007/s11581-020-03614-5
Zuniga J.P., Gupta S.K., Abdou M., De Santiago H.A., Puretzky A.A., Thomas M.P., Guiton B.S., Lui J., Mao Y. Size, Structure and Luminescence of Nd2Zr2O7 Nanoparticles by Molten Salt Synthesis // J. Mater. Sci. 2019. V. 54. № 1. P. 12411–12424. https://doi.org/10.1007/s10853-019-03745-9
Lu X., Shu X., Shao D., Chen S., Zhang H., Yuan X., Chi F. Radiation Stability of Gd2Zr2O7 and Nd2Ce2O7 Ceramics as Nuclear Waste Forms // Ceram. Int. 2018. V. 44. № 1. P. 760–765. https://doi.org/10.1016/j.ceramint.2017.09.244
Farmer J., Boatner L., Chakoumakos B., Du M.-H., Lance M., Rawn C., Bryan J. Structural and Crystal Chemical Properties of Rare-Earth Titanate Pyrochlores // J. Alloys Compd. 2014. V.605. № 1. P. 63–70. https://doi.org/10.1016/j.jallcom.2014.03.153
Subramanian M.A., Aravamudan G., Subba Rao G.V. Oxide Pyrochlores. A Review // Prog. Solid State Chem. 1983. V. 15. № 2. P. 55−143. https://doi.org/10.1016/0079-6786(83)90001-8
Wang Y., Darapaneni P., Ofoegbuna T., Gupta S.K., Kizilkaya O., Mao Y., Dorman J.A. Effect of Oxide Ion Distribution on a Uranium Structure in Highly U-Doped RE2Hf2O7 (RE = La and Gd) Nanoparticles // Inorg. Chem. 2020. V. 59. № 19. P. 14070–14077. https://doi.org/10.1021/acs.inorgchem.0c01850
Комиссарова Л.Н., Шацкий В.М., Пушкина Г.Я., Щербакова Л.Г., Мамсурова Л.Г., Суханова Г.Е. Соединения редкоземельных элементов. Карбонаты, оксалаты, нитраты, титанаты. М.: Наука, 1984.
Попов В.В., Менушенков А.П., Ястребцев А.А., Коровин С.А., Тумаркин А.В., Писарев А.А., Царенко Н.А., Аржаткина Л.А., Аржаткина О.А. Влияние условий синтеза на структуру соединений, образующихся в системе Dy2O3–TiO2 // Журн. неорган. химии. 2016 Т. 61. № 4. С. 423–432. https://doi.org/10.7868/S0044457X16040152
Popov V.V., Menushenkov A.P., Gaynanov B.R., Ivanov A.A., d’Acapito F., Puri A., Shchetinin I.V., Zheleznyi M.V., Berdnikova M.M., Pisarev A.A., Yastrebtsev A.A., Tsarenko N.A., Arzhatkina L.A., Horozova O.D., Rachenok I.G., Ponkratov K.V. Formation and Evolution of Crystal and Local Structures in Nanostructured Ln2Ti2O7 (Ln = Gd-Dy) // J. Alloys Compd. 2018. V. 746. № 1. P. 377–390. https://doi.org/10.1016/j.jallcom.2018.02.263
Popov V.V., Menushenkov A.P., Gaynanov B.R., Ivanov A.A., Yastrebtsev A.A., d’Acapito F., Puri A., Castro G.R., Shchetinin I.V., Zheleznyi M.V., Zubavichus Ya.V., Ponkratov K.V. Comparative Analysis of Long- and Short-Range Structures Features in Titanates Ln2Ti2O7 and Zirconates Ln2Zr2O7 (Ln = Gd, Tb, Dy) upon the Crystallization Process // J. Phys. Chem. Solids. 2019. V. 130. № 1. P. 144–153. https://doi.org/10.1016/j.jpcs.2019.02.019
Альмяшева О.В. Формирование оксидных нанокристаллов и нанокомпозитов в гидротермальных условиях, строение и свойства материалов на их основе: Дис.…докт. хим. наук. Санкт-Петербург. 2017.
Lin K.-M., Lin C.-C., Hsiao C.-Y., Li Y.-Y. Synthesis of Gd2Ti2O7:Eu3+, V4+ Phosphors by Sol-Gel Process and Its Luminescent Properties // J. Lumin. 2007. V. 127. № 2. P. 561–567. https://doi.org/10.1016/j.jlumin.2007.03.010
Kaliyaperumal C., Sankarakumar A., Paramasivam T. Grain Size Effect on the Electrical Properties of Nanocrystalline Gd2Zr2O7 Ceramics // J. Alloys Compd. 2020. V. 813. № 1. P. 152221. https://doi.org/10.1016/j.jallcom.2019.152221
Huang Z., Deng J., Wang H., Zhang Y., Duan J., Tang Z., Cao Z., Qi J., He D., Lu T. Fast Low-Temperature Densification of Translucent Bulk Nanograin Gd2Zr2O7 Ceramics with Average Grain Size below 10 nm // J. Alloys Compd. 2020. V. 830. № 1. P. 154617. https://doi.org/10.1016/j.jallcom.2020.154617
Nayak C., Nigam S., Pandey M., Sudarsan V., Majumder C., Jha S.N., Bhatacharyya D., Vatsa R.K., Kshirsagar R.J. Nano-Size Effects on the Nature of Bonding in Y2Sn2O7: EXAFS and Raman Spectroscopic Investigations // Chem. Phys. Lett. 2014. V. 597. № 1. P. 51–56. https://doi.org/10.1016/j.cplett.2014.02.028
Chatterjee R., Chandra Das G., Chattopadhyay K.K. Luminescence Properties of Nano and Bulk ZnWO4:Eu3+ Phosphors for Solid State Lighting Applications // Mater. Res. Express. 2020. V. 7 № 1. P. 074002. https://doi.org/10.1088/2053-1591/aba0ed
Moreno K.J., Fuentes A.F., Maczka M., Hanuza J., Amador U.J. Structural Manipulation of Pyrochlores: Thermal Evolution of Metastable Gd2(Ti(1–y)Zry)2O7 Powders Prepared by Mechanical Milling // Solid State Chem. 2006. V. 179. № 12. P. 3805–3813. https://doi.org/10.1016/j.jssc.2006.08.023
Glerup M., Faurskov Nielsen O., Poulsen F.W. The Structural Transformation from the Pyrochlore Structure, A2B2O7, to the Fluorite Structure, AO2, Studied by Raman Spectroscopy and Defect Chemistry Modeling // J. Solid State Chem. 2001. V. 160. № 1. P. 25–32. https://doi.org/10.1006/jssc.2000.9142
Sanjuan M.L., Guglieri C., D’ıaz-Moreno S., Aquilanti G., Fuentes A.F., Olivi L., Chaboy J. Raman and X-ray Absorption Spectroscopy Study of the Phase Evolution Induced by Mechanical Milling and Thermal Treatments in R2Ti2O7 Pyrochlores // Phys. Rev. B. 2011. V. 84. № 1. P. 104207. https://doi.org/10.1103/PhysRevB.84.104207
Mullens B.G., Zhang Z., Avdeev M., Brand H.E.A., Cowie B.C.C., Muzquiz M.S., Kennedy B.J. Effect of Long and Short-Range Disorder on the Oxygen Ionic Conductivity of Tm2(Tm2−xTmx)O7−x/2 “Stuffed” Pyrochlores // Inorg. Chem. 2021. V. 60. № 7. P. 4517–4530. https://doi.org/10.1021/acs.inorgchem.0c03363
Popov V., Menushenkov A., Yaroslavtsev A., Zubavichus Y., Gaynanov B., Yastrebtsev A., Leshchev D., Chernikov R. Fluorite-Pyrochlore Phase Transition in Nanostructured Ln2Hf2O7 (Ln = La-Lu) // J. Alloys Compd. 2016. V. 689. № 1. P. 669–679. https://doi.org/10.1016/j.jallcom.2016.08.019
Hess N.J., Begg B.D., Conradson S.D., McCready D.E., Gassman P.L., Weber W.J. Spectroscopic Investigations of the Structural Phase Transition in Gd2(Ti1−yZry)2O7 Pyrochlores // J. Phys. Chem. B. 2002. V. 106. № 18. P. 4663–4677. https://doi.org/10.1021/jp014285t
Weber W.J., Ewing R.C. Plutonium Immobilization and Radiation Effects // Science 2000. V. 289. № 5487. P. 2051–2052. https://doi.org/10.1126/science.289.5487.2
Sattonnay G., Moll S., Thomé L., Decorse C., Legros C., Simon P., Jagielski J., Jozwik I., Monnet I. Phase Transformations Induced by High Electronic Excitation in Ion-Irradiated Pyrochlores // J. Appl. Phys. 2010. V. 108. № 1. P. 103512. https://doi.org/10.1063/1.3503452
Kreller C.R., Valdez J.A., Holesinger T.G., Morgan J., Wang Y., Tang M., Garzon F.H., Mukundan R., Brosha E.L., Uberuaga B.P. Massively Enhanced Ionic Transport in Irradiated Crystalline Pyrochlore // J. Mater. Chem. A. 2019. V.7. № 1. P. 3917–3923. https://doi.org/10.1039/C8TA10967B
Li Y.H., Wen J., Wang Y.Q., Wang Z.G., Tang M., Valdez J.A., Sickafus K.E. The Irradiation Effects of Gd2Hf2O7 and Gd2Ti2O7 // Nucl. Instrum. Methods Phys. Res., Sect. B. 287 (2012) 130–134. https://doi.org/10.1016/j.nimb.2012.06.003
Martos M., Julia’n-Lo’pez B., Cordoncillo E., Escribano P. Structural and Spectroscopic Study of a Novel Erbium Titanate Pink Pigment Prepared by Sol-Gel Methodology // J. Phys. Chem. B. 2008. V. 112. № 8. P. 2319–2325. https://doi.org/10.1021/jp077369w
Sastry R.L.N., Yoganarasimhan S.R., Mehrotra P.N., Rao C.N.R. Preparation, Characterization and Thermal Decomposition of Pr, Tb and Nd-carbonates // J. Inorg. and Nucl. Chem. 1966. V. 28. № 5. P. 1165–1177. https://doi.org/10.1016/0022-1902(66)80442-6
Caro P., Lemaitre-Blasé M. Hydroxycarbonates de Terre Rare Ln2(CO3)2(OH)2(3−x)⋅nH2O // C.R. Acad. Sci. 1969. V. 269. P. 687–690.
Aumont R., Genet F., Passaret M., Toudic Y. Preparation Par Voie Hydrothermale D′hydroxycarbonates D′elements des Terres Rares, et des Produits Correspondants Obtenus par Substitution de OH par Cl; Determination des Principaux Caracteres Cristallographiques // C.R. Acad. Sci. 1971. V. 272. P. 314–317.
Тьен Н.А., Миттова И.Я., Альмяшева О.В., Кириллова С.А., Гусаров В.В. Влияние условий получения на размер и морфологию нанокристаллического ортоферрита лантана // Физика и химия стекла. 2008. Т. 6. № 6. С. 992–998. https://doi.org/10.1134/S1087659608060138
Turcotte R.P., Sawyer J.O., Eiring L.R. On the Rare-Earth Dioxymonocarbonates and Their Decomposition // Inorg. Chem. 1969. V. 8. № 2. P. 238–246. https://doi.org/10.1021/ic50072a012
Шляхтина А.В., Воробьева Г.А., Щеголихин А.Н., Леонов А.В., Колбанев И.В., Стрелецкий А.Н. Фазообразование и поведение углеродсодержащих примесей в керамике Ln2O3:2HfO2 (Ln = Nd, Dy), синтезированной из механически активированной смеси оксидов // Неорган. материалы. 2020. Т. 56. № 5. С. 555–570. https://doi.org/10.31857/S0002337X20050127
Мамсурова Л.Г., Шабатин В.П., Шляхтина А.В., Щербакова Л.Г. Особенности криохимического синтеза титанатов редкоземельных элементов // Неорган. материалы. 1989. Т. 25. № 4. С. 637–641.
Миркин Л.И. Справочник по рентгеноструктурному анализу поликристаллов / Под ред. Уманского Я.С. М.: Изд-во физ.-мат. лит., 1961.
Escolástico S., Vert V.B., Serra J.M. Preparation and Characterization of Nanocrystalline Mixed Proton−Electronic Conducting Materials Based on the System Ln6WO12 // Chem. Mater. 2009. V. 21. № 14. P. 3079–3089. https://doi.org/10.1021/cm900067k
Shlyakhtina A.V., Shcherbakova L.G., Knotko A.V., Steblevskii A.V. Study of the Fluorite-Pyrochlore-Fluorite Phase Transitions in Ln2Ti2O7 (Ln = Lu, Yb, Tm) // J. Solid State Electrochem. 2004. V. 8. № 1. P. 661–667. https://doi.org/10.1007/s10008-003-0491-8
Ćulubrk S., Antić Ž., Marinović-Cincović M., Ahrenkiel P.S., Dramićanin M.D. Synthesis and Luminescent Properties of Rare Earth (Sm3+ and Eu3+) Doped Gd2Ti2O7 Pyrochlore Nanopowders // Opt. Mater. 2014. V. 37. № 1. P. 598–606. https://doi.org/10.1016/j.optmat.2014.08.001
Gupta S.K., Abdou M., Ghosh P.S., Zuniga J.P., Mao Y. Thermally Induced Disorder−Order Phase Transition of Gd2Hf2O7:Eu3+ Nanoparticles and Its Implication on Photo- and Radioluminescence // ACS Omega. 2019. V. 4. № 1. P. 2779–2791. https://doi.org/10.1021/acsomega.8b03458
Lyskov N.V., Shchegolikhin A.N., Stolbov D.N., Kolbanev I.V., Gomes E., Abrantes J.C.C., Shlyakhtina A.V. Study of Oxygen-Ion Conductivity and Luminescence in the ZrO2–Nd2O3 System: Impact of Local Heterogeneity // Electrochim. Acta. 2022. V. 403. № 1. P. 139632. https://doi.org/10.1016/j.electacta.2021.139632
You J., Ma L., Qu Y., Li R., Liu X., Guo R. UC/DC Luminescence of Ho3+ Doped Pyrochlore Structured La2(1–x)Yb2xTiO5 Phosphor Synthesized by Sol-Gel Method // J. Rare Earths. 2016. V. 34. № 3. P. 235–239. https://doi.org/10.1016/S1002-0721(16)60019-4
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы