Журнал неорганической химии, 2019, T. 64, № 12, стр. 1319-1325
Растворимость фолиевой кислоты и некоторых синтезированных фолатов металлов
Н. А. Скорик 1, *, Е. Н. Вострецова 1
1 Томский государственный университет
634050 Томск, пр-т Ленина, 36, Россия
* E-mail: Skorikninaa@mail.ru
Поступила в редакцию 05.03.2019
После доработки 22.04.2019
Принята к публикации 17.06.2019
Аннотация
Описаны синтез и свойства фолатов состава Li2C19H17N7O6 ⋅ 5H2O, PbC19H17N7O6 ⋅ 4H2O, CdC19H17N7O6 · 4H2O, Eu2(C19H17N7O6)3 · 12H2O. Для фолатов свинца(II), кадмия, европия(III) и фолиевой кислоты C19H19N7O6 · 2H2O при ионной силе I = 0.1 определены константы растворимости KS. Высказаны соображения об использовании растворимых солей европия(III) для извлечения фолиевой кислоты из растворов при pH ~6 в виде малорастворимого фолата европия (lg KS = –24.68 ± 0.11) с дальнейшей регенерацией из него в кислой среде фолиевой кислоты (на 99%) и об использовании фолиевой кислоты или растворимого фолата натрия в качестве антидота свинца.
ВВЕДЕНИЕ
Фолиевая кислота (витамин В9)
– жизненно важный витамин, недостаток которого недопустим для нормального функционирования организма человека на всех этапах его развития. Она участвует в процессе формирования кровеносной и иммунной систем. Фолиевая кислота обладает невысокой токсичностью: летальная доза (ЛД50, в мг/кг) составляет 10 000 (мыши, перорально) и 282 (мыши, внутривенно) [1], но препараты фолиевой кислоты являются не безопасными витаминами, передозировка вещества очень опасна. Дозы фолиевой кислоты более 4 мг в сутки могут обладать токсическим эффектом [2].
Антидота к витамину В9 не существует (антидоты – вещества, инактивирующие яды посредством химической реакции). Сама фолиевая кислота является антидотом метилового спирта, при серьезных поражениях метиловым спиртом рекомендуют добавлять к терапии производные фолиевой кислоты [3]. Основными метаболитами метанола являются формальдегид и муравьиная кислота (CH3OH → CH2O → CHOOH → CO2 + + H2O). Считается, что введение фолиевой кислоты усиливает метаболизм муравьиной кислоты [4]. У получавших ее пациентов наблюдался терапевтический эффект, состоящий в снижении ацидоза. Недостатком препаратов с фолиевой кислотой, которые вводят с помощью капсул, таблеток, является то, что в желудке под действием кислот они распадаются, малорастворимая фолиевая кислота осаждается, при этом только часть введенной фолиевой кислоты достигает кишечника. Предпринимаются различные попытки увеличения растворимости фолиевой кислоты. Были исследованы [5] полиамидоаминные дендримеры для повышения растворимости фолиевой кислоты в воде при pH 11 и 5. В процессе растворения при рН 11 доминирует электростатическое взаимодействие между первичными аминами дендримеров и ионизированными карбоксильными группами фолиевой кислоты, а увеличение растворимости фолиевой кислоты при рН 5 объясняется гидрофобным капсулированием ее молекул внутри дендримера.
Фолиевая кислота находит широкое применение. Это малорастворимое соединение, но в литературе отсутствуют данные о его константе растворимости KS. По данным [6], величина растворимости фолиевой кислоты у разных авторов находится в интервале 3.6 × 10–3−3.6 × 10–6 моль/л (25°C). В литературе имеется не так много данных о синтезе, растворимости солей фолиевой кислоты и их свойствах. В работе [7] описан синтез из водных растворов фолатов металлов MFol ⋅ nH2O (M2+ = = Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+; n = 4–6) при мольном соотношении M2+ : H2Fol = 1 : 1 и pH 5.5–6.6. Авторы [8] синтезировали соединения, имеющие общую формулу [M2Fol(Cl)x(H2O)y] · zH2O, где M = Mn2+, Fe3+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+ и Hg2+. Для синтезированных солей x = 2 или 4, y = 2 или 4 и z = 0, 1, 2, 3, 5 или 15. Полученные соединения исследованы с помощью элементного и термогравиметрического анализов, инфракрасной и электронной спектроскопии поглощения. Измерения молярной проводимости показали, что эти соли являются электролитами. Синтезированы соединения состава Kn[M(Fol)2(H2O)2] · xH2O, где M = Cu2+ или Fe3+, n = 2 или 1, Fol2− – фолат-анион, x = 2 или 3. Соли охарактеризованы при помощи элементного и термогравиметрического анализов, ИК-спектров и поляризации света, а также показана их бóльшая эффективность, чем самой фолиевой кислоты, поглощения кровью грызунов [9]. Синтезированы и исследованы новые смешанолигандные соединения с никотиновой (C6H5NO2, NA) или фолиевой (FA) кислотой и глицином (C2H5NO2, G) [10]. Смешанолигандным соединениям двухвалентных металлов с фолиевой кислотой и глицином приписан состав [MFAGCl2] · · 2H2O (М = Cu2+, Mn2+, Ni2+, Pb2+, Cd2+). Разнообразие в составе и структуре фолатов металлов можно объяснить поведением карбоксильной группы, функционирующей как моно- или бидентатный лиганд, связанный с одним ионом металла, или как мостиковый бидентатный лиганд, связанный с двумя ионами металла [11].
Растворимость в воде – одна из наиболее важных физико-химических характеристик вещества, учет которой имеет большое значение при решении различных задач химической технологии, медицины (например, при определении дозы, метода транспортировки лекарственного препарата). Цель настоящей работы – изучение некоторых свойств, в том числе растворимости при ионной силе I = 0.1 и 23°C, фолиевой кислоты и синтезированных фолатов лития, европия(III), свинца(II) и кадмия.
ОБЪЕКТЫ И МЕТОДЫ
Термическая стабильность используемой нами фармацевтической фолиевой кислоты С19H19N7O6 ⋅ 2H2O и синтезированных солей изучена на приборе марки Netzsch STA 449 C. Электронные спектры поглощения растворов фолата лития, насыщенных растворов фолиевой кислоты и ее малорастворимых солей снимали на спектрофотометре Leki SS2107UV. В растворах, приготовленных на бидистиллированной воде, pH измеряли на pH-метре марки рН-673, стеклянный электрод которого калибровали по буферным растворам с pH в интервале 3.56–6.86. ИК-спектры фолиевой кислоты и ее солей в таблетках из KBr получены на спектрометре ThermoNicollet NEXUS FTIR в области частот 4000–350 см−1. Синтезированные соли анализировали методом автоматического элементного CHNS-анализа на анализаторе Euro EA 3000 с применением микровесов Sartorius MSE 3.6P-000-DM.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Необходимую для синтеза солей малорастворимую фолиевую кислоту можно перевести в раствор взаимодействием с гидроксидами (при мольном соотношении H2Fol : NaOH = 1 : 2) или карбонатами щелочных металлов (1 : 1). Выделение осадков фолатов свинца(II), кадмия и европия(III) проводили из водных растворов с pH 6.5–6.9 при мольном соотношении М2+: H2Fol = 1 : 1 (для Eu2Fol3 − 1 : 1.5). В указанном интервале рН фолиевая кислота при взаимодействии с двух- и трехвалентными катионами ведет себя как двухосновная кислота. При синтезе фолатов раствор нитрата металла сливали с раствором фолиевой кислоты с pH 6.7–7.0 (навеску кислоты растворяли в 0.1 моль/л растворе NaOH при мольном соотношении H2Fol : NaOH ≈ 1 : 2). Выделенные соли промывали ледяной водой, сушили на воздухе, выход продуктов составлял 60–70%. Синтез фолата лития осуществляли по реакции взаимодействия карбоната лития с фолиевой кислотой:
Выделенные фолаты имеют желто-оранжевую окраску. Анализ солей на содержание соответствующего оксида проводили термическим способом, выдерживая соли в течение 2 ч при 800–900°С (погрешность 0.2–0.5%). Термогравиметрически (погрешность ~2%) определяли содержание воды, фолат-аниона в фолиевой кислоте и солях, а в фолатах – еще и содержание оксида, поскольку удаление воды, деструкция фолата и образование соответствующего оксида металла протекают в различных температурных интервалах (табл. 1).
Таблица 1.
Анализ термограмм фолиевой кислоты и ее солей
| Характер эффекта | Температурный интервал, °С | Потеря массы (от начальной), % | Соответствующий процесс | |
|---|---|---|---|---|
| найдено | вычислено | |||
| PbFol ⋅ 4H2O | ||||
| Группа эндо-, экзоэффектов | 175–280 | 9.7 | 10.03 | Потеря воды |
| Экзоэффект | 280–560 | 60.8 | 58.89 | Деструкция фолат-иона |
| Эндоэффект | 560–900 | 30.8 | 31.08 | Образование оксида PbO |
| Eu2Fol3 · 12H2O | ||||
| Группа эндо- эффектов | 170–340 | 10.5 | 11.75 | Потеря воды |
| Экзоэффект | 340–510 | 68.6 | 69.10 | Деструкция фолат-иона |
| Эндоэффект | 600–900 | 21.3 | 19.15 | Образование оксида Eu2O3 |
| CdFol · 4H2O | ||||
| Эндоэффект | 125–240 | 10.3 | 11.54 | Потеря воды |
| Экзоэффект | 240–590, 590–900 |
67.0 21.7 |
70.44 20.58 |
Деструкция фолат-иона, образование оксида CdO |
| H2Fol · 2H2O | ||||
| Эндоэффект | 164.7 | 7.8 | 7.54 | Потеря воды |
| Группа экзо-, эндоэффектов | 234–700 | 90.9 | 92.46 | Деструкция и сгорание H2Fol |
| Li2Fol ⋅ 5H2O | ||||
| Эндоэффект | 80–280 | 15.9 | 16.57 | Потеря воды |
| Группа эндо-, экзоэффектов | 280–780 | 78.9 | 77.94 | Деструкция фолат-иона |
| Эндоэффекты | 780–900 | 5.5 | 5.49 | Образование оксида Li2O |
Результаты этих анализов (содержание оксида металла в солях является усредненными данными термического и термогравиметрического анализов), а также элементного анализа фолатов на содержание углерода, азота и водорода приведены в табл. 2.
Таблица 2.
Данные элементного, термического и термогравиметрического анализов фолатов лития, свинца(II), европия(III) и кадмия
| Соединение | N, % | C, % | H, % | MxOy, % | H2O, % | Fol2−, % | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| н | в | н | в | н | в | н | в | н | в | н | в | |
| PbC19H17N7O6 ⋅ 4H2O | 13.5 | 13.65 | 31.5 | 31.75 | 3.1 | 3.48 | 30.9 | 31.08 | 8.7 | 10.03 | 60.8 | 58.89 |
| Eu2(C19H17N7O6)3 ⋅ 12H2O | 15.6 | 16.00 | 35.8 | 37.23 | 3.5 | 2.78 | 21.0 | 19.16 | 10.5 | 11.76 | 68.6 | 69.08 |
| CdC19H17N7O6 ⋅ 4H2O | 14.4 | 15.71 | 35.3 | 36.55 | 3.3 | 4.01 | 21.4 | 20.58 | 10.3 | 11.54 | 67.0 | 70.38 |
| Li2C19H17N7O6 ⋅ 5H2O | − | − | − | − | − | − | 5.7 | 5.49 | 15.9 | 16.57 | 78.9 | 77.94 |
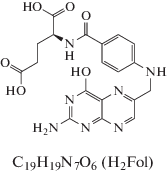
Для определения растворимости фолиевой кислоты и ее солей небольшое количество фолатов кадмия и свинца помещали в 0.1 М раствор NaNO3, а фолиевой кислоты и фолата европия – в 0.1 М раствор NaCl. Суспензии периодически встряхивали в сосудах с притертыми пробками, несколько дней выдерживали до установления гетерогенного равновесия (постоянство значения рН). Равновесную концентрацию фолат-аниона в насыщенных растворах определяли спектрофотометрически, используя градуировочные характеристики на основе растворов фолата лития Li2Fol ⋅ 5H2O известной концентрации (рис. 1).
Рис. 1.
Зависимость оптической плотности раствора фолата лития от концентрации фолат-аниона (R2 = = 0.999).
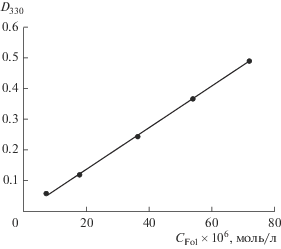
Электронные спектры поглощения (рис. 2) растворов фолатов свинца(II) и кадмия снимали по отношению к 0.1 М раствору NaNO3, так как нитрат-анион поглощает в области 270–330 нм; фолата европия и фолиевой кислоты в 0.1 М растворе NaCl – по отношению к воде. Из рис. 2 видно, что растворы фолиевой кислоты и всех ее солей имеют максимум поглощения при одной и той же длине волны (280 нм). Поэтому для изучаемых систем можно использовать градуировочные характеристики на основе фолата лития при определении содержания фолат-иона в растворе.
Рис. 2.
Электронные спектры поглощения растворов: 1 – Li2Fol (СFol = 5.00 × 10–5 моль/л, pH 6.93), 2 – H2Fol (СFol = 4.50 × 10–5 моль/л, pH 4.89), 3 –PbFol (СFol = 4.00 × 10–5 моль/л, pH 6.64), 4 – CdFol (СFol = = 3.78 × 10–5 моль/л, pH 6.97), 5 – Eu2Fol3 (CFol = = 1.18 × 10–5 моль/л, pH 5.83).
Данные по растворимости фолиевой кислоты, фолатов металлов и результаты расчета их констант растворимости KS содержатся в табл. 3, 4.
Таблица 3.
Данные по растворимости и результаты расчета константы растворимости фолиевой кислоты H2Fol ⋅ ⋅ 2H2O (23°С, I = 0.1, B1 = 1.00 × 109, B2 = 5.62 × 1015, B3 = 2.51 × 1020 [12])
| pH | h, моль/л |
f | λ, нм | D | СFol, моль/л | [Fol3−], моль/л | –lg KS |
|---|---|---|---|---|---|---|---|
| 4.89 | 1.29 $ \times $ 10–5 | 1.49 $ \times $ 106 | 340 | 0.277 | 4.50 $ \times $ 10–5 | 3.02 $ \times $ 10–11 | 20.30 |
| 5.03 | 9.33 $ \times $ 10–6 | 7.02 $~ \times $ 105 | 400 | 0.138 | 1.26 $~ \times $ 10−4 | 1.79 $ \times $ 10−10 | 19.81 |
| 4.84 | 1.45 $ \times $ 10–5 | 1.96 $~ \times $ 106 | 400 | 0.135 | 1.13 $ \times $ 10−4 | 5.76 $~ \times $ 10−11 | 19.92 |
| 4.91 | 1.23 $ \times $ 10–5 | 1.33 $ \times $ 106 | 340 | 0.280 | 4.51 $ \times $ 10–5 | 3.39 $ \times $ 10–11 | 20.29 |
| 4.86 | 1.39 $ \times $ 10–5 | 1.77 $ \times $ 106 | 340 | 0.275 | 4.48 $ \times $ 10–5 | 2.53 $ \times $ 10–11 | 20.31 |
| 4.95 | 1.12 $ \times $ 10–5 | 1.07 $ \times $ 106 | 400 | 0.142 | 1.30 $~ \times $ 10−4 | 1.22 $~ \times $ 10−10 | 19.82 |
Таблица 4.
Данные по растворимости и результаты расчета констант растворимости фолатов свинца(II), кадмия и европия(III) (Kh(Eu3+) = 1.23 × 10–8, Kh (Pb2+) = 2.70 × 10–8, Kh (Cd2+) = 1.00 × 10–9; I = 0.1; lgB1 = 6.75, lgB2 = = 11.40)
| Соединение | pH | f | λ, нм | D | СFol, моль/л | [Fol2−], моль/л | [Mn+], моль/л | –lgKS | $ - \lg {{\bar {K}}_{S}}$ |
|---|---|---|---|---|---|---|---|---|---|
| PbFol ⋅ 4H2O | 6.65 | 1.754 | 330 | 0.247 | 4.02 × 10–5 | 2.29 × 10–5 | 4.02 × 10–5 | 9.23 | 9.21 ± 0.05 |
| 6.62 | 1.809 | 0.243 | 3.97 × 10–5 | 2.19 × 10–5 | 3.97 × 10–5 | 9.19 | |||
| 6.64 | 1.773 | 0.244 | 4.00 × 10–5 | 2.26 × 10–5 | 4.00 × 10–5 | 9.21 | |||
| CdFol ⋅ 4H2O | 7.01 | 1.326 | 400 | 0.209 | 1.88 × 10–4 | 1.42 × 10–4 | 1.88 × 10–4 | 7.65 | 7.64 ± 0.02 |
| 6.99 | 1.341 | 0.208 | 1.87 × 10–4 | 1.39 × 10–4 | 1.87 × 10–4 | 7.64 | |||
| 7.05 | 1.297 | 0.211 | 1.90 × 10–4 | 1.46 × 10–5 | 1.90 × 10–4 | 7.63 | |||
| Eu2Fol3 ⋅ 12H2O | 5.81 | 6.731 | 330 | 0.327 | 5.38 × 10−5 | 2.40 × 10–5 | 3.59 × 10−5 | 24.74 | 24.68 ± 0.11 |
| 5.88 | 5.802 | 0.328 | 5.40 × 10−5 | 2.79 × 10–5 | 3.60 × 10−5 | 24.54 | |||
| 5.87 | 5.924 | 0.329 | 5.42 × 10−5 | 2.74 × 10–5 | 3.61 × 10−5 | 24.56 | |||
| 5.82 | 6.587 | 0.329 | 5.42 × 10−5 | 2.47 × 10–5 | 3.61 × 10−5 | 24.70 | |||
| 5.83 | 6.447 | 0.322 | 5.30 × 10−5 | 2.47 × 10–5 | 3.53 × 10−5 | 24.72 | |||
| 5.78 | 7.187 | 0.328 | 5.40 × 10−5 | 2.25 × 10–5 | 3.60 × 10−5 | 24.82 |
Константы растворимости KS фолатов европия(III), свинца(II) и кадмия (без учета комплексообразования в растворе) рассчитывали с помощью следующих равновесий:
(1)
${\text{E}}{{{\text{u}}}_{{\text{2}}}}{\text{Fo}}{{{\text{l}}}_{{{\text{3(}}}}}_{{{\text{т)}}}} \leftrightarrows {\text{E}}{{{\text{u}}}_{{\text{2}}}}{\text{Fo}}{{{\text{l}}}_{{{\text{3(p)}}}}} \leftrightarrows {\text{2Eu}}_{{{\text{(p)}}}}^{{3 + }} + {\text{3Fol}}_{{({\text{p}})}}^{{2 - }}{\text{,}}$(2)
$\begin{gathered} {\text{MFo}}{{{\text{l}}}_{{\text{(}}}}_{{{\text{т)}}}} \leftrightarrows {\text{MFo}}{{{\text{l}}}_{{{\text{(p)}}}}} \leftrightarrows {{{\text{M}}}^{{{\text{2 + }}}}}_{{{\text{(p)}}}} + {\text{Fol}}_{{{\text{(p)}}}}^{{2 - }} \\ {\text{(}}{{{\text{М}}}^{{{\text{2 + }}}}}{\text{ = P}}{{{\text{b}}}^{{{\text{2 + }}}}}{\text{, C}}{{{\text{d}}}^{{{\text{2 + }}}}}{\text{)}}{\text{.}} \\ \end{gathered} $Из равновесий (1), (2) следует, что CEu = 2Ссоли, CM = Ссоли, где Ссоли – концентрация соли металла (моль/л) в ее насыщенном растворе. При учете равновесия (3), гидролиза иона металла соли по первой ступени с константой равновесия Kh1 (константа гидролиза):
(3)
${{{\text{M}}}^{{n{\text{ + }}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}\overset {{{K}_{{h1}}}} \longleftrightarrow {\text{MO}}{{{\text{H}}}^{{n\,\, - \,\,1}}} + {{{\text{H}}}^{{\text{ + }}}}{\text{,}}$Уравнение (5) материального баланса по аниону в насыщенном растворе солей имеет вид:
(5)
${{C}_{{{\text{Fol}}}}} = {\text{ [}}{{{\text{H}}}_{{\text{2}}}}{\text{Fol}}] + [{\text{Hfo}}{{{\text{l}}}^{ - }}] + [{\text{Fo}}{{{\text{l}}}^{{2 - }}}] = [{\text{Fo}}{{{\text{l}}}^{{2 - }}}]f,$KS(Eu2Fol3 ⋅ 12H2O) = [Eu3+]2[Fol2−]3 = = (2Cсоли/ω)2(3Ссоли/f)3 = 108$C_{{{\text{соли}}}}^{5}$/ω2f 3; KS(MFol ⋅ ⋅ 4H2O) = [M2+][Fol2−] = (Cсоли/ω)(Ссоли/f) = $C_{{{\text{соли}}}}^{2}$/ωf. Константа растворимости фолата европия была оценена также по данным растворимости соли с учетом комплексообразования (табл. 5).
Таблица 5.
Данные по растворимости, расчету константы растворимости Eu2Fol3 ⋅ 12H2O и константы устойчивости комплекса [EuFol]+ (I = 0.1, Kh1 (Eu3+) = = 1.23 × 10–8, lgB1 = 6.75, lgB2 = 11.40)
| CFol, моль/л | CEu, моль/л | D300 | pH | –lg KS |
|---|---|---|---|---|
| 1.68 $ \times $ 10–4 | 1.12 $ \times $ 10–4 | 0.397 | 5.34 | 25.44 |
| 1.09 $ \times $ 10–4 | 7.27 $ \times $ 10–5 | 0.279 | 5.72 | 25.54 |
| 1.41 $ \times $ 10–4 | 9.40 $ \times $ 10–5 | 0.342 | 5.39 | 25.61 |
Результаты расчета по программе “Растворимость” [13]: lg β1 (оптим.) = 5.82, β1 = 6.63 × 105; стандартное отклонение s2 = 1.60 × 10−2; lgKS (средн.) = –25.53.
Для гетерогенного равновесия (6) с участием фолиевой кислоты:
(6)
${{{\text{H}}}_{{\text{3}}}}{\text{Fo}}{{{\text{l}}}_{{{\text{(т)}}}}} \leftrightarrows {{{\text{H}}}_{{\text{3}}}}{\text{Fo}}{{{\text{l}}}_{{{\text{(p)}}}}} \leftrightarrows {\text{3H}}_{{({\text{p}})}}^{ + } + {\text{Fol}}_{{({\text{p}})}}^{{3 - }}$(7)
$\begin{gathered} {{C}_{{{\text{Fol}}}}} = {\text{ [}}{{{\text{H}}}_{{\text{3}}}}{\text{Fol}}] + [{{{\text{H}}}_{{\text{2}}}}{\text{Fo}}{{{\text{l}}}^{ - }}] + \\ + \,\,{\text{[Hfo}}{{{\text{l}}}^{{2 - }}}] + [{\text{Fo}}{{{\text{l}}}^{{3 - }}}] = [{\text{Fo}}{{{\text{l}}}^{{3 - }}}]f, \\ \end{gathered} $Для установления возможности количественной регенерации фолиевой кислоты из малорастворимого фолата европия(III) навеску соли m(Eu2Fol3 ⋅ 12H2O) = 0.1756 г помещали в 6.5 мл 0.11 М раствора соляной кислоты. Через 30 мин наблюдали появление новой фазы – желтого осадка фолиевой кислоты. Со временем (несколько суток) желто-оранжевый осадок соли полностью переходил в желтый. Масса выделенной фолиевой кислоты С19H19N7O6 ⋅ 2H2O составила 0.1359 г (99%, по сравнению с рассчитанной 0.1367 г).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фолиевая кислота имеет низкую растворимость в воде, что создает трудности при синтезе ее солей, когда необходимо создавать рН не ниже 5.5, чтобы происходило выделение фолата металла, а не самой фолиевой кислоты, так как последняя уже при рН 4.7 образует гель. Для этого исходный раствор фолиевой кислоты должен иметь рН 6.7–7.0 (H2Fol : NaOH ≈ 1 : 2).
Молекула фолиевой кислоты представляет собой трехосновную кислоту, от которой последовательно отщепляются два протона карбоксильных групп глутаминового остатка, и только избыток ОН-групп в растворе приводит к отрыву протона от группы NH3+ цвиттер-иона (pH > 8). На рис. 3 представлена диаграмма распределения различных форм фолиевой кислоты.
Рис. 3.
Диаграмма выхода частиц фолиевой кислоты: 1– H3Fol, 2 – H2Fol–, 3 – HFol2–, 4 – Fol3– (lg B1 = = 9.00, lg B2 = 15.75, lg B3 = 20.40; pK1 = 4.65, pK2 = 6.75, pK3 = 9.00).
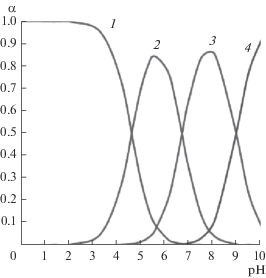
Из диаграммы выхода частиц фолиевой кислоты можно сделать вывод, что в области pH 5.8–7.0, ~5.5 (табл. 4, 5), в которой изучали растворимость фолатов свинца(II), кадмия и европия(III), выход частиц H3Fol составляет ∼0.05–0.02 (5–2%), 0.09 (9%) соответственно. Пренебрегая этими величинами, можно считать кислоту двухосновной. С учетом данных по растворимости фолиевой кислоты (pH ~4.9) выход частиц H3Fol составляет ∼0.25 (25%), поэтому расчет константы растворимости фолиевой кислоты сделан на основании ее трехосновности (табл. 3).
При синтезе фолатов металлов в области рН 6.5–6.9 (в растворе доминируют ионы HFol− и Fol2−) ионы металлов взаимодействуют не только с ионами Fol2−, но и с протонированными фолат-ионами с вытеснением протона:
В ИК-спектрах полученных фолатов металлов отсутствует полоса поглощения валентных колебаний неионизированной карбоксильной группы фолиевой кислоты при 1770.8 см–1, а вместо нее появляются полосы в области 1596–1602 и 1404–1448 см–1, обусловленные валентными колебаниями ионизированных карбоксильных групп. Эти данные свидетельствуют о том, что при синтезе солей из растворов в области рН 6.5−6.9 не происходит загрязнения их осадков фолиевой кислотой.
По данным растворимости фолата европия и фолиевой кислоты в 0.1 М растворе NaCl, фолатов кадмия и свинца в 0.1 М растворе NaNO3 рассчитаны величины констант растворимости данных соединений (табл. 3, 4), которые можно использовать на практике. Низкую растворимость фолиевой кислоты связывают с наличием прочных межмолекулярных водородных связей в твердой фазе, что приводит к более или менее заметной ассоциации молекул, которая возможна в любом агрегатном состоянии вещества. Благодаря водородным связям в результате ассоциации молекул могут образовываться димеры, линейные или цепочечные полимерные частицы. Такое взаимодействие должно затруднять отрыв молекул друг от друга, т.е. уменьшать растворимость, летучесть вещества, увеличивать его термическую стабильность. Так, согласно данным табл. 1, потеря кристаллизационной воды у фолиевой кислоты наблюдается при достаточно высокой температуре (~165°С) при нагревании на воздухе и при 145°С – под глубоким вакуумом, при этом вещество становится гигроскопичным [14]. В атмосфере сухого газообразного азота при 100°С происходит потеря адсорбированной воды [15]. Попытка авторов указанной работы идентифицировать продукты термического разложения фолиевой кислоты с использованием ИК-, масс-спектроскопии и дифракции рентгеновских лучей привела к предположению, что вода, фрагмент глутаминовой кислоты удаляются первыми, затем – остальные составляющие фолиевой кислоты.
При нагревании синтезированных фолатов металлов потеря их кристаллизационной воды протекает в интервале 80–300°С, деструкция фолат-аниона – при 240–600°С.
Фолат европия(III) Eu2Fol3 ⋅ 12H2O (KS = 2.1 × × 10−25), дающий при диссоциации в насыщенном растворе пять ионов, как и оксалаты лантаноидов (Ln) состава Ln2(C2O4)3 ⋅ (5−10)H2O (KS = = 10−25−10−29), по растворимости похож на них [16]. Найденное по данным растворимости фолата европия для комплексного иона [EuFol]+ значение lg β1 = 5.82 удовлетворительно согласуется с данными по устойчивости глутаминатных комплексов других редкоземельных элементов: так, величина lg β1(LnGlut+) (Ln = Nd–Er) изменяется в интервале 4.77–5.94 [17]. Это сходство связано с тем, что в состав фолиевой кислоты входит остаток глутаминовой кислоты, являющийся определяющим в комплексообразовании.
Растворение солей является сложным физико-химическим процессом, механизм которого не исследован в достаточной степени, поэтому в каждом конкретном случае растворимость солей определяется экспериментально. Строгая теория растворимости химических соединений в настоящее время отсутствует, но имеются некоторые полуэмпирические правила. Так, в [18] показано, что минимальная растворимость простых и комплексных солей в воде достигается при отношении радиусов ионов rM/rL для солей типа ML, равном 0.7, а для солей типа МL2 – 1.1. Найдена корреляция растворимости солей и разности масс между анионами (L) и катионами (K) для галогенидов, карбонатов, сульфатов, нитратов ионов щелочных, щелочноземельных металлов и иона аммония [19]. Характер корреляции определяется типом аниона. Растворимость солей повышается с увеличением разности масс. Авторы предполагают, что независимо от сложности состава солей разность масс, отнесенная к молекулярной массе соединения (MM)
Применение эмпирического подхода разности масс к растворимости фолатов свинца(II) и кадмия приводит к следующему. Увеличению гетерополярности связи (0.359 (PbFol) и 0.593 (CdFol)), оцененной с использованием понятия разности масс, соответствует и увеличение растворимости фолата кадмия по сравнению с фолатом свинца (величина KS фолатов свинца(II) и кадмия составляет соответственно 6.17 × 10−10 и 2.29 × 10−8).
Для извлечения фолиевой кислоты из биологических жидкостей (рН ~6) за счет образования малорастворимой соли состава Eu2(C19H17N7O6)3 ⋅ ⋅ 12H2O (lg KS = –24.68 по данным растворимости соли без учета комплексообразования и lg KS = –25.53 с его учетом) могут быть использованы растворимые соли европия(III) (хлорид, нитрат). Из выделенного осадка фолата европия(III) в кислом растворе с невысокой концентрацией сильной кислоты (необходимо учитывать амфотерность фолиевой кислоты) происходит ее количественное выделение (99%) в виде осадка, регенерируется также в растворе и ион европия.
Предельно допустимая концентрация ионов свинца в питьевой воде составляет 0.03 мг/л или 6.21 × 10−3 моль/л (СП 2.1.4.1075-01). Поскольку определенное нами значение KS(PbFol ⋅ 4H2O) = = 6.17 × 10−10, равновесная концентрация ионов свинца в насыщенном растворе фолата свинца составляет 2.5 × 10−5 моль/л, что ниже ПДК свинца. В связи с этим, вероятно, возможно применение фолиевой кислоты, а лучше ее растворимых солей, например фолата натрия, в качестве антидота при отравлении ионами свинца. Фолат-анион при этом уменьшает всасывание ионов свинца в кровь из желудочно-кишечного тракта за счет образования малорастворимого фолата свинца, который выводится из организма.
Список литературы
Kleemann A. Pharmaceutical Substances. Thieme. Pdf. 4Th Ed 2000. P. 925.
Карпов О.И., Зайцев А.А. Риск применения лекарств при беременности и лактации. Справочное руководство. СПб., 1998. 352 с.
Flanagan R.J., Jones A.L. Antidotes. Taylor and Francis. London, 2002. 326 p.
Moghadami M., Masoumpoor M., Tabei S.M.B. et al. // Iran. J. Med. Sci. 2008. V. 33. № 1. P. 22.
Zhang Yong, Xu Mei-Ying, Jiang Tie-Kun et al. // Chin. Chem. Lett. 2014. V. 25. № 5. P. 815.
Yalkowsky Samuel H., He Yan, Jain Parijat. Handbook of Aqueous Solubility Data. CRC Press. 2010. 1608 p.
Skorik N.A. // Russ. J. Inorg. Chem. 2015. V. 60. № 11. P. 1402. [Скорик Н.А. // Журн. неорган. химии. 2015. Т. 60. № 11. С. 1531.]
El-Wahed A.M.G., Refat M.S., El-Megharbel S.M. // Spectrochim. Acta, Part A: Molecular and Biomolecular Spectroscopy. 2008. V. 70. № 4. P. 916.
Hamed E., Attia M.S., Bassiouny K. // Bioinorg. Chem. Appl. V. 2009. Article ID 979680.https://doi.org/10.1155/2009/979680
Fazary Ahmed E., Ju Yi-Hsu, Rajhi Aisha Q. et al. // Open Chem. 2016. V. 14. № 1. P. 287.
Deacon G.B., Phillips R.J. // Coord. Chem. Rev. 1980. V. 33. P. 227.
Досон Р., Эллиот Д., Эллиот У., Джонс К. Справочник биохимика / Пер. с англ. М.: Мир, 1991. 544 с.
Скорик Н.А., Чернов Е.Б. Расчеты с использованием персональных компьютеров в химии комплексных соединений. Томск, 2009. 90 с.
Шнайдман Л.О. Производство витаминов. М.: Пищевая промышленность, 1973. 443 с.
Vora A., Riga A., Dollimore D., Alexander K.S. // Thermochim. Acta. V. 392–393. 2002. P. 209.
Яцимирский К.Б., Костромина Н.А., Шека З.А. и др. Химия комплексных соединений редкоземельных элементов. Киев: Наук. думка, 1966. С. 177.
Севрюгина Ю.Ю. Автореф. дис. … канд. фарм. наук. М., 1994. 19 с.
Яцимирский К.Б. Термохимия комплексных соединений. М.: Изд-во АН СССР, 1951. 251 с.
Шулындин А.А. // Вестн. Моск. ун-та. Сер. 2. Химия. 1999. Т. 40. № 4. С. 233.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии