Журнал неорганической химии, 2019, T. 64, № 12, стр. 1312-1318
Полиэдры гомогенности и первичной кристаллизации халькопирита в тетраэдре Cd–Ge–Mn–As
Г. Д. Нипан 1, *, А. Н. Аронов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: nipan@igic.ras.ru
Поступила в редакцию 18.03.2019
После доработки 17.04.2019
Принята к публикации 17.06.2019
Аннотация
Методом топологического представления фазовых состояний с использованием фрагментарных экспериментальных данных построены изотермы T–x–y–z-проекции p–T–x–y–z фазовой диаграммы системы Cd–Ge–Mn–As. В отсутствие расплава (ниже 320°C) установлено 18 стабильных равновесий с участием четырех кристаллических фаз. Для ограниченного твердого раствора (Cd,Ge,Mn)As2 со структурой халькопирита выделено 8 кристаллических фаз, влияющих на его катионный состав: Cd3As2, CdAs2, GeAs, GeAs2, Ge, MnAs, MnGeAs2 и As. Показано, что область гомогенности (Cd,Ge,Mn)As2 представляет собой 14-вершинный девятигранник, и рассмотрена трансформация полиэдра (Cd,Ge,Mn)As2 при появлении расплава. Представлена модель полиэдра первичной кристаллизации ограниченного твердого раствора (Cd,Ge,Mn)As2, находящегося в равновесии с насыщенным паром.
ВВЕДЕНИЕ
Идея аддитивного совмещения полупроводниковых и ферромагнитных свойств в однофазном материале с помощью твердых растворов [1, 2] упирается в неизоморфизм исходных кристаллических структур. Однако в большинстве случаев сохраняется возможность получения ограниченного твердого раствора, для которого растворимость элементов-допантов определяется фазами, находящимися с ним в равновесии.
Физико-химические исследования твердого раствора (Cd,Ge,Mn)As2 [3] со структурой халькопирита, ограниченные рамками псевдобинарных систем CdGeAs2–Mn [3], CdGeAs2–MnAs [4] и CdGeAs2–MnGeAs2 [5], не позволяют составить полную картину фазовых равновесий с участием (Cd,Ge,Mn)As2 и установить границы гомогенности этого твердого раствора в четверной системе Cd–Ge–Mn–As.
Цель настоящей работы – построение ключевых изотерм T–x–y–z-проекции p–T–x–y–z фазовой диаграммы системы Cd–Ge–Mn–As (p – давление, T – температура, x, y, z – независимые координаты состава), изотермического полиэдра ограниченного твердого раствора со структурой халькопирита (Cd,Ge,Mn)As2 в отсутствие расплава и полиэдра первичной кристаллизации (Cd,Ge,Mn)As2, находящегося в равновесии с насыщенным паром.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Полупроводниковая кристаллическая фаза CdGeAs2 со структурой халькопирита ограниченно растворяет Mn, и в этом физико-химическом исследовании базовой является система Cd–Ge–As, для которой первая диаграмма стабильных фазовых равновесий построена полвека назад [6]. За прошедшее время были уточнены температуры и состав расплава для нонвариантных эвтектических равновесий SSSLV с участием трех кристаллических фаз, расплава и пара [7–12], а также получены метастабильные кристаллические фазы Cd2GeAs4 [13], Cd4Ge3As5 [14], Cd3Ge2As4 [15, 16] и очерчена область стеклообразования в треугольнике составов [8, 17, 18].
Фазовые равновесия в системе Cd–Mn–As исследованы фрагментарно. Сообщается, что в частной системе CdAs2–Cd3As2–MnAs кристаллические фазы на основе трехкомпонентных соединений не образуются [19], но в ограниченном твердом растворе (Cd1– xMnx)3As2 допустимо замещение ~15% Cd на Mn [20]. В граничной бинарной системе Mn–As существует целый ряд интерметаллидов [21], а в системе Cd–Mn они не обнаружены [22].
Получена кристаллическая фаза MnGeAs2 со структурой халькопирита [23], но система Ge–Mn–As не изучена. Однако наряду с термодинамической оценкой вероятных равновесных состояний между интерметаллидами систем Mn–As и Mn–Ge [24] существуют детальные фазовые диаграммы родственной системы Ge–Fe–As [25].
Отсутствуют какие-либо фазовые диаграммы для системы Cd–Mn–Ge, но представление о ней можно составить, используя изотермическую диаграмму In–Mn–Ge [26], так как легкоплавкий Cd не образует с Mn и Ge интерметаллидов, легкоплавкий In образует единственный интерметаллид Mn3In, инконгруэнтно плавящийся выше 900°C, а тройные интерметаллиды в этих системах не образуются.
Несмотря на изоморфизм CdGeAs2 и MnGeAs2, непрерывный твердый раствор со структурой халькопирита в системе Cd–Ge–Mn–As не образуется. Вопрос о концентрационной протяженности ограниченных твердых растворов остается открытым. Согласно [27], предельная растворимость Mn в поликристаллических фазах (CdGe, Mn)As2 находится на уровне 0.35 мол. %, а для монокристаллов Cd1– xMnxGeAs2 величина x ограничивается значением 0.037 [28–30].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
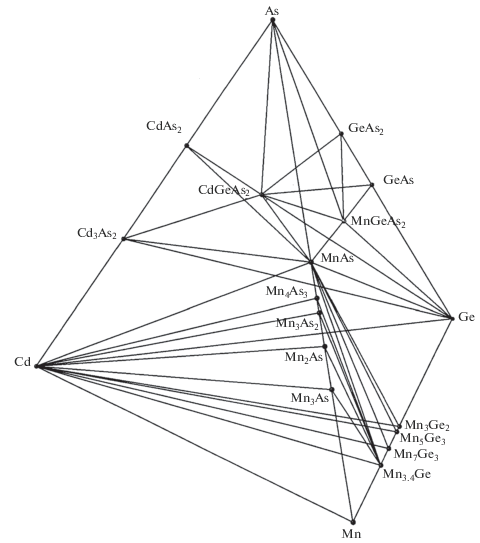
На рис. 1 приведен изотермический концентрационный тетраэдр системы Cd–Ge–Mn–As, разделенный на 18 треугольных пирамид, представляющих фазовые равновесия SSSSV с участием четырех кристаллических фаз и насыщенного пара. Нестехиометрия и полиморфизм кристаллических фаз, а также составы пара, принадлежащие ребру Cd–As, не рассматриваются. В квазичетверной системе Cd–Ge–MnAs–As тетраангуляция проведена гипотетически при использовании работ [25, 26] и фазовый состав не изменяется до появления расплава на основе Cd (~320°C). В экспериментально исследованной квазичетверной системе Cd3As2–Ge–MnAs–As расплав появляется при 595°C, и с ростом температуры диаграммы становятся все более громоздкими и неудобными для восприятия даже при 3D-визуализации (S1–S6 Supporting Information). Следует отметить, что Cd3As2 можно считать компонентом, так как кристаллическая фаза Cd3As2 конгруэнтно сублимируется и плавится, а расплав конгруэнтно испаряется [31], но MnAs компонентом не является из-за инкогруэнтных процессов сублимации и испарения.
Особый интерес представляют равновесия с участием ограниченного твердого раствора со структурой халькопирита (Cd,Ge,Mn)As2. Образцы, содержащие сплавы Ge–As, склонны к образованию метастабильных состояний и стеклообразованию, и сведения о фазовых равновесиях в квазитройной системе Ge–CdAs2–As достаточно противоречивы. При измерении давления насыщенного пара над образцами системы Cd3As2–CdGeAs2–CdAs2 статическим тензиметрическим методом [11], который позволяет следить за установлением равновесий, обнаружена только одна моноварианта SSSV (три кристаллические фазы и пар), поэтому вызывает серьезное сомнение стабильное существование фазы Cd2GeAs4 даже в ограниченном интервале температур [9]. Хотя на диаграмме (рис. 1) приведена фигуративная точка GeAs2, согласно тензиметрическим исследованиям [12], кристаллическая фаза GeAs2 метастабильна по отношению к GeAs и нода GeAs2–CdAs2 соответствует варианту метастабильной триангуляции, а стабильной является нода CdGeAs2‒As.
Ограниченный твердый раствор (Cd,Ge,Mn)As2 до 595°C участвует в восьми равновесиях SSSSV (рис. 1) с кристаллическими фазами Cd3As2, CdAs2, GeAs, GeAs2, MnAs, Ge, As и MnGeAs2. При многократном увеличении концентрационную область (Cd,Ge,Mn)As2 можно представить как 14-вершинный девятигранник (рис. 2), у которого 8 вершин являются составами (Cd,Ge,Mn)As2 в равновесиях SSSSV, 15 ребер составов отвечают равновесиям SSSV и 8 граней составов обращены к восьми фазам и соответствуют равновесиям SSV.
Рис. 2.
Изотермический полиэдр ограниченного твердого раствора со структурой халькопирита (Cd,Ge,Mn)As2.
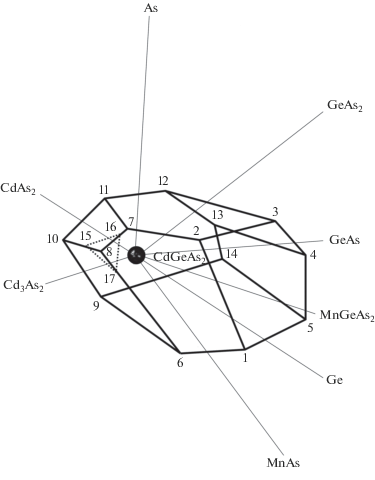
Подробно равновесия с участием (Cd,Ge,Mn)As2 рассмотрены в табл. 1. При появлении расплава L вместо SSSSV 8 ((Cd,Ge,Mn)As2–MnAs–Cd3As2–CdAs2) возникают три равновесия SSSLV и связанные с ними три SSLV и одно SLV. Соответственно на рис. 2 отсекается вершина 8 (штриховое сечение) и образуется грань 15–16–17. Концентрационный полиэдр (Cd,Ge,Mn)As2 трансформируется в 16-вершинный десятигранник (рис. 2), область которого уменьшается в процессе плавления, соответственно область расплава увеличивается. Однако полное описание области расплава в изотермических тетраэдрах или проекции поверхности ликвидуса в неизотермическом тетраэдре для всей системы Cd–Ge–Mn–As вряд ли целесообразно в рамках настоящей работы.
Таблица 1.
Многофазные равновесия с участием халькопирита (Cd,Ge,Mn)As2 (рис. 2)
| Вершина | SSSSV (SSSLV), конденсированные фазы |
|---|---|
| 1 | (Cd,Ge,Mn)As2–MnGeAs2–MnAs–Ge |
| 2 | (Cd,Ge,Mn)As2–MnGeAs2–MnAs–As |
| 3 | (Cd,Ge,Mn)As2–MnGeAs2–GeAs2–As |
| 4 | (Cd,Ge,Mn)As2–MnGeAs2–GeAs2–GeAs |
| 5 | (Cd,Ge,Mn)As2–MnGeAs2–GeAs–Ge |
| 6 | (Cd,Ge,Mn)As2–MnAs–Cd3As2–Ge |
| 7 | (Cd,Ge,Mn)As2–MnAs–CdAs2–As |
| 8 | (Cd,Ge,Mn)As2–MnAs–Cd3As2–CdAs2 |
| 15 | (Cd,Ge,Mn)As2–L–Cd3As2–CdAs2 |
| 16 | (Cd,Ge,Mn)As2–L–MnAs–CdAs2 |
| 17 | (Cd,Ge,Mn)As2–L–MnAs–Cd3As2 |
| Ребро | SSSV (SSLV), конденсированные фазы |
| 1–2 | (Cd,Ge,Mn)As2–MnGeAs2–MnAs |
| 1–5 | (Cd,Ge,Mn)As2–MnGeAs2–Ge |
| 1–6 | (Cd,Ge,Mn)As2–MnAs–Ge |
| 2–3 | (Cd,Ge,Mn)As2–MnGeAs2–As |
| 2–7 | (Cd,Ge,Mn)As2–MnAs–As |
| 3–4 | (Cd,Ge,Mn)As2–MnGeAs2–GeAs2 |
| 3–12 | (Cd,Ge,Mn)As2–GeAs2–As |
| 4–5 | (Cd,Ge,Mn)As2–MnGeAs2–GeAs |
| 4–13 | (Cd,Ge,Mn)As2–GeAs2–GeAs |
| 5–14 | (Cd,Ge,Mn)As2–GeAs–Ge |
| 6–8 | (Cd,Ge,Mn)As2–MnAs–Cd3As2 |
| 6–9 | (Cd,Ge,Mn)As2–Cd3As2–Ge |
| 7–8 | (Cd,Ge,Mn)As2–MnAs–CdAs2 |
| 7–11 | (Cd,Ge,Mn)As2–CdAs2–As |
| 8–10 | (Cd,Ge,Mn)As2–Cd3As2–CdAs2 |
| 15–16 | (Cd,Ge,Mn)As2–L–CdAs2 |
| 15–17 | (Cd,Ge,Mn)As2–L–Cd3As2 |
| 16–17 | (Cd,Ge,Mn)As2–L–MnAs |
| Грань | SSV (SLV), конденсированные фазы |
| 1–2–3–4–5 | (Cd,Ge,Mn)As2–MnGeAs2 |
| 1–2–7–8–6 | (Cd,Ge,Mn)As2–MnAs |
| 1–5–14–9–6 | (Cd,Ge,Mn)As2–Ge |
| 2–3–12–11–7 | (Cd,Ge,Mn)As2–As |
| 3–4–13–12 | (Cd,Ge,Mn)As2–GeAs2 |
| 4–5–14–13 | (Cd,Ge,Mn)As2–GeAs |
| 6–8–10–9 | (Cd,Ge,Mn)As2–Cd3As2 |
| 7–8–10–11 | (Cd,Ge,Mn)As2–CdAs2 |
| 15–16–17–11 | (Cd,Ge,Mn)As2–L |
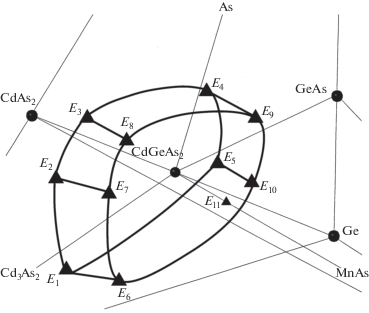
Фрагментарные экспериментальные исследования позволили построить модель полиэдра первичной кристаллизации (Cd,Ge,Mn)As2 (рис. 3), который является частью поверхности ликвидуса в тетраэдре составов. Опорными точками явились составы расплава в тройных эвтектиках системы Cd–Ge–As [10–12] (E1 – 41 мол. % Cd, 18 мол. % Ge, 41 мол. % As; E2 – 35 мол. % Cd, 7 мол. % Ge, 58 мол. % As; E3 – 30 мол. % Cd, 6 мол. % Ge, 64 мол. % As; E4 – 18 мол. % Cd, 21 мол. % Ge, 61 мол. % As; E5 – 20 мол. % Cd, 32 мол. % Ge, 48 мол. % As) и в квазибинарной системе эвтектического типа CdGeAs2–MnAs [4] (E11 – 21 мол. % Cd, 21 мол. % Ge, 8 мол. % Mn, 50 мол. % As). Фазовый состав равновесий с участием (Cd,Ge,Mn)As2 и расплава L представлен в табл. 2. В результате тензиметрического анализа квазитройной системы CdGeAs2–GeAs–As установлено только одно эвтектическое равновесие E4 и стабильное существование GeAs2 совместно с расплавом не подтверждается [12]. Не установлено стабильное существование в многофазных равновесиях MnGeAs2. При кристаллизации расплавов Zn1– x MnxGeAs2 и ZnMnxGe1– xAs2 (x = 0–0.3) родственной системы получены смеси GeAs, MnAs, (Zn,Mn)GeAs2 и Zn3As2, ZnAs2, MnAs, (Zn,Mn)GeAs2, которые имеют эвтектический характер плавления [32], а при кристаллизации из расплава Cd1– xMnxGeAs2 при x > 0.05 наблюдается образование MnAs [29].
Таблица 2.
Многофазные равновесия с участием халькопирита (Cd,Ge,Mn)As2 и расплава (рис. 3)
| Вершина | SSSLV и SSSSLV, конденсированные фазы |
|---|---|
| E1 | CdGeAs2–L–Cd3As2–Ge |
| E2 | CdGeAs2–L–Cd3As2–CdAs2 |
| E3 | CdGeAs2–L–CdAs2–As |
| E4 | CdGeAs2–L–GeAs–As |
| E5 | CdGeAs2–L–GeAs–Ge |
| E6 | (Cd,Ge,Mn)As2–L–Cd3As2–Ge–MnAs |
| E7 | (Cd,Ge,Mn)As2–L–Cd3As2–CdAs2–MnAs |
| E8 | (Cd,Ge,Mn)As2–L–CdAs2–As–MnAs |
| E9 | (Cd,Ge,Mn)As2–L–GeAs–As–MnAs |
| E10 | (Cd,Ge,Mn)As2–L–GeAs–Ge–MnAs |
| $E_{{11}}^{*}$ (условная) | (Cd,Ge,Mn)As2–L–MnAs |
| Ребро | SSLV и SSSLV, конденсированные фазы |
| E1–E2 | CdGeAs2–L–Cd3As2 |
| E1–E5 | CdGeAs2–L–Ge |
| E2–E3 | CdGeAs2–L–CdAs2 |
| E3–E4 | CdGeAs2–L–As |
| E4–E5 | CdGeAs2–L–GeAs |
| E1–E6 | (Cd,Ge,Mn)As2–L–Cd3As2–Ge |
| E2–E7 | (Cd,Ge,Mn)As2–L–Cd3As2–CdAs2 |
| E3–E8 | (Cd,Ge,Mn)As2–L–CdAs2–As |
| E4–E9 | (Cd,Ge,Mn)As2–L–GeAs–As |
| E5–E10 | (Cd,Ge,Mn)As2–L–GeAs–Ge |
| E6–E7 | (Cd,Ge,Mn)As2–L–Cd3As2–MnAs |
| E6–E10 | (Cd,Ge,Mn)As2–L–Ge–MnAs |
| E7–E8 | (Cd,Ge,Mn)As2–L–CdAs2–MnAs |
| E8–E9 | (Cd,Ge,Mn)As2–L–As–MnAs |
| E9–E10 | (Cd,Ge,Mn)As2–L–GeAs–MnAs |
| Грань | SLV и SSLV, конденсированные фазы |
| E1–E2–E3–E4–E5 | CdGeAs2–L |
| E1–E2–E7–E6 | (Cd,Ge,Mn)As2–L–Cd3As2 |
| E1–E5–E10–E6 | (Cd,Ge,Mn)As2–L–Ge |
| E2–E3–E8–E7 | (Cd,Ge,Mn)As2–CdAs2 |
| E3–E4–E9–E8 | (Cd,Ge,Mn)As2–L–As |
| E4–E5–E10–E9 | (Cd,Ge,Mn)As2–L–GeAs |
| E6–E7–E8–E9–E10 | (Cd,Ge,Mn)As2–L–MnAs |
В итоге рассматриваются пять четверных эвтектик (E6–E10) с участием MnAs (табл. 2), для которых содержание Mn в эвтектическом расплаве не превышает 10 мол. %. Криволинейный полиэдр первичной кристаллизации (Cd,Ge,Mn)As2 представляет собой 10-вершинный семигранник. Плоская грань E1–E2–E3–E4–E5 отвечает кристаллизации беспримесного CdGeAs2 в тройной системе. Кривые, связывающие вершины E1, E2, E3, E4, E5, соответствуют составу расплава при совместной кристаллизации CdGeAs2 с одной из пяти равновесных фаз, а сами вершины определяют состав при кристаллизации CdGeAs2 с двумя фазами. Остальные 6 вершин, 10 ребер и 6 граней принадлежат четверной системе Cd–Ge–Mn– As, в которой из расплава кристаллизуется ограниченный твердый раствор (Cd,Ge,Mn)As2 со структурой халькопирита.
ЗАКЛЮЧЕНИЕ
При построении изотерм T–x–y–z-проекции p–T–x–y–z фазовой диаграммы системы Cd–Ge–Mn–As получен концентрационный полиэдр халькопирита (Cd,Ge,Mn)As2, представляющий собой 14-вершинный девятигранник. Выделено восемь кристаллических фаз, влияющих на состав ограниченного твердого раствора (Cd,Ge,Mn)As2: Cd3As2, CdAs2, GeAs, GeAs2, Ge, MnAs, MnGeAs2 и As. Рассмотрена трансформация полиэдра при появлении расплава. Представлена модель полиэдра первичной кристаллизации (Cd,Ge,Mn)As2 в тетраэдре Cd–Ge–Mn–As.
Список литературы
Dietl T. // Nature Mater. 2010. V. 9. № 12. P. 965. https://doi.org/10.1038/nmat2898
Medvedkin G.A., Hirose K., Ishibashi T. et al. // J. Cryst. Growth. 2002. V. 236. № 4. P. 609.
Новоторцев В.М., Калинников В.Т., Королева Л.И. и др. // Журн. неорган. химии. 2005. Т. 50. № 4. С. 552.
Маренкин С.Ф., Изотов А.Д., Федорченко И.В. и др. // Журн. неорган. химии. 2015. Т. 60. № 3. С. 343. https://doi.org/10.7868/S0044457X15030149
Новоторцев В.М., Маренкин С.Ф., Федорченко И.В. и др. // Журн. неорган. химии. 2010. Т. 55. № 11. С. 1868.
Борщевский А.С., Роенков Н.Д. // Журн. неорган. химии. 1969. Т. 14. № 8. С. 2253.
Коцюруба Е.С., Борщевский А.С. // Журн. неорган. химии. 1977. Т. 22. № 11. С. 3174.
Чернов А.П., Фесенко Т.Н., Ольховский В.И. и др. // Журн. неорган. химии. 1983. Т. 28. № 12. С. 3150.
Чернов А.П., Фесенко Т.Н., Ольховский В.И. и др. // Журн. неорган. химии. 1984. Т. 29. № 1. С. 210.
Нипан Г.Д., Николаева Л.Н. // Журн. неорган. химии. 1994. Т. 39. № 6. С. 1001.
Нипан Г.Д., Николаева Л.Н. // Изв. РАН. Неорган. материалы. 1994. Т. 30. № 8. С. 1017.
Нипан Г.Д. Дис. … д-ра хим. наук. М.: ИОНХ РАН, 2003. 248 с.
Mikkelsen J.C., Hong H.Y.-P. // Mater. Res. Bull. 1974. V. 9. № 9. P. 1209.
Pamplin B.R., Feigelson R.S. // Mater. Res. Bull. 1979. V. 14. № 2. P. 263.
Riley B.J., Johnson B.R., Crum J.V. et al. // J. Am. Ceram. Soc. 2012. V. 95. № 7. P. 2161. https://doi.org/10.1111/j.1551-2916.2012.05171.x
Аронов А.Н., Маренкин С.Ф., Федорченко И.В. // Журн. неорган. химии. 2017. Т. 62. № 12. С. 1642. https://doi.org/10.7868/S0044457X17120133
Hong K.S., Berta Y., Speyer R. // J. Am. Ceram. Soc. 1990. V. 73. № 5. P. 1351.
Johnson B.R., Riley B.J., Sundaram S.K. et al. // J. Am. Ceram. Soc. 2009. V. 92. № 6. P. 1236. https://doi.org/10.1111/j.1551-2916.2009.03001.x
Риль А.И., Федорченко И.В., Маренкин С.Ф. и др. // Журн. неорган. химии. 2017. Т. 62. № 7. С. 977. https://doi.org/10.7868/S0044457X17070200
Celinski Z., Burian A., Rzepa A. et al. // Mater. Res. Bull. 1987. V. 22. P. 419.
Okamoto H. // Bull. Alloy Phase Diag. 1989. V. 10. № 5. P. 549.
Okamoto H. // J. Phase Equilibria Diff. 2015. V. 36. № 3. P. 292. https://doi.org/10.1007/s11669-015-0370-x
Cho S., Choi S., Cha G.-B. et al. // Solid State Commun. 2004. V. 129. № 9. P. 609. https://doi.org/10.1016/j.ssc.2003.11.040
Gokhale A.B., Abbashian R. // Bull. Alloy Phase Diag. 1990. V. 11. № 5. P. 460.
Чернов А.П., Калинников В.Т. // Журн. неорган. химии. 1982. Т. 27. № 2. С. 496.
Oliynyk A.O., Djama-Kayad K., Mar A. // J. Alloys. Compd. 2015. V. 622. P. 837. https://doi.org/10.1016/j.jallcom.2014.10.170
Демин Р.В., Королева Л.И., Маренкин С.Ф. и др. // Письма в ЖТФ. 2004. Т. 30. № 21. С. 81.
Новоторцев В.М., Палкина Л.Л., Михайлов С.Г. и др. // Неорган. материалы. 2005. Т. 41. № 5. С. 519.
Kilanski L., Górska M. Dynovska E. et al. // J. Appl. Phys. 2014. V. 115. № 13. P. 133917-1. https://doi.org/10.1063/1.4870474
Romcevic M., Romcevic N., Trajic J. et al. // J. Alloys. Compd. 2016. V. 688B. P. 56. https://doi.org/10.1016/j.jallcom.2016.07.166
Нипан Г.Д., Гринберг Я.Х., Лазарев В.Б. // Изв. АН СССР. Неорган. материалы. 1987. Т. 23. № 9. С. 1423.
Matsushita H., Watanabe M., Katsui A. // J. Phys. Chem. Solids. 2008. V. 69. P. 408. https://doi.org/10.1016/j.jpcs.2007.07.004
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии