Журнал неорганической химии, 2019, T. 64, № 3, стр. 266-271
Двойные комплексные соли [Ln(C6H5NO2)3(H2O)2][Cr(NCS)6] ⋅ 2H2O (Ln = Lu, Ce, Y): синтез и кристаллическая структура
Е. В. Черкасова 1, Н. В. Первухина 2, 3, Н. В. Куратьева 2, 3, Т. Г. Черкасова 1, *
1 Кузбасский государственный технический университет им. Т.Ф. Горбачева
650000 Кемерово, ул. Весенняя, 28, Россия
2 Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
3 Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: ctg.htnv@kuzstu.ru
Поступила в редакцию 04.04.2018
После доработки 15.08.2018
Принята к публикации 23.05.2018
Аннотация
Взаимодействием водных растворов Ln(NO3)3 (Ln = Lu, Ce, Y), K3[Cr(NCS)6] и никотиновой кислоты (C5H5NCOO) синтезированы двойные комплексные соли состава [Ln(C6H5NO2)3(H2O)2][Cr(NCS)6] ⋅ 2H2O, Ln = Lu (I), Ce (II), Y (III). Вещества, представляющие собой кристаллические порошки бледно-сиреневого цвета, изучены методами химического анализа, ИК-спектроскопии и РСА монокристаллов. Соединения кристаллизуются в моноклинной сингонии, пр. гр. P21/n, Z = 4: a = 9.4969(15), b = 25.606(4), c = 15.541(2) Å, β = 107.126(4)°, V = 3624.34 Å3, ρвыч = 1.864 г/см3 для I; a = 9.6559(2), b = 25.8492(5), c = 15.5303(3) Å, β = 106.586(1)°, V = 3715.0(1) Å3, ρвыч = 1.756 г/см3 для II; a = 9.5662(7), b = 25.756(2), c = 15.541(1) Å, β = 107.122(2)°, V = 3659.3(4) Å3, ρвыч = 1.690 г/см3 для III. В кристаллических структурах комплексов I–III катионы имеют полимерное цепочечное строение, координационный полиэдр хрома(III) представляет собой слабоискаженный октаэдр. Стерический фактор не оказывает существенного влияния на особенности кристаллических структур в ряду гекса(изотиоцианато)хроматных(III) комплексов лантаноидов с никотиновой кислотой, в их составе варьируется только содержание молекул кристаллизационной воды.
ВВЕДЕНИЕ
Для получения новых функциональных материалов интерес представляют двойные комплексные соединения (ДКС), состоящие из комплексных катионов и анионов с неорганическими и органическими лигандами и разными металлами – центральными атомами [1–5]. ДКС перспективны как предшественники для получения катализаторов, магнитных материалов, различных сенсоров и полиметаллических систем [6–14]. Ранее сообщалось о получении и исследовании гекса(изотиоцианато)хроматов(III) комплексов лантаноидов цериевой группы [15] и гольмия [16] с никотиновой кислотой. Как показали исследования гекса(изотиоцианато)хроматов(III) комплексов лантаноидов(III) с ε-капролактамом, состав и структура комплекса лютеция(III) отличаются от ДКС других лантаноидов из-за уменьшения радиуса его атома в результате лантаноидного сжатия [17]. Кроме того, установлены значительные структурные различия для ДКС цериевой и иттриевой групп, имеющих одинаковый состав [6]. Для выяснения структурных закономерностей в ряду аналогичных комплексов с никотиновой кислотой синтезированы ДКС [Ln(C6H5NO2)3(H2O)2][Cr(NCS)6] ⋅ 2H2O, где Ln = = Lu (I), Ce (II), Y (III). Вещества изучены методами химического анализа, ИК-спектроскопии и РСА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. При смешивании 1 М водных растворов 0.590 г (0.001 моль) комплексной соли K3[Cr(NCS)6] · 4H2O и 0.369 г (0.003 моль) никотиновой кислоты в интервале pH 4–6 c последующим добавлением 0.47, 0.43 и 0.38 г (0.001 моль) соответственно гексагидратов нитратов лютеция(III), церия(III) и иттрия(III) (все марки “х. ч.”) выпадали мелкокристаллические осадки ДКС бледно-сиреневого цвета, которые промывали холодной водой, отфильтровывали и высушивали на воздухе. Выход 63 (I), 65 (II) и 67% (III).
Химический анализ на содержание ионов лютеция(III), церия(III) и иттрия(III) проводили гравиметрически осаждением в виде оксалатов с последующим прокаливанием до оксидов [18], количество хрома определяли фотоколориметрическим методом [19], элементный C,H,N,S-анализ выполняли на приборе ThermoFlash 2000 фирмы Thermo Scientific.
| Lu | Cr | C | H | N | S | |
| Найдено, %: | 17.15; | 5.05; | 28.30; | 2.20; | 12.35; | 18.85. |
| Для C24H23CrLuN9O10S6 | ||||||
| вычислено, %: | 17.21; | 5.11; | 28.36; | 2.28; | 12.40; | 18.92. |
| Ce | Cr | C | H | N | S | |
| Найдено, %: | 14.23; | 5.25; | 29.30; | 2.30; | 12.79; | 19.55. |
| Для C24H23CrCeN9O10S6 | ||||||
| вычислено, %: | 14.27; | 5.30; | 29.36; | 2.36; | 12.84; | 19.60. |
| Y | Cr | C | H | N | S | |
| Найдено, %: | 9.47; | 5.52; | 30.90; | 2.42; | 13.49; | 20.63. |
| Для C24H23CrYN9O10S6 | ||||||
| вычислено, %: | 9.55; | 5.59; | 30.98; | 2.49; | 13.55; | 20.68. |
ИК-спектры комплексов регистрировали на ИК-Фурье-спектрометре Cary 630 FTIR фирмы Agilent в интервале 4000–400 см–1 в матрице KBr. Основные частоты полос поглощения (ν, см–1): 3398 сл., 3063 сл., 2058 оч.с., 1689 с., 1584 с., 1411 оч.с., 1366 с., 1187 сл., 1109 сл., 1042 сл., 830 сл., 746 оч.с., 691 ср., 512 сл. (I); 3400 сл., 3067 сл., 2075 оч.с., 1690 с., 1590 с., 1415 оч.с., 1379 с., 1112 сл., 1043 сл., 835 сл., 752 оч.с., 695 ср., 515 сл. (II); 3414 сл., 3074 сл., 2058 оч.с., 1639 ср., 1589 с., 1416 оч.с., 1355 ср., 1187 сл., 1109 сл., 1031 сл., 836 сл., 752 оч.с., 691 с., 513 сл. (III).
РСА. Монокристаллы, пригодные для РСА, выращены из смеси разбавленных водных растворов исходных веществ изотермическим испарением на воздухе при 298 K. Рентгеноструктурные исследования соединений I–III выполнены на дифрактометре Bruker APEX DUO с 4K CCD-детектором с использованием φ- и ω-сканирования при температуре 150 K. Поправки на поглощение введены с помощью программы SADABS [20], предусматривающей многократные измерения одних и тех же отражений при разных ориентациях кристалла. Структуры расшифрованы прямым методом и уточнены полноматричным МНК по F 2 в анизотропном приближении для неводородных атомов с использованием комплекса программ SHELXTL [21]. Атомы водорода органических лигандов локализованы из карт разностной электронной плотности и уточнены в приближении жесткого тела. Атомы водорода координированных молекул воды локализованы экспериментально и уточнены с ограничением длины связи О–Н на 0.96 Å (для I–III). Атомы водорода кристаллизационных молекул воды для I, II локализованы и уточнены аналогично, для III – не локализованы. Кристаллографические данные и детали дифракционного эксперимента приведены в табл. 1, основные длины связей в соединениях I–III – в табл. 2–4. Структурные данные депонированы в КБСД (ССDС №1574073, 1823038, 1833753) и доступны на сайте www.ccdc.cam.ac.uk/ data_reguest/cif.
Таблица 1.
Кристаллографические данные и условия дифракционного эксперимента для ДКС I–III
| Параметр | C24H23CrLuN9O10S6 (I) | C24H23CeCrN9O10S6 (II) | C24H23CrN9O10S6Y (III) |
|---|---|---|---|
| М, г/моль | 1016.84 | 981.99 | 930.78 |
| Сингония | Моноклинная | ||
| Пр. гр. | P21/n | ||
| a, Å | 9.497(2) | 9.6559(2) | 9.5662(7) |
| b, Å | 25.696(4) | 25.8492(5) | 25.756(2) |
| c, Å | 15.541(2) | 15.5303(3) | 15.541(1) |
| β, град | 107.126(4) | 106.586(1) | 107.122(2) |
| V, Å3 | 3624.4(9) | 3715.0(1) | 3659.3(4) |
| Z | 4 | ||
| ρвыч, г/см3 | 1.864 | 1.756 | 1.690 |
| μ, мм–1 | 3.417 | 1.902 | 2.281 |
| F(000) | 2004 | 1952 | 1876 |
| Размер кристалла, мм | 0.22 × 0.11 × 0.08 | 0.24 × 0.14 × 0.07 | 0.36 × 0.10 × 0.04 |
| Диапазон сбора данных по θ, град | 1.58–28.33 | 1.58–27.63 | 2.09–26.44 |
| Диапазон h, k, l | –12 ≤ h ≤ 11, –32 ≤ k ≤ 34, –20 ≤ l ≤ 20 |
–12 ≤ h ≤ 12, –20 ≤ k ≤ 33, –20 ≤ l ≤ 20 | –11 ≤ h ≤ 11, –24 ≤ k ≤ 32, –16 ≤ l ≤ 19 |
| Ihkl измеренных | 34 122 | 27 199 | 24 137 |
| Ihkl > 2σI | 9018 (Rint = 0.0272) | 8592 (Rint = 0.0282) | 7447 (Rint = 0.0409) |
| Макс. и мин. пропускание | 0.7717 и 0.5202 | 0.8784 и 0.6582 | 0.9143 и 0.4940 |
| Число рефлексов/огр./ параметров | 9018/8/490 | 8592/10/484 | 7447/7/477 |
| GOOF для $F_{{hkl}}^{{\text{2}}}$ | 1.189 | 1.100 | 1.128 |
| R(I > 2σI ) | R1 = 0.0247, wR2 = 0.0505 | R1 = 0.0266, wR2 = 0.0608 | R1 = 0.0594, wR2 = 0.1470 |
| R(Ihkl изм.) | R1 = 0.0266, wR2 = 0.0511 | R1 = 0.0316, wR2 = 0.0623 | R1 = 0.0716, wR2 = 0.1504 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.905/1.520 | –0.892/0.620 | –0.601/0.879 |
Таблица 2.
Основные межатомные расстояния и углы в комплексе I
| Связь | d, Å | Угол | φ, град | Угол | φ, град |
|---|---|---|---|---|---|
| Lu(1)–O(12)#1 | 2.2428(16) | O(12)#1Lu(1)O(22)#2 | 144.46(7) | O(22)#2Lu(1)O(1w) | 142.87(7) |
| Lu(1)–O(22)#2 | 2.2512(17) | O(12)#1Lu(1)O(31) | 83.24(6) | O(31)Lu(1)O(1w) | 136.46(7) |
| Lu(1)–O(31) | 2.2820(17) | O(22)#2Lu(1)O(31) | 76.73(7) | O(32)#2Lu(1)O(1w) | 71.86(6) |
| Lu(1)–O(32)#2 | 2.2848(17) | O(12)#1Lu(1)O(32)#2 | 139.39(7) | O(11)Lu(1)O(1w) | 71.27(7) |
| Lu(1)–O(11) | 2.2965(17) | O(22)#2Lu(1)O(32)#2 | 76.03(7) | O(21)Lu(1)O(1w) | 69.71(6) |
| Lu(1)–O(21) | 2.3258(18) | O(31)Lu(1)O(32)#2 | 120.57(6) | O(2w)Lu(1)O(1w) | 124.40(6) |
| Lu(1)–O(2w) | 2.3907(19) | O(12)#1Lu(1)O(11) | 97.40(6) | N(6)Cr(1)N(3) | 178.14(12) |
| Lu(1)–O(1w) | 2.4744(18) | O(22)#2Lu(1)O(11) | 85.01(6) | N(6)Cr(1)N(4) | 89.88(11) |
| Cr(1)–N(6) | 1.986(3) | O(31)Lu(1)O(11) | 147.72(7) | N(3)Cr(1)N(4) | 88.48(11) |
| Cr(1)–N(3) | 1.996(2) | O(32)#2Lu(1)O(11) | 79.25(6) | N(6)Cr(1)N(5) | 87.94(11) |
| Cr(1)–N(4) | 2.000(3) | O(12)#1Lu(1)O(21) | 80.08(6) | N(3)Cr(1)N(5) | 92.91(10) |
| Cr(1)–N(5) | 2.000(3) | O(22)#2Lu(1)O(21) | 120.40(6) | N(4)Cr(1)N(5) | 88.19(11) |
| Cr(1)–N(2) | 2.013(3) | O(31)Lu(1)O(21) | 73.14(7) | N(6)Cr(1)N(2) | 88.13(11) |
| Cr(1)–N(1) | 2.014(3) | O(32)#2Lu(1)O(21) | 77.08(7) | N(3)Cr(1)N(2) | 90.98(10) |
| O(11)Lu(1)O(21) | 138.95(6) | N(4)Cr(1)N(2) | 90.29(12) | ||
| O(12)#1Lu(1)O(2w) | 72.65(7) | N(5)Cr(1)N(2) | 175.79(11) | ||
| O(22)#2Lu(1)O(2w) | 73.68(7) | N(6)Cr(1)N(1) | 94.16(11) | ||
| O(31)Lu(1)O(2w) | 73.72(7) | N(3)Cr(1)N(1) | 87.47(11) | ||
| O(32)#2Lu(1)O(2w) | 141.95(7) | N(4)Cr(1)N(1) | 175.95(11) | ||
| O(11)Lu(1)O(2w) | 75.72(7) | N(5)Cr(1)N(1) | 92.19(12) | ||
| O(21)Lu(1)O(2w) | 138.98(7) | N(2)Cr(1)N(1) | 89.60(12) | ||
| O(12)#1Lu(1)O(1w) | 68.87(6) |
Таблица 3.
Основные межатомные расстояния и углы в комплексе II
| Связь | d, Å | Угол | φ, град | Угол | φ, град |
|---|---|---|---|---|---|
| Ce(1)–O(12)#1 | 2.4125(16) | O(12)#1Ce(1)O(22)#2 | 145.35(6) | O(22)#2Ce(1)O(1w) | 143.79(6) |
| Ce(1)–O(22)#2 | 2.4143(17) | O(12)#1Ce(1)O(31) | 82.11(6) | O(31)Ce(1)O(1w) | 135.45(6) |
| Ce(1)–O(31) | 2.4435(16) | O(22)#2Ce(1)O(31) | 75.92(6) | O(32)#2Ce(1)O(1w) | 71.10(6) |
| Ce(1)–O(32)#2 | 2.4455(16) | O(12)#1Ce(1)O(32)#2 | 138.72(6) | O(11)Ce(1)O(1w) | 72.77(6) |
| Ce(1)–O(11) | 2.4742(17) | O(22)#2Ce(1)O(32)#2 | 75.90(6) | O(21)Ce(1)O(1w) | 67.41(6) |
| Ce(1)–O(21) | 2.5009(17) | O(31)Ce(1)O(32)#2 | 122.67(6) | O(2w)Ce(1)O(1w) | 124.92(6) |
| Ce(1)–O(2w) | 2.5444(18) | O(12)#1Ce(1)O(11) | 99.74(6) | N(6)Cr(1)N(3) | 178.74(11) |
| Ce(1)–O(1w) | 2.6446(17) | O(22)#2Ce(1)O(11) | 85.63(6) | N(6)Cr(1)N(5) | 88.12(10) |
| Cr(1)–N(6) | 1.987(2) | O(31)Ce(1)O(11) | 147.55(6) | N(3)Cr(1)N(5) | 92.46(10) |
| Cr(1)–N(3) | 1.998(2) | O(32)#2Ce(1)O(11) | 76.68(6) | N(6)Cr(1)N(4) | 90.15(11) |
| Cr(1)–N(5) | 2.000(2) | O(12)#1Ce(1)O(21) | 76.79(6) | N(3)Cr(1)N(4) | 88.75(10) |
| Cr(1)–N(4) | 2.004(3) | O(22)#2Ce(1)O(21) | 120.81(6) | N(5)Cr(1)N(4) | 88.11(10) |
| Cr(1)–N(2) | 2.007(2) | O(31)Ce(1)O(21) | 73.79(6) | N(6)Cr(1)N(2) | 88.25(10) |
| Cr(1)–N(1) | 2.021(3) | O(32)#2Ce(1)O(21) | 79.64(6) | N(3)Cr(1)N(2) | 91.14(10) |
| O(11)Ce(1)O(21) | 138.43(6) | N(5)Cr(1)N(2) | 176.08(10) | ||
| O(12)#1Ce(1)O(2w) | 73.25(6) | N(4)Cr(1)N(2) | 90.41(10) | ||
| O(22)#2Ce(1)O(2w) | 74.95(6) | N(6)Cr(1)N(1) | 93.48(11) | ||
| O(31)Ce(1)O(2w) | 73.33(6) | N(3)Cr(1)N(1) | 87.62(10) | ||
| O(32)#2Ce(1)O(2w) | 141.30(6) | N(5)Cr(1)N(1) | 92.11(11) | ||
| O(11)Ce(1)O(2w) | 76.24(6) | N(4)Cr(1)N(1) | 176.37(10) | ||
| O(21)Ce(1)O(2w) | 137.86(6) | N(2)Cr(1)N(1) | 89.59(11) | ||
| O(12)#1Ce(1)O(1w) | 68.70(6) |
Таблица 4.
Основные межатомные расстояния и углы в комплексе III
| Связь | d, Å | Угол | φ, град | Угол | φ, град |
|---|---|---|---|---|---|
| Y(1)–O(12)#1 | 2.281(4) | O(12)#1Y(1)O(22)#2 | 144.74(15) | O(22)#2Y(1)O(1w) | 143.14(15) |
| Y(1)–O(22)#2 | 2.290(4) | O(12)#1Y(1)O(31) | 83.30(14) | O(31)Y(1)O(1w) | 136.52(15) |
| Y(1)–O(31) | 2.311(4) | O(22)#2Y(1)O(31) | 76.30(15) | O(32)#2Y(1)O(1w) | 71.89(14) |
| Y(1)–O(32)#2 | 2.327(4) | O(12)#1Y(1)O(32)#2 | 139.15(15) | O(11)Y(1)O(1w) | 71.31(14) |
| Y(1)–O(11) | 2.335(4) | O(22)#2Y(1)O(32)#2 | 76.03(15) | O(21)Y(1)O(1w) | 69.49(14) |
| Y(1)–O(21) | 2.363(4) | O(31)Y(1)O(32)#2 | 120.59(14) | O(2w)Y(1)O(1w) | 124.30(14) |
| Y(1)–O(2w) | 2.418(4) | O(12)#1Y(1)O(11) | 97.65(14) | N(5)Cr(1)N(6) | 88.1(2) |
| Y(1)–O(1w) | 2.503(4) | O(22)#2Y(1)O(11) | 85.38(14) | N(5)Cr(1)N(3) | 92.9(2) |
| Cr(1)–N(5) | 1.993(6) | O(31)Y(1)O(11) | 147.67(15) | N(6)Cr(1)N(3) | 178.5(3) |
| Cr(1)–N(6) | 1.994(6) | O(32)#2Y(1)O(11) | 79.14(14) | N(5)Cr(1)N(4) | 88.4(2) |
| Cr(1)–N(3) | 1.998(6) | O(12)#1Y(1)O(21) | 79.76(14) | N(6)Cr(1)N(4) | 90.2(2) |
| Cr(1)–N(4) | 2.002(6) | O(22)#2Y(1)O(21) | 120.13(14) | N(3)Cr(1)N(4) | 88.7(2) |
| Cr(1)–N(1) | 2.017(6) | O(31)Y(1)O(21) | 73.43(15) | N(5)Cr(1)N(1) | 92.1(3) |
| Cr(1)–N(2) | 2.022(6) | O(32)#2Y(1)O(21) | 77.00(15) | N(6)Cr(1)N(1) | 93.5(3) |
| O(11)Y(1)O(21) | 138.73(15) | N(3)Cr(1)N(1) | 87.6(2) | ||
| O(12)#1Y(1)O(2w) | 72.79(14) | N(4)Cr(1)N(1) | 176.3(2) | ||
| O(22)#2Y(1)O(2w) | 73.99(15) | N(5)Cr(1)N(2) | 175.7(2) | ||
| O(31)Y(1)O(2w) | 73.61(15) | N(6)Cr(1)N(2) | 87.8(2) | ||
| O(32)#2Y(1)O(2w) | 142.10(15) | N(3)Cr(1)N(2) | 91.1(2) | ||
| O(11)Y(1)O(2w) | 75.85(15) | N(4)Cr(1)N(2) | 90.2(2) | ||
| O(21)Y(1)O(2w) | 138.99(15) | N(1)Cr(1)N(2) | 89.6(3) | ||
| O(12)#1Y(1)O(1w) | 68.64(14) |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Комплексы [Ln(C6H5NO2)3(H2O)2][Cr(NCS)6] ⋅ ⋅ 2H2O, Ln = Lu (I), Ce (II), Y (III) представляют собой устойчивые на воздухе бледно-сиреневые кристаллические порошки, плохо растворимые в воде, н-углеводородах, спиртах (этиловом, бутиловом, изопропиловом, изобутиловом, бензиловом), толуоле, ацетоне и хорошо растворимые в ДМСО и ДМФА.
Частоты валентных (CN, CS) и деформационных (NCS) колебаний, равные соответственно 2058, 746, 512 (I); 2075, 752, 515 (II) и 2058, 752, 513 см–1 (III), характеризуют изотиоцианатные комплексы [22–24]. Данные ИК-спектроскопии свидетельствуют о наличии сольватированных и координированных молекул воды в соединениях. Смещение полосы ν(CO) до 1584 (I), 1590 (II) и 1589 см–1 (III) свидетельствует о координации ионов лантаноидов(III) через атомы кислорода карбоксильных групп [25–27]. Бидентатность лиганда никотиновой кислоты, координирующейся с металлом-комплексообразователем через атом кислорода карбоксильной группы, проявляется в ИК-спектре ДКС группой полос разной интенсивности в интервале 1617–1182 см–1 [28].
Соединения I–III изоструктурны исследованным ранее комплексам с общей формулой [Ln(C5H4NHCOO)3(H2O)2][Cr(NCS)6] .nH2O, где Ln = La и Nd [15], Но [16], Eu, Dy, Er, Yb, n = 1–2 [29]. В кристаллических структурах соединений I–III катионы имеют полимерное цепочечное строение. Координационное окружение атома металла состоит из восьми атомов О, принадлежащих шести молекулам никотиновой кислоты (L) и двум координированным молекулам H2O, располагающимся в вершинах искаженной квадратной антипризмы (рис. 1). Координированные молекулы воды расположены в одном из двух тетрагональных оснований в транс-положениях друг к другу. При этом грань полиэдра оказывается вогнутой с двухгранным по линии O(1w)–O(2w) углом 156.0° (I), 161.5° (II) и 156.0° (III). Противоположное основание антипризмы остается практически недеформированным. Каждая молекула никотиновой кислоты служит бидентатным мостиком, за счет которого происходит удлинение координационного полимера в направлении а. При этом связку между соседними катионами лантаноида образуют либо четыре, либо две молекулы L и две парные водородные связи между координированными к катионам молекулами воды (dО⋅⋅⋅О = 2.85 (I), 2.83 (II) и 2.85 Å (III)). Практически отсутствующее отличие в длинах связей C–O для никотиновой кислоты и наличие заметного пика электронной плотности рядом с атомом N в гетероцикле указывают на присутствие кислоты в виде цвиттер-иона, что согласуется с выводами авторов [15, 16]. В качестве противоиона выступают изолированные анионы [Cr(NCS)6]3–, в которых координационный полиэдр Cr состоит из атомов N шести роданид-ионов и близок к правильному октаэдру, отклонение координационных углов NCrN от 90° не превышает 4.16° (I), 3.48° (II) и 3.50° (III).
Рис. 1.
Строение и нумерация атомов в комплексных соединениях [M(C6H5NO2)3(H2O)2][Cr(NCS)6] ⋅ 2H2O, M = Lu (I), Ce (II), Y (III). Серыми четырехугольниками показаны два основания квадратной антипризмы координационного полиэдра со сломом одной из граней (пунктир).
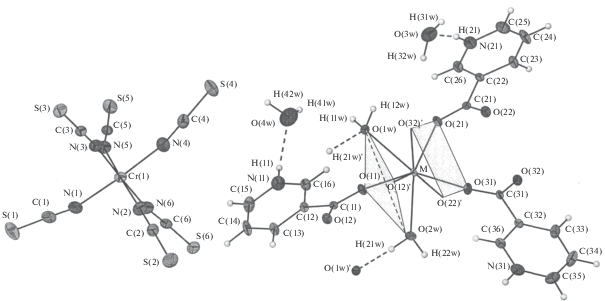
Полимерные цепочки упакованы по закону гексагональной укладки в плоскости bc, пространство между цепочками заполнено островными комплексными анионами [Cr(NCS)6]3– и кристаллизационными молекулами воды. В структурах образуются межмолекулярные водородные связи между кристаллизационными молекулами воды и N–H-группами координированных молекул L (dN⋅⋅⋅O = 2.661(4), 2.776(4) Å (I); 2.692(3), 2.783(3) Å (II) и 2.66(1), 2.78(1) Å (III)).
Полученные результаты показали, что стерический фактор ($r_{{\text{Y}}}^{{3 + }}$ = 1.02, $r_{{{\text{Ce}}}}^{{3 + }}$ = 1.14, $r_{{{\text{Lu}}}}^{{3 + }}$ = 0.97 Å [30]) не оказывает существенного влияния на особенности кристаллических структур. В ряду гекса(изотиоцианато)хроматных(III) комплексов лантаноидов с никотиновой кислотой в их составе варьируется только содержание молекул кристаллизационной воды: 1 (Nd [15]), 1.15 (Eu [29]), 1.5 (Dy, Er [29]), 2 (La [15], Ho [16], Yb [26], Y, Ce, Lu). Ранее было показано [15], что эти различия, возможно, связаны с разворотом отдельных пиридиниевых фрагментов в катионах комплексов, что, в свою очередь, приводит к сокращению всех параметров элементарных ячеек моногидратов и уменьшению их объемов по сравнению со структурами с большим содержанием кристаллизационной воды.
Список литературы
Печенюк С.И., Домонов Д.Р. // Журн. структур. химии. 2011. Т. 52. № 2. С. 419.
Третьяков Ю.Д. // Успехи химии. 2004. Т. 73. № 9. С. 831.
Smekal Z., Brrezina F., Sindela Z. et al. // Trans. Met. Chem. 2010. V. 22. № 3. P. 299.
Wrzeszcz G., Dobrzanska L., Wojtczac A., Grodzicki A. // J. Chem. Soc., Dalton Trans. 2002. P. 2862.
Dobrzanska L., Wrzeszcz G., Grodzicki A., Rozploch F. // Polish J. Chem. 2000. V. 74. P. 1071.
Вировец А.В., Пересыпкина Е.В., Черкасова Е.В. и др. // Журн. структур. химии. 2009. Т. 50. № 1. С. 144.
Cherkasova E.V., Patrakov Yu.F., Tryasunov B.G. et al. // Russ. J. Inorg. Chem. 2009. V. 50. № 10. P. 137. [Черкасова Е.В., Патраков Ю.Ф., Трясунов Б.Г. и др. // Журн. неорган. химии. 2009. Т. 54. № 10. С. 1700.]
Cherkasova E.V., Virovets A.V., Peresypkina E.V. et al. // Inorg. Chem. Commun. 2006. V. 9. № 1. P. 4.
Virovets A.V., Cherkasova E.V., Peresypkina E.V., Cherkasova T.G. // Z. Kristallogr. 2015. V. 230. № 8. P. 551. doi 10.1515/zkri-2015-1854
Pechenyuk S.I., Domonov D.P., Avedisyin A.A. et al. // Russ. J. Inorg. Chem. 2010. V. 55. № 5. P. 741. [Печенюк С.И., Домонов Д.П., Аведисян А.А. и др. // Журн. неорган. химии. 2010. Т. 55. № 5. С. 788.]
Gueye M.N., Dieng M., Thiam I.E. et al. // S. Afr. J. Chem. 2017. P. 8.
Pechenyuk S.I., Domonov D.P., Gosteva A.N. et al. // Russ. J. Chem. Chem. Techn. 2018. V. 61. № 4–5. P. 49. http://dx.org/10.6060/tcct.20186104-05.5617. [Печенюк С.И., Домонов Д.П., Гостева А.Н. и др. // Изв. вузов. Химия и хим. технол. 2018. Т. 61. № 4–5. С. 49.]
Domonov D.P., Pechenyuk S.I., Gosteva A.N. // Russ. J. Phys. Chem. 2014. Т. 88. № 6. [Домонов Д.П., Печенюк С.И., Гостева А.Н. // Журн. физ. химии. 2014. Т. 88. № 6. С. 926. doi 10.7868/ S0044453714060120]
Ansary A.I., Abdel-Kader N.S. // Int. J. Inorg. Chem. 2012. http://dx.org/10.1155/2012/901415.
Cherkasova E.V., Peresypkina E.V., Virovets A.V. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 9. P. 1040. [Черкасова Е.В., Пересыпкина Е.В., Вировец А.В. и др. // Журн. неорган. химии. 2013. Т. 58. № 9. С. 1165. doi 10.7868/S0044457X13090079]
Kay J., Moore J.W., Glick M.D. // Inorg. Chem. 1972. V. 11. № 5. P. 2818.
Cherkasova E.V., Virovets A.V., Peresypkina E.V. et al. // Russ. J. Inorg. Chem. 2009. V. 54. № 2. P. 272. [Черкасова Е.В., Вировец А.В., Пересыпкина Е.В. и др. // Журн. неорган. химии. 2009. Т. 54. № 2. С. 315.]
Шарло Г. Методы аналитической химии. М.: Химия, 1965. 975 с.
Уильямс У.Дж. Определение анионов. М.: Химия, 1982. 642 с.
Sheldrick G.M. SADABS. Version 2.01. Bruker AXS Inc. Madison, Wisconsin, USA, 2004.
Sheldrick G.M. SHELX97. Program for the Solution and Refinement of Crystal Structures. Göttingen: Univ. of Göttingen, 1997.
Кукушкин Ю.Н. Химия координационных соединений. М.: Высш. шк., 1985. 455 с.
Костромина Н.А., Кумок В.Н., Скорик Н.А. Химия координационных соединений. М.: Высш. шк., 1990. 432 с.
Химия псевдогалогенидов / Под ред. Голуба А.М., Келера X., Скопенко В.В. Киев: Вища шк., 1981. 360 с.
Казицына Л.А., Куплетская Н.Б. Применение УФ-, ИК-, ЯМР-спектроскопии в органической химии. М.: Высш. шк., 1971. 264 с.
Смит А. Прикладная ИК-спектроскопия. М.: Мир, 1982. 328 с.
Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина Т.Г. Инфракрасная спектроскопия органических и природных соединений. СПб.: СПбЛТА, 2007. 54 с.
Чупахина Р.М., Серебренников В.В. // Журн. неорган. химии. 1966. Т. 11. № 2. С. 427.
Cherkasova E.V., Pervukhina N.V., Kuratieva N.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 5. P. 626. doi 10.1134/S003602361805011X [Черкасова Е.В., Первухина Н.В., Куратьева Н.В. и др. // Журн. неорган. химии. 2018. Т. 63. № 5. С. 596.]
Волков А.И., Жарский И.М. Большой химический справочник. Минск: Современ. шк., 2005. 608 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


