Журнал неорганической химии, 2019, T. 64, № 3, стр. 272-280
Синтез и строение PbUO2(CH2C(CH3)COO)4
Л. Б. Сережкина 1, *, М. С. Григорьев 2, Н. А. Шимин 1, В. Н. Сережкин 1
1 Самарский национальный исследовательский университет им. акад. С.П. Королева
443086 Самара, Московское шоссе, 34, Россия
* E-mail: lserezh@samsu.ru
Поступила в редакцию 12.03.2018
После доработки 15.08.2018
Принята к публикации 06.08.2018
Аннотация
Синтезировано, рентгеноструктурно и ИК-спектроскопически исследовано новое соединение PbUO2(mac)4, где mac – метакрилат-ион CH2C(CH3)COO−. В экваториальной плоскости пентагональных бипирамид UO7 содержатся атомы кислорода четырех анионов, три из которых координированы к ионам уранила монодентатно, а один – бидентатно, образуя одноядерные комплексы [UO2(mac)4]2–. Каждый ион свинца связан с 8 атомами кислорода пяти метакрилат-ионов из трех таких комплексов. В результате ионы свинца соединяют урансодержащие комплексы в электронейтральные цепочки [PbUO2(mac)4], которые являются основной структурной единицей кристаллов. Разная кристаллоструктурная роль четырех кристаллографически неэквивалентных метакрилат-ионов определяет кристаллохимическую формулу цепочек как А′АВ01В11(B21)2, где А' = Pb2+, А = ${\text{UO}}_{2}^{{2 + }}$, В01, В11 и B21 = mac. Связывание цепочек в каркас происходит за счет системы водородных связей. Рассмотрено влияние природы катионов R2+ на строение метакрилатоуранилатов.
ВВЕДЕНИЕ
Одноядерные комплексы [UO2(L)3]–, где L– – анион одноосновной карбоновой кислоты, являются одним из наиболее известных типов комплексов U(VI) [1, 2]. В таких комплексах атомы урана, входящие в состав практически линейных ионов уранила (${\text{UO}}_{2}^{{2 + }}$), связаны в экваториальной плоскости с атомами кислорода трех бидентатных карбоксилат-ионов L и образуют координационные полиэдры в виде гексагональной бипирамиды UO2O6. В структурах большинства кристаллов, содержащих комплексы [UO2(L)3]−, в качестве L выступают анионы насыщенных алифатических карбоновых кислот (уксусной, пропионовой и др.), а роль противоинов RZ+ обычно играют одно- или двухзарядные органические или неорганические катионы. Отметим, что указанные комплексы [UO2(L)3]− присутствуют в структурах кристаллов даже в тех случаях, когда в составе соединений отношение L : ${\text{UO}}_{2}^{{2 + }}$ > 3. Примерами такого рода могут служить PbUO2(L)4 ⋅ ⋅ 3H2O [3] и Cr3UO2(L)9O ⋅ 6H2O, где L – ацетат-ион [4].
Комплексы уранила с анионами ненысыщенных алифатических одноосновных карбоновых кислот (акриловой и метакриловой) стали изучаться только в последние годы [5–10]. Во всех охарактеризованных к настоящему времени структурах кристаллов акрилатоуранилатов или метакрилатоуранилатов с одно- или двухзарядными катионами металлов [8, 9] также содержатся комплексы состава [UO2(L)3]− с гексагонально-бипирамидальным окружением атома урана и кристаллохимической формулой ${\text{А В }}_{3}^{{01}}$. При исследовании системы Pb2+–${\text{UO}}_{2}^{{2 + }}$–mac−–Н2О (Hmac – метакриловая кислота, CH2C(CH3)COOH) нами было синтезировано соединение PbUO2(CH2C(CH3)COO)4 (I), в котором на один ион уранила приходятся четыре метакрилат-иона. Цель данной работы – исследование особенностей строения I методами рентгеноструктурного анализа и ИК-спектроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Трудности синтеза метакрилатных комплексов обусловлены склонностью метакриловой кислоты к быстрой и необратимой полимеризации, которую инициируют дневной свет и присутствие катиона уранила [11]. Поэтому синтез соединения проводили в сосудах, окрашенных в черный цвет. Навеску оксида свинца(II) (0.32 г, 0.7 ммоль) растворяли в водном растворе Hmac (0.96 г, 5.6 ммоль), к которому затем добавляли навеску UO3 · 2H2O (0.22 г, 0.35 ммоль). Исходные мольные соотношения UO3 · 2H2O : PbO : : Hmac равны 1 : 2 : 16. Водородный показатель полученного раствора составил 4. Раствор оставляли при комнатной температуре для изотермического испарения. Через 4–5 сут выпадали желтые кристаллы состава PbUO2(mac)4 (I) (найдено, %: U – 28.8; вычислено – 28.57, выход 54%). По данным рентгенофазового анализа (ДРОН-3, СuKα-излучение), продукт прокаливания Ι до 850°С представлял собой PbUO4, кристаллографические характеристики которого практически совпадали с данными [12]. Экспериментально установленная потеря массы (39.2%), отвечающая превращению I → PbUO4, хорошо согласуется с теоретическим значением (38.90%).
Рентгенодифракционный эксперимент проведен на автоматическом четырехкружном дифрактометре с двумерным детектором Bruker KAPPA APEX II. Параметры элементарной ячейки уточнены по всему массиву данных [13]. В экспериментально определенные значения интенсивности рефлексов внесены поправки на поглощение с использованием программы SADABS [14]. Структура расшифрована прямым методом (SHELXS97 [15]) и уточнена полноматричным методом наименьших квадратов (SHELXL-2014 [16]) по F 2 по всем данным в анизотропном приближении для всех неводородных атомов, кроме атомов C(17)–С(20) второй ориентации (с заселенностью 0.309) одного разупорядоченного метакрилат-иона. На рисунках и в таблицах приведены данные только для атомов C(13)–C(16) такого метакрилат-иона с большей заселенностью (0.691). Атомы H метакрилат-ионов размещены в геометрически вычисленных позициях с изотропными температурными параметрами, равными 1.2Uэкв(C) для групп CH2 и 1.5Uэкв(C) для групп CH3.
Параметры эксперимента и окончательные значения фактора недостоверности приведены в табл. 1, основные геометрические параметры структуры – в табл. 2. Координационные числа атомов рассчитаны с помощью метода пересекающихся сфер [17]. Координаты атомов и величины температурных параметров депонированы в Кембриджском центре кристаллографических данных CCDC № 1818937.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры PbUO2(mac)4
| Сингония, пр. гр., Z | Триклинная, P1, 2 |
| a, Å | 8.8492(2) |
| b, Å | 11.0952(3) |
| c, Å | 11.9392(3) |
| α, град | 85.480(1) |
| β, град | 74.844(1) |
| γ, град | 69.905(1) |
| V, Å3 | 1062.50(5) |
| ρx, г/см3 | 2.555 |
| μ, мм–1 | 15.571 |
| Температура, K | 100(2) |
| Излучение, λ, Å | МоKα, 0.71073 |
| Размер кристалла, мм | 0.32 × 0.28 × 0.18 |
| θmax, град | 35.00 |
| Область h, k, l | –14 ≤ h ≤ 13, –17 ≤ k ≤ 17, –19 ≤ l ≤ 18 |
| Число отражений: | |
| измеренных/независимых (N1), Rint/ c I > 1.96 σ(I) (N2) | 22 483/9270, 0.0358/7108 |
| Число уточняемых параметров | 275 |
| R1 по N2 | 0.0319 |
| wR2 по N1 | 0.0650 |
| S | 0.991 |
| Остаточная электронная плотность (min/max), e/Å3 | –3.897/1.549 |
Таблица 2.
Основные геометрические параметры структуры PbUO2(mac)4
| Связь * | d, Å | Ω, % ** | Угол | ω, град |
|---|---|---|---|---|
| Пентагональная бипирамида UO7 | ||||
| U–O(1) | 1.766(3) | 21.4 | O(1)UO(2) | 178.13(13) |
| U–O(2) | 1.766(3) | 21.7 | O(1)UO(3) | 91.40(13) |
| U–O(3) | 2.405(3) | 10.6 | O(1)UO(4) | 91.57(12) |
| U–O(4) | 2.414(3) | 10.2 | O(1)UO(5) | 87.56(13) |
| U–O(5) | 2.337(3) | 12.1 | O(1)UO(7) | 88.01(12) |
| U–O(7) | 2.381(3) | 11.4 | O(1)UO(9) | 89.18(13) |
| U–O(9) | 2.338(3) | 12.6 | ||
| КП PbO8 | ||||
| Pb–O(5) | 2.795(3) | 7.6 | O(5)Pb(1)O(6) | 49.85(9) |
| Pb–O(6) | 2.371(3) | 13.4 | O(7)Pb(1)O(8) | 47.60(9) |
| Pb–O(7a) | 2.946(3) | 5.6 | O(7)Pb(1)O(9) | 58.09(9) |
| Pb–O(7) | 2.926(3) | 8.6 | O(9)Pb(1)O(10) | 45.78(9) |
| Pb–O(8) | 2.391(3) | 13.6 | O(5)Pb(1)O(8) | 73.99(9) |
| Pb–O(9) | 3.074(3) | 4.1 | O(6)Pb(1)O(10) | 80.37(10) |
| Pb–O(10a) | 2.363(3) | 10.2 | O(8)Pb(1)O(10) | 81.75(9) |
| Pb–O(10b) | 2.761(3) | 14.3 | O(6)Pb(1)O(8) | 80.74(10) |
| Метакрилат-ионы | ||||
| O(3)–C1 | 1.274(5) | 29.2 | O(3)C(1)O(4) | 118.7(4) |
| O(4)–C1 | 1.266(5) | 29.9 | O(3)C(1)C(2) | 119.9(4) |
| C(1)–C(2) | 1.489(6) | 26.0 | С(1)C(2)C(4) | 116.5(5) |
| C(2)–C(3) | 1.344(7) | 26.5 | С(3)C(2)C(4) | 124.7(5) |
| C(2)–C(4) | 1.451(8) | 19.6 | ||
| O(5)–C(5) | 1.281(4) | 29.4 | O(5)C(5)O(6) | 120.4(4) |
| O(6)–C(5) | 1.266(5) | 29.7 | O(5)C(5)C(6) | 119.8(4) |
| C(5)–C(6) | 1.487(6) | 25.8 | С(5)C(6)C(8) | 117.7(4) |
| C(6)–C(7) | 1.379(6) | 26.4 | С(7)C(6)C(8) | 124.4(5) |
| C(6)–C(8) | 1.441(8) | 19.8 | ||
| O(7)–C(9) | 1.285(5) | 29.7 | O(7)C(9)O(8) | 121.8(3) |
| O(8)–C(9) | 1.248(4) | 30.0 | O(7)C(9)C(10) | 118.8(3) |
| C(9)–C(10) | 1.485(5) | 26.0 | С(9)C(10)C(11) | 119.6(4) |
| C(10)–C(11) | 1.338(5) | 26.9 | С(11)C(10)C(12) | 123.7(4) |
| C(10)–C(12) | 1.492(6) | 19.3 | ||
| O(9)–C(13) | 1.256(5) | 20.2 | O(9)C(13)O(10) | 121.5(5) |
| O(10)–C(13) | 1.281(6) | 18.7 | O(9)C(13)C(14) | 120.4(5) |
| C(13)–C(14) | 1.488(7) | 19.5 | С(13)C(14)C(15) | 118.8(6) |
| C(14)–C(15) | 1.325(8) | 23.2 | С(15)C(14)C(16) | 124.3(5) |
| C(14)–C(16) | 1.499(9) | 19.2 | ||
ИК-спектр был записан при комнатной температуре в диапазоне 400–4000 см–1 на ИК-Фурье-спектрометре ФТ-801. Образцы готовили прессованием таблеток с KBr.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Координационный полиэдр (КП) атома урана – пентагональная бипирамида UO2O5 (рис. 1), в аксиальных позициях которой находятся два атома кислорода, образующих с атомом урана практически линейную и равноплечную уранильную группировку (угол OUO равен 178.13°, расстояния U–O – 1.766(3) Å). В экваториальной плоскости находятся пять атомов кислорода, два из которых принадлежат одному метакрилат-иону, координированному к урану бидентатно (тип координации B01, обозначения приведены в соответствии с [18]). Три других атома кислорода принадлежат трем метакрилат-ионам, связанным с атомом урана монодентатно (тип координации M1).
Рис. 1.
Фрагмент структуры I. Эллипсоиды температурных смещений представлены с вероятностью 50%. Атомы H изображены сферами произвольного радиуса. Для двух монодентатных по отношению к атому свинца метакрилат-ионов показаны только координированные атомы кислорода (O(7а) и O(10b)). Преобразования симметрии: a (1 – x, 1 – y, 1 – z), b (x – 1, y, z).
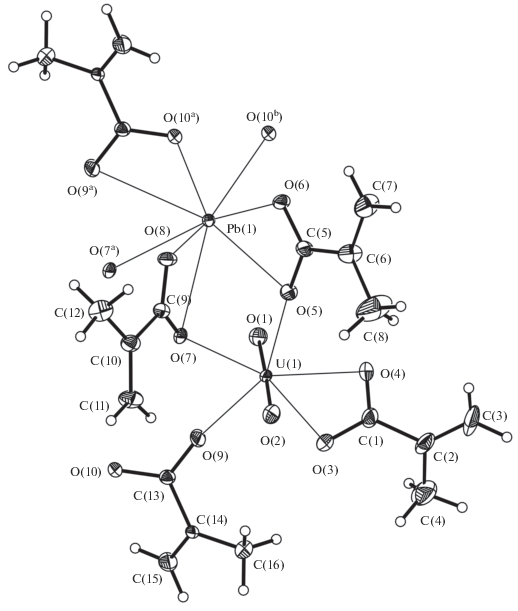
Атом свинца окружен восемью атомами кислорода, два из которых принадлежат двум разным монодентатным метакрилат-ионам, а шесть атомов попарно принадлежат трем бидентатным метакрилат-ионам (рис. 1). В структуре кристаллов один из четырех кристаллографически неэквивалентных метакрилат-ионов (включает атом С(1)) связан только с атомом урана (тип координации B01), а три других координированы одновременно и атомом урана, и атомами свинца. Метакрилат-ион, включающий атом С(5), координирован атомом свинца бидентатно, а атомом урана – монодентатно, реализуя тип координации В11. Метакрилат-ионы, содержащие атомы С(9) и С(13), связаны с одним атомом свинца бидентатно, а с другим атомом свинца и одним атомом урана – монодентатно. В итоге таким метакрилат-ионам отвечает тип координации В21. Типы координации В11 и изомерные В21 (рис. 2) обнаружены в структуре метакрилатоуранилатов впервые. Основными структурными единицами кристаллов являются цепочки [PbUO2(mac)4], распространяющиеся вдоль направления [100] (рис. 3). Разная кристаллоструктурная роль четырех кристаллографически неэквивалентных метакрилат-ионов определяет кристаллохимическую формулу (КХФ) гетероатомных цепочек как А'АВ01В11(B21)2, где А' = = Pb2+, А = ${\text{UO}}_{2}^{{2 + }}$, a В01, В11 и B21 = mac. Ортогональные проекции цепочки представлены на рис. 3. Связывание цепочек в каркас происходит за счет системы водородных связей (табл. 3).
Рис. 2.
Схематическое изображение типов координации метакрилат-ионов, атомы H ионов mac– не показаны.
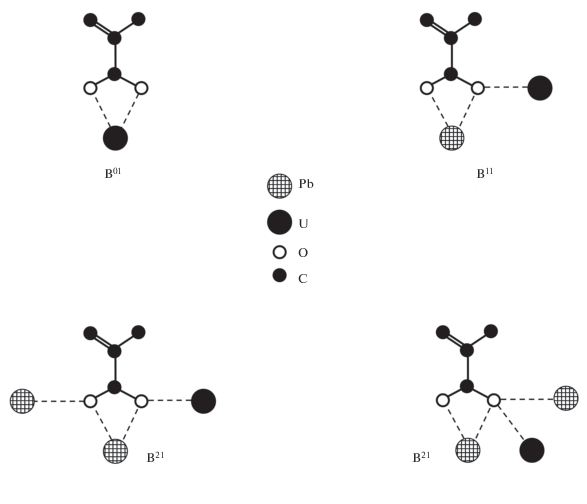
Рис. 3.
Две проекции цепочки PbUO2(mac)4: вдоль направления [100] (а) и [001] (б), для упрощения атомы H не показаны.
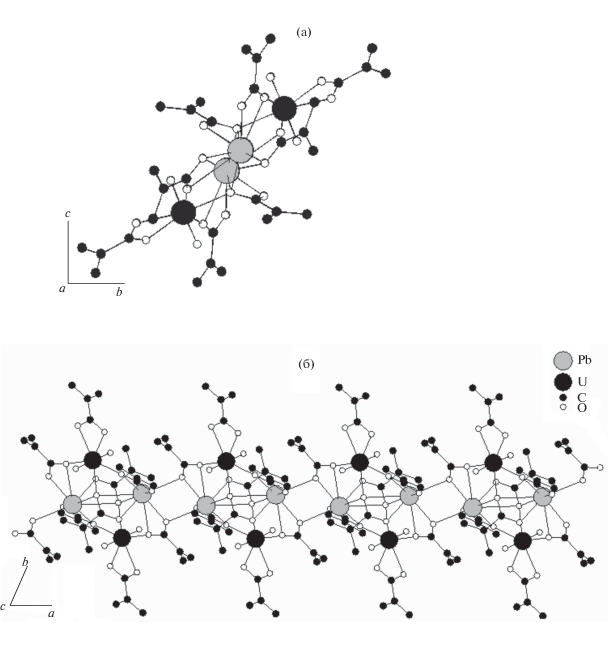
Таблица 3.
Параметры водородных связей в структуре I*
| Связь D–H···A | d(D···A), Å | d(D–H), Å | d(H···A), Å | Угол (D–H···A), град | Ω(H···A), % | РГ** |
|---|---|---|---|---|---|---|
| C(3)–H(1)···O(2) (2 – x, –y, –z) |
3.558(6) | 0.95 | 2.75 | 143 | 11.5 | 0 |
| C(8)–H(10)···O(4) | 3.458(8) | 0.98 | 2.67 | 137 | 11.7 | 6 |
| C(12)–H(15)···O(1) | 3.457(6) | 0.98 | 2.68 | 137 | 15.1 | 8 |
| C(16)–H(19)···O(3) (1 – x, 1 – y, 1 – z) |
3.224(6) | 0.98 | 2.59 | 122 | 14.6 | 6 |
Объем полиэдра Вороного–Дирихле (ПВД) атома урана в структуре составляет 9.1 Å3 и в пределах погрешности совпадает с установленным (9.3(2) Å3 [19]) для КП UOn при n от 5 до 9. Объем ПВД атома Pb(II) равен 16.4 Å3 и согласуется с установленным для КП PbO8 значением 17(1) Å3 [20]. ПВД атома свинца имеет 17 граней и сложный вид из-за наличия граней, отвечающих невалентным взаимодействиям с атомами Н, О и С.
С учетом I в настоящее время установлены состав и строение пяти метакрилатоуранилатов, содержащих в своем составе катионы двухвалентных металлов R2+ [7, 10]. Как видно из табл. 4, в зависимости от природы атомов R кристаллы этих веществ принадлежат к триклинной или моноклинной сингонии. Хотя синтез всех соединений проводился в однотипных условиях из водных растворов, содержащих значительный избыток метакриловой кислоты HL (отношения HL : R и HL : U в исходных растворах равнялись 8 или 16), в кристаллах четырех полученных соединений отношение R : U : L совпадает и равно 1 : 2 : 6. Единственным исключением является комплекс I, в котором отношение R : U : L равно 1 : 1 : 4, несмотря на то, что исходное соотношение компонентов в I совпадает с использованным при синтезе II и III. Еще одной особенностью соединения I является отсутствие воды в его составе, при этом в остальных метакрилатах содержится 13 (II, III) или 14 (IV, V) молекул воды в расчете на один атом R. Следствием уникального соотношения R : U : L в I является и его необычное строение. Так, в соединениях II–V образуются характерные для атомов U(VI) одноядерные комплексы [UO2L3]– (L– – метакрилат-ион) с КХФ ${\text{AB}}_{3}^{{01}}$ (A = ${\text{UO}}_{2}^{{2 + }}$, B01 = L). Только в структуре кристаллов I образуются комплексы [UO2L4]2– с КХФ AB01${\text{М }}_{3}^{1}$ , где A = ${\text{UO}}_{2}^{{2 + }}$, B01 или М1 = L– (рис. 1), в которых из четырех анионов, связанных с атомом урана, только один является бидентатным B01, тогда как остальные три играют очень редкую для анионов одноосновных карбоновых кислот роль монодентатных лигандов M1.
Таблица 4.
Некоторые характеристики метакрилатоуранилатов двухвалентных металлов*
| Соеди-нение | Состав соединения | Пр. гр. | КХФ комплекса уранила | Отношение R : U : L | |
|---|---|---|---|---|---|
| при синтезе | в кристаллах | ||||
| I | Pb[UO2(CH2C(CH3)COO)4] | P1 | AB01М$_{3}^{1}$ | 2 : 1 : 16 | 1 : 1 : 4 |
| II | Sr[UO2(CH2C(CH3)COO)3]2 · 13H2O | P21/c | AB$_{3}^{{01}}$ | 2 : 1 : 16 | 1 : 2 : 6 |
| III | Ba[UO2(CH2C(CH3)COO)3]2 · 13H2O | P1 | AB$_{3}^{{01}}$ | 2 : 1 : 16 | 1 : 2 : 6 |
| IV | Mg[UO2(CH2C(CH3)COO)3]2 · 14H2O | P21/n | AB$_{3}^{{01}}$ | 1 : 2: 16 | 1 : 2 : 6 |
| V | Zn[UO2(CH2C(CH3)COO)3]2 · 14H2O | P21/n | AB$_{3}^{{01}}$ | 1 : 2: 16 | 1 : 2 : 6 |
Имеющиеся данные позволяют считать, что особенности строения кристаллов I обусловлены природой двухвалентного катиона. Как видно из табл. 5, в зависимости от размера иона R2+ (ионного радиуса Rион [21] или радиуса сферического домена Rsd, объем которого совпадает с объемом соответствующего ПВД [17]) в структурах метакрилатоуранилатов атомы R могут проявлять координационные числа (КЧ) 6, 7 или 8. Ионы с небольшими радиусами (Mg, Zn) реализуют КЧ 6, а более крупные ионы (Sr, Ba, Pb) проявляют КЧ 7 или 8. При этом если не учитывать структуру I, содержащую ионы Pb2+, то независимо от размера ионы R2+ координируют от 6 до 8 молекул воды. По-видимому, отсутствие в структуре кристаллов I молекул воды в координационной сфере ионов Pb2+ обусловлено тем, что в их валентной оболочке имеется неподеленная электронная E-пара.
Таблица 5.
Некоторые параметры ионов R2+ в структурах метакрилатоуранилатов*
| R2+ | Rsd, Å | Rион, Å [21] | DA, Å | КЧ атомов R | Число координированных атомов кислорода | Тип координации метакрилат-иона к атомам | ||
|---|---|---|---|---|---|---|---|---|
| молекул H2O | OL | U | R | |||||
| Mg | 1.164 | 0.86 | 0 | 6 | 6 | 0 | B01 | – |
| Zn | 1.181 | 0.88 | 0 | 6 | 6 | 0 | B01 | – |
| Sr(1) | 1.538 | 1.40 | 0.048 | 8 | 6 | 2 | B01 | M1 |
| Sr(2) | 1.575 | 1.35 | 0.119 | 7 | 7 | 0 | B01 | – |
| Ba(1) | 1.621 | 1.56 | 0.068 | 8 | 6 | 2 | B01 | M1 |
| Ba(2) | 1.676 | 1.56 | 0.026 | 8 | 8 | 0 | B01 | – |
| Pb | 1.575 | 1.37 | 0.251 | 8 | 0 | 8 | B01 M1 M1 M1 |
– B01 B11 B11 |
Как известно [20, 22, 23], надежным и убедительным кристаллохимическим признаком присутствия стереохимически активной E-пары в валентной оболочке некоторого атома является большое (выше 0.1 Å) смещение ядра этого атома из центра тяжести его ПВД (параметр DA). В связи с этим отметим, что установленные для ионов Pb2+ в структуре I значения Rsd и DA (соответственно 1.575 и 0.25 Å) хорошо согласуются с аналогичными среднестатистическими параметрами (Rsd = 1.62(7) Å, DA = 0.3(2) Å), которые были установлены для 683 атомов Pb(II) в координационных полиэдрах PbOn при n от 3 до 12 [20]. Не обладая из-за Е-пары склонностью к координации атомов кислорода молекул воды, ионы Pb2+ в кристаллах I выступают в роли дополнительных координационных центров, успешно конкурирующих с ионами ${\text{UO}}_{2}^{{2 + }}$ за связывание атомов кислорода метакрилат-ионов. Из табл. 5 видно, что в метакрилатоуранилатах Mg и Zn все ионы R2+ образуют аквакомплексы ${\text{R}}({{{\text{H}}}_{{\text{2}}}}{\text{O}})_{6}^{{2 + }}$ и не связаны с атомами кислорода (ОL) метакрилат-ионов. В комплексах, содержащих ионы Sr2+ или Ba2+, половина катионов образует аквакомплекы ${\text{R(}}{{{\text{H}}}_{{\text{2}}}}{\text{O)}}_{7}^{{2 + }}$ или ${\text{R}}({{{\text{H}}}_{{\text{2}}}}{\text{O}})_{8}^{{2 + }},$ тогда как другая половина катионов одновременно монодентатно координирует шесть атомов кислорода молекул воды и два атома ОL разных метакрилат-ионов. И только в метакрилатоуранилате свинца все восемь атомов кислорода координационного полиэдра PbO8 являются атомами ОL, которые входят в состав пяти анионов. Полиэдры PbO8 соединены между собой двумя общими ребрами в бесконечные цепочки PbO4/2O4/1, распространяющиеся вдоль направления [100]. В отличие от кристаллов I, в структурах всех остальных метакрилатоуранилатов координационные полиэдры ROn (R = Mg, Zn, Sr, Ba) не связаны друг с другом.
ИК-спектр соединения согласуется с данными РСА. В ИК-спектре присутствуют полосы поглощения, отвечающие характеристическим колебаниям уранильной группировки и метакрилат-ионов (табл. 6). Отнесение полос колебаний проведено на основании литературных данных [24–26]. Валентное антисимметричное колебание уранильной группы проявляется в виде дублета при 923 и 945 см–1. Поглощение при 1551 см–1 и широкая полоса при 1494–1415 см–1 отвечают антисимметричным и симметричным колебаниям метакрилатной группы соответственно. Полосы средней интенсивности при 1640 и 862 см–1 обусловлены колебаниями С=С и С–С связей. В области 1372–1012 см–1 проявляются деформационные колебания углерод-водородсодержащих группировок, а в интервале 668–555 см–1 – деформационные колебания группы СОО.
Таблица 6.
Отнесение полос поглощения в ИК-спектре PbUO2(mac)4
| Волновые числа, см–1* | Отнесение | |
|---|---|---|
| 555 сл | ω(CОO) | |
| 607 ср | ρ(CОO) | |
| 668 сл | δ(CОO) | |
| 833 сл | νs(${\text{UO}}_{2}^{{2 + }}$) | |
| 862 ср | ν(С−С) | |
| 923 с 945 ср |
$\left. {_{{_{{_{{}}^{{}}}}^{{}}}}^{{}}} \right\}$ | νas(${\text{UO}}_{2}^{{2 + }}$) |
| 1012 сл | δ(СH3) | |
| 1237 с | δ(С−H) | |
| 1372 с | δ(СH2) | |
| 1415–1494 ш, с | νs(COO) | |
| 1551 с | νas(COO) | |
| 1640 ср | ν(C=C) | |
| 2929 сл 2962 сл 2983 сл |
$\left. \begin{gathered} \hfill \\ _{{_{{}}^{{}}}}^{{}} \hfill \\ \end{gathered} \right\}$ | ν(CH) |
ЗАКЛЮЧЕНИЕ
Изученная структура PbUO2(CH2C(CH3)COO)4 (I) является первым охарактеризованным примером соединения, в структуре которого метакрилат-ионы проявляют по отношению к ионам уранила сравнительно редкий для карбоксилат-ионов монодентатный тип координации M1. С учетом сведений о структурах кристаллов II–V и PbUO2(L)4 ⋅ 3H2O (L – ацетат-ион) [3] полученные для I данные свидетельствуют о том, что выбор типа координации карбоксилат-ионов L атомами U(VI) из спектра теоретически возможных (B01, B11, B2, B21, B3, M1 или M2 [2]) зависит также от свойств внешнесферных катионов R, компенсирующих заряд урансодержащих ацидокомплексов.
Список литературы
Loiseau T., Mihalcea I., Henry N., Volkringer C. // Coord. Chem. Rev. 2014. V. 266–267. P. 69. http://dx.org/10.1016/j.ccr.2013.08.038.
Savchenkov A.V., Vologzhanina A.V., Pushkin D.V., Serezhkina L.B. // Eur. J. Inorg. Chem. 2018. V. 2018. № 18. P. 1869. doi 10.1002/ejic.201701318
Сережкина Л.Б., Вологжанина А.В., Клепов В.В., Сережкин В.Н. // Кристаллография. 2011. Т. 56. № 1. С. 138.
Клепов В.В., Пересыпкина Е.В., Сережкина Л.Б. и др. // Журн. неорган. химии. 2012. Т. 57. № 10. С. 1426.
Serezhkina L.B., Grigor’ev M.S., Shimin N.A., et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 6. P. 672. doi 10.1134/S0036023615060121 [Сережкина Л.Б., Григорьев М.С., Шимин Н.А. и др. // Журн. неорган. химии. 2015. Т. 60. № 6. С. 746. doi 10.7868/S0044457X15060124].
Klepov V.V., Vologzhanina A.V., Alekseev E.V. et al. // Cryst. Eng. Comm. 2016. V. 18. P. 1723. doi 10.1039/ C5CE01957E
Klepov V.V., Serezhkina L.B., Pushkin D.V. et al. // Eur. J. Inorg. Chem. 2016. V. 2016. P. 118. doi 10.1002/ ejic.201501035
Klepov V.V., Serezhkina L.B., Vologzhanina A.V. et al. // Inorg. Chem. Commun. 2014. V. 46. P. 5.
Klepov V.V., Serezhkina L.B., Grigoriev M.S. et al. // Polyhedron. 2017. V. 133. P. 40.
Сережкина Л.Б., Григорьев М.С., Клепов В.В., и др. // Кристаллография. 2019. № 2.
White R.B., Melvill H.W. // J. Soc. Dyers Colourists. 1949. V. 65. № 12. P. 703. doi 10.1111/j.1478-4408.1949.tb02548.x
Cremers T.L., Eller P.G., Larson E.M. // Acta Crystallogr. 1986. V. C42. № 12. P. 1684. doi 10.1107S0108270186090947
SAINT-Plus (Version 7.68) // Bruker AXS Inc., Madison, Wisconsin, USA. 2007.
SADABS. Bruker AXS Inc., Madison, Wisconsin, USA.
Sheldrick G.M. // Acta Crystallogr. 2008. V. 64A. № 1. P. 112. doi 10.1107/S0108767307043930
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71C. № 1. P. 3. doi 10.1107/S2053229614024218
Serezhkin V.N., Mikhailov Yu.N., Buslaev Yu.A. // Russ. J. Inorg. Chem. 1997. V. 42. № 12. P. 1871.
Serezhkin V.N., Vologzhanina A.V., Serezhkina L.B. et al. // Acta Crystallogr. 2009. V. 65B. № 1. P. 45. doi 10.1107/ S0108768108038846
Serezhkin V.N., Karasev M.O., Serezhkina L.B. // Radiochem. 2013. V. 55. № 2. P. 137. [Сережкин В.Н., Карасев М.О., Сережкина Л.Б. // Радиохимия. 2013. Т. 55. № 2. С. 97.] doi 10.1134/S106636221302001X
Pushkin D.V., Marukhnov A.V., Serezhkin V.N. // Russ. J. Inorg. Chem. 2006. V. 51. № 1. P. 99. [Пушкин Д.В., Марухнов А.В., Сережкин В.Н. // Журн. неорган. химии. 2006. Т. 51. № 1. С. 107.] doi 10.1134/ S0036023606010165
Вайнштейн Б.К., Фридкин В.М., Инденбом В.Л. Современная кристаллография (в 4-х томах). Структура кристаллов. М.: Наука, 1979. Т. 2. С. 75.
Сережкин В.Н., Буслаев Ю.А. // Журн. неорган. химии. 1997. Т. 42. № 7. С. 1178.
Marukhnov A.V., Pushkin D.V., Serezhkin V.N. // Russ. J. Coord. Chem. 2008. V. 34. № 8. P. 570. [Марухнов А.В., Пушкин Д.В., Сережкин В.Н. // Коорд. химия. 2008. Т. 34. № 8. С. 577.] doi 10.1134/S1070328408080034
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. Part A. Theory and Applications in Inorganic Chemistry. Wiley, 2009 [Накамото K. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536 с.]
Wu B., Lu W., Zheng X. // J. Coord. Chem. 2003. V. 56. P. 65. doi 10.1080/0095897031000065368
Zhu Y., Lu W., Chen F. // Acta Crystallogr. 2004. V. 60E. P. m1459. doi 10.1107/S1600536804022779
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


