Журнал неорганической химии, 2019, T. 64, № 3, стр. 323-329
Экстракция РЗЭ(III) смесями 1-фенил-3-метил-4-бензоил-5-пиразолона и амидов 2-фосфорилфеноксиуксусных кислот
А. Н. Туранов 1, *, В. К. Карандашев 2, Д. В. Баулин 3, В. Е. Баулин 3, 4, А. Ю. Цивадзе 3
1 Институт физики твердого тела РАН
142432 Черноголовка Московской обл., ул. Академика Осипьяна, 2, Россия
2 Институт проблем технологии микроэлектроники и особо чистых материалов РАН
142432 Черноголовка Московской обл., ул. Академика Осипьяна, 6, Россия
3 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр-т, 31, корп. 4, Россия
4 Институт физиологически активных веществ РАН
142432 Черноголовка Московской обл., Северный пр-д, 1, Россия
* E-mail: turanov@issp.ac.ru
Поступила в редакцию 17.04.2018
После доработки 06.07.2018
Принята к публикации 15.08.2018
Аннотация
Изучена экстракция ионов РЗЭ(III) из хлоридных растворов смесями 1-фенил-3-метил-4-бензоил-5-пиразолона и амидов 2-фосфорил–феноксиуксусных кислот в органических растворителях. Наблюдаемый значительный синергетический эффект связан с образованием гидрофобных смешанолигандных комплексов РЗЭ(III). Определена стехиометрия экстрагируемых комплексов, рассчитаны константы экстракции. Рассмотрено влияние состава водной фазы, природы органического растворителя и строения амидов 2-фосфорилфеноксиуксусных кислот на эффективность извлечения ионов РЗЭ(III) в органическую фазу.
ВВЕДЕНИЕ
Экстракционные методы широко используются для извлечения, концентрирования и разделения ионов редкоземельных элементов (РЗЭ) [1]. Для повышения степени извлечения ионов металлов из водных растворов часто используют смеси экстрагентов, дающие синергетический эффект – неаддитивное увеличение коэффициентов распределения ионов элементов [2]. Синергетический эффект обнаружен при экстракции РЗЭ(III) смесями хелатообразующих кислотных реагентов, таких как β-дикетоны, 4-ацилпиразолоны, 3-фенил-4-бензоил-5-изоксазолон с нейтральными донорно-активными экстрагентами [3–18]. Экстракция РЗЭ(III) растворами 1-фенил-3-метил-4-бензоил-5-пиразолона (HP) возрастает в присутствии нейтральных фосфорорганических соединений [19–21], диалкил- и дифенилсульфоксидов [22, 23], оксидов карбамоилметилфосфинов [22, 24], тетраоктилдигликольамида [24], краун-эфиров [25], фосфорилсодержащих каликсаренов [26–30].
В последнее время растет интерес к использованию амидов фосфорилсодержащих феноксиуксусных кислот в качестве экстрагентов [31]. Представляет интерес оценить возможность использования таких соединений в качестве добавки при экстракции РЗЭ(III) растворами HP.
Цель настоящей работы – исследование влияния строения амидов 2-фосфорилфеноксиуксусных кислот I–IV на эффективность экстракции РЗЭ(III) смесями этих соединений и 1-фенил-3-метил-4-бензоил-5-пиразолона в органических растворителях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений I–IV описан в [31]. 1-Фенил-3-метил-4-бензоил-5-пиразолон марки “х. ч.” (Вектон) использовали без дополнительной очистки. Оксид дифенил(дибутилкарбамоилметил)фосфина (V) синтезировали по методике [32]. В качестве органических растворителей использовали хлороформ, 1,2-дихлорэтан, четыреххлористый углерод, толуол и циклогексан марки “х. ч.” или “ч. д. а.” без дополнительной очистки. Растворы экстрагентов в органических растворителях готовили по точным навескам.
Исходные водные растворы хлоридов РЗЭ готовили растворением соответствующих солей в воде с последующим добавлением растворов HCl до требуемой концентрации. Постоянную ионную силу полученных растворов (0.1 M) поддерживали с помощью NaCl. Концентрация каждого из РЗЭ(III) в исходных водных растворах составляла 2 × 10–6 моль/л. Все используемые реактивы соответствовали марке “х. ч.”.
Опыты по экстракции проводили в пробирках с притертыми пробками при температуре 22 ± 1°С и соотношении объемов органической и водной фаз 1 : 1. Контакт фаз осуществляли на роторном аппарате для перемешивания со скоростью вращения 60 об./мин в течение 1 ч. Предварительно было установлено, что этого времени достаточно для установления постоянных значений коэффициентов распределения РЗЭ (DLn).
Концентрацию РЗЭ(III) в исходных и равновесных водных растворах определяли масс-спектральным методом с ионизацией пробы в индуктивно-связанной плазме с использованием масс-спектрометра X-7 (Thermo Electron, США) по ранее описанной методике [33]. Концентрацию РЗЭ(III) в органической фазе определяли после двукратной реэкстракции 1 М раствором HCl. Величину DLn рассчитывали как отношение концентраций РЗЭ(III) в равновесных органической и водной фазах. Погрешность определения DLn не превышала 5%. Величину pH равновесных водных фаз определяли с использованием pH-метра “pH 150” со стеклянным электродом.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что РЗЭ(III) экстрагируются растворами HP в органических растворителях в виде 1-фенил-3-метил-4-бензоил-5-пиразолонатов, сольватированных молекулой HP [22, 34], в результате протекания реакции
(1)
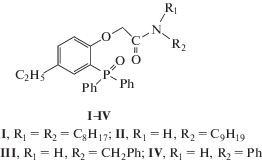
${\text{Ln}}_{{\left( {\text{в }} \right)}}^{{3 + }} + 4{\text{H}}{{{\text{P}}}_{{({\text{o}})}}} \rightleftarrows {\text{Ln}}{{{\text{P}}}_{3}}{\text{H}}{{{\text{P}}}_{{\left( {\text{о }} \right)}}} + 3{\text{H}}_{{\left( {\text{в }} \right)}}^{ + },\,\,\,\,{{K}_{{{\text{Ln,HP}}}}},$Рис. 1.
Зависимость коэффициентов распределения Eu(III) при его экстракции изомолярными смесями амида I и HP в толуоле от мольного соотношения экстрагентов в органической фазе, [HP] + [L] = 0.01 моль/л, рН 2.70.
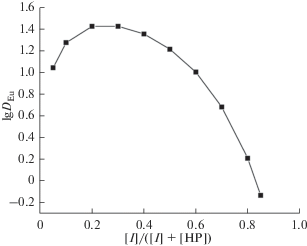
Эффективность извлечения РЗЭ(III) в органическую фазу смесью HP и амида I возрастает с увеличением значения рН равновесной водной фазы (рис. 2). При этом угловой наклон зависимости lg DLn–pH близок к 3 для всех РЗЭ(III), что соответствует переходу трех ионов H+ в водную фазу в процессе экстракции.
Рис. 2.
Зависимость коэффициентов распределения РЗЭ(III) при их экстракции смесью амида I (0.005 моль/л) и HP (0.03 моль/л) в толуоле от величины рН равновесной водной фазы.
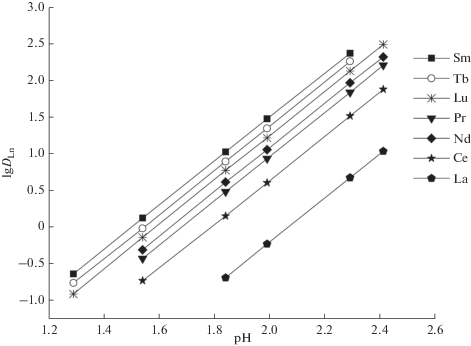
Для определения стехиометрического соотношения РЗЭ(III) : амид I в экстрагируемых комплексах РЗЭ(III) использовали метод сдвига равновесия. При постоянной концентрации HP в органической фазе и постоянном значении рН водной фазы тангенс угла наклона зависимости lg DLn–lg[L(I)] близок к 1 (рис. 3), что соответствует извлечению комплексов с соотношением РЗЭ(III) : L = 1 : 1. Такое же стехиометрическое соотношение получено при экстракции всех других РЗЭ(III) смесями HP и соединений II–IV. При извлечении смесями HP и оксида октил(фенил)-N,N-диизобутилкарбамоилметилфосфина (КМФО) отмечено образование комплексов с соотношением РЗЭ(III) : КМФО = 1 : 1 [22], тогда как при экстракции Eu(III) смесями HP и триоктилфосфиноксида (ТОФО) в хлороформе получено соотношение Eu(III) : ТОФО = 1 : 2 [22]. Уменьшение числа лигандов I–IV в экстрагируемых комплексах РЗЭ(III) может быть связано с большей дентатностью фосфорилсодержащих амидов I–IV по сравнению с таковой для ТОФО.
Рис. 3.
Зависимость коэффициентов распределения РЗЭ(III) от концентрации амида I в толуоле, содержащем 0.03 моль/л HP, рН 2.0.
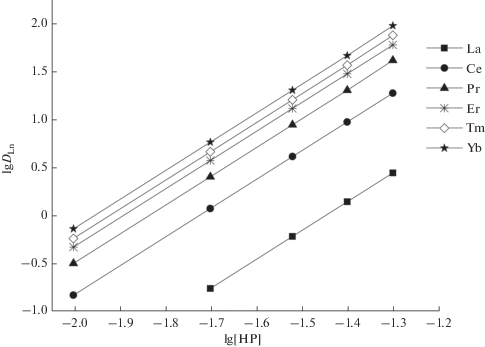
При постоянной концентрации амида I в органической фазе и постоянной величине рН водной фазы тангенс угла наклона зависимости lg DLn–lg[HP] близок к 3 (рис. 4), что соответствует извлечению комплексов с соотношением РЗЭ(III) : P– = 1 : 3. Такое же стехиометрическое соотношение получено при экстракции РЗЭ(III) смесями HP и амидов II–IV.
Рис. 4.
Зависимость коэффициентов распределения РЗЭ(III) от концентрации HP в толуоле, содержащем 0.005 моль/л амида I, рН 2.0.
С учетом найденных стехиометрических коэффициентов межфазное распределение ионов РЗЭ(III) в процессе их экстракции растворами смесей HP и фосфорилсодержащих амидов I–IV может быть описано уравнением:
(2)
$\begin{gathered} {\text{Ln}}_{{\left( {\text{в }} \right)}}^{{3 + }} + 3{\text{H}}{{{\text{P}}}_{{({\text{o}})}}} + {{{\text{L}}}_{{\left( {\text{o}} \right)}}} \rightleftarrows \\ \rightleftarrows \,\,{\text{Ln}}{{{\text{P}}}_{3}}{{{\text{L}}}_{{\left( {\text{о }} \right)}}} + 3{\text{H}}_{{\left( {\text{в }} \right)}}^{ + },\,\,\,\,{{K}_{{{\text{Ln,HP,L}}}}}, \\ \end{gathered} $(3)
${\text{Ln}}{{{\text{P}}}_{{\text{3}}}}{\text{H}}{{{\text{P}}}_{{\left( {\text{о }} \right)}}} + {{{\text{L}}}_{{{\text{(o)}}}}} \rightleftarrows {\text{Ln}}{{{\text{P}}}_{{\text{3}}}}{{{\text{L}}}_{{\left( {\text{о }} \right)}}} + {\text{H}}{{{\text{P}}}_{{{\text{(o)}}}}},\,\,\,\,\quad{{\beta }_{{{\text{HP,L}}}}},$(4)
${{\beta }_{{{\text{HP,L}}}}} = {{{{K}_{{{\text{Ln,HP,L}}}}}} \mathord{\left/ {\vphantom {{{{K}_{{{\text{Ln,HP,L}}}}}} {{{K}_{{{\text{Ln,HP}}}}}}}} \right. \kern-0em} {{{K}_{{{\text{Ln,HP}}}}}}}.$Зависимость коэффициентов распределения РЗЭ(III) от равновесных концентраций компонентов в органической и водной фазах при экстракции смесями HP и фосфорилсодержащих амидов может быть выражена как
(5)
${{D}_{{{\text{Ln}}}}} = {{K}_{{{\text{Ln,HP,L}}}}}\left[ {{\text{HP}}} \right]_{{{\text{(о }})}}^{3}{{\left[ L \right]}_{{({\text{о }})}}}\left[ {{{H}^{ + }}} \right]_{{({\text{в )}}}}^{{ - 3}}.$Константы экстракции РЗЭ(III) смесями HP и фосфорилсодержащего амида I в толуоле и константы образования смешанолигандных комплексов РЗЭ(III), рассчитанные методом наименьших квадратов по уравнениям (5) и (4), представлены в табл. 1. Видно, что значения KLn,HP увеличиваются с ростом атомного номера (Z) РЗЭ. Это связано с увеличением устойчивости комплексов РЗЭ(III) с жесткими (по Пирсону) лигандами по мере увеличения плотности заряда ионов Ln3+ вследствие уменьшения их ионных радиусов с ростом Z [35]. Значения KLn,HP,L увеличиваются в ряду РЗЭ(III) от La(III) до Sm(III), а затем наблюдается немонотонное изменение величин KLn,HP,L, связанное с проявлением тетрадного эффекта при экстракции РЗЭ(III) [36, 37]. Такой же характер зависимости KLn,HP,L–Z отмечался при экстракции РЗЭ(III) смесями HP с оксидом дибутил(N,N-дибутилкарбамоилметоксиметил)фосфина [24].
Таблица 1.
Константы равновесия и величины синергетического эффекта в системе РЗЭ(III)–HP–амид I–толуол
| Ln(III) | lg KLn,HP [24] | lg KLn,HP,L | lg βHP,L | lg SC* |
|---|---|---|---|---|
| La | –5.56 ± 0.03 | 0.54 ± 0.03 | 6.10 ± 0.03 | 5.32 |
| Ce | –4.83 ± 0.03 | 1.33 ± 0.03 | 6.16 ± 0.03 | 5.38 |
| Pr | –4.36 ± 0.03 | 1.67 ± 0.03 | 6.03 ± 0.03 | 5.25 |
| Nd | –4.08 ± 0.04 | 1.78 ± 0.04 | 5.86 ± 0.04 | 5.09 |
| Sm | –3.48 ± 0.03 | 2.18 ± 0.03 | 5.66 ± 0.03 | 4.88 |
| Eu | –3.35 ± 0.03 | 2.16 ± 0.03 | 5.51 ± 0.03 | 4.73 |
| Gd | –3.44 ± 0.04 | 1.95 ± 0.04 | 5.39 ± 0.04 | 4.61 |
| Tb | –3.17 ± 0.03 | 2.06 ± 0.03 | 5.32 ± 0.03 | 4.45 |
| Dy | –3.06 ± 0.04 | 2.02 ± 0.04 | 5.08 ± 0.04 | 4.30 |
| Ho | –3.07 ± 0.03 | 1.91 ± 0.03 | 4.98 ± 0.03 | 4.20 |
| Er | –2.94 ± 0.03 | 1.91 ± 0.03 | 4.85 ± 0.03 | 4.07 |
| Tm | –2.67 ± 0.03 | 2.02 ± 0.03 | 4.69 ± 0.03 | 3.91 |
| Yb | –2.43 ± 0.04 | 2.12 ± 0.04 | 4.55 ± 0.04 | 3.77 |
| Lu | –2.46 ± 0.03 | 2.09 ± 0.03 | 4.55 ± 0.03 | 3.77 |
Величина синергетического эффекта SC = = D(DL + DHP)–1 (DL, DHP и D – коэффициенты распределения РЗЭ(III) при экстракции соединениями I, HP и их смесью соответственно) определяется устойчивостью смешанолигандных комплексов РЗЭ(III) и зависит от концентрации соединений I и HP в органической фазе:
(6)
$SC = {\text{ }}{{\beta }_{{{\text{HP,L}}}}}\left[ {{\text{HP}}} \right]_{{({\text{о }})}}^{{ - 1}}{{\left[ {\text{L}} \right]}_{{({\text{о }})}}}.$При постоянных концентрациях соединений I и HP в органической фазе величина синергетического эффекта уменьшается в ряду РЗЭ(III) от La(III) к Lu(III) (табл. 1). Такой же характер зависимости SC–Z отмечался при экстракции РЗЭ(III) смесями HP с оксидом дибутил(N,N-дибутилкарбамоилметоксиметил)фосфина [24] и фосфорилсодержащим каликс[6]ареном [29].
Влияние структуры фосфорилсодержащих амидов I–IV на эффективность экстракции РЗЭ(III) смесями этих соединений и HP рассмотрено путем сопоставления величин DLn, определенных в одинаковых экспериментальных условиях (рис. 5). N,N-диалкилзамещенный реагент I увеличивает экстракцию РЗЭ(III) растворами HP более заметно, чем вторичный N-алкиламид II. Природа заместителей при атоме азота оказывает существенное влияние на эффективность экстракции РЗЭ(III) смесями этих соединений и HP. Увеличение величин DLn в ряду соединений IV < <III < II связано, по-видимому, с уменьшением электроотрицательности заместителей при атоме азота, сопровождаемым увеличением основности реагента и ростом его комплексообразующей способности. Подобная зависимость наблюдалась при экстракции Am(III) оксидами карбамоилметилфосфинов [38].
Рис. 5.
Экстракция РЗЭ(III) и Y(III) 0.03 M растворами HP в толуоле, содержащими 0.005 моль/л амидов I–IV и КМФО V, рН 2.0.
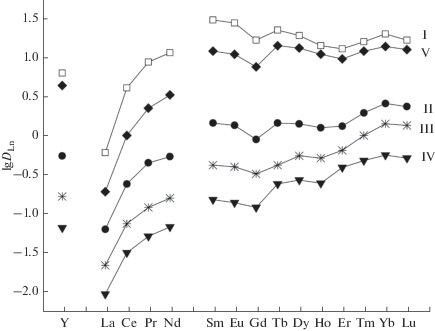
Сопоставление коэффициентов распределения РЗЭ(III) в процессе их экстракции смесями HP с соединениями I–IV и смесью НР с КМФО V (рис. 5) показало, что соединение I является более эффективной донорно-активной добавкой в экстракционной системе, содержащей HP, чем КМФО V.
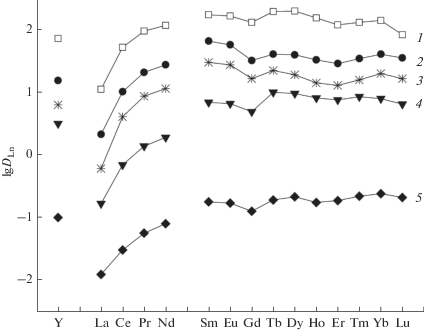
Природа органического растворителя оказывает существенное влияние на эффективность экстракции РЗЭ(III) смесями HP и амидов I–IV. Так, при экстракции растворами HP и соединения I величины DLn возрастают в ряду хлороформ < 1,2-дихлорэтан < толуол < CCl4 < циклогексан по мере снижения полярности органических растворителей (рис. 6). Подобная тенденция наблюдалась при экстракции смесями хелатообразующих реагентов и нейтральных фосфорорганических соединений [7, 39, 40].
Рис. 6.
Экстракция РЗЭ(III) и Y(III) смесями амида I (0.005 моль/л) и HP в циклогексане (1), CCl4 (2), толуоле (3), дихлорэтане (4) и хлороформе (5). Концентрация HP, моль/л: 1 – 0.007, 2–5 – 0.03, рН 2.0.
Представленные данные показали, что экстракция ионов РЗЭ(III) 1-фенил-3-метил-4-бензоил-5-пиразолоном значительно увеличивается в присутствии фосфорилзамещенных амидов I–IV. Синергетический эффект связан с образованием гидрофобных смешанолигандных комплексов РЗЭ(III) LnP3L. Структура фосфорилзамещенных амидов оказывает существенное влияние на их экстракционную способность. N,N-диалкилзамещенный реагент I является более эффективной донорно-активной добавкой в экстракционной системе, содержащей 1-фенил-3-метил-4-бензоил-5-пиразолон, чем КМФО V.
Список литературы
Михайличенко А.И., Михлин Е.Б., Патрикеев Ю.Б. Редкоземельные металлы. М.: Металлургия, 1987. 232 с.
Ягодин Г.А., Каган С.З., Тарасов В.В. и др. Основы жидкостной экстракции. М.: Химия, 1981. 400 с.
Золотов Ю.А., Кузьмин Н.М. Экстракция металлов ацилпиразолонами. М.: Наука, 1977. 140 с.
Rao L., Xia Y., Rapko B.M., Martin P.F. // Solvent Extr. Ion Exch. 1998. V. 16. P. 913.
Satake S., Tsukahara S., Suzuki N. // Solvent Extr. Ion Exch. 1999. V. 17. P. 259.
Shu S.K., Chakravortty V., Reddy M.L.P., Ramamohan T.R. // Talanta. 2000. V. 51. P. 523.
Bond A.H., Dietz M.L., Chiarizia R. // Ind. Eng. Chem. Res. 2000. V. 39. P. 3442.
Pavithran R., Reddy M.L.P. // Anal. Chim. Acta. 2005. V. 536. P. 219.
Hasegawa Y., Tsusima S., Noro J., Kusakabe S. // Solvent Extr. Ion Exch. 2006. V. 24. P. 663.
Odashima T., Satoh S., Sato T., Ishii H. // Solvent Extr. Ion Exch. 1995. V. 13. P. 845.
Maroun E., Arichi J., Goetz-Grandmont G.J. // Sep. Purif. Technol. 2007. V. 53. P. 259.
Kitatsuji Y., Meguro Y., Yoshida Z. et al. // Solvent Extr. Ion Exch. 1995. V. 13. P. 289.
Petrova M.A., Kurteva V.B., Lubenov L.A. // Ind. Eng. Chem. Res. 2011. V. 50. P. 12170.
Okamura H., Hirayama N., Morita K. et al. // Anal. Sci. 2010. V. 26. P. 607.
Petrova M.A. // J. Chem. Eng. Data. 2010. V. 55. P. 5791.
Reddy M.L.P., Luxma Varma R., Ramamohan T.R. et al. // Radiochim. Acta. 1995. V. 69. P. 55.
Sahu S.K., Chakravotty V., Reddy M.L.P. et al. // Radiochim. Acta. 1999. V. 85. P. 107.
Umetani S., Freiser H. // Inorg. Chem. 1987. V. 26. P. 3179.
Reddy M.L.P., Damodaran A.D., Mathur J.N. et al. // J. Radioanal. Nucl. Chem. 1995. V. 198. P. 367.
Zhao J., Meng S., Li D. // J. Chem. Technol. Biotechnol. 2006. V. 81. P. 1384.
Mukai H., Umetani S., Matsui M. // Solvent Extr. Ion Exch. 2003. V. 21. P. 73.
Santhi P.B., Reddy M.L.P., Ramamohan T.R., Damodaran A.D. // Solvent Extr. Ion Exch. 1994. V. 12. P. 633.
Atanassova M., Dukov I. // J. Solution Chem. 2009. V. 38. P. 289.
Turanov A.N., Karandashev V.K., Kharlamov A.V., Bondarenko N.A. // Solvent Extr. Ion Exch. 2014. V. 32. P. 492.
Dukov I.L. // Solvent Extr. Ion Exch. 1992. V. 10. P. 637.
Tashev E., Atanassova M., Varbanov S. et al. // Sep. Purif. Technol. 2008. V. 64. P. 170.
Atanassova M., Lachkova V., Vassiliev N. et al. // J. Incl. Phenom. Macrocycl. Chem. 2007. V. 58. P. 173.
Atanassova M., Vassilev N., Tashev E. et al. // Sep. Sci. Technol. 2016. V. 51. P. 49.
Varbanov S., Tashev E., Vassiliev N. et al. // Polyhedron. 2017. V. 134. P. 135.
Atanassova M., Kurteva V. // RSC Advances. 2016. V. 6. P. 11303.
Turanov A.N., Karandashev V.K., Baulin V.E. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 3. P. 377. [Туранов А.Н., Карандашев В.К., Баулин В.Е. и др. // Журн. неорган. химии. 2016. Т. 61. № 3. С. 396.]
Туранов А.Н., Карандашев В.К., Харитонов А.В. и др. // Журн. общ. химии. 1999. Т. 69. № 7. С. 1109.
Turanov A.N., Karandashev V.K., Baulin V.E., Tsvetkov E.N. // Russ. J. Inorg. Chem. 1995. V. 40. № 11. P. 1854. [Туранов А.Н., Карандашев В.К., Баулин В.Е., Цветков Е.А. // Журн. неорган. химии. 1995. Т. 40. № 11. С. 1926.]
Jordanov V.M., Atanassova M., Dukov I.L. // Sep. Sci. Technol. 2002. V. 37. P. 3349.
Nash K.L., Jensen M.P. // Sep. Sci. Technol. 2001. V. 36. P. 1257.
Peppard D.F., Mason G.W., Lewey S. // J. Inorg. Nucl. Chem. 1969. V. 31. P. 2271.
Михайличенко А.И. // Радиохимия. 1975. Т. 17. № 3. С. 352.
Чмутова М.К., Литвина М.Н., Прибылова Г.А. и др. // Радиохимия. 1995. Т. 37. № 5. С. 430.
Akiba K., Wada M., Kanno T. // J. Inorg. Nucl. Chem. 1981. V. 43. P. 1031.
Шмидт В.С., Рыбаков К.А., Рубисов В.Н. // Радиохимия. 1982. Т. 24. № 1. С. 25.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии