Журнал неорганической химии, 2019, T. 64, № 6, стр. 603-606
Синтез и исследование термодинамических свойств Cu5V2O10
Л. Т. Денисова 1, *, Ю. Ф. Каргин 2, Н. В. Белоусова 1, Н. А. Галиахметова 1, В. М. Денисов 1
1 Сибирский федеральный университет, Институт цветных металлов и материаловедения
660041 Красноярск, Свободный пр-т, 79, Россия
2 Институт металлургии и материаловедения им. А.А. Байкова РАН
119991 Москва, Ленинский пр-т, 49, Россия
* E-mail: antluba@mail.ru
Поступила в редакцию 16.11.2017
После доработки 28.11.2018
Принята к публикации 27.12.2018
Аннотация
Твердофазным синтезом при последовательном обжиге на воздухе стехиометрической смеси CuO и V2O5 получен Cu5V2O10. Методом дифференциальной сканирующей калориметрии измерена его высокотемпературная теплоемкость. По экспериментальной зависимости Cp = f(T) рассчитаны термодинамические свойства (изменение энтальпии, энтропии, приведенная энергия Гиббса). Показано, что имеется корреляция между удельной теплоемкостью и составом оксидов системы CuO–V2O5.
ВВЕДЕНИЕ
Несмотря на значительный интерес к оксидным соединениям, образующимся в системе CuO–V2O5, многие их свойства к настоящему времени исследованы недостаточно [1–7]. Заметим, что результаты исследования таких соединений до 2010 г. рассмотрены и обобщены в монографии [1] и обзоре [2]. Следует отметить, что имеющиеся сведения о фазовых равновесиях в системе CuO–V2O5 различаются между собой как видом диаграммы состояния, так и количеством образующихся соединений. Приводятся данные по образованию как четырех соединений CuO : : V2O5 = 1 : 1, 2 : 1, 3 : 1, 5 : 1, так и пяти (помимо этих соединений еще одного 4 : 1) [1, 2, 5, 7, 8]. Сообщается об образовании соединения Cu11V6O26 [8, 9], которое на диаграмме состояния CuO–V2O5 не отмечено. Синтез подобных соединений проводят, как правило, при высоких температурах. Для термодинамического моделирования таких процессов требуются сведения, которые для соединений системы CuO–V2O5 весьма ограничены. Имеются данные об энтальпии образования CuV2O6, Cu2V2O7, Cu3V2O8, Cu4V2O9 [1], низкотемпературной теплоемкости CuV2O6 [10] и Cu2V2O7 [11], высокотемпературной теплоемкости CuV2O6 и Cu2V2O7 [12].
Цель работы – синтез, исследование высокотемпературной теплоемкости и определение по этим данным термодинамических свойств Cu5V2O10.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения Cu5V2O10 использовали твердофазный синтез. Исходные навески CuO (Alfa Aesor (99.996%)) и V2O5 (ос. ч.) предварительно прокаливали на воздухе при 1173 и 773 K соответственно. Стехиометрическую смесь исходных компонентов после гомогенизации в агатовой ступке прессовали в таблетки и обжигали на воздухе последовательно при 833 (200 ч), 863 (20 ч), 923 (80 ч) и 973 K (20 ч). Для достижения полноты твердофазного взаимодействия реагентов образцы через каждые 20 ч перетирали и снова прессовали в таблетки. Контроль фазового состава полученных образцов проводили с использованием рентгенофазового анализа на приборе X′Pert Pro MPD (PANalytical, Нидерланды) в CuKα-излучении. Регистрацию дифрактограмм выполняли высокоскоростным детектором PIXcel с графитовым монохроматором в интервале 2θ = 10°–113° с шагом 0.013°. Установлено, что при таких условиях синтеза Cu5V2O10 в образце имеются следы неидентифицированной фазы (рис. 1). Поэтому время синтеза при Т = 973 K было увеличено еще на 50 ч. В этом случае получен однофазный образец черного цвета. Рентгенограмма полученного Cu5V2O10 приведена на рис. 2. Параметры решетки определены путем полнопрофильного уточнения методом минимизации производной разности [13]. Для полученного соединения (пр. гр. P21/c) a = 8.3937(1), b = 6.0659(1), c = 16.1601(2) Å, β = 108.0857(6)°, V = 782.14(2) Å3. Эти результаты хорошо совпадают с данными [14]: a = 8.393(2), b = 6.0652(8), c = 16.156(3) Å, β = 108.09(2)°.
Рис. 1.
Фрагмент рентгенограммы образца Cu5V2O10. Рефлексы основной фазы и CuO помечены штрихами, примесные рефлексы – звездочкой.
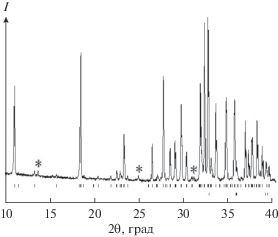
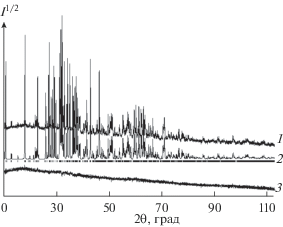
Рис. 2.
Экспериментальный (1), расчетный (2) и разностный (3) профили рентгенограммы Cu5V2O10 после уточнения методом минимизации производной разности; штрихи – расчетное положение рефлексов.
Теплоемкость Cp измеряли методом дифференциальной сканирующей калориметрии в платиновых тиглях с крышкой на приборе STA 449 C Jupiter (NETZSCH, Германия), используя держатель TG+DSC 6.226.1–72+S. Производили не менее трех измерений. Масса образцов была близка массе эталона и составляла 114 ± 3 мг. Методика измерений теплоемкости подобна описанной нами ранее [15, 16]. Экспериментальные результаты обрабатывали с помощью пакета анализа Proteus Thermal Analysis и лицензионного программного инструмента Sistat Sigma Plot 12.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 3 показано влияние температуры на молярную теплоемкость Cu5V2O10. Видно, что значения Cp с ростом температуры увеличиваются, а на зависимости Cp = f(T) нет экстремумов. Видимо, это может свидетельствовать о том, что у Cu5V2O10 в интервале температур 320–1000 K нет полиморфных превращений. Полученные результаты могут быть описаны классическим уравнением Майера–Келли:
(1)
$\begin{gathered} {{C}_{p}} = a + bT + c{{T}^{{ - 2}}} = \left( {399.54 \pm 0.49} \right) + \\ + \,\,\left( {44.24 \pm 0.50} \right) \times {{10}^{{ - 3}}}T - \left( {63.17 \pm 4.71} \right) \times {{10}^{5}}{{T}^{{ - 2}}}. \\ \end{gathered} $Рис. 3.
Влияние температуры на теплоемкость Cu5V2O10: кружки – эксперимент, линия – аппроксимирующая кривая.
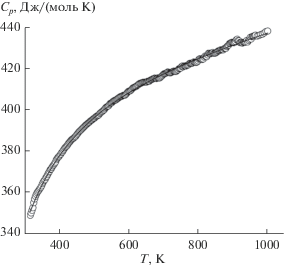
Коэффициент корреляции для уравнения (1) равен 0.9995, максимальное отклонение экспериментальных точек от сглаживающей кривой – 0.7%.
Наличие температурной зависимости теплоемкости для Cu5V2O10 позволяет по известным термодинамическим уравнениям рассчитать термодинамические функции: изменение энтальпии H°(T) – H°(320 K), энтропии S°(T) – S°(320 K) и приведенной энергии Гиббса. Полученные результаты приведены в табл. 1.
Таблица 1.
Сглаженные величины теплоемкости и рассчитанные по ним значения термодинамических свойств Cu5V2O10
| T, K | Cp, Дж/(моль K) | H°(T) – H°(320 K), кДж/моль | S°(T) – S°(320 K), Дж/(моль K) | Ф°(T) – Ф°(320 K), Дж/(моль K) |
|---|---|---|---|---|
| 320 350 400 450 500 550 600 650 700 750 800 850 900 950 1000 |
352.0 363.4 377.7 388.2 396.4 403.0 408.5 413.3 417.6 421.5 425.0 428.4 431.5 434.5 437.4 |
– 10.74 29.29 48.45 68.07 88.06 108.3 128.9 149.7 170.6 191.8 213.2 234.6 256.3 278.1 |
–
32.07
81.59 126.7 168.1 206.2 241.4 274.4 305.1 334.1 361.4 387.3 411.9 435.3 457.6 |
–
1.39
8.37
19.05
31.91
46.04
60.87
76.04
91.32 106.5 121.6 136.5 151.1 165.5 179.5 |
С использованием полученного нами значения характеристической температуры Дебая θD = = 630 K, которое для Cu5V2O10 определяли подобно [17] по соотношению
где $D\left( {{{{{\Theta }_{{\text{D}}}}} \mathord{\left/ {\vphantom {{{{\Theta }_{{\text{D}}}}} T}} \right. \kern-0em} T}} \right)$ – функция Дебая [18], были рассчитаны Cp. При этом принимали, что в первом приближении величины Cp и CV близки между собой. Установлено, что до 700 K рассчитанные и экспериментальные значения теплоемкости совпадают между собой. При T > 700 K наблюдается их расхождение: чем выше температура, тем больше это расхождение. Последнее можно было ожидать априори, так как экспериментальные значения Cp при T > 850 K превышают классический предел Дюлонга–Пти 3 Rs, где R – универсальная газовая постоянная, s – число атомов в формульной единице Cu5V2O10 (s = 17). Отметим, что при сравнении экспериментальных величин теплоемкости со значениями 3Rs необходимо использовать теплоемкость при постоянном объеме CV, а не при постоянном давлении Cp. Однако для определения CV на основании опытных величин Cp требуются дополнительные сведения о температурной зависимости постоянной Грюгайзена γG и температурном коэффициенте линейного расширения α [19] которые для Cu5V2O10 в литературе отсутствуют.Сравнить полученные нами значения θD для исследованного ванадата с данными других авторов не представлялось возможным из-за их отсутствия. Для близкого по составу соединения с той же пространственной группой (P21/c) Cu3V2O8 расчет по разным моделям дает θD = 598–612 K [20].
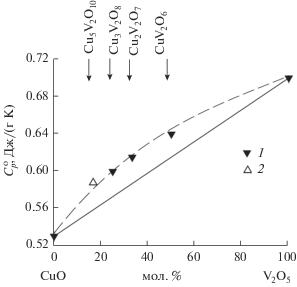
В [12] было показано, что имеется корреляция между составом оксидов системы CuO–V2O5 и их удельной теплоемкостью $c_{p}^{{\text{o}}}.$ На этом основании предсказано значение $c_{{p298}}^{{\text{o}}}\left( {{\text{C}}{{{\text{u}}}_{5}}{{{\text{V}}}_{2}}{{{\text{O}}}_{{10}}}} \right),$ равное 0.58 Дж/(г K). Полученное нами значение $c_{{p298}}^{{\text{o}}}\left( {{\text{C}}{{{\text{u}}}_{5}}{{{\text{V}}}_{2}}{{{\text{O}}}_{{10}}}} \right)$ равно 0.59 Дж/(г K) и не нарушает установленной корреляции $c_{p}^{{\text{o}}} = f\left( {{{C}_{{{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{5}}}}}} \right)$ для системы CuO–V2O5 (рис. 4).
Рис. 4.
Связь состава и удельных значений теплоемкости системы CuO−V2O5: 1 – данные [12], 2 – данные настоящей работы.
ЗАКЛЮЧЕНИЕ
Обжигом на воздухе стехиометрической смеси CuO и V2O5 при 833–973 K синтезированы стехиометрические образцы Cu5V2O10. Измерена молярная теплоемкость оксидного соединения и показано, что зависимость Cp = f(T) хорошо описывается уравнением Майера–Келли. На основании этих данных в интервале 320–1000 K рассчитаны термодинамические свойства (изменение энтальпии и энтропии, приведенная энергия Гиббса).
БЛАГОДАРНОСТЬ
Работа выполнена в рамках Государственного задания Министерства образования и науки Российской Федерации Сибирскому федеральному университету на 2017–2019 гг. (проект 4.8083.2017/БЧ “Формирование банка данных термодинамических характеристик сложнооксидных полифункциональных материалов, содержащих редкие и рассеянные элементы”).
Список литературы
Фотиев А.А., Слободин Б.В., Ходос М.Я. // Ванадаты. Состав, синтез, структура, свойства. М.: Наука, 1988.
Perrot P. // Refractory metal systems: phase diagrams, crystallographic and thermodynamic data. Berlin Heidelberg: Springer-Verlag, 2010. P. 240.
Slobodin B.V., Surat L.L., Samigullina R.F. // Russ. J. Inorg. Chem. 2009. V. 54. № 5. P. 797. https://doi.org/10.1134/ S0036023609050192 [Слободин Б.В., Сурат Л.Л., Самигуллина Р.Ф. // Журн. неорган. химии. 2009. Т. 54. № 5. С. 857.]
He Z., Lin C., Chen W. et al. // J. Am. Chem. Soc. 2011. V. 133. № 5. P. 1298. https://doi.org/10.1021/ja110394j
Hillel T., Ein-Eli Y. // J. Power Sources. 2013. V. 229. P. 112. https://doi.org/10.1016/j.jpowsour.2012.11.128
Guo W., Chemelewski W.D., Mabayoje O. et al. // J. Phys. Chem. C. 2015. V. 119. № 49. P. 27220. doi https://doi.org/10.1021/acs.jpcc.5b07219
Kawada T., Hinokuma S., Machida M. // Catal. Today. 2015. V. 242. P. 268. https://doi.org/10.1016/j.cattod.2014.05.023
Hughes J.M., Hadidiacos C.G. //Am. Mineralog. 1985. V. 70. P. 193.
Dabrowska G., Filipek E. // J. Thermal. Anal. Calorim. 2008. V. 93. № 3. P. 839. https://doi.org/10.1007/s10973-008-9301-y
Prokofiev A.V., Kremer R.K. // J. Cryst. Growth. 2001. V. 231. № 4. P. 498.
Bhatia S.N., Mohapatra M., Nirmala R. et al. // Pramana. J. Phys. 2010. V. 74. № 5. P. 833. https://doi.org/10.1007/ s12043-010-0103-y
Denisova L.T., Belousova N.V., Denisov V.M., Galiakhmetova N.A. // Phys. Solid State. 2017.Т. 59. № 6. P. 1270. https://doi.org/10.1134/S1063783417060075 [Денисова Л.Т., Белоусова Н.В., Денисов В.М., Галиахметова Н.А. // Физика тв. тела. 2017. Т. 59. № 6. С. 1243.]
Solovyov L.A. // J. Appl. Crystallogr. 2004. V. 37. P. 743. https://doi.org/10.1107/S0021889804015638
Shannon R.D., Calvo C. // Acta Crystallogr. 1973. V. B29. P. 1338.
Denisov V.M., Denisova L.T., Irtyugo L.A., Biront V.S. // Phys. Solid State. 2010. Т. 52. № 7. P. 1362. https://doi.org/10.1134/ S1063783410070073 [Денисов В.М., Денисова Л.Т., Иртюго Л.А., Биронт В.С. // Физика тв. тела. 2010. Т. 52. № 7. С. 1274.]
Denisova L.T., Irtyugo L.A., Kargin Y.F. et al. // Inorg. Mater. 2017. V. 53. № 1. P. 93. https://doi.org/10.1134/ S0020168517010046 [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Неорган. материалы. 2017. Т. 53. № 1. С. 71.]
Pet'kov V.I., Markin A.V., Smirnova N.N. // Russ. J. Phys. Chem. A. 2013. Т. 87. № 8. Р. 1266. doi 10.1134/S0036024413070261 [Петьков В.И., Маркин А.В., Смирнова Н.Н. // Журн. физ. химии. 2013. Т. 87. № 8. С. 1279.]
Скуратов С.М., Колесов В.П., Воробьев А.Ф. Термохимия. М.: Изд-во МГУ, 1966. Ч. II.
Prekul A.F., Kazantsev V.A., Shchegolikhina N.I. et al. // Phys. Solid State. 2008. V. 50. № 11. Р. 2013. https://doi.org/10.1134/ S1063783408110024 [Прекул А.Ф., Казанцев В.А., Щеголихина Н.М. и др. // Физика тв. тела. 2008. Т. 50. № 11. С. 1933.]
Jezierski A., Kaczkowski J. // Phase Transitions. 2015. V. 88. № 10. P. 1. https://doi.org/10.1080/01411594.2015.1007056
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


