Журнал неорганической химии, 2019, T. 64, № 9, стр. 938-944
Комплексообразование гексафторосиликатов Co(II), Ni(II), Cu(II) и Zn(II) с никотинамидом в водном растворе
Т. Г. Черкасова 1, *, Н. В. Первухина 2, 3, Н. В. Куратьева 2, 3, В. А. Санникова 1, Э. С. Татаринова 1, Е. В. Черкасова 1
1 Кузбасский государственный технический университет им. Т.Ф. Горбачева
650000 Кемерово, ул. Весенняя, 28, Россия
2 Институт неорганической химии им. А.В. Николаева СО РАН
630092 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
3 Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: ctg.htnv@kuzstu.ru
Поступила в редакцию 05.02.2019
После доработки 12.03.2019
Принята к публикации 15.04.2019
Аннотация
Получены из водных растворов и изучены методами химического, ИК-спектроскопического и рентгеноструктурного анализов новые комплексные соединения [M(NA)2(H2O)4]SiF6 ⋅ 2H2O, где M2+ = Co, Ni, Zn (комплексы I, II, III соответственно), NA = C6H6N2O – никотинамид; [Cu(NA)2(SiF6)(H2O)2] ⋅ 2H2O (IV) и (HNA)2SiF6 (V). Параметры элементарных ячеек: a = 16.2448(18), b = 6.8834(8), c = 10.0767(11) Å, β = 102.765(3)°, V = 1098.92 Å3, пр. гр. C2 для I; a = 16.1591(7), b = 6.8777(3), c = 10.0314(5) Å, β = 102.410(1)°, V = 1088.82 Å3, пр. гр. C2 для II; a = 16.2265(6), b = 6.8965(3), c = 10.0696(5) Å, β = 102.390(1)°, V = 1100.60 Å3, пр. гр. C2 для III; a = 6.5915(4), b = 7.7670(4), c = 10.1506(5) Å, α = 110.7390(10)°, β = 105.824(2)°, γ = 95.448(2)°, V = = 456.868 Å3, пр. гр. P1 для IV; a = 14.1904(7), b = 9.0468(4), c = 11.8160(7) Å, β = 106.277(2)°, V = = 1456.1 Å3, пр. гр. C2/c для V. Комплексы I–III изоструктурны, представляют собой соединения ионного типа, образованные гексафторосиликат-анионами и комплексными катионами. Координационный полиэдр металла – малоискаженный октаэдр, построенный из атомов О четырех координированных молекул воды и двух атомов N двух пиридиновых колец двух молекул никотинамида, находящихся в транс-положении полиэдра. Соединение IV имеет полимерное цепочечное строение. Координационный полиэдр катиона меди представляет собой вытянутый по оси октаэдр, образованный двумя атомами N двух пиридиновых колец двух молекул никотинамида, двумя атомами O координированных молекул воды и двумя атомами F гексафторосиликат-анионов, выступающих в роли мостиков между соседними катионами. В структуре соединения V протонирован атом азота пиридинового кольца HNA+. Геометрия гексафторосиликат-анионов идентична во всех пяти соединениях. В структурах присутствуют разветвленные сети водородных связей.
ВВЕДЕНИЕ
Гетероциклические азотсодержащие соединения, являющиеся компонентами некоторых витаминов и лекарственных средств, важны для жизнедеятельности живых систем [1, 2]. В частности, никотинамид (NA) участвует в метаболических процессах человеческого организма [3–6], является компонентом ряда ферментов, например кофермента никотинамидадениндинуклеотида, и часто используется в синтезе комплексов металлов для создания лекарственных препаратов [7]. Комплексы на основе NA являются перспективными соединениями с большой биологической активностью [8]. Никотинамид проявляет противовоспалительные свойства, его используют в качестве гидротропного агента в фармацевтической химии [9]. Так, с его помощью увеличивают растворимость нифедипина, индометацина. В работах [10–16] сообщается об антибактериальной и противогрибковой активности некоторых комплексов переходных металлов на основе никотинамида. Координационные соединения металлов-биоэлементов с NA представляют интерес не только как потенциальные биоактивные вещества, но и как комплексы с амбидентатными лигандами. Молекула NA имеет три потенциальных донорных атома: азот пиридинового кольца, азот аминогруппы и кислород карбонильной группы. Предпочтительно никотинамид координируется через атом азота пиридинового кольца [9]. В работах [17–21] описаны структуры координационных полимеров, в работе [22] – структура комплекса, в котором NA выступает в роли мостикового лиганда, координируясь через азот пиридинового кольца и кислород амидной группы.
Цель работы – синтез, ИК-спектроскопическое исследование и изучение структурных характеристик комплексных соединений [M(NA)2(H2O)4]SiF6 ⋅ 2H2O, где M2+ = Co, Ni, Zn (комплексы I, II, III соответственно), NA = = C6H6N2O – никотинамид, [Cu(NA)2(SiF6)(H2O)2] ⋅ ⋅ 2H2O (IV) и (HNA)2SiF6 (V).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений. В качестве исходных веществ использовали CoCO3, NiO, 2CuCO3 · ⋅ Cu(OH)2, ZnCO3 марки “х. ч.”, раствор H2[SiF6] с ω = 45% (ч. д. а.) и NA квалификации “х. ч.”.
Гексафторосиликаты металлов МSiF6 · 6H2O (M2+ = Co, Ni, Cu, Zn) получены взаимодействием исходных веществ с H2[SiF6] и последующей кристаллизацией при комнатной температуре [23].
Синтез соединений I–IV проводили смешением раздельно водных растворов CoSiF6 · 6H2O (0.309 г, 0.001 моль), NiSiF6 · 6H2O (0.309 г, 0.001 моль), ZnSiF6 · 6H2O (0.316 г, 0.001 моль), CuSiF6 · 6H2O (0.314 г, 0.001 моль) и NA (0.244 г, 0.002 моль). Полученные растворы оставляли для медленной кристаллизации при комнатной температуре. Образовавшиеся через несколько дней кристаллы отделяли от маточного раствора фильтрованием и сушили в эксикаторе над CaCl2. Выход 70 (I), 75 (II), 67 (III), 90% (IV).
При разработке условий синтеза установлено, что добавление NA (0.244 г, 0.002 моль) в раствор гексафторокремниевой кислоты с ω = 9% при перемешивании приводит через несколько дней к образованию бесцветных кристаллов (HNA)2SiF6 (V), которые отделяли от маточного раствора фильтрованием и сушили в эксикаторе над CaCl2. Выход 56%.
Химический анализ выполняли гравиметрическим методом: на содержание ${\text{SiF}}_{{\text{6}}}^{{{\text{2}}--}}$ – в виде BaSiF6 [24], кобальта и никеля – в виде сульфатов, цинка – в виде 8-оксихинолината [25]. Содержание меди в соединении IV определяли фотоколориметрическим методом [26]. Элементный C,H,N-анализ выполнен на приборе ThermoFlash 2000.
ИК-спектры соединений I–V снимали на ИК-Фурье-спектрометре Cary 630 FTIR фирмы Agilent в интервале 4000–400 см–1 в матрице KBr. Основные частоты полос поглощения соединений (ν, см–1): I – 3621 (сл.), 3409 (ср.), 3258 (ср.), 1667 (ср.), 1623 (ср.), 1567 (ср.), 1439 (ср.), 1215 (сл.), 1065 (сл.) 744 (с.), 707 (с.); II – 3621 (сл.), 3409 (ср.), 3264 (ср.), 1673 (ср.), 1623 (ср.), 1567 (ср.), 1439 (ср.), 1221 (сл.), 1070 (сл.), 743 (с.), 707 (с.); III – 3621 (сл.), 3403 (ср.), 3319 (ср.), 1673 (ср.), 1623 (ср.), 1567 (ср.), 1439 (ср.), 1221 (сл.), 1065 (сл.) 746 (с.), 707 (с.); IV – (ν, см–1): 3532 (сл.), 3493 (сл.), 3370 (ср.), 1684 (ср.), 1634 (ср.), 1606 (ср.), 1450 (сл.), 1411 (ср.), 1210 (сл.), 1070 (сл.), 753 (с.), 685 (с.); V – 3392 (ср.), 1679 (ср.), 1623 (ср.), 1561 (ср.), 1427 (ср.), 1204 (ср.), 696 (с.).
РСА. Рентгеноструктурный эксперимент для соединений I–V выполнен на дифрактометре Bruker APEX DUO с 4K CCD-детектором с использованием φ- и ω-сканирования при 150(2) K. Поправки на поглощение введены с помощью программы SADABS [27], которая использует многократные измерения одних и тех же отражений при разных ориентациях кристалла. Структуры расшифрованы прямым методом и уточнены полноматричным МНК по F 2 в анизотропном приближении для неводородных атомов с использованием комплекса программ SHELXTL [28]. Атомы водорода органических лигандов локализованы из карт разностной электронной плотности и уточнены в приближении жесткого тела, атомы водорода молекул воды уточнены свободно в изотропном приближении с ограничением длины связи О–Н 0.96 Å. В структурах I–III анион ${\text{SiF}}_{{\text{6}}}^{{{\text{2}}--}}$ разупорядочен по двум симметрийно связанным позициям с равной заселенностью положений.
Кристаллографические данные и детали дифракционного эксперимента приведены в табл. 1. Структурные данные для I–V депонированы в КБСД (ССDС 1983435-1983439) и могут быть свободно получены по запросу на сайте www.ccdc. cam.ac.uk/data_reguest/cif.
Таблица 1.
Кристаллографические данные и условия дифракционного эксперимента для соединений I–V
| Параметр | C12H24CoF6N4O8Si (I) | C12H24F6N4NiO8Si (II) | C12H24F6N4O8SiZn (III) | C12H20CuF6N4O6Si (IV) | C12H14F6N4O2Si (V) |
|---|---|---|---|---|---|
| М | 553.37 | 553.15 | 559.81 | 521.95 | 388.36 |
| Сингония, пр. гр. | Моноклинная, C2 | Триклинная, Р$\overline 1 $ | Моноклинная, C2/c | ||
| a, Å | 16.245(2) | 16.1591(7) | 16.2265(6) | 6.5915(4) | 14.1904(7) |
| b, Å | 6.8834(8) | 6.8777(3) | 6.8965(3) | 7.7670(4) | 9.0468(4) |
| c, Å | 10.077(1) | 10.0314(5) | 10.0696(5) | 10.1506(5) | 11.8160(7) |
| α, град | 110.739(1) | ||||
| β, град | 102.765(3) | 102.410(1) | 102.390(1) | 105.824(2) | 106.277(2) |
| γ, град | 95.448(2) | ||||
| V, Å3/Z | 1098.9(2)/2 | 1088.81(9)/2 | 1100.60(8)/2 | 456.87(4)/1 | 1456.1(1)/4 |
| ρвыч, г/см3 | 1.672 | 1.687 | 1.689 | 1.897 | 1.772 |
| μ, мм–1 | 0.932 | 1.043 | 1.267 | 1.362 | 0.250 |
| Размер кристалла, мм | 0.30 × 0.21 × 0.10 | 0.38 × 0.12 × 0.06 | 0.24 × 0.20 × 0.06 | 0.28 × 0.26 × 0.16 | 0.20 × 0.16 × 0.10 |
| Диапазон сбора данных по σ, град | 2.07–27.15 | 2.08–27.54 | 2.07–27.52 | 2.27–27.53 | 2.70–27.56 |
| Диапазон h, k, l | –20 ≤ h ≤ 19 –8 ≤ k ≤ 8 –10 ≤ l ≤ 12 |
–20 ≤ h ≤ 20 –8 ≤ k ≤ 8 –12 ≤ l ≤ 13 |
–13 ≤ h ≤ 20 –8 ≤ k ≤ 8 –13 ≤ l ≤ 13 |
–8 ≤ h ≤ 8 –10 ≤ k ≤ 9 –11 ≤ l ≤ 13 |
–17 ≤ h ≤ 18 –11 ≤ k ≤ 11 –15 ≤ l ≤ 15 |
| Ihkl измеренных | 4125 | 4446 | 4072 | 4045 | 6580 |
| Ihkl > 2σI | 2316 (Rint = 0.0281) | 2380 (Rint = 0.0202) | 2391 (Rint = 0.0179) | 2104 (Rint = 0.0215) | 1681 (Rint = 0.0244) |
| Число рефлексов/огр./параметров | 2316/34/156 | 2380/8/192 | 2391/8/192 | 2104/4/156 | 1681/0/114 |
| R (I > 2σI) | R1 = 0.0731 wR2 = 0.1999 |
R1 = 0.0211 wR2 = 0.0549 |
R1 = 0.0207 wR2 = 0.0526 |
R1 = 0.0206 wR2 = 0.0554 |
R1 = 0.0267 wR2 = 0.0768 |
| R (Ihkl изм.) | R1 = 0.0782 wR2 = 0.2024 |
R1 = 0.0222 wR2 = 0.0558 |
R1 = 0.0215 wR2 = 0.0530 |
R1 = 0.0209 wR2 = 0.0555 |
R1 = 0.0291 wR2 = 0.0783 |
| Параметр абс. структуры | 0.54(7) | 0.47(3) | 0.47(2) | ||
| Макс. и мин. остаточная эл. плотность, e/Å3 | 1.323 и –1.358 | 0.388 и –0.238 | 0.370 и –0.297 | 0.409 и –0.360 | 0.369 и –0.268 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные вещества представляют собой устойчивые на воздухе мелкокристаллические порошки. Кристаллы III, V бесцветные, соединение I имеет розовую окраску, вещество II – голубую, комплекс IV синего цвета. Вещества разлагаются в концентрированных растворах серной и азотной кислот, в ДМСО, ДМФА, этилендиамине, не растворяются в ацетоне, этаноле, диэтиловом эфире, толуоле, н-углеводородах, спиртах (этиловом, бутиловом, изопропиловом, изобутиловом), ацетоне. Растворимость в воде при 25.0 ± ± 0.5°С составляет для соединений: I – 0.08, II – 0.03, III – 0.15, IV – 0.02, V – 0.22 моль/л.
Поскольку, согласно концепции “жестких–мягких кислот и оснований”, ионы Co2+ относятся к “мягким” кислотам Льюиса, ионы Ni2+ и Cu2+ являются кислотами, занимающими промежуточное положение, а ион Si4+ является “жестким” акцептором электронных пар, возможно образование как ионных, так и полимерных соединений [29, 30]. Отнесение полос поглощения в ИК-спектрах веществ выполнено в соответствии с [31–35]. Молекулы воды в составе комплексов I–IV характеризуются наличием полос валентных колебаний ν(OH) в интервале 3621–3403 см–1. Полосы валентных колебаний первичных амидов ν(NH) регистрируются для NA при 3359 и 3152 см–1, для соединений: при 3258 (I), 3264 (II), 3319 (III), 3370 и 3180 (IV), 3392 и 3219 см–1 (V), т.е. наблюдается некоторое смещение полос поглощения в низкочастотную область для соединений I–III и в высокочастотную – для веществ IV и V. Значения δ(NH2) в комплексах смещаются в высокочастотную область до 1623 см–1 в соединениях I–III, до 1634 см–1 в комплексе IV по сравнению с δ(NH2) = 1617 см–1 в NA. Частота ν(CO)NA = = 1679 см–1 незначительно смещается в низкочастотную область до 1667, 1673, 1673 см–1 в соединениях I–III соответственно, в то время как в комплексе IV (1684 см–1) наблюдается ее повышение, что может свидетельствовать об отсутствии связи атома кислорода амидной группы с атомом меди. Приведенные данные свидетельствуют, скорее, о неучастии амидной группировки в координации и отличии строения комплекса IV от других соединений. В большинстве комплексных соединений с никотинамидом координация иона металла осуществляется через атом азота пиридинового кольца [9, 17–21], но известны комплексы, в которых координация осуществляется через амидную группу [22]. Вероятно, NA координирован с ионами-комплексообразователями через гетероатом азота пиридинового кольца, что подтверждается смещением в ИК-спектрах комплексов в высокочастотную область νкольца в интервале 1600–1030 см–1 по сравнению со спектром “свободного” NA.
Полоса валентных колебаний октаэдрического аниона ${\text{SiF}}_{{\text{6}}}^{{{\text{2}}--}}$ при 741 см–1 практически не смещается в соединениях I–III (744, 743, 744 см–1), но претерпевает изменение в комплексе IV (756 см–1), что свидетельствует о смене структурной роли гексафторосиликат-иона в этом соединении.
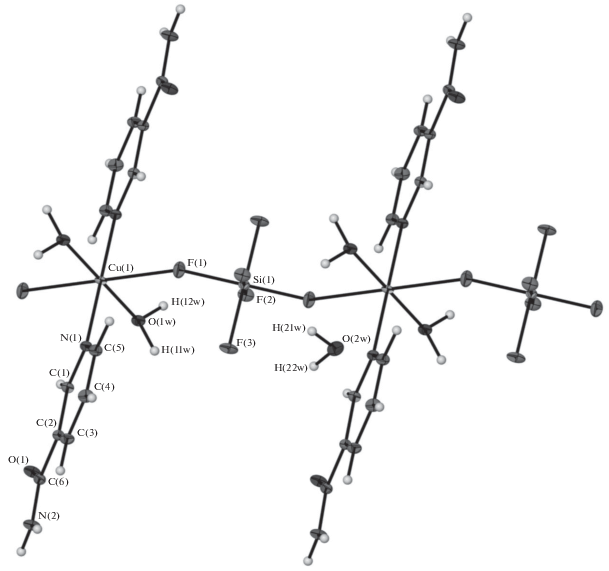
Монокристаллы веществ выделены при длительной изотермической кристаллизации из водных растворов соединений. Кристаллы комплексов I–III изоструктурны. Анализ массива отражений показал наличие нецентросимметричной группы у этой серии кристаллов. Возможными оказались варианты пр. гр. C2 и Сm. В результате структуры решены в моноклинной группе C2, так как показали лучшие параметры уточнения. Соединения имеют островное строение (рис. 1). В независимой части находится половина комплексного катиона, половина гексафторосиликат-аниона и одна молекула кристаллизационной воды. Координационный полиэдр катиона металла – малоискаженный октаэдр (валентные углы отличаются от идеальных на 3°), состоящий из атомов О четырех координационных молекул воды и двух атомов N пиридиновых колец никотинамида, находящихся в транс-положении полиэдра. Гексафторосиликат-анион выступает противоионом, не входя во внутреннюю координационную сферу металла. Катион металла и атом Si занимают позиции на разных осях 2. В структуре присутствует разветвленная сеть водородных связей между аминогруппой NA и координированными молекулами воды в качестве донора Н и кристаллизационными молекулами воды, гексафторосиликат-анионами и атомом О карбонильной группы NA в качестве акцептора водородной связи (d(D…A) 2.71–2.99 Å).
Рис. 1.
Фрагмент структуры I–III. Пунктиром обозначена разупорядоченная часть гексафторосиликат-аниона.
В упаковке вдоль оси с чередуются катионные и анионные слои (рис. 2). Внутри катионных слоев происходит параллельное упорядочение π-систем NA лигандов по принципу “голова–хвост” с расстоянием ∼3.5 Å между плоскостями лигандов соседних комплексных частиц (угол разворота плоскостей лигандов соседних катионов не превышает 2°). Центры катионов располагаются по искаженному, согласно форме частицы, гексагональному закону в плоскости ab. Слои располагаются друг над другом практически без смещения. Анионные слои также образуют однослойную гексагональную укладку четко над и под центрами катионов.
Соединение IV кристаллизуется в триклинной сингонии и имеет полимерное цепочечное строение. Координационный полиэдр катиона меди (рис. 2) представляет собой вытянутый по оси октаэдр, образованный двумя атомами N двух пиридиновых колец никотинамида, двумя атомами O координированных молекул воды и двумя атомами F гексафторосиликат-анионов, выступающих в роли мостиков между соседними катионами. Атомы Cu и Si занимают две системы центров инверсии пространственной группы. Полимерные цепочки располагаются в ячейке параллельно оси b и образуют гексагональную упаковку стержней в этом же направлении. В структуре также присутствует разветвленная сеть водородных связей между аминогруппой NA и координированными молекулами воды в качестве донора Н и кристаллизационными молекулами воды, гексафторосиликат-анионами и атомом О карбонильной группы NA в качестве акцептора водородной связи (d(D…A) 2.77–2.92 Å).
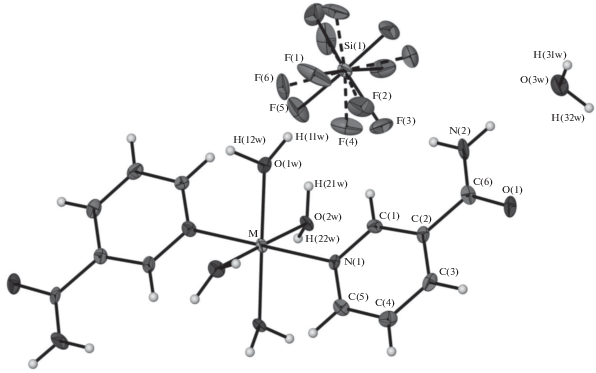
Гексафторосиликат никотинамидия V кристаллизуется в моноклинной сингонии. В структуре соединения четко видно, что атом азота пиридинового кольца HNA+ протонирован. Вероятно, за счет этого нарушается общая сопряженность π-системы лиганда, так что угол разворота пиридинового кольца относительно амидной группы становится равным 38.1° (сравн. с 2.8° (I), 0.5°(II), 0.8° (III), 2.7°(IV)). В структуре образуется двухслойная гексагональная укладка совместных катионно-анионных слоев вдоль оси b. При этом плоскость пиридинового кольца HNA+ развернута почти перпендикулярно (70.0°) плоскости гексагонального слоя. Атомы Si гексафторсиликат-анионов занимают одну из двух систем осей 2, тогда как весь катион располагается в общем положении. В структуре присутствуют водородные связи: сильная “кислая” водородная связь между протонированным пиридиновым кольцом HNA+ и выступающей акцептором водородной связи карбонильной группой соседнего катиона (d(D…A) 2.66 Å) и две водородные связи средней силы с участием аминогруппы типа N–H…F (d(D…A) 2.85 и 2.92 Å).
Геометрия гексафторосиликат-анионов во всех пяти соединениях идентична.
ЗАКЛЮЧЕНИЕ
Проведенные исследования комплексов I–III показали, что для них характерны островные структуры, состоящие из изолированных катионов [M(NA)2(H2O)4]2+, анионов ${\text{SiF}}_{{\text{6}}}^{{{\text{2}}--}}$ и кристаллизационных молекул воды, как это ранее наблюдалось в гексафторосиликатах комплексов кобальта(II) с DMSO и DMFA [36]. В то же время структура соединения IV [37] существенно отличается. Вещество IV имеет полимерное цепочечное строение, в котором гексафторосиликат-анионы выступают в роли мостиков между соседними катионами, координационный полиэдр катиона меди – вытянутый по оси октаэдр. Структура гексафторосиликата комплекса меди(II) с DMSO островная, построенная из нейтральных молекул, в которых гексафторосиликат-анион координирован одним атомом фтора к катиону меди(II), координационное окружение катиона меди(II) квадратно-пирамидальное. Таким образом, различие в структурах определяется способом координации анионов ${\text{SiF}}_{{\text{6}}}^{{{\text{2}}--}}$.
Кроме того, получен и структурно охарактеризован гексафторосиликат никотинамидия (HNA)2SiF6 (V), в котором атом азота пиридинового кольца HNA+ протонирован.
Список литературы
Kose D.A., Necefogly H. // Therm. Anal. Calorim. 2008. V. 93. № 2. P. 509.
Кокшарова Т.В., Гриценко И.С., Курандо С.В. и др. // Вiсник ОНУ. 2009. Т. 14. № 12. С. 91.
Sayın E., Kurkcuoglu G.S., Yesilel O.Z. et al. // J. Mol. Struct. 2015. V. 1096. P. 84. https://doi.org/10.1016/j.molstruc.2015.04.046
Puchonova M., Repicka Z., Moncol J. et al. // J. Mol. Struct. 2015. V. 1092. P. 1. https://doi.org/10.1016/j.molstruc.2015.02.086
Dilip C.S., Thangaraj V., Paul Raj A.P. // Arab. J. Chem. 2016. V. 9. P. 731. https://doi.org/10.1016/j.arabjc.2011.07.016
Tella A.C., Owalude S.O., Ajibade P.A. et al. // J. Mol. Struct. 2016. V. 1125. P. 570. https://doi.org/10.1016/j.molstruc.2016.07.016
Vaskova Z., Kitanovski N., Jaglicic Z. et al. // Polyhedron. 2014. V. 81. P. 555. https://doi.org/10.1016/j.poly.2014.07.017
Al-Saif F.A., Refat M.S. // J. Mol. Struct. 2012. V. 1021. P. 40. https://doi.org/10.1016/j.molstruc.2012.04.057
Dziewulska-Kulaczkoska A., Mazur L., Ferenc W. // J. Therm. Anal. Calorim. 2009. V. 96. № 1. P. 255.
Smith N.A., Zhang P., Salassa L. et al. // Inorg. Chim. Acta. 2017. V. 454. P. 240. https://doi.org/10.1016/j.ica.2016.06.014
Ozbek F.E., Sertcelik M., Yuksek M. et al. // J. Mol. Struct. 2017. V. 1150. P. 112. https://doi.org/10.1016/j.molstruc.2017.08.074
Askin G.S., Necefoglu H., Tonbul A.M. et al. // Acta Crystallogr., Sect. E. 2015. V. 71. P. 479. https://doi.org/10.1107/S2056989015006490
Bozkurt N., Dilek N., Delibas N.C. et al. // Acta Crystallogr., Sect. E. 2013. V. 69. P. 389. https://doi.org/10.1107/S1600536813015948
Sharnin V.A., Dushina S.V., Grazhdan K.V. et al. // J. Chem. Therm. 2015. V. 82. P. 116. https://doi.org/10.1016/j.jct.2014.11.004
Altun O., Suozer M. // J. Mol. Struct. 2017. V. 1149. P. 307. https://doi.org/10.1016/j.molstruc.2017.07.069
Tella A.C., Owalude S.O., Ajibade P.A. et al. // J. Mol. Struct. 2016. V. 1125. P. 570. https://doi.org/10.1016/j.molstruc.2016.07.016
Baig R.B.N., Vaddula B.R., Nadagouda M.N. et al. // J. Royal Soc. Chem. 2015. V. 17. P. 1243.
Li C., Cui F., Zhang H. et al. // Spectrochim. Acta. Part A: Mol. and Biomol. Spectr. 2015. V. 134. P. 367. https://doi.org/10.1016/j.saa.2014.06.080
Chisca D., Croitor L., Petunov O. et al. // CrystEngComm. 2018. V. 20. P. 432. https://doi.org/10.1039/c7ce01988b
Arici M., Yesilel O.Z., Acar E. et al. // Polyhedron. 2017. V. 127. P. 293. https://doi.org/10.1016/j.poly.2017.02.013
Gor K., Kurkcuogly G.S., Yesilel O.Z. et al. // J. Mol. Struct. 2014. V. 1060. P. 166. https://doi.org/10.1016/j.molstruc.2013.12.024
Xue J., Hua X., Li W. et al. // J. Mol. Struct. 2014. V. 1059. P. 108. https://doi.org/10.1016/j.molstruc.2013.11.001
Yildirum T., Kose D.A., Avci E. et al. // J. Mol. Struct. 2019. V. 1176. P. 576. https://doi.org/10.1016/j.molstruc.2015.02.086
Рысс И.Г. Химия фтора и его неорганических соединений. М.: Госхимиздат, 1956. 718 с.
Мышляева Л.В., Краснощеков В.В. Аналитическая химия кремния. М.: Наука, 1972. 212 с.
Шарло Г. Методы аналитической химии. М.: Химия, 1965. 976 с.
Sheldrick G.M. SADABS. Version 2.01. Brucer AXS Inc. Madison, Wisconsin, USA, 2004.
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71. P. 3.
Pearson R.G. // J. Chem. Educ. 1985. V. 45. P. 581.
Гарновский А.Д., Садименко А.П., Осипов О.А. и др. Жестко-мягкие взаимодействия в координационной химии. Ростов-на-Дону: Изд-во Ростовск. ун-та, 1986. 272 с.
Накамото К. ИК-спектры и спектры КР неорганических и коорд. соединений. М.: Мир, 1991. 536 с.
Садиков Г.Г., Анцышкина А.С., Кокшарова Т.В. и др. // Кристаллография. 2007. Т. 52. № 5. С. 847. [Sadikov G.G., Antsyskina A.S., Koksharova et al. // Cryst. Reports. 2007. V. 52. № 5. P. 819. https://doi.org/10.1134/S1063774507050112]
Jain S.C., Rivest R. // Can. J. Chem. 1969. V. 47. P. 2209.
Смит A. Прикладная ИК-спектроскопия. М.: Мир, 1982. 328 с.
Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. Таблицы спектральных данных. М.: Мир; БИНОМ. Лаборатория знаний, 2006. 438 с.
Черкасова Т.Г., Багрянская И.Ю., Первухина Н.В. и др. // Журн. неорган. химии. 2017. Т. 62. № 6. С. 776. [Cherkasova T.G., Bagryanskaya I.Yu., Pervukhina N.V. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 6. P. 760.]https://doi.org/10.7868/S0044457X17060022
Черкасова Т.Г., Первухина Н.В., Куратьева Н.В. и др. // Журн. неорган. химии. 2018. Т. 63. № 7. С. 858. [Cherkasova T.G., Pervukhina N.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 7. P. 899. https://doi.org/10.1134/S0036023618070045]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии