Журнал неорганической химии, 2019, T. 64, № 9, стр. 945-950
Особенности строения мономерных октаэдрических монооксокомплексов d2-рения(V) [ReO(Lмоно)$\left( {{\mathbf{L}}_{{{\mathbf{тетра}}}}^{n}} \right)$] с атомами кислорода тетрадентатно-хелатных лигандов ОХ3, Х = О, N, P $\left( {{\mathbf{L}}_{{{\mathbf{тетра}}}}^{n}} \right)$
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Всероссийский институт научной и технической информации РАН
125190 Москва, ул. Усиевича, 20, Россия
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 29.01.2019
После доработки 01.02.2019
Принята к публикации 15.04.2019
Аннотация
Рассмотрены особенности строения шести моноядерных октаэдрических монооксокомплексов d2-Re(V) [ReO(Lмоно)$\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)$] с тетрадентатно-хелатными (OХ3; Х = О, N, P) $\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)$ и монодентатными (Lмоно) лигандами. В транс-позициях к кратносвязанным лигандам О(оксо) всегда располагаются атомы О$\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right).$
ВВЕДЕНИЕ
Особенности строения мономерных октаэдрических комплексов (МОК) d0-, d2-металлов V–VII групп (Nb, V, Mo, W, Re, Tc) с кратносвязанными лигандами О(оксо) подробно рассмотрены в работах [1–7]. Для d2-Re(V) методом РСА определена кристаллическая структура более пятисот соединений (см. Кембриджский банк структурных данных (КБСД), вeрсия 5.39, август 2018 г.) [8]. Большинство из этих комплексов – МОК ReOоксоО(Lтранс) – с атомами кислорода моно- и полидентатных лигандов в транс-позициях к оксолигандам. Ранее мы опубликовали ряд обзорных статей по МОК d2-Re(V) c полидентатными лигандами – бидентатно-хелатными (О, О) [9], (O, S) и (O, C) [10], (О, Р) [11], (O, N) [12, 13] и тридентатно-хелатными (O, N, O) [14], (O, S, O) и (S, O, S) [15], (O, P, O) и (O, P, N) [16], (O, N, S) [17]. Мы опубликовали также обзорные статьи по особенностям строения МОК с оксолигандами d0-Re(VII) [18] и d0-, d2-Tc(V, VII) [19].
Структурное проявление трансвлияния кратносвязанного лиганда O(оксо) – удлинение противолежащей связи Re–Lтранс – характеризуется параметром ∆ (разность длин одноименных связей {[Re–Lтранс] – [Re–Lцис]}). В том случае, когда в структуре нет лигандов одного сорта и в транс-, и в цис-позициях к О(оксо), мы применяем параметр {[Re–Lтранс] – [Re–L(СТ)]}, где СТ – среднестатистическая стандартная длина связи Re(V) с атомом лиганда того же сорта, что и Lтранс. За величину параметра Re–O(СТ) мы приняли, как и в [4], 2.04 Å.
В настоящей статье обсуждаются особенности строения мономерных октаэдрических монооксокомплексов [ReO(Lмоно)$\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)$], содержащих тетрадентатные трис(хелатные) лиганды ${\text{L}}_{{{\text{тетра}}}}^{n},$ а также монодентатные (Lмоно) лиганды. Транс-позиции к кратносвязанным оксолигандам всегда занимают атомы кислорода О$\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right).$
Основные длины связей в структурно исследованных комплексах приведены в табл. 1.
Таблица 1.
Основные геометрические параметры (в Å) в мономерных октаэдрических монооксокомплексах [ReO(Lмоно)$\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)$] с тетрадентатно-хелатными лигандами ОХ3 (Х = О, N, P)
| № комп-лекса | Комплекс | Re=O | Re–Lцис | Re–О${{\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)}_{{транс}}}$ | (∆'), Δ | Литера- тура |
|---|---|---|---|---|---|---|
| I | [ReOСl$\left( {{\text{L}}_{{{\text{тетра}}}}^{1}} \right)$]PF6 | 1.692(8) ± 0.007 | 2.126(9) ± 0.017 N$\left( {{\text{L}}_{{{\text{тетра}}}}^{1}} \right)$ 2.365(2) ± 0.010 Cl |
1.910(7) ± 0.006 | (–0.125) | [20] |
| II | [ReOBr$\left( {{\text{L}}_{{{\text{тетра}}}}^{2}} \right)$]Br · H2O | 1.704(3) | 2.121(3) ± 0.044 N$\left( {{\text{L}}_{{{\text{тетра}}}}^{2}} \right)$ 2.4914(6) Br |
1.912(3) | (–0.128) | [21] |
| III | [ReO(Cl$\left( {{\text{L}}_{{{\text{тетра}}}}^{3}} \right)$] · H2O | 1.700(8) | 1.934(9) N$\left( {{\text{L}}_{{{\text{тетра}}}}^{3}} \right)$ 2.054(9) N$\left( {{\text{L}}_{{{\text{тетра}}}}^{3}} \right)$ 2.214(9) N$\left( {{\text{L}}_{{{\text{тетра}}}}^{3}} \right)$ 2.455(3) Cl |
2.133(7) | (0.093) | [24] |
| IV | [ReOСl$\left( {{\text{L}}_{{{\text{тетра}}}}^{4}} \right)$] · Н2О | 1.675(7) | 1.937(8) O$\left( {{\text{L}}_{{{\text{тетра}}}}^{4}} \right)$ 1.967(8) N$\left( {{\text{L}}_{{{\text{тетра}}}}^{4}} \right)$ 2.394(2) Р$\left( {{\text{L}}_{{{\text{тетра}}}}^{4}} \right)$ 2.435(2) Cl |
2.414(7) | (0.374) 0.477 |
[25] |
| V | [ReO(PPh3)$\left( {{\text{L}}_{{{\text{тетра}}}}^{5}} \right)$][Na(NCMe)2] · ⋅ 4MeCN | 1.698(2) | 2.059(2) ± 0.011 O$\left( {{\text{L}}_{{{\text{тетра}}}}^{5}} \right)$ 2.4390(9) P(Ph3) |
1.938(2) | (–0.102) –0.121 |
[26] |
| VI | [ReO(PPh3)$\left( {{\text{L}}_{{{\text{тетра}}}}^{5}} \right)$][K(NCMe)2] · ⋅ 4MeCN | 1.696(2) | 2.062(2) ± 0.008 O$\left( {{\text{L}}_{{{\text{тетра}}}}^{5}} \right)$ 2.4433(10) Р(PРh3) | 1.925(2) | (–0.115) –0.137 |
[26] |
1. Строение комплексов [ReO(Lмоно)$\left( {L_{{тетра}}^{n}} \right)$], где$L_{{тетра}}^{n}$ = тетрадентатные (О, 3N), Lмоно = монодентатные (Cl, Br) лиганды
Три атома азота во всех трех структурах расположены меридианально (mer).
В кристаллической структуре [ReOCl$\left( {{\text{L}}_{{{\text{тетра}}}}^{1}} \right)$](PF6) (I) [20], где ${{\left( {{\text{L}}_{{{\text{тетра}}}}^{1}} \right)}^{ - }}$ = N,N-бис(2-пиридилметил)-2-аминоэтанолато (NC5H4CH2)2N(CH2)2O, есть две кристаллографически неэквивалентные молекулы сходного строения. Однозарядный комплексный катион одной из них изображен на рис. 1. В обсуждении структуры I мы употребляем нумерацию атомов именно этой молекулы. В тетрадентатном трис(хелатном) лиганде ${\text{L}}_{{{\text{тетра}}}}^{1}$ три пятичленных металлоцикла – два ReNC2N и один ReNC2O – сочленены по связи Re–N(1). В транс-положении к атому О(1)(оксо) расположен атом О(2)(оксиэтил), связь с которым (Re–O(2) 1.910 ± ± 0.007 Å) существенно короче (в среднем на 0.130 Å) стандартной связи Re–O(СТ) (2.04 Å); подробно особенности расстояний Re–Oцис обсуждаются в главе 4. Две Ру-группы двух аналогичных металлоциклов ReNC2N расположены в транс-позициях друг к другу. Связи Re–N(3, 4) c периферийными атомами N(Py) (2.126 ± 0.017 Å) несколько короче связи Re–N(1) (2.139 ± 0.005 Å) с аминным атомом азота.
Рис. 1.
Строение комплексов [ReOСl$\left( {{\text{L}}_{{{\text{тетра}}}}^{1}} \right)$]+ (I), [ReOBr$\left( {{\text{L}}_{{{\text{тетра}}}}^{2}} \right)$]+ (II), [ReOСl$\left( {{\text{L}}_{{{\text{тетра}}}}^{3}} \right)$] (III).
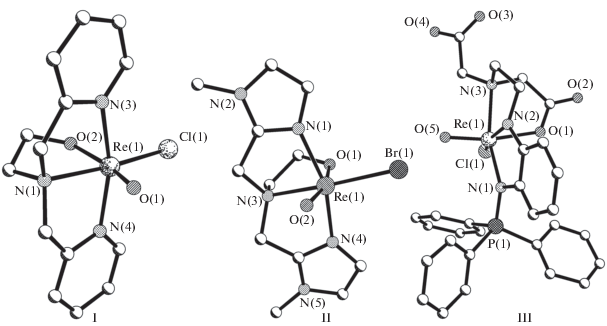
В комплексном катионе структуры [ReOBr$\left( {{\text{L}}_{{{\text{тетра}}}}^{2}} \right)$]Br · H2O (II) [21] (рис. 1), где ${{\left( {{\text{L}}_{{{\text{тетра}}}}^{{\text{2}}}} \right)}^{--}}$ = бис(1-метилимидазол-2-илметил)-2-аминоэтанолато {(N2C3H2Me)CH2}2N(CH2)2O, как и в комплексе структуры I, в однозарядном лиганде ${\text{L}}_{{{\text{тетра}}}}^{2}$ три пятичленных металлоцикла – два ReNC2N и один ReNC2O – сочленены по связи Re–N(3)амин. Как и в структуре I, в комплексе II связь Re–O(1)транс(алкоголят) (1.912 Å) заметно (на 0.128 Å) короче, чем Re–O(СТ) (носит частично двойной характер [22]), а периферийные связи Re–N(1, 4)имидазол (2.099 ± 0.017 Å) в среднем на 0.067 Å короче, чем центральная связь Re–N(3) (2.166 Å), по мнению авторов [22], за счет π-составляющих имидазольных циклов. Связь Re–Brцис в структуре II cходна по длине со связями Re–Brтранс (~2.500 Å) в оксокомплексах Re(V) с трет-аминным азотом [23]. Атом рения смещен из экваториальной плоскости N3Br октаэдра к оксолиганду на ΔRe = 0.13 Å.
Нейтральный фосфоранилиновый комплекс в структуре [ReOCl$\left( {{\text{L}}_{{{\text{тетра}}}}^{3}} \right)$] · H2O (III) [24] (рис. 1) – продукт неожиданного внутримолекулярного восстановления нитрогруппы в координационной сфере оксо-Re(V) фосфораниминато (R3P=N–) или фосфораниминных (R3P=NR) комплексов. Двухзарядный лиганд ${{\left( {{\text{L}}_{{{\text{тетра}}}}^{3}} \right)}^{{2 - }}}$ – N-(2-(трифенилфосфоранилиденамино)фенил)-этилендиамин-N'-ацетато-N'-уксусная кислота (Ph3P=N)C6H4N(CН2)2N(CH2COOH)CH2CO2 – построен по-иному, чем лиганды ${\text{L}}_{{{\text{тетра}}}}^{{1,\,2}}$ в структуре I, II. Он также содержит три пятичленных металлоцикла – два ReNC2N и один ReNC2O, но первые два имеют разный состав: в одном из них к связи С–С приконденсирован фенильный цикл С6Н4. Кроме того, три цикла сочленены не по одной, а попарно по двум связям Re–N(2), Re–N(3). В структуре есть две независимые молекулы сходного строения. Связь Re–O(1)транс (2.133 Å) существенно (на 0.093 Å) длиннее, чем Rе–O(СТ) (2.04 Å). Три связи Re–N различаются по длине: Re–N(1) 2.054, Re–N(2) 1.934, Re–N(3) 2.214 Å; атомы N(1) и N(3) находятся в транс-положении друг другу в соответствии с разной гибридизацией и типом атома азота: соответственно sp2 – имин, sp2 – амидо, sp3 – амин. Связь Р–N(1) (1.656 Å) попадает в верхнюю область значений свободных и координированных фосфоранаминов, что соответствует π-взаимодействию между атомами фосфора и азота.
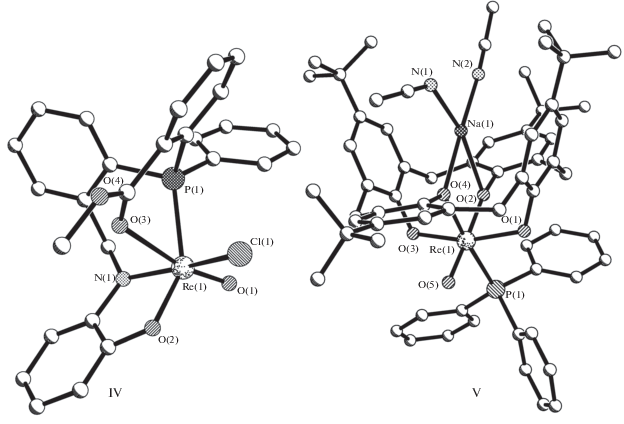
2. Cтроение [ReOСl$\left( {L_{{тетра}}^{4}} \right)$] · Н2О, где $L_{{тетра}}^{4}$ = тетрадентатный (2О, N, P) лиганд
В структуре [ReOCl$\left( {{\text{L}}_{{{\text{тетра}}}}^{4}} \right)$] · H2O (IV) [25] в комплексной молекуле (рис. 2) двухзарядный тетрадентатный трис(хелатный) (2О, N, P) лиганд – основание Шиффа метил-2-((2-(((2-гидрокси)фениламино)метил)фенил)(фенил)фосфино)-бензоато ОC6H4NCH2C6H4P(Ph)C6H4C(MeO)О, ${{\left( {{\text{L}}_{{{\text{тетра}}}}^{4}} \right)}^{{2 - }}}$ – потенциально пентадентатный лиганд (разомкнута связь с группой ОМе). При координации лиганда ${\text{L}}_{{{\text{тетра}}}}^{4}$ с атомом рения замыкаются три металлоцикла – шестичленные ReNC3P и ReNC3O, пятичленный ReNC2O. Связь Re–O(3)транс (2.414 Å) существенно (на 0.441 Å) удлинена по сравнению с Re–O(2)цис (1.973 Å).
3. Строение двух комплексов [ReO(PPh3)$\left( {L_{{тетра}}^{5}} \right)$], где $L_{{тетра}}^{5}$ = тетрадентатный (4О) лиганд
Известна кристаллическая структура двух соединений [ReO(PPh3)$\left( {{\text{L}}_{{{\text{тетра}}}}^{5}} \right)$][M(NCMe)2] · ⋅ 4MeCN [26], где M = Na (V) (рис. 2) и K (VI). Кристаллы V и VI изоструктурны. Лиганд ${{\left( {{\text{L}}_{{{\text{тетра}}}}^{5}} \right)}^{{2 - }}}$ – μ-5,11,17,23-тетра-бутилкаликс(4)-арен-25,26,27,28-тетраолато [{O(C6H2) · трет-Bu}CH2]4 – содержит 16-членный макроцикл С16, включающий четыре сопряженных по линиям Re–O–C восьмичленных металлоцикла ReOC5O. Связи Re–Oтранс (1.938 и 1.925 Å соответственно в V и VI) существенно (в среднем на 0.121 и 0.137 Å в двух структурах) короче связей Re–Oцис (2.059 и 2.062 Å соответственно в V и VI). Расстояния Re…M 3.535 (V, M = Na) и 3.8835 Å (VI, M = K), Na–O 2.309, 2.591 Å, средн. Na–N 2.386 ± 0.011, K–О 2.595, 2.867 Å, средн. K–N 2.745 ± 0.040 Å. Авторы [26] отмечают, что соединения V и VI – новые агенты в терапии рака.
4. Особенности строения мономерных октаэдрических монооксокомплексов рения(V) с тетрадентатно-хелатными (O, N, P) лигандами
В табл. 2 приведены средние значения основных геометрических параметров в структуре I–VI.
Таблица 2.
Основные геометрические параметры (Å) мономерных октаэдричеcких монооксокомплексов [ReO(Lмоно)$\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)$] с тетрадентатнo-хелатными (О, N, Р) лигандами
| Параметр | Значение, Å |
|---|---|
| Re–O(оксо) | 1.675–1.704 {6} (1.693 ± 0.018) |
| Re–O ${{\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)}_{{транс}}}$ | 1.910–1.938 {4} (1.921 ± 0.017) 2.133 {1} 2.414 {1} |
| Re–O${{\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)}_{{цис}}}$ | 1.937 {1} 2.059, 2.062 {2} (2.061 ± 0.002) |
| (Δ)Re–O$\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)$ | –0.102…–0.128 {4} (–0.117 ± 0.015) (0.093) {1} (0.374) {1} |
| Δ{Re–O$\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)$ | –0.121, –0.137 {2} (–0.129 ± 0.008) 0.477 {1} |
| Re–N${{\left( {{\text{L}}_{{{\text{тетра}}}}^{n}} \right)}_{{цис}}}$ | 1.934–2.214 {4} (2.070 ± 0.144) |
| Re–Clцис | 2.364–2.455 {3} (2.418 ± 0.054) |
| Re–Brцис | 2.4914 {1} |
| Re–Pцис | 2.394–2.443 {3} (2.419 ± 0.025) |
Отметим две особенности стереохимии октаэдрических монооксокомплексов металлов V–VII групп, в частности рения.
1. Выбор транс-партнера (при наличии конкурирующих лигандов) определяется “правилом самосогласованности” [2]: в транс-положении к кратносвязанному оксолиганду обычно расположен наименее поляризуемый нейтральный σ-донорный лиганд (атом), связь с которым легче ослабить, а не отрицательно заряженный (ацидо) лиганд (атом).
2. Связи Re–L, транс к О(оксо), удлиняются из-за структурного проявления трансвлияния (СПТВ) кратносвязанного лиганда О(оксо).
Во всех шести соединениях в транс-положениях к кратносвязанным оксолигандам расположены ацидоатомы кислорода тетрадентатно-хелатных лигандов ${\text{L}}_{{{\text{тетра}}}}^{n}.$
Второе правило реализуется (в существенно разной степени) в двух соединениях, рассмотренных в данной статье – IV и III: связи Re–Oтранс (2.414 и 2.133 Å) длиннее на 0.374 и 0.093 Å стандартного расстояния Re–O(СТ) (2.04 Å) [4]. В этих двух случаях можно говорить о СПТВ кратносвязанного оксолиганда.
В остальных четырех соединениях с отрицательно заряженными атомами кислорода лигандов ${\text{L}}_{{{\text{тетра}}}}^{n}$ в транс-позициях к О(оксо) реализуется принципиально другой вариант. В этих комплексах связи Re–O(L)транс (1.910–1.938 Å) сопоставимы по длине или заметно короче со значением Re–O(СТ) 2.04 Å [4] и связями Re–O(L)цис (1.937–2.062 Å, Δ = –0.121 и –0.137 Å). Этот факт, казалось бы, противоречит “правилу самосогласованности” [2]. Однако на самом деле связи Re–O(L)– в транс-позициях к оксолигандам можно рассматривать как имеющие повышенную кратность, так как они соизмеримы по длине (а не удлинены) с величиной Re–O(СТ). Другими словами, можно говорить о псевдодиоксокомплексах, содержащих два лиганда (О(оксо) и О(L)транс) повышенной кратности. Напомним, что в d2‑комплексах металлов V–VII групп два кратносвязанных лиганда всегда располагаются в транс-позициях друг к другу.
Отметим широкий интервал длин связей Re–Nцис 1.934–2.214 Å, в том числе и в одной структуре: в III Re–Nцис 1.934, 2.054, 2.214 Å.
Список литературы
Порай-Кошиц М.А., Гилинская Э.А. Кристаллохимия. М.: ВИНИТИ. Итоги науки и техники, 1966. С. 126.
Порай-Кошиц М.А., Атовмян Л.О. // Коорд. химия. 1975. Т. 1. № 8. С. 1271.
Griffith F., Wicing C. // J. Chem. Soc. A. 1968. № 3. P. 379.
Порай-Кошиц М.А. // Изв. Югосл. Кристаллогр. центра. 1974. Т. 9. С. 19.
Порай-Кошиц М.А., Атовмян Л.О. Кристаллохимия координационных соединений молибдена. М.: Наука, 1974. 231 с.
Shustorovich E.M., Porai-Koshits M.A., Buslaev Yu.A. // Coord. Chem. Rev. 1975. V. 17. № 1. P. 1.
Порай-Кошиц М.А., Сергиенко В.С. // Успехи химии. 1990. Т. 59. № 1. С. 86.
Allen F.H. // Acta Crystallogr. 2002. V. 58B. № 2. P. 380.
Sergienko V.S., Churakov A.V. // Russ. J. Inorg. Chem. 2016. V. 61. № 14. P. 1708.
Sergienko V.S. // Russ. J. Inorg. Chem. 2017. V. 62. № 6. P. 751. [Сергиенко В.С. // Журн. неорган. химии. 2017. Т. 62. № 6. С. 766.]https://doi.org/10.1134/S0036023617060195
Sergienko V.S., Churakov A.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 10. P. 1327. [Сергиенко В.С., Чураков А.В. // Журн. неорган. химии. 2017. Т. 62. № 10. С. 1337.]https://doi.org/10.1134/S0036023617100151
Sergienko V.S., Churakov A.V. // Russ. J. Inorg. Chem. 2018. V. 63. № 5. P. 631. [Сергиенко В.С., Чураков А.В. // Журн. неорган. химии. 2018. Т. 63. № 5. С. 601.] https://doi.org/10.1134/S0036023618050121
Sergienko V.S., Churakov A.V. // Russ. J. Inorg. Chem. 2018. V. 63. № 6. P. 753. [Сергиенко В.С., Чураков А.В. // Журн. неорган. химии. 2018. Т. 63. № 6. С. 718.]https://doi.org/10.1134/S0036023618060219
Sergienko V.S. // Russ. J. Inorg. Chem. 2018. V. 63. № 14. P. 1757.
Sergienko V.S., Churakov A.V. // Russ. J. Coord. Chem. 2019. V. 45. № 3. P. 332. [Сергиенко В.С., Чураков А.В. // Коорд. химия. 2019. Т. 45. № 3. С. 276] https://doi.org/10.1134/S1070328419030072
Sergienko V.S., Churakov A.V. // Russ. J. Coord. Chem. 2019. V. 45. № 6. P. 439. [Сергиенко В.С., Чураков А.В. // Коорд. химия. 2019. Т. 45. № 6. С. 378.] https://doi.org/10.1134/S107032841906007
Sergienko V.S., Churakov A.V. // Russ. J. Coord. Chem. 2019. V. 45. № 8 (in press). [Сергиенко В.С., Чураков А.В. // Коорд. химия. 2019. Т. 45. № 8 (в печати).]
Sergienko V.S., Churakov A.V. // Crystallography Rep. 2014. V. 59. № 3. Р. 300. [Сергиенко В.С., Чураков А.В. // Кристаллография. 2014. Т. 59. № 3. С. 341.]https://doi.org/10.7868/S0023476114030199
Sergienko V.S., Churakov A.V. // Crystallography Rep. 2013. V. 58. № 1. Р. 5. [Сергиенко В.С., Чураков А.В. // Кристаллография. 2013. Т. 58. № 1. С. 3.]https://doi.org/10.1134/S106377451301010112
Botha J.M., Umakoshi K., Sasaki Y., Lamprecht G.J. // Inorg. Chem. 1998. V. 37. № 7. P. 1609.
Gerber T.I.A., Mayer P., Tshentu Z.R. // J. Coord. Chem. 2007. V. 60. № 3. P. 237.
Gerber T.I.A., Mayer P., Tshentu Z.R. // J. Coord. Chem. 2003. V. 56. № 8. P. 1357.
Gerber T.I.A., Mayer P., Tshentu Z.R. // J. Coord. Chem. 2005. V. 58. № 6. P. 947.
Allali M., Benoist E., Gressier M. et al. // Dalton Trans. 2004. № 9. P. 3178.
Barandov A., Abram U. // Inorg. Chem. 2009. V. 48. № 24. P. 8072.
Redshaw C., Liu X., Zhan S. et al. // Eur. J. Inorg. Chem. 2008. № 10. P. 2698.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии