Журнал неорганической химии, 2020, T. 65, № 2, стр. 162-170
Образование и деструкция карбонильных нанокластеров палладия в системах Pd(II)–Cl––H+–H2O–CO
И. В. Федосеев a, *, А. В. Шевельков b, В. В. Васекин a, К. Б. Поярков c, Н. В. Ровинская a
a Акционерное общество “Научно-производственный комплекс “Суперметалл” им. Е.И. Рытвина
115184 Москва, Озерковская наб., 22/24, корп. 2, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
c Московский институт электронной техники
124498 Москва, площадь Шокина, 1, Россия
* E-mail: prof.igor.fedoseev@gmail.com
Поступила в редакцию 23.09.2019
После доработки 07.10.2019
Принята к публикации 09.10.2019
Аннотация
Карбонильные Pd-черни образуются действием монооксида углерода на раствор хлорокомплекса Pd(II) при атмосферном давлении и температуре ≥20°С. Исследования с использованием ИК-спектроскопии, рентгенофазового анализа и электронной микроскопии показали, что карбонильные Pd-черни являются гетерогенными и неустойчивыми системами, в состав которых входят палладий, углерод и кислород. Их соотношение изменяется при термической обработке. Палладий представлен металлом, карбонильным кластером Pdx(СО)y и фазой PdСx переменного состава, а углерод – отчасти в форме аморфного алмаза с sp3-гибридизацией атомов. После прокаливания Pd-черни при 1000°С значительное количество углерода остается в образующейся Pd-губке, которая обладает абразивностью. После растворения губки в царской водке нерастворимый остаток имеет высокое содержание углерода.
ВВЕДЕНИЕ
Среди металлов платиновой группы только палладий не образует карбонилов, устойчивых при обычных условиях, хотя давно отмечено, что Pd-чернь хорошо адсорбирует молекулы СО. При комнатной температуре адсорбция СО составляет 0.3–0.4% от массы черни. Полная десорбция СО происходит при t > 200°С [1].
И только относительно недавно при изучении адсорбции СО на Pd-чернях, нанесенных на оксидные носители, были идентифицированы кластеры Pd13(СО)x, имеющие концевые и ή2-СО лиганды [2] и Pd6(СО)x, у которых обнаружены также ή3-СО лиганды [3].
Синтез карбонилов палладия определенного состава был осуществлен только при криогенных температурах (Т ~ 20 K) совместной конденсацией атомов палладия и молекул СО. Были идентифицированы Pd(СО), Pd(СО)2, Pd(СО)3 и Pd(СО)4, для которых νCO составляет соответственно, см–1: 2050, 2044, 2000 и 2070 [4, 5]. В то же время получены многочисленные производные карбонилов палладия общей формулы Pdx(СО)yLz, где L – галогенид-ионы, арил- и алкилфосфины и другие органические лиганды, которые стабилизируют связь Pd–СО [6]. Постепенное удаление таких лигандов из внутренней сферы вызывает увеличение нуклеарности металлоостова кластера и его последующую деструкцию с выделением Pd-черней, содержащих переменное количество монооксида углерода.
Показано, что в толуольном растворе кластеров Pd4(CO)5(PR3)4, Pd10(CO)12(PR3)6 и Pd12(CO)12(PR3)6, где R = nBu, Et, под действием воздуха происходит элиминирование PR3-лигандов, увеличение нуклеарности кластеров с последующей их деструкцией и агрегацией в Pd-черни, в которых содержится до половины исходных СО-лигандов. В кластерах Pdx(СО)yLz атомы палладия могут иметь степени окисления от 0 до +2, включая дробные величины. Так, действием СО на раствор Pd3(ОАс)6 был получен устойчивый кластер Pd4(CO)4(ОАс)4 с одновременным восстановлением Pd(II) до Pd(I) [7].
В последние годы проведены детальные исследования систем Pd–CO–О2, что связано с использованием нанесенных палладиевых катализаторов для очистки выхлопных газов двигателей внутреннего сгорания и в процессах гидрирования непредельных углеводородов. В частности, показано образование углерода на поверхностях наночастиц и пленках палладия с большим количеством дефектов, но на отожженных металлах этого не наблюдалось [8–11].
В работе [8] показано, что при выдерживании наночастиц палладия размером 15 и 35 нм, нанесенных на SiO2 в атмосфере CO + О2 при температурах от комнатной до сотен градусов по Цельсию и давлении до 10 мбар образуются фазы PdСx, которые проявляются на рентгенограммах. При 2θ 3.98°–4.03° идентифицированы фазы с “высоким” содержанием углерода, при 2θ 3.90°–3.98° – фазы с “низким” содержанием углерода, а в интервале 2θ 17.0°–17.5° – фаза PdС, что связано с диссоциацией СО на дефектах наночастиц палладия, как отмечалось и в ряде других работ.
В работе [10] исследованы соединения углерода с Pd-катализатором. Найдена карбидная фаза Pd6С, где Pd6 – октаэдр и в его центре находится атом углерода, с которым связан каждый атом Pd. В присутствии Pd6С реакция гидрирования алкилов протекает селективно.
В настоящей работе представлены результаты исследований Pd-черней, полученных карбонильным способом при различных условиях синтеза. Наши результаты предваряются обзором литературы об образовании кластеров палладия.
Образование карбонильных кластеров палладия в системах Pd(II)–Cl––H+–H2O–CO
Способность монооксида углерода быстро восстанавливать палладий(II) в растворах его хлорокомплекса с выделением Pd-черни по общему уравнению (1) известна давно и использовалась в газовом анализе:
(1)
${{{\text{H}}}_{{\text{2}}}}{\text{PdC}}{{{\text{l}}}_{4}} + {\text{CО}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Pd}} + {\text{C}}{{{\text{О}}}_{2}} + 4{\text{HCl}}{\text{.}}$Также давно известна [12] способность хлорида палладия(II) присоединять молекулы СО с образованием карбонилхлорида палладия(II):
(2)
$2{\text{PdC}}{{{\text{l}}}_{2}} + 2{\text{CО}} = {\text{P}}{{{\text{d}}}_{2}}{{({\text{CО)}}}_{2}}{\text{C}}{{{\text{l}}}_{4}}.$Кинетика реакции (2) описана в работе [13]. Лимонно-желтые кристаллы карбонилхлорида палладия(II) гигроскопичны и на воздухе быстро разлагаются с образованием черни, а под действием воды разлагаются моментально в соответствии с реакцией:
(3)
${\text{P}}{{{\text{d}}}_{{\text{2}}}}{{{\text{(CО)}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{4}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 2{\text{Pd}} + 2{\text{C}}{{{\text{О}}}_{2}} + 4{\text{HCl}}.$Восстановление Pd(II) до Pd(0) происходит в результате внутрисферного гидролитического редокс-процесса:
В концентрированной соляной кислоте карбонилхлорид палладия(II) растворяется с образованием анионной формы:
(4)
${\text{P}}{{{\text{d}}}_{{\text{2}}}}{{\left( {{\text{CО}}} \right)}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{4}} + 2{\text{HCl}} = {{{\text{H}}}_{{\text{2}}}}\left[ {{\text{P}}{{{\text{d}}}_{{\text{2}}}}{{{\left( {{\text{CО}}} \right)}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{{\text{6}}}}} \right].$Кинетика реакции (1) исследована на системах Pd(II)–Cl––Н+–Н2О–СО при различных концентрациях этих компонентов и температурах [14, 15].
На рис. 1 представлена кривая изменения светопропускания этой системы при протекании реакции (1), состоящая из трех участков. Из них участки 1 и 2 отвечают гомогенному состоянию системы, а участок 3 – гетерогенному, где наблюдается выделение черни. Порядок реакций по компонентам на этих участках показан в табл. 1.
Рис. 1.
Характер изменения светопропускания при взаимодействии солянокислых растворов хлорида палладия(II) с окисью углерода.
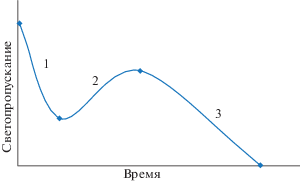
Таблица 1.
Порядок реакции (1) по компонентам
| Участок кривой светопропускания | Порядок по компоненту | ||||
|---|---|---|---|---|---|
| Pd(II) | Сl– | H+ | H2O | СО | |
| 1 | 1 | –1 | 0 | 1 | 0.5 при рСО ≤ 0.3 атм <0.1 при рСО > 0.3 атм |
| 2 | 0 | –2 | 1 | 2 | – |
| 3 | 1 | –1 | –2 | 2 | 0.5 при рСО ≤ 0.3 атм <0.1 при рСО > 0.3 атм |
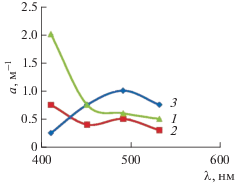
На рис. 2 показаны спектры поглощения раствора H2[Pd2(CО)2Cl6] и растворов H2PdCl4 до и после обработки СО.
Рис. 2.
Электронные спектры поглощения солянокислых растворов карбонилхлорида палладия (1), хлорида палладия, обработанного окисью углерода (2), и хлорида палладия (3).
Анализ кривых на рис. 1 и 2, а также совокупность реакций (2)–(4) показывают, что начальная стадия реакции (1) – участок 1 на рис. 1 – отвечает переходу хлорокомплекса палладия(II) в его карбонилхлоридный анион:
(5)
${\text{PdCl}}_{{\text{4}}}^{{ - {\text{2}}}} + {\text{СО}} \leftrightarrow {\text{Pd}}\left( {{\text{CО}}} \right){\text{Cl}}_{{\text{3}}}^{{ - {\text{2}}}} + {\text{С}}{{{\text{l}}}^{ - }}.$Реакция (5) была подтверждена экспериментально. После обработки раствора PdCl2 в 10 М HCl монооксидом углерода при 50°С до изменения окраски раствора на желто-зеленоватую в раствор вводили кристаллический СsCl. Наблюдалось быстрое образование мелкокристаллического осадка желто-зеленого цвета. Анализ показал, что этот продукт соответствует простейшей формуле Сs[PdCОCl3], а в ИК-спектре присутствует полоса νCO при 1930 см–1. Эта соль, подобно нейтральному карбонилхлориду палладия(II), на воздухе быстро чернеет, а при внесении в воду моментально разлагается с образованием Pd-черни в соответствии с реакцией (3).
Участок 2 на рис. 1 также соответствует гомогенному состоянию системы. Здесь увеличение светопропускания системы может быть связано с уменьшением концентрации частиц в единице объема за счет увеличения числа атомов палладия в металлоостовах карбонильных кластеров в результате восстановления палладия(II) до низших степеней окисления. Первой стадией этого процесса является восстановление Pd(II) до Pd(I):
(6)
$\begin{gathered} {\text{2PdCОCl}}_{{\text{3}}}^{--} + {\text{СО}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow \\ \leftrightarrow {\text{P}}{{{\text{d}}}_{{\text{2}}}}{{\left( {{\text{CО}}} \right)}_{{\text{2}}}}{\text{Cl}}_{{\text{4}}}^{{{\text{2}}--}} + {\text{С}}{{{\text{О}}}_{{\text{2}}}} + {\text{2HCl}}. \\ \end{gathered} $Карбонилхлоридный анион Pd(I) был выделен в виде соли Сs2[Pd2(CО)2Cl4] из раствора PdCl2 в концентрированной HCl при его обработке СО до величины окислительно-восстановительного потенциала 175 мВ по хлорсеребряному электроду и введении в раствор соли СsCl. ИК-спектр соли Сs2[Pd2(CО)2Cl4] имеет νCO = 1916 и 1873 см–1, что показывает наличие мостикового СО-лиганда в этом веществе [16].
Далее происходит последовательное уменьшение степени окисления атомов палладия и увеличение их числа в металлоостовах кластеров, что в итоге приводит к формированию карбонильных нанокластеров общего состава [Pdx(CО)yClz]n–, где степень окисления Pd меньше +1, а соотношение z/x и величина n уменьшаются. Следует отметить, что по мере уменьшения степени окисления атомов палладия связь между ними в металлоостовах ослабевает. По данным [17], значения энергии связи в катионе [Pd–Pd]+ составляют 39 ± ± 12 кДж/моль, а в нейтральной молекуле Pd–Pd – только 15 ± 5 кДж/моль. Стабильность системы [Pdx(CО)yClz]n– уменьшается, в итоге происходит ее деструкция с выделением Pd-черни, которая не является индивидуальным веществом, а представляет собой гетерогенную метастабильную систему. Участок 3 на рис. 1 отвечает появлению и накоплению в системе Pd-черни в соответствии с реакцией (1).
При этом физико-химические параметры Pd-черней: насыпная плотность, удельная поверхность, окисляемость и др., а также размеры частиц – определяются составом исходного раствора H2PdCl4 и температурой процесса карбонилирования. Математическое планирование эксперимента позволило получить уравнение регрессии, описывающее зависимость насыпной плотности порошков Pd-черней от состава раствора и температуры процесса карбонилирования. Заметное влияние на размер частиц Pd-черней оказывает также состав растворителя (вода + органическая жидкость) [18].
Детальные исследования Pd-черней, полученных в разных условиях, не проводились, хотя в работе [19] показана возможность присутствия в Pd-чернях атомов углерода с sp3-гибридизацией.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения карбонильных черней палладия первоначально использовали реактивный PdCl2 марки “ч.”, а затем PdCl2 получали регенерацией из Pd-черней путем их растворения в концентрированной HCl при действии H2O2. Монооксид углерода получали действием муравьиной кислоты на горячую H2SO4, полученным газом заполняли газометр. Образцы Pd-черней получали при пропускании монооксида углерода через растворы H2PdCl4 при атмосферном давлении, комнатной температуре и интенсивном перемешивании в течение 40–60 мин. Полученные черни отделяли фильтрацией, промывали и высушивали. Параметры экспериментов приведены в табл. 2.
Таблица 2.
Химический состав Pd-черней и продуктов их деструкции по данным РЭМ
| № измерения | Содержание элементов, ат. % | Соотношение элементов, ат. |
Условия подготовки образцов после фильтрации | |||
|---|---|---|---|---|---|---|
| Pd | С | О* | С : О | Pd : С | ||
| Образец 1 | ||||||
| 1.1a | 19.40 | 38.48 | 30.01 | 1.28 : 1 | 1 : 2.00 | Чернь промыта этанолом и высушена на воздухе при комнатной температуре aСостав определен по площади 0.3 × 0.3 мм bСостав определен по точкам 002, 003, 004 (рис. 4) |
| 1.2b | 3.78 | 44.92 | 5.57 | 6.17 : 1 | 1 : 11.90 | |
| 1.3b | 50.85 | 31.46 | 6.31 | 5.00 : 1 | 1 : 0.60 | |
| 1.4b | 46.15 | 25.07 | 19.14 | 1.31 : 1 | 1 : 0.50 | |
| Образец 2 | ||||||
| 2.1 | 17.50 | 71.08 | 6.41 | 11.1 : 1 | 1 : 4.00 | Чернь промыта этанолом и высушена на воздухе при температуре 40°С aОбразец содержал 0.74 ат. % хлора |
| 2.2a | 15.28 | 73.38 | 6.56 | 11.2 : 1 | 1 : 4.80 | |
| 2.3 | 58.45 | 37.43 | Не обнаружен | – | 1 : 0.60 | |
| 2.4 | 21.38 | 16.23 | 45.50 | 0.36 : 1 | 1 : 0.76 | Образец прокален при температуре 1000°С |
| Образец 3 | ||||||
| 3.1 | 37.09 | 45.57 | 9.74 | 4.68 : 1 | 1 : 1.23 | Чернь промыта 2М HCl и этанолом и высушена на воздухе при комнатной температуре |
| 3.2 | 47.75 | 38.56 | 7.84 | 4.92 : 1 | 1 : 0.84 | Чернь промыта этанолом и высушена на воздухе при температуре 100°С |
| 3.3 | 32.25 | 24.59 | 35.98 | 0.68 : 1 | 1 : 0.76 | Чернь промыта этанолом и прокалена на воздухе при температуре 1000°С |
Рентгенофазовый анализ проводили с использованием камеры Гинье высокого разрешения (Image Plate Huber G670 CuKα1, длина волны излучения λ = 1.54051 Å). Съемку проводили при комнатной температуре в диапазоне углов 2θ 5°– 100°. Для обработки полученных данных использовали стандартный пакет программ WinXPow и базу данных PDF-2.
ИК-спектр записывали в режиме нарушенного полного внутреннего отражения на ИК-спектрофотометре Perkin-Elmer Spectrum One в диапазоне от 4000 до 580 см–1.
Исследования морфологии и состава образцов проводили на растровом электронном микроскопе JSM-6010 Plus/LA (JEOL). Микроскоп оборудован энергодисперсионным детектором для проведения элементного анализа (EDS-анализ). Исследования проводили при ускоряющем напряжении 20 кВ. Уровень вакуума в камере ≤1 × 10–4 Па.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В работе использовали образцы Pd-черней, полученные при пропускании монооксида углерода через растворы H2PdCl4 при атмосферном давлении, комнатной температуре и интенсивном перемешивании в течение 40–60 мин. Полученные черни отделяли фильтрацией, промывали и высушивали, как указано в табл. 2.
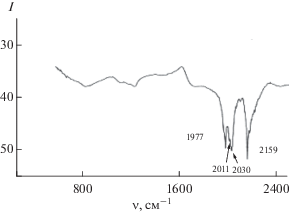
На рис. 3 представлен ИК-спектр образца 1 черни (табл. 2), который показал наличие молекул СО, имеющих νСО = 2159, 2030, 2011, 1977 см–1.
В ряде исследований дано отнесение значений частот гармонических колебаний молекулы СО для различных конфигурационных сайтов адсорбции на плотноупакованной поверхности палладия [20]:
Таким образом, в карбонильной Pd-черни присутствуют концевые и мостиковые ή2 молекулы СО, поэтому следует ожидать изменения ИК-спектров Pd-черней, прошедших термическую обработку.
Три образца Pd-черней исследованы на многофункциональном электронном микроскопе. В табл. 2 показан элементный состав черней в отдельных точках и на площадях 0.3 × 0.3 мм, а на рис. 4 представлены снимки черни образца 1. Из табл. 2 видно, что содержание палладия и углерода во всех образцах сильно отличается: для палладия в пределах от 3.78 до 50.58 ат. %, а для углерода от 16.23 до 73.38 ат. %, а атомное соотношение Pd : С находится в пределах от 0.084 : 1 до 1.70 : 1, что определяется условиями обработки Pd-черней после их отделения от раствора и говорит о неоднородности и неустойчивости этих продуктов. Атомное соотношение С : О почти во всех образцах >1, т.е. не весь углерод в Pd-чернях связан в СО и может находиться либо в свободном состоянии, либо в составе фазы PdСx.
Таким образом, Pd-черни, полученные гидрокарбонильным способом, в том числе прошедшие термическую обработку, не являются индивидуальными веществами и представляют собой гетерогенные системы с высоким содержанием Pd, С и О. Содержание и формы этих элементов меняются при термической обработке черней.
Обнаружено, что характерным качеством Pd-черней, полученных гидрокарбонильным способом, является абразивность, даже у свежевыделенных продуктов. После прокаливания при 1000°С образовывались непластичные палладиевые губки, абразивные по отношению не только к стеклу и кварцу, но и к кремнию. Механизм образования углерода, по-видимому, связан с каталитическим распадом лигандных молекул СО по реакции Будуара:
Авторы работы [21] отмечают: “Существует множество фактов и наблюдений природных явлений, подтверждающих модель поликонденсационного синтеза алмазов из легких углеродсодержащих молекул”, в том числе по реакции Будуара. Однако следует учитывать также такую возможность синтеза для графита и других неалмазных форм углерода.
Образование углерода возможно в результате диссоциации молекул СО. Этот процесс происходит на наночастицах палладия. Дефекты поверхности приводят к качественно новым особенностям в поведении адсорбированных молекул СО. Определенное конфигурационное окружение атомов металла на дефектных участках поверхности может приводить к диссоциации молекул СО и диффузии атомов С и О вдоль ступеней и порогов. Вероятность этих процессов увеличивается с ростом температуры.
Для образцов 3.1, 3.2 и 3.3 (табл. 2) получены рентгенограммы (рис. 5), которые не показали наличия кристаллических форм углерода. Поэтому можно предположить, что углерод присутствует в виде алмазоподобного аморфного углерода. Также возможно наличие фазы PdСx, описанной в работе [8], где показано, что каталитическая активность палладия в отношении селективного гидрирования связана с образованием на поверхности металлических частиц пленки, богатой углеродом за счет его растворения в палладии. Наибольшую стабильность имеет состав Pd6С с содержанием углерода 14 ат. %. Содержание углерода в гранецентрированной кубической кристаллической решетке палладия составляет 3 ат. %. Атомы аморфного углерода имеют sp3-гибридизацию [10].
Рис. 5.
Рентгенограммы образцов карбонильных Pd-черней, представленных в табл. 2: 3.1 (а), 3.2 (б), 3.3 (в). Вертикальные риски показывают положение пиков палладия согласно базе данных PDF-2.
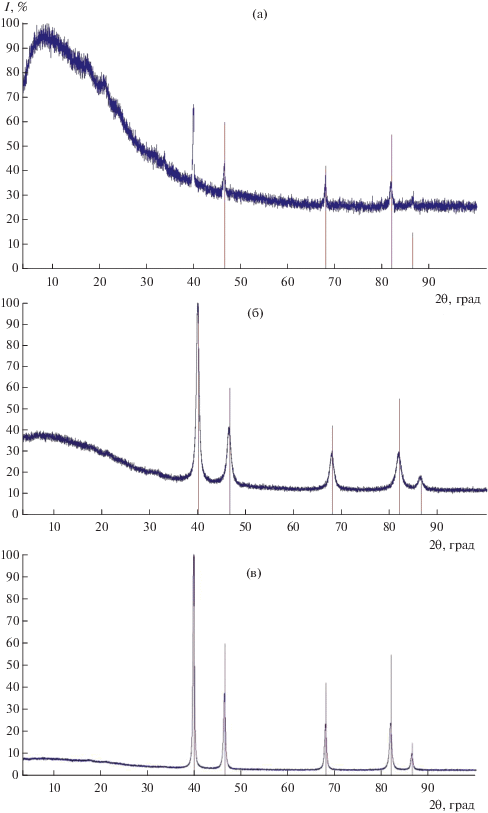
Анализ рентгенограмм образца Pd-черни (рис. 5) показал изменение состава в зависимости от условий обработки черни после отделения от раствора. На рис. 5а представлена рентгенограмма образца черни, который был промыт 2М HCl и этанолом, а затем высушен на воздухе. Этот образец характеризуется небольшой степенью кристалличности, что подтверждается наличием фона высокой интенсивности в области малых величин 2θ в согласии с литературными данными [8].
Образец, представленный на рис. 5б, высушен при 100°С, он имеет более высокую кристалличность и менее высокий фон интенсивности, сохраняющийся в тех же пределах 2θ.
Образец на рис. 5в характеризуется гораздо меньшей шириной дифракционных пиков, следовательно, имеет высокую степень кристалличности при отсутствии аморфных примесей, несмотря на высокое содержание углерода. Эти изменения рентгенограмм сопровождаются значительным увеличением атомных соотношений Pd : С (табл. 2, образцы 3.1, 3.2, 3.3), что для образца 3.2 не может быть связано с выгоранием углерода и является, вероятно, результатом либо реакции Будуара, либо связано с диссоциацией молекул СО.
В то же время углерод из Pd-черней полностью не удалялся даже при прокаливании при 1000°С (табл. 2, образцы 2.4, 3.3). При растворении Pd-черней (рис. 6а) в царской водке или в системе HCl + Н2О2 оставался нерастворимый осадок, который после обработки раствором НF (для удаления стекла) представлял собой углеродную субстанцию в форме зерен и нитей, пример которых представлен на рис. 6б. Такие же субстанции присутствовали и в свежеосажденных Pd-чернях. Следует отметить, что в настоящее время углеродным материалом уделяется большое внимание как в теоретическом, так и в практическом направлениях. В частности, это относится к углеродным волокнам, которые получают из органических прекурсоров. Так, в работе [22] описан синтез нано- и микроволокон углерода пиролизом метана на оксиде циркония.
Рис. 6.
Микрофотографии образца палладиевой черни при увеличении в 7600 раз (а); нити из нерастворимой углеродной субстанции, выделенной из черни Pd, при увеличении в 30 раз (б).

В табл. 3 представлен состав продукта (по данным микрорентгеноспектрального анализа), который остается после растворения Pd-черни в системе HCl + Н2О2 и последующего прокаливания на воздухе при 1000°С. Этот продукт не был обработан раствором НF.
Таблица 3.
Элементный состав остатка от выщелачивания Pd-черни в системе HCl + Н2О2 после прокаливания на воздухе при 1000°С по данным РЭМ
| № точки | Содержание элементов в точках, мас. %/ат. % | ат. % | ат. % | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| С | О | Si | Mg | Al | Ca | Fe | Ba | О* | С : О | |
| 1 | $\frac{{7.24}}{{11.66}}$ | $\frac{{39.74}}{{48.05}}$ | $\frac{{11.03}}{{7.60}}$ | $\frac{{38.97}}{{31.01}}$ | $\frac{{1.01}}{{0.73}}$ | $\frac{{0.36}}{{0.18}}$ | $\frac{{0.54}}{{0.19}}$ | – | 0.29 | 1 : 0.025 |
| 2 | $\frac{{16.97}}{{25.32}}$ | $\frac{{48.09}}{{53.86}}$ | $\frac{{21.61}}{{13.81}}$ | $\frac{{6.74}}{{4.48}}$ | $\frac{{2.97}}{{1.33}}$ | $\frac{{1.75}}{{0.23}}$ | 17.96 | 1 : 0.71 | ||
| 3 | $\frac{{4.56}}{{7.53}}$ | $\frac{{50.63}}{{62.69}}$ | $\frac{{24.20}}{{17.07}}$ | $\frac{{1.25}}{{1.02}}$ | $\frac{{10.54}}{{7.74}}$ | $\frac{{3.92}}{{1.94}}$ | – | $\frac{{2.06}}{{0.30}}$ | 13.62 | 1 : 1.81 |
Основными элементами этой субстанции являются кислород, углерод, кремний и легкие цветные металлы: Al, Mg, Ca, Na. Высокое содержание кремния и легких цветных металлов, по-видимому, является следствием абразивного действия Pd-черни на стенки стеклянного реактора при интенсивном перемешивании раствора H2PdCl4 в процессе карбонилирования. При этом наблюдалось внедрение абразивных частиц в стеклянные лопасти мешалок, что придавало им абразивность.
Возможно, абразивность черней и губок палладия вызвана аморфной формой алмаза, которая образуется при деструкции карбонильных нанокластеров палладия, получаемых при действии монооксида углерода на растворы H2PdCl4.
Исследованиям аморфной формы алмаза посвящена обзорная статья [20], в которой описан тетрагональный аморфный углерод, обозначенный как tа-С. В табл. 4 приведены его физико-химические параметры по сравнению с алмазом. Возможно, абразивность карбонильных Pd-черней связана с наличием в них этой формы углерода.
Таблица 4.
Физико-химические параметры алмаза и аморфного тетрагонального углерода (tа-С) [20] (доля Н 0%)
| Форма углерода | Доля sp3-атомов, % | Плотность, г/см3 | Ширина запрещенной зоны, эВ | Твердость, ГПа |
|---|---|---|---|---|
| Алмаз | 100 | 3.5 | 5.5 | 100 |
| tа-С | 80–88 | 3.1 | 2.5 | 80 |
ЗАКЛЮЧЕНИЕ
Изложенные результаты исследования процесса деструкции карбонильных кластеров палладия (Pd-черней), которые образуются при обработке растворов H2PdCl4 монооксидом углерода при атмосферном давлении показали, что карбонильные Pd-черни являются гетерогенными и метастабильными системами, включающими Pd, С, Pdx(СО)y, PdСx в различных соотношениях и различных формах углерода. Эти системы возникают в результате деструкции карбонильных нанокластеров общего состава [Pdx(CО)yClz]n–, что можно представить следующей схемой:
Фазы PdСx могут возникать при диссоциации СО в процессе выделения Pd-черней при обработке монооксидом углерода на дефектах кластеров Pdn.
Совокупность физико-химических свойств делает карбонильные Pd-черни перспективным компонентом в ряде технологических решений. Так, показана возможность использования карбонильной Pd-черни для изготовления нанесенного катализатора, активного и селективного в процессе гидрирования непредельных углеводородов [23]. В работе [24] отмечается, что палладий, нанесенный на углерод (Pd/С), где в качестве углерода используют активированные угли и новые формы углерода: фуллерены, нанотрубки, волокна и другие нанопористые углеродные материалы, отличается высокой каталитической активностью и селективностью.
Испытания многослойных керамических конденсаторов, в которых токопроводящие слои были получены с использованием карбонильной Pd-черни, показали их высокие эксплуатационные параметры.
Целесообразно провести испытания карбонильных Pd-черней в качестве электродов топливных элементов. Следует отметить, что можно получать гетероатомные карбонильные черни, которые наряду с палладием содержат и другие платиновые металлы, в частности, черни общего состава PtхPdy(CO)z [25]. Эти соединения могут быть прекурсорами при получении биметаллических кластеров Pd/Pt, которые оказывают влияние на сенсорные свойства нанокристаллического SnO2 при детектировании СО, как это показано в работе [26].
Полученные результаты показывают целесообразность дальнейших исследований карбонильных черней палладия, в частности, определение влияния условий образования и последующей обработки на их состав, а также определение электрофизических параметров углеродных субстанций, что может расширить области их применения.
Список литературы
Белозерский Н.А. Карбонилы металлов. М.: Металлургиздат, 1958. 372 с.
Gates B.C. // Chem. Rev. 1995. V. 95. P. 511.
Zhang Z.C., Sachtler W.M.K. // J. Mol. Catal. 1991. V. 67. P. 349.
Darling J.H., Ogden J.S. // Inorg. Chem. 1972. V. 11. № 3. P. 666.
Darling J.H., Ogden J.S. // J. Chem. Soc. (D). 1973. №10. P. 1079.
Спицын В.И., Федосеев И.В. Карбонильные комплексы платиновых металлов. М.: Наука, 1980. 200 с.
Моисеев И.И., Варгафтик М.Н. // Рос. хим. журн. 2006. Т. 50. № 4. С. 72.
Balmes O., Resta A., Wermeille D. et al. // Phys. Chem. Chem. Phys. 2012. V. 14. P. 4796.
Viñes F., Lochen C., Illas F. et al. // J. Catalysis. 2009. V. 266. № 1. P. 59.
Seriani N., Mittendorfen F., Kresse G. // J. Chem. Phys. 2010. V. 132. № 2. P. 024711.
Lanzani G., Nasibulin A.G., Laasonen K. et al. // J. Catalysis. 2009. V. 266. № 1. P. 59.
Manchot W., Könnig J. // Ber. 1926. B. 59. № 5. S. 883.
Спицын В.И., Федосеев И.В. // Докл. АН СССР. 1967. Т. 174. № 2. С. 414.
Спицын В.И., Федосеев И.В., Знаменский И.В. и др. // Докл. АН СССР. 1974. Т. 219. № 2. С. 368.
Спицын В.И., Федосеев И.В., Знаменский И.В. // Журн. неорган. химии. 1980. Т. 25. № 10. С. 2754.
Fedoseev I.V., Gordeev A.S. // Russ. J. Inorg. Chem. 2007. V. 52. № 1. P. 7. [Федосеев И.В., Гордеев А.С. // Журн. неорган. химии. 2007. Т. 52. № 1. С. 12.]
Гурвич Л.В. Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. М.: Наука, 1974. 39 с.
Федосеев И.В., Шевницына Л.В., Гордеев А.С. // Известия ВУЗов, химия и хим. технология. 2005. Т. 48. Вып. 12. С. 16.
Fedoseev I.V., Korzhavyi A.P., Maramygin K.V. // Russ. J. Inorg. Chem. 2013. V. 58. № 12. P. 1443. [Федосеев И.В., Коржавый А.П., Марамыгин К.В. // Журн. неорган. химии. 2013. Т. 58. № 12. С. 1586.]
Robertson J. // Mater. Sci. Eng., R. 2002. V. 37. P. 129.
Руденко П.Н., Кулакова И.И., Скворцова В.А. // Успехи химии. 1993. Т. 62. № 2. С. 99.
Lyu S.T., Rakov E.G. // Russ. J. Inorg. Chem. 2017. V. 62. P. 94. [Шон Т.Н., Раков Э.Г. // Журн. неорган. химии. 2017. Т. 62. № 1. С. 92.] https://doi.org/10.1134/S0036023617010193
Федосеев И.В., Фасман А.Б., Шевницына Л.К. Способ получения палладиевого катализатора, нанесенного на оксид алюминия, для гидрирования фенилацетилена: А.с. № 1 593 008 CCCР: К 4482188.
Украинцев В.Б., Хохряков К.А. // Рос. хим. журн. 2006. Т. 50. № 4. С.154.
Fedoseev I.V., Gerasimova N.S., Loginova A.Yu. // Russ. J. Inorg. Chem. 2010. V. 55. № 2. P. 186. [Федосеев И.В., Герасимова Н.С., Логинова А.Ю. // Журн. неорган. химии. 2010. Т. 55. № 2. С. 221.]
Malkov I.V., Krivetskii V.V., Marikutsa A.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1007. [Малков И.В., Кривецкий В.В., Потемкин Д.И. и др. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 968.] https://doi.org/10.1134/S0036023618080168
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии