Журнал неорганической химии, 2020, T. 65, № 7, стр. 982-989
Термодинамика растворов и азеотропия в расплавах системы цинк–кальций
В. Н. Володин a, b, Ю. Ж. Тулеушев a, *, Н. М. Бурабаева b, A. S. Kerimshe a
a Институт ядерной физики
050032 Алматы, ул. Ибрагимова, 1, Казахстан
b Институт металлургии и обогащения
050010 Алматы, ул. Шевченко, 29/33, Казахстан
* E-mail: tuleushev@mail.ru
Поступила в редакцию 10.01.2020
После доработки 13.02.2020
Принята к публикации 27.02.2020
Аннотация
На основании величин давления пара, определенных методом точек кипения, рассчитаны парциальные и интегральные термодинамические функции смешения и испарения расплавов системы Zn–Са. Образование сплавов во всем интервале концентраций протекает с выделением тепла, сопровождается значительным упорядочением в системе по сравнению с идеальным раствором до концентрации ~70 ат. % Са в сплаве и незначительным увеличением беспорядка при превышении указанной концентрации. На кривых зависимостей интегральных функций испарения при концентрации кальция ~85 ат. % присутствуют экстремумы: минимум изменения энтропии 85.48 Дж/(моль K) и максимум энтальпии 156.44 кДж/моль. На основании данных о величине давления пара компонентов диаграмма состояния Zn–Са дополнена полями сосуществования жидкости и пара при атмосферном давлении (101.33 кПа) и в вакууме (1.33 и 0.7 кПа). Обнаружено существование нераздельно кипящей при температуре 1494°С жидкости с концентрацией кальция 93.2 ± 6.7 ат. %. С понижением давления (температуры кипения) состав азеотропной смеси незначительно смещается (в соответствии с законом Вревского) в сторону цинкового края диаграммы состояния, где цинку соответствует меньшая (118.6 кДж/моль) по сравнению с кальцием (153.7 кДж/моль) энтальпия испарения. Расположение границ полей парожидкостного равновесия свидетельствует о невозможности дистилляционного разделения системы Zn–Са на металлы дистилляцией.
ВВЕДЕНИЕ
Использование кальция в металлотермических процессах восстановления тугоплавких редких элементов предполагает в нем минимальное содержание примесей, одной из которых может быть цинк. Рафинирование как цинка, так и кальция может быть осуществлено дистилляцией в вакууме, для этого необходимы сведения о термодинамике металлических растворов и парожидкостном равновесии в рассматриваемой системе. Однако количество термодинамических исследований системы Са–Zn в ретроспективе нескольких десятков лет крайне ограничено.
Авторами [1] эффузионным методом Кнудсена определено давление пара цинка (рZn) над кристаллическим соединением CaZn2 при температуре 385–500°С (658–773 K), представленное в виде зависимости: lg pZn [мм рт. ст.] = 15.47 – 12 710Т–1 (lnpZn [Па] = = 40.514 – 29266T–1 пересчитано нами), здесь и далее Т – температура, K. На основании величины давления пара рассчитана теплота сублимации, равная (58 ± 6) × 103 ккал/моль (243.3 ± 25.2 кДж/моль).
В исследовании [2] аналогичным методом определено давление пара цинка над жидкими растворами с кальцием в интервале концентраций 32.6–92.4 ат. % (44.1–95.2 мас. %) Zn: при температуре 430–559°С (703–832 K) в начале интервала и 730–904°С (1003–1177 K) в конце. На основании величин давления пара определены термодинамические функции составляющих сплава, а также интерметаллических соединений CaZn0.333, CaZn0.571, CaZn, CaZn2, CaZn2.857, CaZn5, CaZn11 и CaZn13. Для системы найдено незначительное знакопеременное отклонение от закона идеальных растворов, что не согласуется с наличием в системе большого количества интерметаллидов, сохраняющих, как правило, взаимодействие между разноименными металлами при расплавлении, а коэффициент термодинамической активности, по нашим расчетам, не зависит от температуры.
Позднее [3] в рамках теории регулярных растворов рассчитана энтальпия плавления соединения CaZn2, равная 9.23 кДж/моль, при этом температура плавления CaZn2 занижена (688°С, 961 K) по сравнению с температурой (704°С, 977 K), указанной в справочных изданиях [4, 5].
Немногочисленные сведения о двойной системе Zn–Ca обобщены в работе [6].
Авторами [7] при получении сплавов кальция и цинка из хлоридных расплавов электролитическим методом на основании величин деполяризации рассчитаны коэффициенты активности Са в сплавах, содержащих 0.28–0.72 ат. % элемента, которые свидетельствуют о справедливости для них закона Генри.
Приведенные в работе [8] коэффициенты активности цинка при 827°С (1100 K) для сплавов, содержащих до 50 ат. % Са, свидетельствуют о значительном отрицательном отклонении растворов от закона Рауля.
Более поздние исследования системы Са–Zn посвящены термодинамическому моделированию [9–13], в том числе с использованием метода CALPAD, и оптимизации термодинамических параметров для различных фаз.
Термодинамические константы элементов, составляющих систему Zn–Ca, приведены в работах [14–17].
Представленные выше данные свидетельствуют о противоречивости результатов исследований и явной недостаточности физико-химических сведений о системе Zn–Ca, используемой в различных технологических процессах.
Цель настоящей работы – определение на основании уточненных величин давления пара над расплавами термодинамических характеристик жидкой фазы и границ полей сосуществования расплавов и пара при атмосферном давлении и в вакууме.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Для решения поставленной задачи использовали значения термодинамической активности элементов, связанные известными зависимостями с термодинамическими константами раствора и определяемые как отношение давления насыщенного пара над раствором к давлению пара над чистым элементом.
В то же время суммарная величина давления пара компонентов над раствором, равная атмосферному давлению при некоторой температуре, соответствует температуре кипения этого раствора, а доля давления пара элемента в суммарном давлении, исходя из уравнения Клапейрона–Менделеева, соответствует мольной доле этого элемента в паре.
Объектом исследования были сплавы, содержание кальция в которых (остальное цинк) составляло, мас. %: 9.74, 20.44, 33.89, 52.02 и 74.86 (14.97, 29.53, 45.54, 63.88 и 82.93 ат. % соответственно).
Сплавы готовили нагреванием соответствующих количеств бидистиллированного кальция (99.9 мас. %) и цинка (99.99 мас. %) до температур, на 50°С (50 K) превышающих линию ликвидуса, в тонкостенных тиглях из ниобия с перемешиванием при расплавлении в атмосфере очищенного аргона. После охлаждения из-за смачивания расплавом внутренней поверхности тигля ниобий от слитка отделяли механически.
Инертный газ очищали последовательным пропусканием через емкости, заполненные пентаоксидом фосфора, омедненным силикагелем, при температуре 350°С (623 K) и титановой губкой при 800–900°С (1073–1173 K). Слитки во избежание оксидирования хранили в емкостях, заполненных очищенным аргоном.
Для определения величины давления насыщенного пара использовали метод точек кипения (изотермический вариант), описанный нами ранее [18, 19] и подробно изложенный в [20], в основу которого положено значительное увеличение скорости испарения при равенстве внешнего давления и давления насыщенного пара исследуемого вещества при понижении давления над расплавом при заданной температуре.
В связи с тем, что давление пара цинка при температуре его кипения 906°С (1179 K), по данным [15], в 2.11 × 102 раза превышает давление пара кальция при этой температуре, считали, что суммарное давление пара, определенное методом точек кипения, соответствует давлению насыщенного пара цинка.
Нагреваемые части установок, контактирующие с паровой фазой, были выполнены из кварцевого стекла. В качестве газа-заполнителя объема в методе точек кипения использовали аргон.
РАСЧЕТНАЯ ЧАСТЬ
Температурную зависимость парциального давления пара цинка (рZn) для каждого из составов описывали уравнением аррениусовского типа. Затем, аппроксимируя зависимость коэффициентов в уравнении от концентрации цинка (xZn) в сплаве, получали температурно-концентрационную зависимость давления пара ln pZn [Па] = f(xZn, T). Аналогичное уравнение зависимости давления пара кальция $({{p}_{{{\text{Ca}}}}})$ от состава и температуры имеет вид: lnpCa [Па] = f(xCa, T), где ${{p}_{{{\text{Ca}}}}} = p_{{{\text{Ca}}}}^{^\circ }{{{\gamma }}_{{{\text{Ca}}}}}{{x}_{{{\text{Ca}}}}},$ а ${{{\gamma }}_{{{\text{Ca}}}}}$ найдено численным интегрированием уравнения Гиббса–Дюгема с использованием вспомогательной функции, предложенной Даркеном [21, 22], связывающей $\ln {{{\gamma }}_{{{\text{Zn}}}}}$ и $\ln {{{\gamma }}_{{{\text{Ca}}}}}{\text{:}}$
Парциальные энтропии смешения кальция и цинка $\Delta \overline {S_{{{\text{Ca}}}}^{{{\text{см}}}}} ,$ $\Delta \overline {S_{{{\text{Zn}}}}^{{{\text{см}}}}} $ найдены дифференцированием парциальной энергии смешения Гиббса $\Delta \overline {G_{i}^{{{\text{см}}}}} $ по температуре: $\frac{{\partial G_{i}^{{{\text{см}}}}}}{{\partial T}}$ = $ - \Delta \overline {S_{i}^{{{\text{см}}}}} $ с последующим вычислением парциальных энтальпий смешения $\Delta \overline {H_{{{\text{Ca}}}}^{{{\text{см}}}}} ,$ $\Delta \overline {H_{{{\text{Zn}}}}^{{{\text{см}}}}} ,$ где $\frac{{\partial G_{i}^{{{\text{исп}}}}}}{{\partial T}}$ = –RT ln ai.
Парциальные функции энтропии испарения $\Delta \overline {S_{{{\text{Ca}}}}^{{{\text{исп}}}}} ,$ $\Delta \overline {S_{{{\text{Ca}}}}^{{{\text{исп}}}}} $ найдены дифференцированием парциальной энергии испарения Гиббса $\Delta \overline {G_{i}^{{{\text{исп}}}}} $ = –RT ln ai по температуре: $\frac{{\partial G_{i}^{{{\text{исп}}}}}}{{\partial T}}$ = $ - \Delta \overline {S_{i}^{{{\text{исп}}}}} $ с последующим вычислением изменения парциальной энтальпии испарения компонентов $\Delta \overline {H_{{{\text{Ca}}}}^{{{\text{исп}}}}} ,$ $\Delta \overline {H_{{{\text{Zn}}}}^{{{\text{исп}}}}} ,$ составляющих систему. Интегральные характеристики определены суммированием долей парциальных функций.
Границы полей сосуществования расплава и пара рассчитывали на основании парциальных величин давления насыщенного пара составляющих сплава. При этом за температуру кипения расплава принимали температуру, при которой сумма парциальных давлений пара кальция и цинка равна атмосферному или другому, соответствующему условиям вакуумных технологий.
Состав паровой фазы (концентрацию кальция ${{y}_{{{\text{Ca}}}}}$ и цинка ${{y}_{{{\text{Zn}}}}}$) при температуре кипения определяли на основании уравнения Клапейрона–Менделеева как:
где ${{n}_{{{\text{Ca}}}}}$ и ${{n}_{{{\text{Zn}}}}}$ – число молей кальция и цинка в паровой фазе; ${{p}_{{{\text{Ca}}}}}$ и ${{p}_{{{\text{Zn}}}}}$ – парциальные давления насыщенного пара кальция и цинка, Па.
Вследствие того, что снижение температуры при понижении давления от атмосферного (101 325 Па) с переходом в высокий вакуум (0.01 Па) составляет, по нашим расчетам [23], 5.6 × 10–3°С, уменьшение температуры фазовых переходов конденсированных систем при низком давлении при построении диаграммы не учитывалось. Границы фазовых переходов жидкость–пар в вакууме нанесены на диаграммы, на которых границы существования конденсированных фаз определены при атмосферном давлении.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Величины давления насыщенного пара над элементным кальцием $\left( {p_{{{\text{Ca}}}}^{^\circ }} \right),$ определенные нами методом точек кипения, приведены в табл. 1 и соответствуют зависимости: $\ln p_{{{\text{Ca}}}}^{^\circ }\,\,[{\text{Па}}]$ = (22.046 ± ± 1.272) – (18 483 ± 1066)T–1, откуда температура кипения при атмосферном давлении равна 1484°С (1757 K). Полученные значения сильно отличаются от данных [15] и хорошо совпадают с результатами [8, 16, 17]. В частности, температура кипения кальция, определенная аналогичным образом [8], соответствует 1494°С, а в работе [17], где выполнена коррекция справочных данных с целью согласования температуры и теплоты испарения с температурной зависимостью давления пара простых веществ, равна 1484°С. Хорошее согласование величин давления пара кальция, по нашим данным и результатам [8, 16, 17], свидетельствует о достаточной надежности выполненных определений.
Таблица 1.
Давление пара жидкого кальция
| Температура, K (оС) | Давление пара Ca, кПа (мм рт. ст.) | Погрешность аппроксимации, отн. % | |
|---|---|---|---|
| эксперимент | расчет | ||
| 1273 (1000) | 1.73 (13) | 1.857 (13.9) | –6.84 |
| 2.00 (15) | +7.70 | ||
| 1.73 (13) | –6.84 | ||
| 2.13 (16) | +14.70 | ||
| 1473 (1200) | 13.07 (98) | 13.335 (100.0) | –1.99 |
| 12.93 (97) | –3.04 | ||
| 14.00 (105) | +4.99 | ||
| 13.33 (100) | –0.04 | ||
| |Δср| = 5.77 | |||
Величины парциального давления насыщенного пара цинка (рZn) над сплавами с кальцием аппроксимированы зависимостью:
(1)
$\begin{gathered} \ln {{p}_{{{\text{Zn}}}}}\left[ {{\text{Па}}} \right] = \left( { - 14{\kern 1pt} 857x_{{{\text{Zn}}}}^{{\text{4}}} + 46{\kern 1pt} 122x_{{{\text{Zn}}}}^{{\text{3}}} - 52{\kern 1pt} 090x_{{{\text{Zn}}}}^{{\text{2}}}} \right. + \\ \left. { + \,\,28{\kern 1pt} 936{{x}_{{{\text{Zn}}}}} - 22{\kern 1pt} 365} \right){{T}^{{ - 1}}} + 8.189x_{{{\text{Zn}}}}^{{\text{4}}} - 9.574x_{{{\text{Zn}}}}^{{\text{3}}} - \\ - \,\,6.544x_{{{\text{Zn}}}}^{{\text{2}}} + 8.91{{x}_{{{\text{Zn}}}}} + 22.634 + \ln {{x}_{{{\text{Zn}}}}}, \\ \end{gathered} $(2)
$\begin{gathered} \ln {{p}_{{{\text{Ca}}}}}~\left[ {{\text{Па}}} \right] = \left( { - 14{\kern 1pt} 857x_{{{\text{Ca}}}}^{4} + 33{\kern 1pt} 115x_{{{\text{Ca}}}}^{3} - 22{\kern 1pt} 825x_{{{\text{Ca}}}}^{2} + } \right. \\ + \,\,\left. {2038{{x}_{{{\text{Ca}}}}} - 15{\kern 1pt} 954 + 3694\ln {{x}_{{{\text{Ca}}}}}} \right){{T}^{{ - 1}}} + 8.189x_{{{\text{Ca}}}}^{4} - \\ - \,\,34.101x_{{{\text{Ca}}}}^{3} + 48.641x_{{{\text{Ca}}}}^{2} - 27.592{{x}_{{{\text{Ca}}}}} + \\ + \,\,26.909 + 0.856\ln {{x}_{{{\text{Ca}}}}}. \\ \end{gathered} $Величины давления пара элементного цинка при разных температурах определены нами ранее [24] и совместно с экспериментально найденными и рассчитанными по уравнениям (1), (2) величинами давления пара цинка и кальция над растворами приведены в табл. 2. Общая погрешность определений вычислена как сумма погрешностей независимых измерений, %: температуры – 1, взвешивания – 0.1, давления – 0.5, аппроксимации экспериментальных данных – 5.13 и равна 6.73.
Таблица 2.
Давление пара цинка и кальция в системе цинк–кальций
| Содержание в сплаве, мол. д. | Температура, K (°С) | Давление пара Zn, кПа | Давление пара Ca (раcчет), кПа | Погрешность аппроксимации, отн. % | ||
|---|---|---|---|---|---|---|
| Zn | Ca | эксперимент | раcчет | |||
| 1.0 | – | 873 (600) | 1.47 | 1.46 | – | +0.55 |
| 1.33 | –9.03 | |||||
| 1.60 | +9.45 | |||||
| 1073 (800) | 30.80 | 30.66 | – | +0.45 | ||
| 29.33 | –4.34 | |||||
| 32.00 | +4.37 | |||||
| 0.8503 | 0.1497 | 1023 (750) | 10.26 | 10.01 | 1.36 × 10–5 | +2.53 |
| 9.33 | –6.77 | |||||
| 9.13 | –8.76 | |||||
| 1173 (900) | 65.33 | 63.92 | 1.88 × 10–3 | +2.21 | ||
| 61.81 | –3.29 | |||||
| 56.69 | –11.30 | |||||
| 0.7047 | 0.2953 | 973 (700) | 34.20 | 3.61 | 5.76 × 10–4 | –5.18 |
| 38.10 | +5.63 | |||||
| 36.30 | +0.64 | |||||
| 1173 (900) | 51.87 | 53.27 | 2.33 × 10–2 | –2.63 | ||
| 54.40 | +2.12 | |||||
| 53.55 | +0.52 | |||||
| 0.5446 | 0.4554 | 973 (700) | 2.13 | 2.33 | 1.17 × 10–3 | –8.58 |
| 2.27 | –2.58 | |||||
| 2.53 | +8.58 | |||||
| 1223 (950) | 62.13 | 66.19 | 8.08 × 10–2 | –6.14 | ||
| 65.46 | –1.11 | |||||
| 71.40 | +7.06 | |||||
| 0.3612 | 0.6388 | 1173 (900) | 11.33 | 11.56 | 1.02×10–1 | –1.99 |
| 12.13 | +4.93 | |||||
| 11.24 | –2.81 | |||||
| 1273 (1000) | 34.26 | 35.60 | 3.78 × 10–1 | –3.76 | ||
| 34.13 | –4.13 | |||||
| 38.41 | +7.89 | |||||
| 0.1707 | 0.8293 | 1173 (900) | 0.53 | 0.49 | 0.30 | +8.16 |
| 0.40 | –18.03 | |||||
| 0.48 | –1.64 | |||||
| 1273 (1000) | 1.60 | 1.71 | 1.08 | –6.49 | ||
| 1.73 | +1.11 | |||||
| 1.87 | +9.29 | |||||
| |Δср| = 5.13 | ||||||
Из анализа данных табл. 2 видно, что наше допущение о преобладающем количестве цинка в паровой фазе верно при понижении концентрации цинка в расплаве до 36.12 ат. % – концентрация кальция в паре не превышает 0.9–1.0 ат. %, что значительно ниже погрешностей эксперимента. При концентрации Zn в расплаве 17.07 ат. % (остальное кальций) количество цинка в паровой фазе снижается до 62.0–1.3 ат. %. Для жидких растворов цинк–кальций характерно сильное отрицательное отклонение от закона Рауля. Расчетная величина активности цинка (аZn) в расплаве указанной концентрации при 1173 K (900°С) и в паровой фазе, полностью представленной цинком, равна 5 × 10–3. Снижение в паре реального содержания цинка до 62.0–61.3 ат. % влечет за собой уменьшение аZn до (3.05–3.06) × 10–3, что практически незначимо и в дальнейших расчетах не учитывалось.
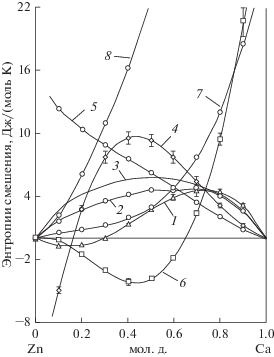
Интегральные и парциальные термодинамические функции смешения – изменения энтропии и энтальпии, рассчитанные на основании величин активности компонентов сплава, – отображены на рис. 1, 2. Там же приведены термодинамические функции, рассчитанные нами на основании данных работ [2, 8].
Рис. 2.
Зависимость интегральной (1) и парциальных (2, 3) энтальпий смешения от состава сплава: 2 – кальция; 3 – цинка.
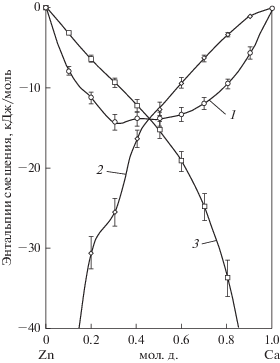
Видно, что образование сплавов сопровождается значительным упорядочением в системе по сравнению с идеальным раствором до концентрации ~70 ат. % Са в сплаве и незначительным увеличением беспорядка при превышении указанной концентрации. Парциальная энтропия смешения кальция в указанном интервале имеет отрицательную величину, что свидетельствует о присутствии в жидком сплаве ассоциатов и согласуется с наличием ряда конденсированных интерметаллических соединений кальция и цинка на диаграмме состояния. Результаты исследования [2] расположены значительно выше интервала погрешностей при определении интегральной функции в нашем исследовании, а значения парциальной энтропии смешения цинка, рассчитанные нами на основании данных [8], значительно превышают величины для идеального раствора. Последнее не соответствует упорядочению при наличии соединений Са с Zn и не коррелирует с отрицательными величинами энтальпии смешения (рис. 2), свидетельствующими об экзотермическом характере образования сплавов.
Термодинамические функции испарения, рассчитанные на основании парциального давления насыщенного пара компонентов, приведены на рис. 3, 4.
Рис. 3.
Зависимость интегральных (1, 2) и парциальных (3–6) энтропий испарения от состава сплава: 3, 4 – кальция; 5, 6 – цинка; 1, 3, 5 – наши данные; 2, 4, 6 – [2].
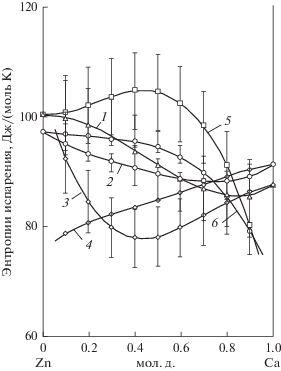
Рис. 4.
Зависимость интегральных (1, 2) и парциальных (3, 4) энтальпий испарения от состава сплава: 3 – кальция; 4 – цинка; 2 – [2].
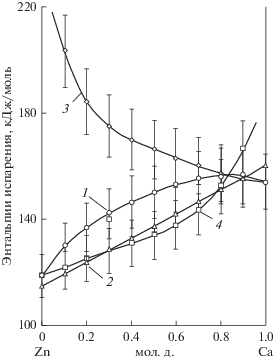
Кривые зависимостей интегральных функций испарения при концентрации кальция ~85 ат. % содержат экстремумы: минимум изменения энтропии 85.5 ± 5.7 Дж/(моль K) и максимум энтальпии 156.4 ± 10.5 кДж/моль, что близко, как будет показано ниже, к составу обнаруженной азеотропной смеси (93.2 ат. % Са). Минимум энтропии на кривой, рассчитанной на основании результатов исследования [2], значительно смещен в область меньших концентраций кальция.
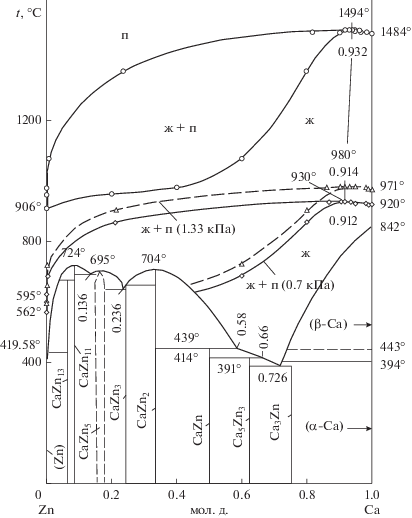
На основании температурно-концентрационных зависимостей величин парциального давления насыщенного пара компонентов расплава рассчитаны границы полей сосуществования жидкости и пара системы Zn–Ca с дополнением диаграммы состояния [4, 5] фазовыми переходами жидкость–пар (рис. 5) при атмосферном (101.33 кПа) и низких давлениях, соответствующих условиям вакуум-термических технологий (1.33 и 0.7 кПа).
При расчете состава паровой фазы использованы величины парциального давления пара из аппроксимирующей зависимости для цинка и уравнения зависимости давления пара кальция, найденные в результате интегрирования уравнения Гиббса–Дюгема.
На фазовой диаграмме при атмосферном давлении присутствует азеотропная смесь, имеющая в своем составе 93.2 ± 6.3 ат. % Са, с температурой кипения 1494°С. Понижение давления до 1.33 и 0.7 кПа сопровождается сдвигом состава азеотропной смеси в сторону более высокой концентрации цинка, что находится в соответствии со вторым законом Вревского [25]: если давление системы раствор–пар имеет минимум, то при повышении температуры в азеотропной смеси возрастает концентрация того компонента, парциальная молярная теплота испарения которого меньше. В нашем случае парциальная энтальпия испарения кальция (153.7 ± 8.9 кДж/моль) больше, чем цинка (118.6 ± 8.0 кДж/моль).
Состав нераздельно кипящей жидкости при 1.33 кПа соответствует 91.4 ± 6.1 ат. % кальция при температуре кипения 980°С, а при 0.7 кПа – 91.2 ± 6.1 ат. % кальция при 930°С.
Температура кипения нераздельно кипящих металлических растворов $\left( {t_{{\text{к}}}^{{{\text{аз}}}}} \right)$ понижается с уменьшением давления в системе и линейно зависит от изменения состава азеотропа ($x_{{{\text{Ca}}}}^{{{\text{аз}}}},$ мольная доля кальция в сплаве): $t_{{\text{к}}}^{{{\text{аз}}}}$(°С) = –28 341$x_{{{\text{Ca}}}}^{{{\text{аз}}}}$ + + 3419.8 и $T_{{\text{к}}}^{{{\text{аз}}}}$ (K) = 28 341$x_{{{\text{Ca}}}}^{{{\text{аз}}}}$ – 3692.8.
Исходя из границ областей сосуществования жидкости и пара при низких давлениях на диаграмме состояния, разделение системы цинк–кальций на элементы дистилляцией не может быть технологически реализовано. Возможно разделение сплавов цинкового края диаграммы состояния на элементный цинк и азеотропную смесь при повторении циклов дистилляция–конденсация. Дистилляционное разделение сплавов с большей концентрацией кальция, чем состав нераздельно кипящих растворов, практически невозможно из-за вырожденной по температуре области сосуществования расплава и пара.
ЗАКЛЮЧЕНИЕ
На основании парциальных величин давления пара кальция и цинка, определенных методом точек кипения (изотермический вариант), рассчитаны парциальные и интегральные термодинамические функции смешения и испарения расплавов системы цинк–кальций, представленные в виде графических зависимостей для всего интервала концентраций.
Образование сплавов сопровождается значительным упорядочением в системе по сравнению с идеальным раствором до концентрации ~70 ат. % Са в сплаве и незначительным увеличением беспорядка более указанной концентрации. Парциальная энтропия смешения кальция в указанном интервале имеет отрицательную величину, что свидетельствует о присутствии в жидком сплаве ассоциатов и согласуется с наличием ряда конденсированных интерметаллических соединений кальция и цинка на диаграмме состояния.
Энтальпия смешения отрицательна во всем интервале концентраций элементов системы, что свидетельствует об экзотермическом характере образования сплавов.
На основании данных о величине давления насыщенного пара компонентов сплава диаграмма состояния Zn–Са дополнена полями сосуществования жидкости и пара при атмосферном давлении (101.33 кПа) и в вакууме (1.33 и 0.7 кПа). Обнаружено существование нераздельно кипящей при температуре 1494°С жидкости с концентрацией кальция 93.2 ат. %. С понижением давления (температуры кипения) состав азеотропной смеси смещается в сторону цинкового края диаграммы состояния, что согласуется с законами Вревского.
Расположение границ полей парожидкостного равновесия свидетельствует о невозможности дистилляционного разделения системы Zn–Са на металлы дистилляцией.
Список литературы
Schulze G.E.R., Werncke U. // Monatsberichte der Deutschen Akademie der Wissenschaften. 1963. Bd. 5. H. 2. S. 68.
Chiotti P., Hecht R.J. // Trans. Met. Soc. 1967. V. 239. № 4. P. 536.
Бурылев Б.П. // Термодинамические и термохимические константы. М.: Наука, 1970. С. 32.
Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.: Наука, 1979. Т. 4. 576 с.
Диаграммы состояния двойных металлических систем / Под ред. Лякишева Н.П. М.: Машиностроение, 1996. Т. 1. 992 с.
Hultgren R., Desai P.D., Hawkins D.T. et al. Selected Values of the Thermodynamic Properties of Binary Alloys. N.Y.: ASM, 1973. 558 p.
Журавлев В.И., Волкович А.В., Жирков Г.Н. // Физ. химия и электрохимия редк. и цв. мет.: Тез. докл. 7 кол. семин. Апатиты, 1992. С. 38.
Yong Nian Dai, Bing Yang. Vacuum Metallurgy of Non-Ferrous Metals. Beijing: Metallurgical Ind. Press, 2000. V. 3. 547 p.
Brubaker C.O., Zi-Kui Liu // Calpad. 2001. V. 25. № 3. P. 381. https://doi.org/10.1016/S0364-5916(01)00057-8
Yu Zhong, Koray Ozturk, Zi-Kui Liu // J. Phase. Equilbria. 2003. V. 24. № 4. P. 340.
Spencer P.J., Pelton A.D., Youn-Bae Kang et al. // Calpad. 2008. V. 32. № 2. P. 423. https://doi.org/j.calphad.200803.01
Штенберг М.В., Бычинский В.А., Королева О.И. и др. // Журн. неорган. химии. 2017. Т. 62. № 11. С. 1470. https://doi.org/10.7868/S0044457X17110071
Шилов И.Ю., Лященко А.К. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 1006. https://doi.org/10.1134/S0044457X19090216
Мурадов В.Г. // Ученые записки Ульяновского государственного педагогического института. 1964. Т. 18. № 5. С. 64.
Schürmann E., Schmid R. // Arch. Eisenhüttenw. 1975. Bd. 46. № 12. S. 773.
Глазов В.М., Лазарев В.Б., Жаров В.В. Фазовые диаграммы простых веществ. М.: Наука, 1980. 63 с.
Малышев В.П., Турдукожаева А.М., Оспанов Е.А., Саркенов Б. Испаряемость и кипение простых веществ. М.: Научный мир, 2010. 304 с.
Володин В.Н., Храпунов В.Е., Кенжалиев Б.К.и др. // Изв. вузов. Цветн. металлургия. 2005. № 3. С. 22.
Володин В.Н., Тулеушев Ю.Ж. // Журн. физ. химии. 2020. Т. 94. № 7. С. 975.
Володин В.Н., Тулеушев Ю.Ж., Бурабаева Н.М., Kerimshe A.S. // Журн. неорган. химии. 2020. Т. 65. № 5. https://doi.org/0.31857/S0044457X20050256
Rao Y.K. // Met. Trans. 1983. V. B14. № 1–4. P. 308.
Морачевский А.Г. Термодинамика расплавленных металлических и солевых систем. М.: Металлургия, 1987. 240 с.
Clark J.B., Richter P.W. // High Pressure Sci. and Technol. Proc. 7th Int. AIRAPT Conf. Le Creusot, 1979. V. 1. Oxford, 1980. P. 363.
Володин В.Н., Храпунов В.Е., Марки И.А. // Журн. физ. химии. 2011. Т. 85. № 7. С. 1392.
Вревский М.С. Работы по теории растворов. М.–Л.: Изд-во АН СССР, 1953. 335 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии