Журнал неорганической химии, 2020, T. 65, № 7, стр. 990-994
Влияние аниона соли на экстракцию лития в системах LiX–H2O–бензо-15-краун-5–CHCl3, где X = Br–, ${\mathbf{ClO}}_{{\mathbf{4}}}^{ - },$ SCN–
А. А. Бездомников a, *, С. В. Демин a, b, А. Ю. Цивадзе a, b
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: jlexarus@yandex.ru
Поступила в редакцию 14.01.2020
После доработки 13.02.2020
Принята к публикации 03.03.2020
Аннотация
Впервые получены данные по экстракции солей лития и распределению экстрагента в системах LiX–H2O–бензо-15-краун-5–CHCl3, где X = Br–, ${\text{ClO}}_{4}^{ - },$ SCN–, в широком диапазоне концентраций солей и экстрагента. Определена растворимость бензо-15-краун-5-эфира в воде в интервале температур 25–60°С и изотерма распределения краун-эфира между хлороформом и водой при комнатной температуре.
ВВЕДЕНИЕ
Литий – распространенный химический элемент, встречающийся в природе в виде смеси изотопов лития-6 и лития-7. Литий-6 хорошо взаимодействует с тепловыми нейтронами, что позволяет использовать его в термоядерных процессах [1]. Литий-7 практически инертен по отношению к тепловым нейтронам, а расплавы его солей являются высокоэффективными теплоносителями, поэтому его соединения можно использовать в активной области водо-водяных и жидкосолевых ядерных реакторов [2]. Из-за различия физических свойств этих изотопов соли лития, которые используют в ядерной энергетике, необходимо обогатить литием-7 от природных ≈92.4 до 99.99% в случае водо-водяных реакторов и 99.995% в случае жидкосолевых реакторов. В последние годы благодаря активному развитию ядерной энергетики в Китае спрос на обогащенный литий-7 растет и в будущем будет расти еще бóльшими темпами из-за ввода в строй жидкосолевых реакторов. Эти обстоятельства требуют новых мощностей для разделения изотопов лития. Единственная на сегодня работающая технология, основанная на COLEX-процессе, использующем ртуть, неэкологична [3]. Наиболее перспективным является экстракционное разделение изотопов лития краун-эфирами [4].
Процесс разделения изотопов лития экстракцией краун-эфирами основан на различии комплексообразования двух изотопов в органической фазе. Фаза, в которой образуется комплекс, обогащается легким изотопом. Большая часть работ по данной тематике учитывает, что в органической фазе может оставаться незакомплексованный лиганд. Предполагается, что это не влияет на изотопный эффект. Учитывают также присутствие соли в органической фазе в виде ионной пары, что должно снижать изотопный эффект. В первом приближении концентрацию ионной пары можно приравнять к холостой экстракции растворителем. В данной работе учитывали еще и переход экстрагента бензо-15-краун-5 (Б15К5) в водную фазу, что делает возможным образование в ней комплекса и может быть причиной снижения изотопного эффекта. В последние годы выпущено множество работ на эту тему [5–11], но крайне мало количество статей, в которых определялся переход экстрагента (Б15К5) в водную фазу в процессе экстракционного разделения изотопов лития. В литературе переход, как правило, определялся только при низких концентрациях экстрагента [12–14]. Авторы [15] определяли переход экстрагента в широком диапазоне концентраций соли, но рассматривали только LiCl с 1 М раствором Б15К5. Опубликованные ранее изотермы экстракции LiCl [16] указывают на то, что рост перехода лития в органическую фазу происходит только в диапазоне концентраций от 5 моль/л по литию с выходом на плато при 10 моль/л. С практической точки зрения это означает, что процесс разделения изотопов лития в системе с хлоридом лития должен проводится при высоких концентрациях соли, что приводит к большой разнице потоков водной и органической фаз, а также к возможной нестабильности экстракционных систем из-за высокой вязкости растворов и риска выпадения осадка. Особенно критичной является область концентраций соли от 6 до 9 моль/л по литию, где оказывается максимум потерь, обнаруженный в работе [15] для концентрации Б15К5 1 моль/л. Это накладывает дополнительные концентрационные ограничения, смещая область рабочих концентраций в сторону более насыщенных растворов, что усиливает недостатки системы с хлоридом лития. Если не учитывать переход экстрагента в водную фазу, то будут наблюдаться большие потери экстрагента, что может привести к снижению изотопного эффекта.
Анион напрямую не должен влиять на изотопный эффект [17–19], но определяет экстракцию соли. Согласно литературным данным, лучше всего экстрагируются соли лития, анионы которых имеют наименьшую энергию гидратации и наибольший ионный радиус [20]. Из этого ряда можно исключить CH3COOLi [15] из-за низкой экстракции. Также можно исключить тетрафтороборат лития из-за его химической нестабильности и высокой цены [21]. В итоге остаются галогениды лития (кроме фторида), перхлорат и тиоцианат лития.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В качестве экстрагента использовали бензо-15-краун-5 эфир ≥98%, а в качестве солей – безводный LiBr ≥99% (Sigma Aldrich), LiClO4 тригидрат (Alfa Aesar), LiSCN ≥98% (Sigma Aldrich). В экспериментах использовали дистиллированную воду. В качестве органического растворителя применяли химически чистый хлороформ, стабилизированный 0.2–0.5 мас. % этанола (ЭКОС-1).
Водные растворы солей с различными концентрациями смешивали c хлороформными растворами Б15К5 в течение 1 ч, фазы разделяли после часового отстаивания. Из полученного экстракта соль реэкстрагировали избытком воды. Методом пламенной фотометрии на приборе ФПА-2-01 определяли равновесные концентрации лития в рафинате и реэкстракте. Таким образом были определены изотермы экстракции для солей в широком диапазоне концентраций от разбавленных до насыщенных растворов. Помимо концентрации соли варьировали концентрацию экстрагента от 0.78 до 1.5 моль/л.
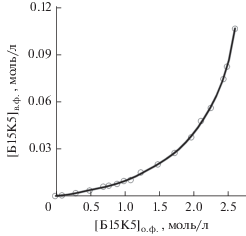
Переход Б15К5 в водную фазу в процессе экстракции определяли с помощью УФ-спектрофотометрии по характеристичному пику бензольного кольца на длине волны 274 нм на приборе Jasco V-730 (UF-VIS спектрофотометр). Для лучшего понимания процесса перехода Б15K5 в водную фазу определяли его растворимость в воде, а также распределение Б15К5 в системе хлороформ–вода в соотношении 1 : 1 (рис. 1). Растворимость в воде в диапазоне 25–50°C растет от 0.10 до 0.12 моль/л, а при нагревании до 60°C наблюдается резкий рост растворимости до 0.17 моль/л. Колебания комнатной температуры практически не влияют на концентрацию экстрагента в водной фазе.
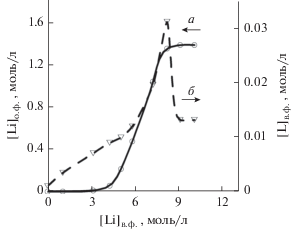
Как упоминалось выше, системы с хлоридом лития имеют ряд серьезных недостатков. На первый взгляд, для исключения недостатков систем с хлоридом лития достаточно использовать бромид или иодид. В литературе есть данные по иодиду лития [21]. Действительно, экстракция данной соли идет существенно лучше, чем экстракция LiCl, при сохранении высоких изотопных эффектов. Однако LiI имеет существенные недостатки, вытекающие из его физико-химических свойств: долгое расслаивание фаз, инверсия фаз при $C_{{{\text{Li}}}}^{{{\text{орг}}}}$ = = 0.7 моль/л, $С_{{{\text{Li}}}}^{{\text{в}}}$ = 4.3 моль/л и окисление иода.
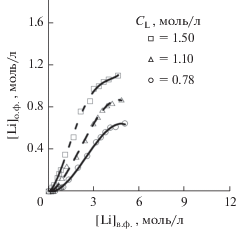
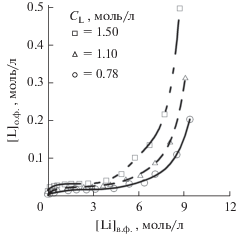
Бромид лития, по результатам наших экспериментов (рис. 2а), как и ожидалось, занял промежуточную позицию между хлоридом и иодидом лития. Во-первых, наблюдается инверсия фаз при $C_{{{\text{Li}}}}^{{{\text{орг}}}}$ = 1.0 моль/л, $С_{{{\text{Li}}}}^{{\text{в}}}$ = 7.5 моль/л, во-вторых – долгое расслаивание фаз (в сравнении с системами с хлоридом лития). Помимо этого, согласно нашим данным по переходу экстрагента в воду (рис. 2б), имеют место крайне высокие потери экстрагента, что в сочетании с высокой стоимостью соли и ее слабой устойчивостью к окислению безоговорочно исключает LiBr из дальнейшего рассмотрения.
Рис. 2.
Изотерма экстракции LiBr, концентрация Б15К5 1.1 моль/л (а); переход Б15К5 в водную фазу в процессе экстракции LiBr (б).
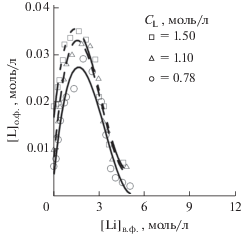
Использование LiClO4 решает основные проблемы системы с хлоридом лития. Изотермы экстракции (рис. 3) позволяют сделать вывод, что хорошая экстракция наблюдается уже при низких концентрациях соли по литию, рост концентрации экстрагента увеличивает экстракцию пропорционально. Данные по равновесной концентрации Б15К5 в водной фазе (рис. 4) свидетельствуют о незначительных потерях экстрагента в процессе экстракции, которые даже в максимуме не превышают 2.7% от исходной концентрации экстрагента. Столь низкий переход экстрагента по сравнению с хлоридом лития, скорее всего, связан с большим ионным радиусом аниона и его относительно низкой растворимостью в обеих фазах, что приводит к “высаливанию” экстрагента из водной фазы. Низкий запас растворимости может приводить к выпадению осадка в процессе экстракции.
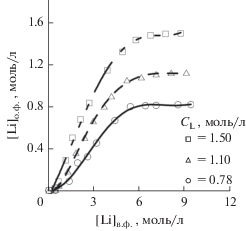
Из полученных изотерм экстракции (рис. 5) следует, что LiSCN имеет похожую экстракцию с перхлоратом лития. Однако тиоцианат лития имеет больший запас растворимости, что позволяет работать в диапазоне концентраций от 1 до 5 моль/л по литию без недостатков, свойственных системам с хлоридом и перхлоратом лития. Резкое увеличение перехода экстрагента (рис. 6) в водную фазу наблюдается при концентрациях более 5 моль/л по литию. Так как хорошая степень экстракции достигается до 5 моль/л по литию, то на практике большие потери экстрагента можно избежать.
ЗАКЛЮЧЕНИЕ
В ряду галогенидов от хлорида к иодиду экстракция улучшается, но из-за роста молекулярной массы наблюдается инверсия фаз при высоких концентрациях соли. Потери Б15К5 при этом проходят через максимумы. Помимо этого, бромид и иодид нельзя использовать из-за низкой стойкости к окислению.
Наиболее перспективными солями для разделения изотопов лития в экстракционных системах типа вода–соль–хлороформ–Б15К5 являются перхлорат и тиоцианат лития. Основные преимущества этих солей перед хлоридом лития – высокая степень экстракции при низких концентрациях и слабый переход экстрагента в водную фазу в рабочем диапазоне концентраций. Высокая степень экстракции позволяет реализовать технологический процесс разделения изотопов лития при близких потоках, а низкий переход экстрагента в водную фазу не только снижает затраты на экстрагент, но и должен поддерживать изотопные эффекты, близкие к теории.
Список литературы
Giegerich T., Battes K., Schwenzer J.C., Day C. // Fusion Eng. Des. 2019. V. 149. P. 111339. https://doi.org/10.1016/j.fusengdes.2019.111339
Forsberg C., Zheng G., Ballinger R., Lam S. // Nucl. Technol. 2019. P. 1. https://doi.org/10.1080/00295450.2019.1691400
Brooks S.C., Southworth G.R. // Environ. Pollut. 2011. V. 159. №1. P. 219. https://doi.org/10.1016/j.envpol.2010.09.009
Ault K.B.T., Brozek K., Fan L. et al. // Lithium Isotope Enrichment. 2012. P. 1.
Yakshin V.V., Zhilov V.I., Demin S.V. et al. // Comptes Rendus Chimie. 2007. V. 10. № 10–11. P. 1020. https://doi.org/10.1016/j.crci.2007.02.007
Xiao J., Ji Y., Shi C. et al. // J. Mol. Liq. 2016. V. 223. P. 1032.
Demin S.V., Fatyushina E.V., Zhilov V.I. et al. // Russ. J. Inorg. Chem. 2008. V. 53. № 7. Р. 1149. [Демин С.В., Фатюшина Е.В., Жилов В.И. и др. // Журн. неорган. химии. 2008. Т. 53. № 7. С. 1234.]https://doi.org/10.1134/S0036023608070280
Pengrui Z., Mingyong W., Jinhe S. et al. // Chem. Lett. 2019. V. 48. P. 1541. https://doi.org/10.1246/cl.190669
Krivorotko E.S., Ivanova I.S., Pyatova E.N. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 3. Р. 384. [Криворотько Е.С., Иванова И.С. Пятова Е.Н. и др. // Журн. неорган. химии. 2016. Т. 61. № 3. С. 403.]https://doi.org/10.1134/S0036023616030141
Kudo Y., Tomokata S. // J. Mol. Liq. 2018. V. 249. P. 904. https://doi.org/10.1016/j.molliq.2017.11.098
Torrejos R.E.C., Nisola G.M., Lawagon C.P. et al. // Hydrometallurgy. 2016. V. 164. P. 362. https://doi.org/10.1016/j.hydromet.2016.05.010
Takeda Y., Hashimoto K., Yoshiyama D., Katsuta S. // J. Inclusion Phenomena Macrocyclic Chem. 2002. V. 42. P. 313. https://doi.org/10.1023/a:1016042402828
Zakurdaeva O.A., Asachenko A.F., Topchiy M.A., Nesterov S.V. // J. Radioanal. Nucl. Chem. 2018. V. 316. № 2. P. 535. https://doi.org/10.1007/s10967-018-5773-9
Nishizawa K., Ishino S., Watanabe H. // J. Nucl. Sci. Technol. 1984. V. 21. № 9. P. 694.
Kostikova G.V., Maltseva I.E., Krasnova O.G. et al. // Russ. Chem. Bull. 2018. V. 67. № 12. P. 2188. https://doi.org/10.1007/s11172-018-2353-7
Demin S.V., Zhilov V.I., Tsivadze A.Yu. // Russ. J. Inorg. Chem. 2015. V. 60. № 5. P. 633. [Демин С.В., Жилов В.И., Цивадзе А.Ю. // Журн. неорган. химии. 2015. Т. 60. № 5. С. 705.]https://doi.org/10.1134/S0036023615050046
Cui L., Yang X., Wang J. et al. // Chem. Eng. J. 2019. V. 358. P. 435. https://doi.org/10.1016/j.cej.2018.09.181
Жаворонков Н.М., Князев Д.А., Клински Г.Д. // Журн. физ. химии. 1978. Т. 52. № 4. С. 89.
Жаворонков Н.М., Князев Д.А., Ивлев А.А., Клинский Г.Д. // Успехи химии. 1980. Т. 49. № 3. С. 385.
Olsher U. // J. Am. Chem. Soc. 1993. V. 115. P. 3370. https://doi.org/10.1021/ja00061a062
Shokurova N.A., Demina L.I., Zhilov V.I. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 6. Р. 787. [Шокурова Н.А., Демина Л.И., Жилов В.И. и др. // Журн. неорган. химии. 2016. Т. 61. № 6. С. 824.]https://doi.org/10.1134/S0036023616060176
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии