Журнал неорганической химии, 2020, T. 65, № 8, стр. 1044-1054
Новый комплексообразующий минерально-органический носитель на основе оксигидроксида алюминия, модифицированного нитрилтри(метиленфосфоновой) кислотой
Т. Н. Кропачева a, *, А. Р. Газизянова a, Ф. З. Гильмутдинов b
a Удмуртский государственный университет
426034 Ижевск, ул. Университетская, 1, Россия
b Удмуртский федеральный исследовательский центр УрО РАН
426067 Ижевск, ул. им. Татьяны Барамзиной, 34, Россия
* E-mail: krop@uni.udm.ru
Поступила в редакцию 14.01.2020
После доработки 11.03.2020
Принята к публикации 31.03.2020
Аннотация
Предложен способ химического модифицирования поверхности оксигидроксида алюминия (бемит γ-AlO(OH)) комплексообразующим лигандом – нитрилтри(метиленфосфоновой) кислотой (НТФ). Методами РФА, РФЭС, ИК-спектроскопии исследован исходный и НТФ-модифицированный бемит, изучены кислотно-основные и комплексообразующие свойства НТФ на поверхности. Установлено, что в связывании с поверхностью бемита принимает участие одна из трех фосфоновых групп НТФ. Определена поверхностная концентрация и ступенчатые константы диссоциации привитой НТФ. Изучение зависимости сорбции Ni(II) от кислотности среды показывает, что модифицирующее покрытие увеличивает сорбционную способность бемита (смещение рН50 на одну единицу в область более низких значений). Сорбция ионов Ni(II) из водных растворов с позиции теории образования поверхностных комплексов может быть описана моделями, включающими комплексы состава ≡Al–ONi+ и ≡Al–ONi(OH) в случае бемита и ≡Al–LHi Nii–3 (i = 0, 1, 2, 3) в случае НТФ-бемита. Закрепление НТФ на поверхности приводит к уменьшению устойчивости комплексов Ni(II) по сравнению с их аналогами в растворах. Предложен механизм связывания ионов Ni(II) НТФ-бемитом. Полученный новый органоминеральный носитель может быть использован для закрепления ионов различных металлов, образующих устойчивые комплексы с фосфоновыми кислотами.
ВВЕДЕНИЕ
Минеральные носители на основе оксидов, оксигидроксидов и гидроксидов кремния (SiO2), железа (Fe3O4, γ-Fe2O3, α-FeO(OH)), алюминия (γ-Al2O3, γ-AlO(OH), α-Al(OH)3), марганца (MnO2), магния (MgO), цинка (ZnO), титана (TiO2) и др. служат подложками для закрепления на их поверхности ионов различных металлов, включая тяжелые, благородные, каталитически активные. Это является основой для использования (гидр)оксидных носителей в процессах сорбционной очистки загрязненных вод, концентрирования и разделения ионов металлов, получения нанесенных гетерогенных металлокатализаторов, синтеза фото-/электрохимически активных материалов и др. Для более эффективного удерживания ионов тяжелых металлов (Cu(II), Cd(II), Co(II), Ni(II), Pb(II), As(III), Cr(III), Zn(II), Mn(II), Hg(II) и др.) поверхность (гидр)оксидов может быть дополнительно химически модифицирована соединениями, функциональные группы которых проявляют более сильные или специфичные комплексообразующие свойства по сравнению с поверхностными ОН-группами исходных носителей [1, 2]. Одним из новых подходов к функционализации поверхности (гидр)оксидов является использование в качестве модификаторов различных фосфоновых кислот, содержащих в качестве якоря фосфоновую группу –РО(ОН)2 [3–7]. Для получения комплексообразующих носителей наряду с различными производными алкил/арилфосфоновых кислот, содержащими одну концевую комплексообразующую группу (–NH2, –COOH) [8, 9], более перспективными модификаторами могут быть фосфоновые комплексоны, которые помимо якорной –РО(ОН)2-группы содержат несколько других координационно-активных центров (–СООН, –ОН, –РО(ОН)2, атомы N), при связывании которых с ионами металлов могут образовываться устойчивые хелатные циклы. Большой ассортимент коммерчески доступных фосфоновых комплексонов (имино-N-уксусная-N-метиленфосфоновая кислота/N-фосфонометилглицин (ФМГ)/глифосат, имино-N,N-диуксусная-N-метиленфосфоновая кислота (ИДУМФ), 1-гидроксиэтилидендифосфоновая кислота (ОЭДФ), иминоди(метиленфосфоновая) кислота (ИДФ), N-гидроксиэтилимино-N,N-ди(метиленфосфоновая) кислота (ГЭИДФ) нитрилтри(метиленфосфоновая) кислота (НТФ), этилендиамин-N,N,N',N'-тетра(метиленфосфоновая) кислота (ЭДТФ), диэтилентриамин N,N,N',N'-пента(метиленфосфоновая) кислота (ДТПФ) и др.) значительно упрощает синтез подобных химически модифицированных (гидр)оксидов. В литературе имеются немногочисленные сведения по функционализации поверхности (гидр)оксидов (SiO2, Fe3O4, γ-Fe2O3, α-FeO(OH), γ-AlO(OH)) различными фосфоновыми комплексонами [10–15]. При этом не выяснены до конца вопросы о строении образующегося фосфонового покрытия, механизме связывания ионов металлов с модифицированной поверхностью и особенно о взаимосвязи между процессом комплексообразования ионов металлов со свободным и закрепленным на поверхности фосфоновым комплексоном. Среди различных (гидр)оксидов металлов удобными объектами для модификации являются оксиды Al2O3, оксигидроксиды AlO(OH) и гидроксиды Al(OH)3 алюминия ввиду их доступности, нетоксичности, большой удельной поверхности, химической устойчивости, высокой концентрации активных поверхностных центров, участвующих в связывании модификаторов [16]. В связи с этим целью настоящей работы было изучение условий модифицирования поверхности одного из оксигидроксидов алюминия (γ-AlO(OH), бемит) нитрилтри(метиленфосфоновой) кислотой (НТФ) и комплексное исследование физико-химических свойств полученного носителя (НТФ-бемит), включая протолитические и сорбционные характеристики по отношению к ионам никеля(II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения бемита γ-AlO(OH) использовали метод щелочного гидролиза соли алюминия, описанный в работе [17]. Для этого к водному раствору Al(NO3)3 · 9H2O (20.0 г в 50 мл воды) по каплям добавляли раствор NaOH (6.49 г в 30 мл воды) при постоянном перемешивании со скоростью ~3 мл/мин. Полученный аморфный осадок выдерживали при температуре 90°С в течение 4 ч, тщательно промывали дистиллированной водой до отрицательной реакции на ионы ${\text{NO}}_{3}^{ - }$ с дифениламином (чувствительность реакции 1–5 мкг ${\text{NO}}_{3}^{ - }$ в пробе), отфильтровывали, сушили на воздухе при 20°С и далее в сушильном шкафу при 220°С в течение 4 ч. Образование бемита происходит в результате дегидратации по схеме: Al(OH)3 · nH2O → байерит α-Al(OH)3 → гиббсит γ-Al(OH)3 → псевдобемит → бемит γ-AlO(OH).
В работе использовали коммерческий препарат НТФ (продукт АР 1, серия Cublen®, Zschimmer and Schwarz). Раствор комплексона (0.1 моль/л) готовили путем растворения навески препарата в дистиллированной воде с последующей стандартизацией методом потенциометрического титрования раствором щелочи. Модифицирование поверхности бемита проводили методом иммобилизации путем обработки навески бемита (1.0 г) раствором НТФ (0.1 моль/л, 10 мл) при 60°С в течение 3 ч. Далее сорбент отфильтровывали, тщательно промывали дистиллированной водой до рН 7 и сушили на воздухе (60°С, 2 ч). Для определения содержания привитой НТФ определяли остаточную концентрацию НТФ в фильтрате после предварительного окисления НТФ до фосфата. Для этого полученный фильтрат разбавляли в 104 раз, к полученному раствору объемом 50 мл добавляли 1 мл 30%-ной H2SO4, 0.4 г (NH4)2S2O8 и медленно упаривали на водяной бане до объема ~10 мл. Далее раствор переносили в колбу на 50 мл и определяли содержание фосфат-ионов спектрофотометрическим методом по реакции образования фосфорно-молибденовой сини. Измерение оптической плотности окрашенных растворов проводили на спектрофотометре UNICO 1201 при λ = 882 нм в кювете 5 см. Рассчитанное содержание НТФ на поверхности бемита составляет 0.83 (±0.02) ммоль/ г.
Для определения содержания гидроксогрупп на поверхности бемита использовали реакцию замещения фторид-ионами: ≡Al–OH + F– → ≡Al–F + + OH–. Для этого навеску бемита (0.05 г) помещали в раствор NaF (1 ммоль/л) объемом 50 мл (рН 5, установлен добавлением HNO3). Полученную суспензию перемешивали в течение 24 ч, затем сорбент отфильтровывали, а остаточную концентрацию фторид-ионов определяли с помощью фторид-селективного электрода ЭЛИТ 221 методом многократных стандартных добавок. Рассчитанная концентрация ОН-групп на поверхности бемита равна 0.92 (±0.01) ммоль/ г.
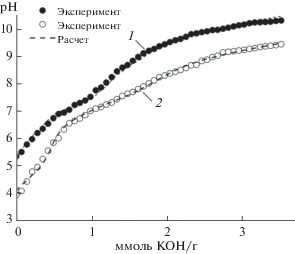
Изучение кислотно-основных свойств бемита/НТФ-бемита проводили методом потенциометрического титрования (иономер И-160 МИ) суспензии (концентрация 1 г/л) стандартным раствором KOH при температуре (20 ± 1)°С и постоянной ионной силе раствора (I = 0.1 моль/л, KCl). Математическую обработку кривых потенциометрического титрования проводили с использованием программы Hyperquad 2008 [18].
Для изучения зависимости сорбции Ni(II) на бемите/НТФ-бемите от кислотности среды к растворам NiCl2 (0.1 ммоль/л) c предварительно установленными исходными значениями рН (добавлением HCl/KOH) в присутствии фонового электролита (KCl) c общей ионной силой I = 0.1 моль/л добавляли навески сорбента (содержание 1 г/л). Суспензии встряхивали в течение 24 ч при температуре (20 ± 1)°С, затем сорбент удаляли центрифугированием, измеряли рН центрифугата (равновесный раствор) и определяли в нем остаточную концентрацию Ni(II) спектрофотометрическим методом по реакции образования окрашенного комплекса с диметилглиоксимом в щелочной среде в присутствии окислителя (йод). Измерение оптической плотности проводили на спектрофотометре UNICO 1201 при λ = 470 нм в кювете 5 см. Относительная погрешность методики определения составляет 10% [19]. Степень сорбции Ni(II) рассчитывали по формуле: Г(%) = 100(Со – С)/Со, где Со и С – исходная и равновесная концентрация раствора соответственно. Моделирование сорбционных кривых с позиций теории комплексообразования на поверхности было проведено с использованием программ Hyss и HypSpec [18].
Статическая обменная емкость НТФ-бемита по ионам Ni(II) была определена по изотерме сорбции, полученной для серии растворов с исходной концентрацией Ni(II) в диапазоне 10–4–10–3 моль/л при рН 6.5.
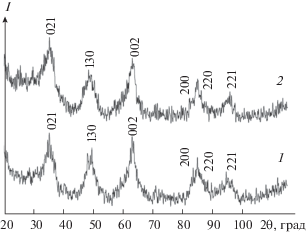
Рентгенодифракционные спектры порошков получали на рентгеновском дифрактометре ДРОН-3.0 в монохроматическом FeKα-излучении в интервале брэгговских углов 25°–115° в режиме пошагового сканирования с шагом 0.1° и временем экспозиции в точке 10 с. Для оценки среднего размера кристаллитов использовали формулу Дебая–Шеррера.
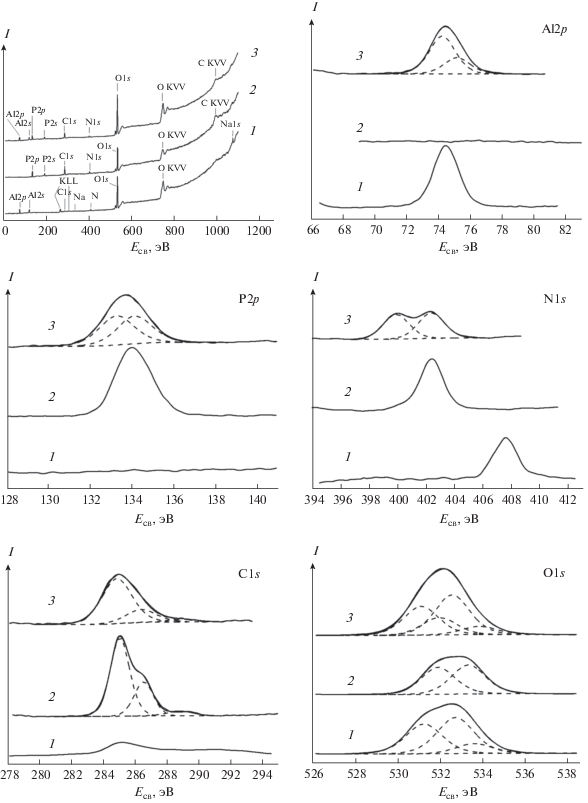
Рентгенофотоэлектронные спектры (РФЭС) измеряли на электронном спектрометре SPECS с использованием возбуждающего MgKα-излучения (hν = 1253.6 эВ) в режиме постоянной энергии пропускания 15 эВ энергоанализатора Phoibos-150. Измерения проводили при остаточном давлении в камере анализатора 2 × 10–9 Торр с использованием безмасляного насоса при температуре 293 K. Исследуемые порошки без какой-либо предварительной обработки наносили тонким слоем на поверхность чистого индия и устанавливали на молибденовом держателе таким образом, чтобы в зону РФЭС-анализа попадала только поверхность исследуемого порошка (окружность пятна диаметром 5 мм). Калибровку шкалы энергии связи спектрометра проводили по положению линии Au4f7/2 (Есв = 84.0 эВ). Погрешность в измерении энергии связи составляла ±0.1 эВ. Обработку результатов выполняли с использованием программного обеспечения CasaXPS. Линии спектров при разложении на компоненты аппроксимировали смешанной функцией Гаусса–Лоренца.
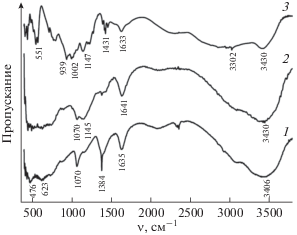
ИК-Фурье-спектры полученных образцов регистрировали на ИК-спектрометре ФСМ-2201 в диапазоне частот 400–4000 см–1 (шаг 2 см–1) в таблетках KBr. Для этого 2.5 мг образца измельчали в агатовой ступке с 250 мг KBr и прессовали таблетку с помощью ручного гидравлического пресса.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Положение и относительная интенсивность линий на дифрактограмме синтезированного оксигидроксда алюминия указывают на то, что его кристаллическая структура соответствует бемиту γ-AlO(OH) (ICPDS card 3-65). Химическая модификация поверхности бемита НТФ не приводит к изменению кристаллической решетки бемита (рис. 1). Рассчитанный по формуле Дебая–Шеррера размер кристаллитов бемита и НТФ-бемита одинаковый и составляет 23 ± 3 нм.
В ИК-спектре полученного бемита (рис. 2) присутствуют полосы при 476 и 623 см–1, обусловленные валентными колебаниями связи Al–O. Интенсивные полосы при 3600–3000 и 1635 см–1 относятся соответственно к валентным и деформационным колебаниям связей О–Н (ОН-группы бемита и сорбированная вода). Характерный для бемита узкий пик при 1070 см–1 относится к деформационным колебаниям водородных связей OH…OH межплоскостных гидроксогрупп [17]. Посторонний пик при 1384 см–1 связан с хемосорбированными ${\text{NO}}_{3}^{ - }$-ионами, поскольку прекурсором синтеза бемита является Al(NO3)3. В ИК-спектрах чистого препарата НТФ в области колебаний фосфоновой группы (900–1400 см–1) присутствуют характеристические полосы, относящиеся к валентным колебаниям фосфорильной группы Р=О (1147 см–1) и валентным асимметричным (1002 см–1) и симметричным (939 см–1) колебаниям связи P–O протонированных фосфоновых групп (–H2PO3, $ - {\text{HPO}}_{3}^{ - }$). Широкие полосы в области 2100–2300 и 2600–2800 см–1 относятся к валентным колебаниям P–OH [20]. В спектре бемита, модифицированного НТФ, по сравнению с исходным образцом наблюдается усиление поглощения в области колебаний фосфоновых групп с максимумом около 1145 см–1 (колебания связей Р=О и Р–ОAl [21]).
РФЭ-спектры образцов НТФ, бемита и НТФ-бемита представлены на рис. 3. Из сопоставления обзорных спектров отчетливо видно, что при закреплении НТФ на поверхности бемита наблюдается появление новых характерных линий, соответствующих углероду (С1s), фосфору (P2р) и азоту (N1s). Связывание НТФ с поверхностью бемита отражается в появлении в спектре Al2p спектральной компоненты с энергией связи Есв = 75.1 эВ (связь Al–OP) в дополнение к компоненте 74.3 эВ, характерной для связи Al–O в оксидах [20]. Для чистого препарата НТФ спектр Р2р представлен одной линией c Есв = 134.1 эВ, отвечающей эквивалентному состоянию атомов фосфора во всех трех фосфоновых группах молекулы НТФ. Спектр фосфора для НТФ, закрепленной на поверхности бемита, содержит две компоненты с энергиями связи 134.1 и 133.3 эВ с приблизительно равным вкладом. Два близких по положению пика в спектре Р2р наблюдали ранее для различных сорбированных фосфоновых комплексонов (глицин-N,N-ди(метиленфосфоновая) кислота на стали [22], имино-N,N-диуксусная-N-метиленфосфоновая кислота на Fe3O4 [12], НТФ на алюминии [23]). Можно допустить, что появление низкоэнергетической составляющей при закреплении НТФ на поверхности бемита связано с образованием нового состояния атомов фосфора при образовании химической связи P–OAl. Спектр N1s для препарата кристаллической НТФ состоит из одной компоненты 402.5 эВ, относящейся к протонированному третичному атому азота бетаиновой структуры комплексона. Для НТФ на поверхности бемита в спектре N1s присутствуют две близкие по интенсивности компоненты с Есв = 402.5 и 400.1 эВ. Появление дополнительной спектральной компоненты с Есв = 400.1 эВ может быть связано с образованием донорно-акцепторной связи между атомом азота НТФ и атомами алюминия поверхности, являющимися сильными центрами Льюиса. Схожие по положению спектральные компоненты в спектрах N1s наблюдались ранее для поверхностно-связанных фосфоновых комплексонов [12, 22, 23]. Пик N1s с Есв = 407.8 эВ в спектре чистого бемита относится к азоту хемосорбированных нитрат-ионов. При разложении спектра углерода C1s НТФ (свободной и связанной с поверхностью) выделено несколько компонент, главная из которых (285.1 эВ) отвечает метиленовым СН2-группам НТФ, а компоненты 286.5 и 288.9 эВ связаны с присутствием C–О- и С=О-состояний (загрязнение поверхности углеродсодержащими соединениями). Спектр кислорода O1s для чистого бемита может быть описан двумя составляющими: 531.0 эВ (Al–O) и 532.8 эВ (Al–OH) [20]. Два неэквивалентных состояния кислорода фиксируются для чистой НТФ: 531.5 эВ (P=O) и 533.0 эВ (P–OH). Основная компонента спектра O1s для НТФ-бемита Есв = 532.5 эВ, вероятно, связана с образованием на поверхности новой связи P–OAl; при этом остальные компоненты отвечают связям P–OH (533.4 эВ) и Al–O (531.2 эВ).
Таким образом, результаты исследований ИК- и РФЭ-спектров воздушно-сухих образцов бемита и НТФ-бемита показывают, что состояние НТФ на поверхности характеризуется наличием как связанных с поверхностью, так и свободных фосфоновых групп. Дальнейшие исследования свойств носителей проводили с образцами, находящимися в контакте с водной фазой, что не исключало изменения характера взаимодействия модификатора с поверхностью. Важнейшей характеристикой комплексообразующих носителей являются протолитические свойства привитых лигандов, для изучения которых используют титриметрические методы. Математическая обработка кривых кислотно-основного титрования носителей с привитыми соединениями является сложной задачей, решение которой должно учитывать наличие на поверхности электрического заряда, связанного с диссоциацией привитых групп, а также возможный вклад остаточных поверхностных групп, взаимодействие между привитыми группами, энергетическую неоднородность поверхности и др. [3, 11]. В настоящей работе моделирование кривых кислотно-основного титрования бемита и НТФ-бемита в условиях постоянной ионной силы раствора (I = 0.1 моль/л) выполнено с использованием простейшей неэлектростатической модели поверхности, т.е. без учета электростатического фактора, связанного с наличием на поверхности заряда. Подобная “псевдогомогенная” модель используется в литературе для описания протолитических свойств различных носителей наряду с более сложными моделями, учитывающими наличие двойного электрического слоя. При моделировании кривой потенциометрического титрования суспензии бемита стандартным раствором щелочи (рис. 4) учитывали амфотерные свойства поверхностных ОН-групп [16]: ≡AlOH + H+ ↔ $ \equiv {\kern 1pt} {\text{AlOH}}_{2}^{ + };$ ≡AlOH ↔ ↔ ≡AlO– + H+. Рассчитанные константы равновесий (табл. 1), а также точка нулевого заряда поверхности (рНТНЗ 8.5 ± 0.2) находятся в пределах значений, приводимых для бемита в литературе [16].
Таблица 1.
Протолитические свойства бемита и бемита, содержащего привитые группы НТФ (0.1 моль/л KCl, (20 ± 1)°С)
| Равновесие | lgK |
|---|---|
| Бемит | |
| ≡Al–O${\text{H}}_{2}^{ + }$ ↔ ≡Al–OH + H+ | –7.2 ± 0.1 |
| ≡Al–OH ↔ ≡Al–O– + H+ | –9.8 ± 0.1 |
| НТФ на поверхности бемита | |
| ≡Al–L5– + H+ ↔ ≡Al–LH4– | 9.7 ± 0.1 |
| ≡Al–L5– + 2H+ ↔ ≡Al–L${\text{H}}_{2}^{{3 - }}$ | 18.9 ± 0.1 |
| ≡Al–LH4– + H+ ↔ ≡Al–L${\text{H}}_{2}^{{3 - }}$ | 9.2 ± 0.1 |
| ≡Al–L5– + 3H+ ↔ ≡Al–L${\text{H}}_{3}^{{2 - }}$ | 26.2 ± 0.1 |
| ≡Al–LH23– + H+ ↔ ≡Al–L${\text{H}}_{3}^{{2 - }}$ | 7.3 ± 0.1 |
| ≡Al–L5– + 4H+ ↔ ≡Al–L${\text{H}}_{4}^{ - }$ | 30.0 ± 0.2 |
| ≡Al–L${\text{H}}_{3}^{{2 - }}$ + H+ ↔ ≡Al–L${\text{H}}_{4}^{ - }$ | 3.8 ± 0.2 |
| НТФ в растворе (0.1 моль/л KNO3, 25°С) [25, 26] | |
| L6– + H+ ↔ HL5– | 12.5 |
| L6– + 2H+ ↔ H2L4– | 19.72 |
| HL5– + H+ ↔ H2L4– | 7.22 |
| L6– + 3H+ ↔ H3L3– | 25.62 |
| H2L4– + H+ ↔ H3L3– | 5.90 |
| L6– + 4H+ ↔ H4L2– | 30.21 |
| H3L3– + H+ ↔ H4L2– | 4.59 |
| L6– + 5H+ ↔ H5L– | 31.8 |
| H4L2– + H+ ↔ H5L– | 1.6 |
| L6– + 6H+ ↔ H6L | 32.3 |
| H5L– + H+ ↔ H6L | 0.5 |
Химическое модифицирование бемита НТФ, подобно модификации других (гидр)оксидов металлов фосфоновыми кислотами [4–6], происходит за счет реакции лигандного замещения поверхностных ОН-групп. Поскольку установленное содержание привитой НТФ на поверхности бемита близко к концентрации поверхностных ОН-групп исходного бемита (см. выше), можно предположить, что закрепление молекулы НТФ, являющейся в водных растворах шестиосновной кислотой (H6L), происходит с образованием только моноядерных (включающих один атом алюминия поверхности) комплексов по схеме:
Ранее авторами работ, исследовавших адсорбцию НТФ на гетите [10, 24] и бемите [13], было сделано аналогичное предположение. Результаты математической обработки кривых титрования НТФ-бемита (рис. 4) показывают, что при закреплении НТФ на поверхности происходит понижение основности кислоты; привитая к поверхности НТФ ведет себя как четырехосновная кислота $ \equiv {\kern 1pt} {\text{Al}}{\kern 1pt} --{\kern 1pt} {\text{LH}}_{4}^{ - },$ что можно логично объяснить участием одной из фосфоновых групп НТФ во взаимодействии с поверхностью. Сопоставление констант диссоциации привитых к поверхности групп НТФ с соответствующими константами для свободной НТФ в растворе (табл. 1) показывает, что связывание с поверхностью уменьшает основность атома азота, как это наблюдалось ранее для привитых к кремнезему аминогрупп [3, 11]. Причиной понижения основности атома азота может быть его координационное взаимодействие с поверхностными атомами алюминия, установленное по данным РФЭС. Кислотность фосфоновых групп НТФ при закреплении на поверхности немного уменьшается по сравнению с аналогом в растворе аналогично поведению закрепленных на кремнеземе аминоди(метиленфосфоновых) групп [11, 15].
Таким образом, на основании полученных нами данных и литературных сведений по возможным механизмам взаимодействия фосфоновой группы с оксидными носителями [4–6] можно сделать предположение о строении привитого слоя НТФ на бемите. Спектральные данные (ИК-, РФЭС), относящиеся к воздушно-сухим образцам, указывают на наличие свободных и связанных с поверхностью фосфоновых групп. Установленная стехиометрия между содержанием ОН-групп в исходном бемите и привитой НТФ (1.1 : 1.0), а также протолитические характеристики привитой НТФ, характеризующие гидратированный образец, где НТФ является четырехосновной кислотой, указывают на то, что в связывании с поверхностью принимает участие одна фосфоновая группа молекулы НТФ, образующая связь с одним атомом алюминия. Аналогичное предположение было сделано ранее при изучении сорбции НТФ на бемите [13] и гетите [10]. При этом свободные фосфоновые группы НТФ, а также атом азота являются функционально-активными центрами, которые могут участвовать в координации ионов различных металлов.
В качестве модельного катиона для изучения комплексообразующих свойств НТФ-бемита был выбран двухзарядный катион Ni(II), комплексы которого с НТФ исследованы в водных растворах [25–27] и в кристаллическом состоянии [27, 28]. Одним из важнейших параметров, влияющих на сорбцию ионов металлов комплексообразующими сорбентами, является кислотность среды. Сорбция ионов Ni(II) бемитом с увеличением рН раствора увеличивается (рис. 5), как это наблюдается для различных ионов металлов на (гидр)оксидах алюминия [16]. Величина рН, при которой в данных условиях сорбируется 50% ионов Ni(II), составляет рН50 7.0, а полное связывание Ni(II) бемитом происходит в условиях щелочной реакции среды. В целом сорбционная способность Ni(II) на (гидр)оксидах алюминия значительно ниже, чем для двухзарядных ионов других тяжелых металлов, которая изменяется в их ряду следующим образом (для аморфного Al(OH)3)): Cu(II) > Pb(II) > Zn(II) > Cd(II) > Ni(II), Co(II) [29]; Cu(II) > Pb(II) > Zn(II) > Ni(II) > Co(II) > > Cd(II) [30].
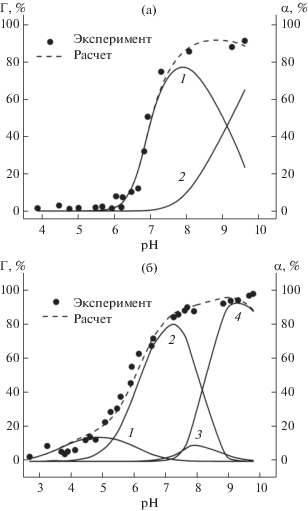
Рис. 5.
Зависимость степени сорбции Ni(II) на бемите от кислотности среды (Г, %) и диаграмма распределения комплексов (α, %) на поверхности. 1 – ≡Al–ONi+, 2 – ≡Al–ONi(OH). CNi(II) = 10–4 моль/л, Сбемит = = 1 г/ л (а).
Зависимость степени сорбции Ni(II) на НТФ-бемите от кислотности среды (Г, %) и диаграмма распределения комплексов (α, %) на поверхности: ≡Al–LH3Ni (1), ≡Al–LH2Ni– (2), ≡Al–LHNi2– (3), ≡Al–LNi3– (4). CNi(II) = 10–4 моль/л, СНТФ–бемит = 1 г/л (б).
Полученные экспериментальные данные по связыванию Ni(II) бемитом были рассмотрены с позиции теории комплексообразования на поверхности (Surface Compexation Modelling, SCM [31]) в применении к взаимодействию ионов металлов с поверхностью оксидов. В частности, при сорбции ионов двухзарядных металлах на (гидр)оксидах алюминия возможны следующие поверхностные реакции [16]:
В ходе расчетов была использована определенная нами концентрация поверхностных ОН-групп бемита (С≡Al–OH = 0.92 ммоль/г), а также рассчитанные константы их протонирования/диссоциации (табл. 1). Значения констант гидролиза Ni(II) для I = 0.1 моль/л (lgKг1 = –8.0, lgKг2 = –16.76) были взяты из [25]. При моделировании использовали неэлектростататическую модель поверхности (Non-Eletrostatic Model, NOM), которая наряду с электростатическими моделями применяется для описания сорбционных процессов c участием ионов металлов и оксидов [31]. Установлено, что сорбционная кривая Ni(II) на бемите может быть описана образованием двух типов поверхностных комплексов: резкий рост сорбции связан с образованием комплекса ≡Al–ONi+, который в щелочной среде гидролизуется с образованием комплекса ≡Al–ONi(OH) (рис. 5, табл. 2). Аналогичные по составу поверхностные комплексы были использованы при описании сорбции ионов Ni(II) на поверхности аморфного Al(OH)3 [29] и бемита [32]. Полученные значения констант равновесий образования сорбционных комплексов составляют: lgK = –4.0 (≡Al–ONi+), lgK = –13.8 (≡Al–ONi(OH)) [32], что близко к полученным нами данным.
Таблица 2.
Комплексообразующие свойства бемита и и бемита, содержащего привитые группы НТФ (0.1 моль/л KCl, (20 ± 1)°С)
| Равновесие | lg K |
|---|---|
| Бемит | |
| ≡Al–OH + Ni2+↔ ≡Al–ONi+ + H+ | –3.6 ± 0.1 |
| ≡Al–OH + Ni2+ + H2O ↔ ↔ ≡Al–ONi(OH) + 2H+ | –12.8 ± 0.3 |
| Ni(II)–НТФ-бемит | |
| ≡Al–L5– + Ni2+↔ ≡Al–LNi3– | 7.0 ± 0.2 |
| ≡Al–L5– + Ni2+ + H+ ↔ ≡Al–LHNi2– | 14.5 ± 0.3 |
| ≡Al–LNi3– + H+ ↔ ≡Al–LHNi2– | 7.5 ± 0.3 |
| ≡Al–L5– + Ni2+ + 2H+ ↔ ≡Al–LH2Ni– | 23.1 ± 0.1 |
| ≡Al–LHNi2– + H+ ↔ ≡Al–LH2Ni– | 8.6 ± 0.3 |
| ≡Al–L5– + Ni2+ + 3H+ ↔ ≡Al–LH3Ni | 28.5 ± 0.1 |
| ≡Al–LH2Ni– + H+ ↔ ≡Al–LH3Ni | 5.4 ± 0.2 |
| Ni(II)–НТФ в растворе (0.1 моль/л KNO3, 25°С) [25, 26] |
|
| Ni2+ + L6– ↔ NiL4– | 11.3 |
| Ni2+ + L6– + H+ ↔ NiHL3– | 19.6 |
| NiL4– + H+ ↔ NiHL3– | 8.3 |
| Ni2+ + L6– + 2H+ ↔ NiH2L2– | 25.3 |
| NiHL3– + H+ ↔ NiH2L2– | 5.7 |
| Ni2+ + L6– + 3H+ ↔ NiH3L– | 28.5 |
| NiH2L2– + H+ ↔ NiH3L– | 3.2 |
Кривая зависимости сорбции Ni(II) НТФ-модифицированным бемитом от кислотности среды смещена в область более низких значений рН (рН50 6.0) по сравнению с кривой для исходного бемита. Из литературы известно, что в водных растворах в системе Ni(II)–НТФ образуются комплексы мольного состава 1 : 1 с различной степенью протонирования NiHiLi– 4 (i = 0, 1, 2, 3) [25–27]. Аналогичный по составу набор комплексов был использован при моделировании взаимодействия Ni(II) с закрепленной на поверхности НТФ. При этом в ходе расчетов были использованы константы диссоциации НТФ на поверхности, определенные ранее (табл. 1), и литературные константы гидролиза Ni(II) [25]. Полученные результаты показывают, что сорбционная кривая Ni(II) на НТФ-бемите может быть удовлетворительно описана образованием набора комплексов ≡Al–LHiNii– 3 (i = 0, 1, 2, 3), идентичных по составу комплексам в растворах. Ранее при изучении сорбционных равновесий с участием НТФ, ионов металлов (Cu(II), Cd(II), Zn(II)) и бемита также было установлено, что на поверхности образуются комплексы состава ≡Al–LH2М–, ≡Al–LHМ2–, ≡Al–LМ3– [13]. При сорбции Ni(II) на НТФ-бемите в интервале рН 6–8 образуются протонированные комплексы ≡Al–LH3Ni и ≡Al–LH2Ni–, которые далее переходят в монопротонированный комплекс ≡Al–LHNi2–, а в сильнощелочной среде – в средний комплекс ≡Al–LNi3–. Устойчивость поверхностных комплексов Ni(II) состава ≡Al–LHiNii–3 (i = 0, 1, 2) ниже, чем соответствующих комплексов в растворе. Так, константы устойчивости комплексов ≡Al–LHNi2– и ≡Al–LNi3– на четыре-пять порядков меньше, чем их гомогенных аналогов NiHL3– и –NiL4 (табл. 2). Полученный результат отличается от данных авторов [15], которые установили что комплексы Cu(II), Pb(II), Zn(II), Cd(II) c аминоди(метиленфосфоновой) кислотой, закрепленной на поверхности SiO2 (SiO2–H3L–) состава SiO2–MH2L и SiO2–MHL–, прочнее по сравнению с их аналогами в растворах.
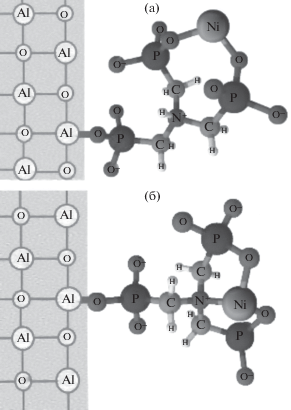
Исследование строения комплексов Ni(II) с НТФ в растворе [27] и в кристаллическом состоянии [28] показало, что в протонированных комплексах NiHiL (i = 1, 2, 3) атом азота не принимает участия в координации Ni(II). Координация осуществляется за счет атомов кислорода двух/трех различных фосфоновых групп с замыканием неустойчивого восьмичленного цикла/циклов. Можно предположить, что протонированные поверхностные комплексы Ni(II) на НТФ-бемите имеют аналогичное строение с тем отличием, что в координации Ni(II) участвуют только две свободные от связывания с поверхностью фосфоновые группы (рис. 6). Нормальный (средний) комплексонат Ni(II) c НТФ состава NiL4– в растворах и в кристаллическом состоянии имеет хелатную структуру с образованием трех пятичленных циклов с участием атома азота [27, 28]. Строение среднего комплекса на поверхности, вероятно, аналогично, а его меньшую устойчивость можно объяснить наличием только двух хелатных металлоциклов.
Рис. 6.
Схемы связывания ионов Ni(II) с поверхностью НТФ-модифицированного бемита: комплекс ≡Al–LHNi2– (а), комплекс ≡Al–LNi3– (б).
Представляет интерес сопоставление сорбционных свойств полученного НТФ-бемита и других комплексообразующих сорбентов, содержащих привитые фосфоновые группы, такие как комплексообразующие иониты на основе полимеров с аминометиленфосфоновыми группами –CH2–NH–CH2–PO(OH)2 [33] и кремнеземы SiO2 с закрепленными группами аминометиленфосфоновой и аминоди(метиленфосфоновой) –N(CH2–PO(OH)2)2 кислот [11, 15]. Полимерные фосфоновые сорбенты, представленные различными промышленными марками (Purolite S940 и S950, Lewatit TP260 и др.), наряду с другими комплексообразующими полимерами широко используются для связывания ионов различных металлов (Cu(II), Zn(II), Ni(II), Cd(II), Fe(III)). Кремнеземы с гетерогенизированными фосфоновыми производными, напротив, мало изучены и редко используются на практике. Преимуществом всех органоминеральных носителей с привитыми фосфоновыми кислотами и их производными является их ненабухаемость в различных растворителях, механическая прочность, термическая устойчивость и высокая скорость массообмена. Так, результаты данной работы показывают, что время установления сорбционного равновесия в системе Ni(II)–НТФ-бемит составляет 30–60 мин в сравнении с 24–48 ч для фосфоновых ионитов. Сорбционные свойства НТФ-бемита по отношению к ионам металлов, включая Ni(II), не уступают таковым для фосфонового полимерного сорбента, что видно при сопоставлении коэффициентов распределения (D, мл/г): lgD = 3.4 (аминометиленфосфоновый ионит, рН 5.6) [34] и lgD = 3.0 (НТФ-бемит, рН 5.6), lgD = 4.0 (НТФ-бемит, рН 7.5). Определенным минусом гетерогенизированных на оксидных носителях фосфоновых соединений в сравнении с полимерной подложкой является более низкая концентрация привитых групп и, как следствие, более низкая сорбционная емкость по ионам металлов. Так, для для фосфоновых полимерных ионитов (Purolite S940) она составляет ~2 ммоль/г (по ионам Cu(II)), в то время как для SiO2–АДФК – ~0.3 ммоль/г (по ионам Cu(II)) [15], а для НТФ-бемита – ~0.25 ммоль/г (по ионам Ni(II)). Полученный новый органоминеральный носитель на основе оксигидроксида алюминия, поверхностно модифицированного фосфоновым комплексоном, может найти применение для извлечения ионов Ni(II) из производственных растворов и сточных вод гидрометаллургических предприятий, для регенерации никельсодержащих отходов в гальванотехнике. Модифицированный бемит благодаря своим улучшенным комплексообразующим свойствам может быть также использован в качестве эффективной подложки для получения гетерогенных катализаторов на основе Ni(II).
ЗАКЛЮЧЕНИЕ
Результаты работы впервые показали принципиальную возможность химической пришивки к поверхности оксигидроксида алюминия не только относительно простых производных фосфоновых кислот [4], но и более сложных по строению полифосфоновых комплексонов, таких как НТФ. Совокупность полученных данных позволяет заключить, что якорная функция НТФ осуществляется лишь одной фосфоновой группой комплексона, делая оставшиеся функциональные группы активными в отношении связывания ионов металлов. Выбранный для изучения комплексообразующих свойств модифицированного носителя катион Ni(II) является представителем серии двухзарядных катионов тяжелых металлов (Co(II), Fe(II), Сu(II), Zn(II), Cd(II), Pb(II)), образующих с НТФ в растворах сходные по составу комплексы, что придает полученным результатам более общий характер. Оказалась, что устойчивость фосфонатов Ni(II), образующихся на поверхности бемита с привитыми группами НТФ, ниже, чем их аналогов в растворах, что, вероятно, связано с уменьшением дентатности НТФ при закреплении на поверхности. Дальнейшие исследования по модификации поверхности (гидр)оксидов алюминия другими фосфоновыми комплексонами позволят установить закономерности в комплексообразующих свойствах закрепленных комплексонов и получить новые комплексообразующие органоминеральные носители для более эффективного/селективного связывания ионов различных металлов.
Список литературы
Manyangadzea M., Chikuruwob N.H.M., Narsaiahc T.B. et al. // S. Afr. J. Chem. Eng. 2020. V. 31. P. 25. https://doi.org/10.1016/j.sajce.2019.11.003
Olenin A.Y., Lisichkin G.V. // Russ. J. Gen. Chem. 2019. V. 89. № 7. P. 1101. [Оленин А.Ю., Лисичкин Г.В. // Журн. общей химии. 2019. Т. 89. № 7. С. 1101.]https://doi.org/10.1134/S1070363219070168
Химия привитых поверхностных соединений / Под ред. Лисичкина Г.В. М.: Физматлит, 2003. 592 с.
Mihgalyov P.G., Lisichkin G.V. // Russ. Chem. Rev. 2006. V. 75. № 6. P. 541. [Мингалев П.Г., Лисичкин Г.В. // Успехи химии. 2006. Т. 75. № 6. С. 604.]https://doi.org/10.1002/chin.200645245
Queffélec C., Petit M., Janvier P. et al. // Chem.Rev. 2012. V. 112. № 7. P. 3777. https://doi.org/10.1021/cr20042121
Pujari S.P., Scheres L., Marcelis T.M., Zuilhof H. // Angew. Chem. Int. Ed. 2014. V. 51. № 25. P. 6322. https://doi.org/org/10.1002/anie.201306709
Lisichkin G.V., Olenin A.Y. // Russ. J. Appl. Chem. 2020. V. 93. № 1. P. 1. [Лисичкин Г.В., Оленин А.Ю. // Журн. прикл. химии. 2020. Т. 93. № 1. С. 5. https://doi.org/10.31857/S0044461820010016]
Mohapatra M., Pramanic P. // Colloids and Surfaces: Physicochem Eng. Aspects. 2009. V. 339. № 1. P. 35. https://doi.org/10.1016/j.colsurfa.2009.01.009
Wang J., Liu Y., Wang Z., Wang P. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 16575. https://doi.org/10.1016/j.ijhydene.2019.04.192
Nowack B., Stone A.T. // J. Colloid Interface Sci. 1999. V. 214. P. 20. https://doi.org/10.1006/jcis.1999.6111
Kholin Yu.V., Zaitsev V.N., Zaitseva G.N. et al. // Russ. J. Inorg. Chem. 1995. V. 62. № 40. P. 275. [Холин Ю.В., Зайцев В.Н., Зайцева Г.Н. и др. // Журн. неорган. химии. 1995. Т. 40. № 2. С. 275.]
Das M., Mishra D., Dhak P. et al. // Small. 2009. V. 5. № 24. P. 2883. https://doi.org/10.1002/smll.200901219
Zenobi M.C., E.H. Rueda // Quim. Nova. 2012. V. 35. № 3. P. 505. https://doi.org/10.1590/s0100-40422012000300012
Kropacheva T.N., Antonova A.S., Kornev V.I. // Mendeleev Commun. 2019. V. 29. P. 358. https://doi.org/0.1016/j.mencom.2019.05.040
Костенко Л.С., Ахмедов С.А., Зайцев В.Н. // Методы и объекты химического анализа. 2006. Т. 1. № 2. С. 116. https://doi.org/10.17721/moca
The environmental chemistry of aluminum / Ed. Sposito G. CRC Press, 1996. 480 p.
Rajabi L., Derakhshan A. // Sci. Adv. Mater. 2010. V. 2. P. 163. https://doi.org/10.1166/sam.2010.1063
Stability Constants Computation Programs: Hyperquad 2008. Hyperquad Simulation and Speciation HySS2009. www.hyperquad.co.uk
ПНД Ф 14.1:46-9. Количественный химический анализ вод. М., 1996.
Zhao R., Rupper P., Gaan S. // Coatings. 2017. V. 7. P. 133. https://doi.org/10.3390/coatings7090133
Zenobi M.C., Luengo C.V., Avena M.J., Rueda E.H. // Spectrochim. Acta. Part A. 2010. V. 75. P. 1283. https://doi.org/10.1016/j.ssa.2009.12.059
Rao B.V.A., Rao M.V., Rao S.S., Sreedhar B. // J. Surf. Eng. Mater. Adv.Technol. 2013. V. 3. P. 28. https://doi.org/10.4236/jsemat.2013.31005
Wang S.H., Liu C.S., Shan F.J., Qi G.C. // Acta Metall. Sin. (Engl. Lett). 2008. V. 21. № 5. P. 355. https://doi.org/10.1016/s1006-7191(08)60059-9
Kropacheva T.N., Antonova A.S., Kornev V.I. // Russ. J. Inorg. Chem. 2017. V. 62. № 2. P. 150. [Кропачева Т.Н., Антонова А.С., Корнев В.И. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 155.]https://doi.org/10.1134/S0036023617020103
Pettit L.D., Powell H.K.J. // IUPAC Stability Constants Database. Version 4.74. Academic Software. www.acadsoft.co.uk
Deluchat V., Bollinger J.-C., Serpaud B., Caullet C. // Talanta. 1997. V. 44. № 5. P. 897. https://doi.org/10.1016/S0039-9140(96)02136-4
Sawada K., Araki T., Suzuki T., Doi K. // Inorg. Chem. 1989. V. 28. № 13. P. 2687. https://doi.org/10.1021/ic00312a036
Somov N.V., Chausov F.F., Zakirova R.M., Fedotova I.V. // Crystallogr. Rep. 2016. V. 61. № 2. P. 238. [Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М., Федотова И.В. // Кристаллография. 2016. Т. 61. № 2. С. 216.]https://doi.org/10.1134/s1063774516020243
Pavlova P., Sigg L. // Wat. Res. 1988. V. 22. № 12. P. 1571. https://doi.org/10.1016/0043-1354(88)90170-4
Kinniburgh D.G., Jackson M.L., Syers J.K. // Soil Sci. Soc. Am. J. 1976. V. 40. № 5. P.796. https://doi.org/10.2136/sssaj1976.03615995004000050047x
Surface Complexation Modelling / Ed. Lutzenkirchen J. Academic Press, 2006. 652 p.
Islam M.A., Angove M.J., Morton D.W. // J. Water Process Eng. 2019. V. 32. P. 100964. https://doi.org/10.1016/j.jwpe.2019.100964
Зубакова Л.Б., Тевлина А.С., Даванков А.Б. Синтетические ионообменные материалы. М.: Химия, 1978. 184 с.
Trochimczuk A.W., Jezierska J. // J. Inorg. Organomet. Polym. 2000. V. 10. № 2. P. 81. https://doi.org/10.1023/A:1009423925041
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии