Журнал неорганической химии, 2020, T. 65, № 8, стр. 1061-1072
Синтез и термические превращения карбоксилатов никеля(II) с анионами ненасыщенных монокарбоновых кислот − прекурсоров металлосодержащих нанокомпозитов
А. С. Пронин a, С. А. Семенов a, *, Д. В. Дробот a, Е. В. Волчкова a, Г. И. Джардималиева b
a МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
119454 Москва, пр-т Вернадского, 78, Россия
b Институт проблем химической физики РАН
142432 Московская область, Черноголовка, пр-т Академика Семенова, 1, Россия
* E-mail: srg.semenov@gmail.com
Поступила в редакцию 07.10.2019
После доработки 13.02.2020
Принята к публикации 27.03.2020
Аннотация
Синтезированы соли никеля(II) с ненасыщенными монокарбоновыми кислотами: акриловой, метакриловой, сорбиновой, 4-пентиновой, пропиоловой, кротоновой, линолевой, олеиновой. Полученные соединения исследованы методами термогравиметрии, дифференциальной сканирующей калориметрии, элементного анализа, ИК-спектроскопии. В результате контролируемого термолиза полученных карбоксилатов синтезированы никельсодержащие нанокомпозиты и исследованы методами элементного анализа, ИК-спектроскопии, сканирующей и просвечивающей микроскопии, энергодисперсионной рентгеновской спектроскопии и рентгенофазового анализа. Рассчитаны энтальпии $\left( {\Delta Н_{{\text{р}}}^{^\circ }} \right)$ реакции образования солей ненасыщенных монокарбоновых кислот c никелем(II) полуэмпирическим квантово-химическим методом РМ3. Установлена положительная корреляция среднего диаметра наночастиц (dcр), входящих в состав нанокомпозитов, и $\Delta Н_{{\text{р}}}^{^\circ }.$ Изучены магнитные свойства полученных нанокомпозитов.
ВВЕДЕНИЕ
Соли ненасыщенных монокарбоновых кислот – класс соединений, обладающих не только карбоксилатной, но и непредельной функцией, вследствие чего эти соединения являются типичными представителями металлосодержащих мономеров [1]. Интерес к химии данных соединений определяется гибкостью их свойств, промышленным применением в больших объемах, а также возможностью использования этих материалов в качестве прекурсоров при получении металлополимерных нанокомпозитов [2–5].
Акрилаты и производные акриловой кислоты широко применяются при производстве акриловых эмульсий в лакокрасочной промышленности, для пропитки кожи и тканей, в роли сырья для производства клеев и строительных смесей, акрилатных каучуков и полиакрилонитрильных волокон. Значительная доля акриловой кислоты расходуется на производство суперабсорбентов и конструкционных материалов. Олеаты и линолеаты различных металлов применяют как загустители и сиккативы в лакокрасочной промышленности [6], а также при получении наночастиц [7]. Сорбаты натрия и калия используют в качестве консервантов [4]. Конъюгированная линолевая кислота является биологически активной добавкой и широко применяется спортсменами [8].
Интерес к комплексным соединениям переходных металлов, содержащим в качестве лиганда мономер карбоксилата с ненасыщенной двойной или тройной связью, растет благодаря способности данных связей к раскрытию под воздействием высоких температур в инертной атмосфере и получению нанокомпозитов [9, 10].
Подобные материалы, содержащие наноразмерные частицы, широко применяются в различных областях науки, таких как химия, физика, биология, что, в свою очередь, стимулирует дальнейшие исследования целого ряда теоретических и практически значимых проблем, связанных с их получением и анализом [10, 11]. Изучение наночастиц, эффективных методик стабилизации и методов контроля их состава является на сегодняшний момент наиболее актуальной задачей, несмотря на обширное количество научных работ, посвященных исследованию данных соединений. При формировании физико-химических характеристик и свойств нанокомпозитов главный вклад вносит квантово-размерный эффект. Значительный интерес к наночастицам d-элементов обусловлен особенностями их магнитных свойств [12], а также возможностью создания магнитных носителей с высокой плотностью записи информации на основе наночастиц кобальта, никеля и железа [13]. Магнитные наночастицы широко применяются в биомедицине [14]. Одним из наиболее перспективных методов синтеза нанокомпозитов является управляемый термолиз металлосодержащих мономеров в инертной атмосфере. Он одновременно сочетает в себе синтез высокодисперсной металлической фазы, представленной в виде ядра, состоящего из металла/оксида металла или их смеси, и формирование стабилизирующей полимерной матрицы, препятствующей агломерации частиц образующихся нанокомпозитов [9, 15].
Ранее были синтезированы акрилаты, метакрилаты [16, 17] и олеаты кобальта и никеля [18]. Цель настоящей работы – синтез ненасыщенных монокарбоксилатов никеля акриловой СН2=СН–СООН (AcrA), кротоновой СН3–СН=СН–СООН (CrotA), линолевой CH3(CH2)3–(CH2CH=CH)2(CH2)7COOH (LinA), метакриловой СН2=С(СН3)–СООН (MethAcrA), олеиновой СН3(СН2)7СН=СН(СН2)7CООН (OleicA), 4-пентиновой CH≡C–CH3–CH2–COOH (PentA), сорбиновой CH3CH=CH–CH=CH–COOH (SorbA), пропиоловой СН≡С–СООН (PropiolA) кислот, исследование их термических свойств, получение путем контролируемого термолиза никельсодержащих нанокомпозитов и исследование их свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали тетрагидрат ацетата никеля Ni(CH3COO)2 · 4H2O (ч.), гексагидрат хлорида никеля NiCl2 · 6H2O (ГОСТ 4038-79), нонагидрат нитрата никеля Ni(NO3)2 · 9H2O (ч. д. а.), а также акриловую (99.5%, Sigma-Aldrich), кротоновую (99%, Sigma-Aldrich), линолевую (99%, Sigma-Aldrich), метакриловую (99.5%, Sigma-Aldrich), олеиновую (97.4%, ТУ 9145-1724731297-94), 4-пентиновую (99%, Sigma-Aldrich), пропиоловую (99%, Sigma-Aldrich) и сорбиновую кислоты (99%, Sigma-Aldrich).
Синтез карбоксилатов никеля проводили по разным методикам в зависимости от свойств кислот и наличия известных методик для различных соединений.
Кротонат, сорбат, акрилат, пропиолат и метакрилат получали в результате взаимодействия водных растворов кислот с раствором тетрагидрата ацетата никеля (мольное соотношение 2 : 1). Синтез проводили при комнатной температуре, за исключением сорбиновой кислоты ввиду ее плохой растворимости, синтез с ней проводили при 90°С. Затем раствор упаривали, полученный осадок с целью удаления образующейся в процессе синтеза уксусной кислоты доводили до постоянной массы при температуре 120°С.
Линолеат никеля получали следующим образом. В 3.8 моль воды добавляли 0.018 моль гидроксида натрия и перемешивали до полного растворения, затем добавляли 0.018 моль линолевой кислоты. Смесь нагревали до 60–70°С при перемешивании до полного растворения полученного осадка, добавляли 0.009 моля гексагидрата хлорида никеля и наблюдали выпадение салатового осадка. Полученные осадки сушили до постоянной массы на воздухе, затем измельчали и промывали несколько раз ацетоном для удаления остатка кислоты и оставляли сушиться на воздухе. Далее отмытый от кислоты линолеат никеля несколько раз промывали водой для удаления хлорида натрия и оставляли сушиться на воздухе до постоянной массы, затем сушили в вакуумном шкафу при температуре 45°С также до постоянной массы. Итоговый выход продукта – 33.14%.
Олеат никеля получали по следующей методике. Эквимолярное количество гидроксида натрия смешивали с олеиновой кислотой и приливали 70 мл воды, затем 70 мл гексана и 70 мл метилового спирта, далее добавляли стехиометрическое количество нонагидрата нитрата никеля. Образовавшуюся тройную смесь с расслаиванием при постоянном перемешивании на магнитной мешалке нагревали до 70°С и выдерживали при этой температуре в течение 3 ч. Далее в делительной воронке отделяли верхний органический слой, промывая его несколько раз дистиллированной водой. Упариванием раствора до полного удаления гексана получали зеленый порошок олеата никеля.
ИК-спектры образцов в виде таблеток с KBr регистрировали в области 4000–500 см–1 на ИК-Фурье-спектрометре Equinox 55 фирмы Bruker (Германия). Элементный анализ проводили на автоматическом элементном CHNS-анализаторе фирмы Thermo Finnigan (Италия). Содержание никеля определяли прямым титрованием ЭДТА с мурексидом [19]. Термоаналитические исследования карбоксилатов никеля проводили на дериватографе системы Паулик–Паулик–Эрдей (Q-1500 D, фирма МОМ, Венгрия) при нагревании образцов на воздухе (порошки, m = 0.03–0.04 г) со скоростью 10 град/мин в интервале 20–500°C.
Синтез нанокомпозитов никеля проводили в изотермических условиях при температуре 335 ± 1°С с использованием электротигля ЭТ-МГК 0.7 × × 1.5/12 с цифровым регулятором температуры “Дельта” серии ДТА в течение 9 ч в атмосфере аргона.
Композиты, полученные при термолизе, исследовали методами просвечивающей электронной микроскопии (ПЭМ) на электронном микроскопе JEМ 100СХ (Jeol, Япония) в ЦКП “Коллекция UNIQEM” ФИЦ Биотехнологии РАН при ускоряющем напряжением 80 кВ, сканирующей электронной микроскопии (СЭМ) на электронном микроскопе JSM-6700F (JEOL, Япония) с приставкой для энергодисперсионной спектрометрии INCA (Oxford, UK). Рентгенофазовый анализ выполняли на рентгеновском дифрактометре ДРОН-4.0 с использованием монохроматизированного CoKα-излучения. Для интерпретации дифракционного спектра использовали программу количественного фазового анализа PHAN% [20].
Для автоматической обработки электронных фотографий использовали программный продукт (ПП) LabVIEW 8.5.1 [21]. Магнитные свойства нанокомпозитов измеряли при комнатной температуре посредством вибрационного магнитометра (VSM) M4500 EG&G PARC, калиброванного с использованием стандартного никелевого образца массой 90 мг. В ходе измерений магнитное поле варьировали от 0 до 800 кА/м. Масса исследуемого образца составляла ∼50 мг.
Квантово-химические расчеты энтальпии реакции образования карбоксилатов никеля на основе ненасыщенных монокарбоновых кислот проводили с использованием ПП HyperChem 8.0.8 (Hypercube Inc.) полуэмпирическим методом РМ3. Расчет проводили с учетом эффекта водной среды, для чего использовали ячейку размером 10 × 12 × × 19 Å, в которую помещали рассчитываемые молекулы. При таком соотношении сторон и с учетом минимального расстояния между атомами соединения и растворителя 2.3 Å в ячейке находилось 72 молекулы воды. Расчет вели до значения градиента 0.03 ккал/моль.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для подтверждения получения карбоксилатов никеля использовали данные элементного анализа и ИК-спектроскопии. Данные ИК-спектроскопии позволяют сделать качественный вывод о наличии карбоксилат-ионов в полученных соединениях и указывают на присутствие координационной воды. На основании полученных данных видно (табл. 1), что олеиновая и линолевая кислоты, а также карбоксилаты никеля на их основе не имеют ярко выраженной характеристической частоты колебаний кратной связи. Это свидетельствует не об отсутствии последней в полученных соединениях, а о симметричном или близкосимметричном строении изучаемых соединений относительно данной связи. Сделанные выводы количественно подтверждаются результатами элементного анализа (табл. 2). Установлено, что все синтезированные соединения имеют в своем составе воду, о чем свидетельствуют широкие полосы поглощения в ИК-спектре (νOH(H2O) = 3277–3581 см–1). Все полученные вещества, за исключением олеата и линолеата, являются водорастворимыми, аналогичная ситуация наблюдалась для соответствующих карбоксилатов кобальта [22].
Таблица 1.
Характеристические частоты (ν, см–1) в ИК-спектрах непредельных карбоксилатов никеля
| Соединение | νOH(H2O) | ν(COOH) | ν(кр. св.) | νs(COO–) | νas(COO–) |
|---|---|---|---|---|---|
| Акрилат никеля | 3535 (ср) | – | 1640 (сл) | 1354 (сл), 1437 (с) | 1559 (с) |
| Акриловая кислота | – | 1705 (с) | 1635 (сл) | – | – |
| Кротонат никеля | 3581 (ср) | 1700 (сл) | 1659 (ср) | 1408 (с) | 1539 (с) |
| Кротоновая кислота | – | 1705 (с) | 1643 (ср) | 1395 (ср) | 1530 (сл) |
| Линолеат никеля | 3430 (ш) | 1710 (сл) | – | 1409 (ш) | 1572 (ш) |
| Линолевая кислота | – | 1712 (с) | – | 1375 (ср) | – |
| Метакрилат никеля | 3437 (ср) | – | – | 1413 (с) | 1559 (с) |
| Метакриловая кислота | – | 1708 (с) | 1638 (ср) | 1389 (сл), 1425 (сл) | – |
| Олеат никеля | 3419 (ш) | 1708 (сл) | – | 1411 (с) | 1573 (с) |
| Олеиновая кислота | – | 1712 (с) | – | 1375 (ср) | – |
| 4-Пентиноат никеля | 3252 (ш) | 1714 (ср) | 1571 (с) | 1415 (ш) | 1537 (ш) |
| Сорбат никеля | 3400 (ш) | 1698 (ср) | 1643 (ср) | 1410 (ш) | 1558 (ш) |
| Сорбиновая кислота | – | 1690 (ш) | 1640 (ср) | 1378 (ср) | – |
| Пропиолат никеля | 3277 (ш) | 2106 (с) | – | 1379 (с) | 1587 (ср) |
Таблица 2.
Данные элементного анализа монокарбоксилатов никеля (найдено/вычислено)
| Соль | Ni, % | С, % | Н, % |
|---|---|---|---|
| Ni(С3Н3О2)2 · 3Н2О Акрилат никеля |
20.85/23.70 | 28.30/28.28 | 3.49/4.25 |
| Ni(С4Н5О2)2 · 3Н2О Кротонат никеля |
23.89/22.20 | 34.39/34.01 | 4.51/5.10 |
| Ni(С18Н31О2)2 · 7Н2О Линолеат никеля |
9.12/7.73 | 58.53/58.12 | 8.93/9.30 |
| Ni(С4Н5О2)2 · 6Н2О Метакрилат никеля |
15.97/17.40 | 28.18/28.50 | 4.20/5.25 |
| Ni(С18Н33О2)2 · 9Н2О Олеат никеля |
7.89/7.49 | 54.88/55.18 | 8.31/9.20 |
| Ni(С5Н5О2)2 · 2Н2О 4-Пентиноат никеля |
19.37/20.32 | 36.79/41.57 | 4.73/4.88 |
| Ni(С3НО2)2 · 2Н2О Пропиолат никеля |
23.23/25.19 | 31.37/30.92 | 3.02/2.60 |
| Ni(С6Н7О2)2 · 4Н2О Сорбат никеля |
18.82/16.63 | 41.25/40.90 | 4.44/5.25 |
Термолиз исследованных соединений сопровождается газовыделением и потерей массы образцов, что обусловлено протеканием эндотермических реакций с потерей молекул воды во время нагревания (табл. 3). Далее происходят экзотермические реакции декарбоксилирования с потерей органического лиганда (рис. 1). Основным продуктом термолиза, согласно данным рентгенофазового анализа, является NiO.
Таблица 3.
Процесс дегидратации карбоксилатов никеля (эндотермическая природа трансформации)
| Соединение | t, °C | Потеря массы, % | |
|---|---|---|---|
| вычислено | найдено | ||
| Ni(С4Н5О2)2 · 3Н2О → Ni(С4Н5О2)2 Кротонат никеля |
138 | 19.08 | 17.26 |
| Ni(С18Н31О2)2 · 7Н2О → Ni(С18Н31О2)2 Линолеат никеля |
148 | 16.94 | 16.62 |
| Ni(С6Н7О2)2 · 4Н2О → Ni(С6Н7О2)2 Сорбат никеля |
108 | 20.40 | 20.59 |
Рис. 1.
TГ/ДTA-кривые термолиза непредельных карбоксилатов никеля: кротоната никеля Ni(С4Н5О2)2 · 3Н2О (а); сорбата никеля Ni(С6Н7О2)2 · 4Н2О (б); линолеата никеля Ni(С18Н31О2)2 · 7Н2О (в).
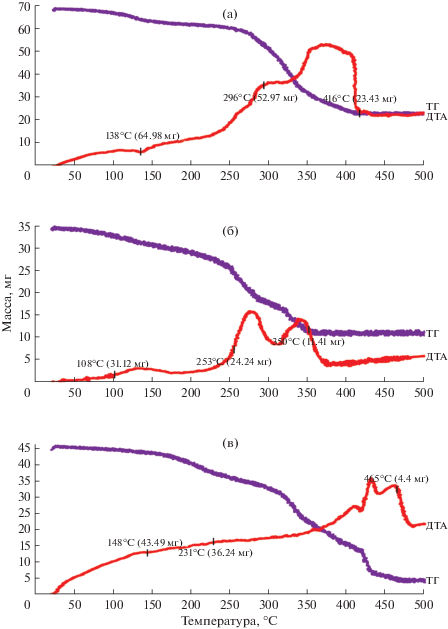
Наблюдаемые потери массы для этих процессов совпадают с теоретическими значениями. Разложение безводных комплексов немедленно следует за процессом дегидратации, остаточный вес хорошо согласуется со значениями, соответствующими для NiO (табл. 4).
Таблица 4.
Процесс разложения карбоксилатов никеля (экзотермическая природа трансформации)
| Процесс | t, °C | Остаток, % | |
|---|---|---|---|
| вычислено | найдено | ||
| Ni(С4Н5О2)2 → NiO Кротонат никеля |
355–412 | 32.66 | 33.29 |
| Ni(С18Н31О2)2 → NiO + Ni Линолеат никеля |
425–465 | 10.82 | 9.01 |
| Ni(С6Н7О2)2 → NiO Сорбат никеля |
253–350 | 26.61 | 32.44 |
Композиты, полученные в результате термического разложения ненасыщенных монокарбоксилатов никеля в токе аргона, представляют собой черный порошок, состоящий из двух структурных элементов: матрицы из аморфного углерода, в которую на основании данных электронной микроскопии имплантированы наночастицы. Как видно из полученных данных, при термолизе акрилата и линолеата никеля преобладает кубический металлический Ni (сF4/1) с примесью кубического оксида Ni (cF8/2). В случае термолиза кротоната, метакрилата, пропиолата никеля преобладает кубический оксид Ni (cF8/2) с примесью металлического Ni (сF4/1). В случае олеата, 4-пентиноата и сорбата никеля наблюдается смесь данных фаз (табл. 5). В составе композита, полученного в результате термолиза кротоната никеля, содержится также графит (структурный тип hP4/1). Дифрактограммы полученных образцов приведены на рис. 2.
Таблица 5.
Данные РФА продуктов термолиза ненасыщенных монокарбоксилатов никеля
| Фаза | Структурный тип | Об. % | a, Å |
|---|---|---|---|
| Продукт термолиза акрилата никеля | |||
| ГЦК-Ni | cF4/1 | 71.4 | 3.526 |
| ГЦК-NiО | cF8/2 | 28.6 | 4.217 |
| Продукт термолиза кротоната никеля | |||
| ГЦК-Ni | cF4/1 | 12.2 | 3.520 |
| ГЦК-NiО | cF8/2 | 78.6 | 4.187 |
| Графит | hP4/1 | 9.2 | – |
| Продукт термолиза линолеата никеля | |||
| ГЦК-Ni | cF4/1 | 68.7 | 3.526 |
| ГЦК-NiО | cF8/2 | 31.3 | 4.191 |
| Продукт термолиза метакрилата никеля | |||
| ГЦК-Ni | cF4/1 | 3.4 | 3.523 |
| ГЦК-NiО | cF8/2 | 96.6 | 4.219 |
| Продукт термолиза олеата никеля | |||
| ГЦК-Ni | cF4/1 | 51.9 | 3.522 |
| ГЦК-NiО | cF8/2 | 48.2 | 4.208 |
| Продукт термолиза 4-пентиноата никеля | |||
| ГЦК-Ni | cF4/1 | 48.5 | 3.519 |
| ГЦК-NiО | cF8/2 | 51.5 | 4.217 |
| Продукт термолиза пропиолата никеля | |||
| ГЦК-Ni | cF4/1 | 7.7 | 3.523 |
| ГЦК-NiО | cF8/2 | 92.3 | 4.214 |
| Продукт термолиза сорбата никеля | |||
| ГЦК-Ni | cF4/1 | 29.1 | 3.527 |
| ГЦК-NiО | cF8/2 | 70.9 | 4.205 |
Рис. 2.
Дифрактограммы композитов, полученных из карбоксилатов никеля: акрилата никеля (а), сорбата никеля (б), линолеата никеля (в).
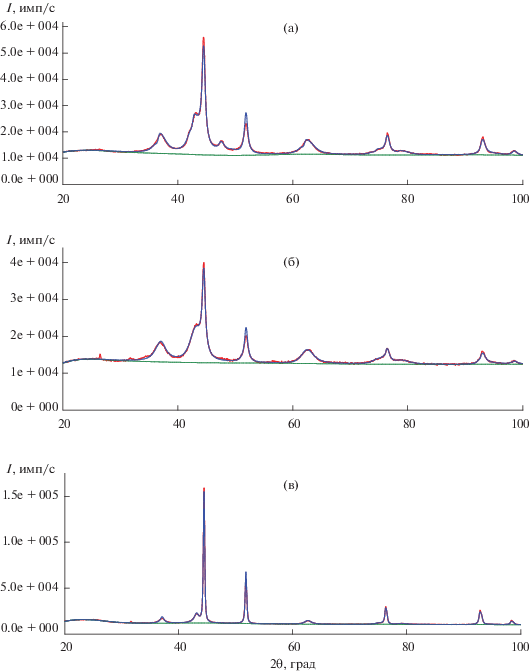
Черный цвет композитов объясняется присутствием аморфного углерода [23]. На основании данных элементного и рентгеноспектрального анализа продуктов термолиза, представленных в табл. 6, высказано предположение об образовании аморфной углеродной матрицы. По данным сканирующей электронной микроскопии, изученные композиты представляют собой агрегаты размером от 1 до 100 мкм (рис. 3).
Таблица 6.
Элементный состав продуктов термолиза карбоксилатов никеля, ат. %
| Продукт термолиза карбоксилата | C | H | O | Ni |
|---|---|---|---|---|
| Акрилат | 37.07 | 0.67 | 10.93 | 51.33 |
| Кротонат | 23.40 | 0.57 | 16.80 | 59.23 |
| Линолеат | 58.85 | 2.19 | 4.96 | 34.00 |
| Метакрилат | 28.86 | 0.23 | 22.38 | 48.53 |
| Олеат | 53.30 | 2.04 | 5.04 | 39.62 |
| Пропиолат | 27.74 | 0.93 | 6.94 | 64.39 |
| 4-Пентиноат | 33.62 | 1.77 | 9.75 | 54.86 |
| Сорбат | 34.24 | 2.05 | 8.15 | 55.56 |
Рис. 3.
СЭМ-изображения продуктов термолиза карбоксилатов никеля: сорбата никеля (а), кротоната никеля (б), 4-пентиноата никеля (в).

Стадии обработки ПЭМ-изображения композита, полученного разложением кротоната никеля, представлены на рис. 4.
Рис. 4.
Стадии обработки ПЭМ-изображения композита, полученного разложением кротоната никеля при помощи ПП LabVIEW 8.5.1.

В табл. 7 приведены результаты обработки ПЭМ-изображений композитов, полученных разложением карбоксилатов никеля, а на рис. 5 показано распределение частиц по размерам.
Таблица 7.
Результаты обработки ПЭМ-изображений продуктов термолиза карбоксилатов никеля
| Предшественник нанокомпозита | Количество частиц в исследованном фрагменте | Средний диаметр наночастиц, нм* |
|---|---|---|
| Линолеат никеля | 348 | 4.3 ± 0.2 |
| Метакрилат никеля | 565 | 3.5 ± 0.2 |
| Сорбат никеля | 415 | 2.6 ± 0.4 |
| Олеат никеля | 397 | 3.6 ± 0.1 |
| 4-Пентиноат никеля | 735 | 2.2 ± 0.2 |
| Пропиолат никеля | 621 | 2.2 ± 0.3 |
| Акрилат никеля | 978 | 2.9 ± 0.3 |
| Кротонат никеля | 325 | 5.3 ± 0.2 |
Рис. 5.
Распределение частиц по размерам в нанокомпозитах никеля, полученных при использовании прекурсоров: 4-пентиноата никеля (а), пропиолата никеля (б), кротоната никеля (в).
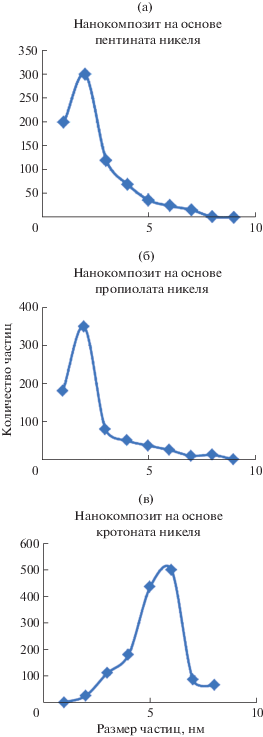
Рост и размер наночастиц зависят от ряда факторов: температуры, времени, среды и ряда других характеристик. К факторам, влияющим на эти характеристики наночастиц, можно также отнести и энергию Гиббса образования предшественников наночастиц (в данном случае карбоксилатов никеля). Ранее мы предположили, что существует зависимость между энергетическими характеристиками карбоксилатов металлов (комплементарность, энергия предорганизации, энергия образования) и наночастиц (размеры, распределение по размерам, магнитные свойства), получаемых в результате термолиза [24]. В работах [22, 25, 26] было доказано существование зависимости среднего диаметра наночастиц от энтальпии реакции образования карбоксилатов металлов, являющихся предшественниками нанокомпозитов, на примере ненасыщенных дикарбоксилатов кобальта и никеля.
Экспериментальные энергетические характеристики карбоксилатов не всегда известны, так как их определение часто связано с трудностями. Один из возможных путей определения этих характеристик – квантово-химические расчеты, которые часто проводят для вакуума. Однако известно, что эффект среды оказывает значительное влияние на протекание химических реакций. Поскольку энтропийная составляющая часто вносит небольшой вклад в энергию Гиббса, и последняя, как правило, пропорциональна энтальпии [27], одной из целей настоящей работы являлся расчет энтальпии реакции образования карбоксилатов никеля на основе ненасыщенных монокарбоновых кислот с учетом водной среды, так как синтез всех соединений проводили в водной среде либо на границе фаз, одной из которых была вода. Согласно уравнению (1), расчет проводили при условии нахождения в ячейке двух молекул кислоты.
Реакция образования солей непредельных монокарбоновых кислот имеет следующий вид:
(1)
$2{\text{HA}} + {\text{N}}{{{\text{i}}}^{{2 + }}} = {\text{Ni}}{{{\text{A}}}_{2}} + 2{{{\text{H}}}^{ + }},$Энтальпия реакции образования соли $\Delta H_{{\text{р}}}^{^\circ }$ может быть рассчитана как
(2)
$\Delta H_{{\text{р}}}^{^\circ } = \Delta H_{{{\text{обр}}\left( {\text{с}} \right)}}^{^\circ }--{\text{2}}\Delta H_{{{\text{обр}}\left( {{\text{ск}}} \right)}}^{^\circ },$Таблица 8.
Энтальпия реакции образования непредельных монокарбоксилатов никеля
| Карбоксилат | ∆$H_{{\text{p}}}^{^\circ }$, кДж/моль | Диаметр наночастиц, нм |
|---|---|---|
| 4-Пентиноат никеля | –1441 | 2.2 |
| Пропиолат никеля | –1410 | 2.2 |
| Метакрилат никеля | –605 | 3.5 |
| Сорбат никеля | –445 | 2.6 |
| Акрилат никеля | –342 | 2.9 |
| Олеат никеля | –188 | 3.6 |
| Линолеат никеля | 21 | 4.3 |
| Кротонат никеля | 493 | 5.3 |
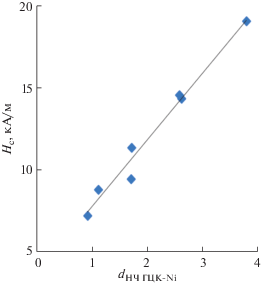
На рис. 6 представлена корреляция среднего диаметра наночастиц, формирующихся в результате термолиза карбоксилатов никеля, и энтальпии реакции образования карбоксилатов.
Рис. 6.
Зависимость среднего диаметра наночастиц от энтальпии реакции образования ненасыщенных монокарбоксилатов никеля.
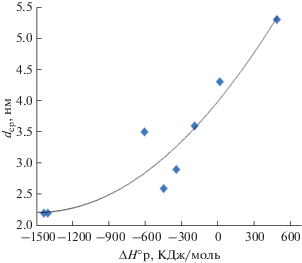
Наблюдаемую зависимость среднего диаметра наночастиц от энтальпии реакции образования карбоксилатов никеля можно интерпретировать следующим образом. Энтальпия реакции образования карбоксилатов никеля характеризует их устойчивость, которая, в свою очередь, определяет начало и скорость термического разложения этих карбоксилатов: чем выше устойчивость карбоксилата, тем позже от начала процесса термолиза происходит его разрушение и, соответственно, формирование аморфной углеродной матрицы с распределенной в ней фазой наночастиц. Процесс нуклеации связан, по-видимому, с неоднородным распределением атомов никеля в твердофазной структуре его карбоксилатов, которое может быть обусловлено своеобразием кристаллической структуры либо ее дефектами.
Магнитные характеристики полученных нанокомпозитов приведены в табл. 9.
Таблица 9.
Магнитные характеристики полученных нанокомпозитов
| Предшественник нанокомпозита | Диаметр ядра наночастиц ГЦК-Ni, нм | Намагниченность насыщения, А м2/кг | Остаточная намагниченность, А м2/кг | Коэрцитивная сила, кА/м |
|---|---|---|---|---|
| 4-Пентиноат никеля | 1.7 | 16.5 | 4.69 | 11.4 |
| Пропиолат никеля | 0.9 | 6.77 | 0.38 | 7.24 |
| Метакрилат никеля | 1.1 | 5.66 | 1.21 | 8.84 |
| Сорбат никеля | 1.7 | 12.2 | 3.02 | 9.47 |
| Акрилат никеля | 1.6 | 17.4 | 5.73 | 14.6 |
| Олеат никеля | 2.9 | 18.0 | 6.9 | 21.3 |
| Линолеат никеля | 3.8 | 15.6 | 4.28 | 19.1 |
| Кротонат никеля | 2.6 | 9.75 | 3.44 | 14.4 |
Для создания магнитных носителей информации высокой плотности магнитные наночастицы должны обладать большой коэрцитивной силой, что позволяет предотвратить саморазмагничивание вследствие тепловых флуктуаций [12, 28].
В работах [29, 30] отмечается, что наночастицы размером 11–26 нм, содержащие β-Ni, имеют гранецентрированную кубическую (ГЦК) кристаллическую решетку и являются ферромагнитными. Массивный образец NiO обладает антиферромагнитными свойствами [31]. При уменьшении размера зерен магнитного материала до наноуровня, он преобразуется в суперпарамагнитный [32], поэтому наночастицы NiO проявляют суперпарамагнитную природу [31, 33] и обладают коэрцитивной силой, равной нулю [12]. Учитывая, что во всех полученных композитах наночастицы состоят из ГЦК-Ni и ГЦК-NiO в разных соотношениях (табл. 5), а также представляя строение наночастицы в виде ядра-оболочки [34], т.е. рассматривая частицу как ферромагнитное ядро, окруженное суперпарамагнитной оболочкой, состоящей из NiO, мы рассчитали размер ферромагнитного ядра и построили зависимость коэрцитивной силы от среднего диаметра ферромагнитного ядра (рис. 7), описываемую линейным уравнением:
с достоверностью аппроксимации R2 = 0.976 и коэффициентом корреляции r = 0.988. Проверка значимости коэффициента корреляции по t-критерию показала, что с доверительной вероятностью 0.999 коэффициент корреляции значим. Полученная зависимость является левой ветвью зависимости коэрцитивной силы от диаметра ферромагнитных частиц, которая имеет вид кривой с максимумом [12, 35]. Литературные данные [36] показывают, что критический диаметр для никеля находится в районе 79 нм, т.е. при значительно большем диаметре частиц. Установленная зависимость позволяет:1) рассчитать коэрцитивную силу образца, если известна объемная доля ферромагнитной фазы и средний диаметр частиц;
2) определить объемную долю ферромагнитной фазы, если известна коэрцитивная сила образцов и средний диаметр частиц;
3) определить средний диаметр частиц, если известна коэрцитивная сила образцов и доля ферромагнитной фазы.
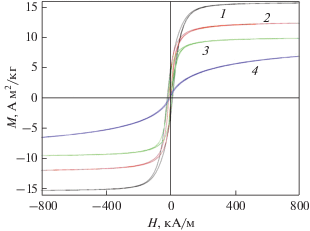
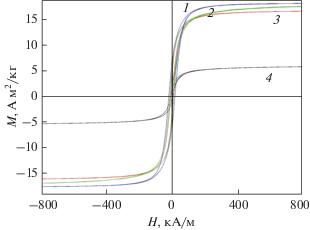
Из приведенных в табл. 9 данных следует, что наибольшая коэрцитивная сила (21.3 кА/м) наблюдается у нанокомпозита, полученного в результате термолиза олеата никеля. Средний диаметр металлосодержащих наночастиц этого нанокомпозита составляет 3.6 нм, а диаметр ферромагнитного ядра, состоящего из ГЦК-Ni, – 2.9 нм. С уменьшением среднего диаметра ферромагнитного ядра наночастиц от 3.8 нм (нанокомпозит, полученный в результате термолиза линолеата никеля) до 0.9 нм (нанокомпозит, полученный в результате термолиза пропиолата никеля) коэрцитивная сила уменьшается от 19.1 до 7.2 кА/м, что связано с возрастанием роли тепловых флуктуаций [36, 37]. Максимальные намагниченность насыщения (18.0 А м2/кг) и остаточная намагниченность (6.90 А м2/кг) также были зафиксированы для нанокомпозита, полученного термолизом олеата никеля.
Следует отметить, что в случае нанокомпозита, полученного фронтальной полимеризацией кобальтового акриламидного комплекса с последующим термолизом, значение коэрцитивной силы составило 7.96 кА/м [28].
Разброс точек на рис. 7 связан с трудностями теоретического исследования магнитного гистерезиса в наночастицах, которые состоят в том, что это нелинейное, неравновесное и нелокальное явление, вызванное существованием энергетических минимумов и разделяющих их барьеров, сложным образом зависит от внешнего магнитного поля [12, 37].
На рис. 8 и 9 приведены зависимости намагниченности композитов, полученных из карбоксилатов никеля, от величины магнитного поля.
Список литературы
Помогайло А.Д., Джардималиева Г.И. Мономерные и полимерные карбоксилаты металлов. М.: Физматлит, 2009. 400 с.
Химическая энциклопедия / Под ред. Кнунянца И.Л. М.: Советская энциклопедия, 1988. Т. 1. С. 623.
Химическая энциклопедия / Под ред. Кнунянца И.Л. М.: Советская энциклопедия, 1992. Т. 3. С. 639.
СанПиН 2.32.1293-03. Санитарно-эпидемиологические правила и нормативы “Гигиенические требования по применению пищевых добавок. Приложение 1”. М.: 15.06.2003 с изменениями от 26.05.2008.
Химический энциклопедический словарь / Под ред. Кнунянц И.Л. М.: Советская энциклопедия, 1983. 678 с.
Химический энциклопедический справочник. М.: Советская энциклопедия, 1983. С. 788.
Хоанг Х.Т., Серцова А.А., Маракулин С.И. и др. // Журн. неорган. химии. 2018. Т. 63. № 11. С. 1388. https://doi.org/10.1134/S0044457X18110077
Zullet M.A., Marti A., Parra M.D., Martinez J.A. // J. Physiol. Biochem. 2005. V. 61. P. 483.
Pomogailo A.D., Dzhardimalieva G.I. Nanostructured Materials Preparation via Condensation Ways. London: Springer, 2014. 460 p.
Розенберг А.С., Джардималиева Г.И., Помогайло А.Д. // Докл. АН. 1997. Т. 356. № 1. С. 66.
Симоненко Е.П., Симоненко Н.П., Мокрушин А.С. и др. // Журн. неорган. химии. 2018. Т. 63. № 7. С. 805. https://doi.org/10.1134/S0044457X1807019X
Губин С.П., Кокшаров Ю.А., Хомутов Г.Б., Юрков Г.Ю. // Успехи химии. 2005. Т. 74. № 6. С. 539.
Алферов Ж.И., Асеев А.Л., Гапонов С.В. и др. // Нано- и микросистемная техника. 2003. № 8. С. 3.
Mornet S., Vasseur S., Grasset F., Duguet E. // J. Mater. Chem. 2004. V. 14. 2161.
Дворикова Р.А., Васнёв В.А., Корлюков А.А. и др. // Тонкие химические технологии. 2018. Т. 13. № 5. С. 49.
Джардималиева Г.И., Помогайло А.Д., Пономарев В.И. и др. // Изв. АН СССР. Сер. хим. 1988. Т. 49. № 10. С.1525.
Gronowski A., Wojtczak Z. // J. Therm. Anal. 1983. V. 26. P. 233.
Kwangjin A., Nohyun L., Jongnam P. // J. Am. Chem. Soc. 2006. V. 128. P. 9753.
Шварценбах Г., Флашка Г. Комплексонометрическое титрование. М.: Химия, 1970. 360 с.
Шелехов Е.В., Свиридова Т.А. // Металловедение и термическая обработка металлов. 2000. № 8. С. 16.
Визильтер Ю.В., Желтов С.Ю., Князь В.А. и др. Обработка и анализ цифровых изображений с примерами на LabVIEW IMAQ Vision. М.: ДМК Пресс, 2009. 464 с.
Пронин А.С., Семенов С.А., Дробот Д.В., Джардималиева Г.И. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 1005. https://doi.org/10.1134/S0044457X18080196
Юданова Л.И., Логвиненко В.А., Юданов Н.Ф. и др. // Неорган. материалы. 2013. Т. 49. № 10. С. 1138.
Кочетова И.М., Семенов С.А., Помогайло А.Д., Джардималиева Г.И. // Химическая технология (сб. тез. докл.): IV Всерос. конф. по хим. технол. М.: ИОНХ, 2012. Т. 2. С. 78.
Семенов С.А., Дробот Д.В., Мусатова В.Ю., Пронин А.С. и др. // Журн. неорган. химии. 2015. Т. 60. № 8. С. 991. https://doi.org/10.7868/S0044457X15080176
Мусатова В.Ю., Семенов С.А., Дробот Д.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 9. С. 1168. https://doi.org/10.7868/S0044457X16090166
Розен А.М., Крупнов Б.В. // Журн. физ. химии. 1995. Т. 69. № 10. С. 1891.
O'Grady K., Laidler H. // J. Magn. Magn. Mater. 1999. V. 200. P. 616. https://doi.org/10.1016/S0304-8853(99)00499-0
Багмут А.Г., Шипкова И.Г., Жучков В.А. // Журн. техн. физики. 2011. Т. 81. Вып. 4. С. 102.
Yoon Tae Jeon, Je Yong Moon et al. // J. Phys. Chem. B. 2006. V. 110. P. 1187.
Mahendraprabhu K., Elumalai P. // J. Sol-Gel Sci. Technol. 2015. V. 73. P. 428.
Proenca M.P., Sousa C.T., Pereira A.M. et al. // Phys. Chem. Chem. Phys. 2011. V. 13. P. 9561.
Thota S., Kumar J. // J. Phys. Chem. Solids. 2007. V. 68. P. 1951.
Помогайло А.Д., Джардималиева Г.И. Металлополимерные гибридные нанокомпозиты. М.: Наука, 2015. 494 с.
Martin J.I., Nogues J., Liu K. et al. // J. Magn. Magn. Mater. 2003. V. 256. P. 449.
Непийко С.А. Физические свойства малых металлических частиц. К.: Наук. думка, 1989. 246 с.
Sowka E., Leonowicz M., Kazmierczak J. et al. // Physica. 2006. V. 384B. P. 282.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии