Журнал неорганической химии, 2021, T. 66, № 1, стр. 81-87
Термическая устойчивость смешанных фторидов 3d-элементов
М. И. Никитин a, Н. С. Чилингаров b, А. С. Алиханян a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: alikhan@igic.ras.ru
Поступила в редакцию 18.06.2020
После доработки 30.07.2020
Принята к публикации 31.07.2020
Аннотация
Проанализированы литературные данные о существовании смешанных фторидов 3d-элементов M(II)M(III)F5 (M = Mn, Fe, Co, Ni). Рассмотрены гетерогенные равновесия в системах MF2–MF3, рассчитаны константы равновесия и энтальпии реакций с участием M2F5(к). Подтверждено значение энтальпии сублимации FeF2, равное 268.7 ± 1.9 кДж/моль, и существенно уточнена величина энтальпии сублимации FeF3(к), равная 264.5 ± 2.2 кДж/моль. Определены величины стандартных энтальпий образования кристаллических фторидов Mn2F5, Fe2F5, Co2F5 и Ni2F5, равные при температуре 0 K –1909.0 ± 7.8, –1716.3 ± 4.4, ≥–1554.2 ± 11 и –1370.5 ± 8.0 кДж/моль соответственно. Величины энтальпий и энергий Гиббса образования этих соединений из кристаллических MF2 и MF3 попадают в диапазон значений, характерных для твердых растворов со слабым взаимодействием.
ВВЕДЕНИЕ
Существование смешанных фторидов 3d-элементов M(II)M(III)F5 известно достаточно давно, например Fe2F5 [1], Cr2F5 [2]. Они легко синтезируются из водных растворов фторидов M(II) и M(III) в виде кристаллогидратов с различным содержанием воды. При их термическом обезвоживании происходит только частичное удаление воды. Дальнейшее повышение температуры приводит к термогидролизу [3].
Это ставит под сомнение результаты [1]. Действительно, по данным [4], диаграмма фазового состояния системы FeF2–FeF3 включает только простую эвтектику состава 1 : 1. Образование соединения Fe2F5 не обнаружено. Однако в более поздней работе [5] методом рентгенофазового анализа (РФА, синхротронное излучение) достоверно обнаружены фазы M2F5 для Mn, Fe и Co, а Ni2F5 синтезирован термическим разложением безводного фторида Ni(III) [6] и помимо химического анализа идентифицирован методом РФА как индивидуальная фаза.
Цель настоящей работы – устранение этих противоречий и получение термодинамических характеристик смешанных кристаллических фторидов M2F5 3d-элементов, необходимых для расчетов равновесий реакций с их участием.
Так, одним из современных способов получения магнитных сплавов, включающих редкоземельные элементы, является восстановление безводных смесей их трифторидов с фторидом железа(III), получаемым фторированием его оксида газообразным фтором. Применяемые условия фторирования должны исключать возможность образования кристаллического Fe2F5 [7, 8].
СИСТЕМА MnF3–MnF2
Насыщенный пар над системой VF3–MnF3 начального состава, близкого к MnF3, был исследован эффузионным методом с масс-спектрометрической регистрацией состава пара [9]. Для реакции
(1)
${\text{Mn}}{{{\text{F}}}_{4}}\left( {\text{г}} \right) + {\text{V}}{{{\text{F}}}_{4}}\left( {\text{г}} \right) = {\text{Mn}}{{{\text{F}}}_{3}}\left( {\text{г}} \right) + {\text{V}}{{{\text{F}}}_{5}}\left( {\text{г}} \right)$Казалось бы, устранить проблему расшифровки ионных токов из молекул фторидов марганца можно заменой реакции (1) гетерогенной реакцией
(2)
${\text{V}}{{{\text{F}}}_{4}}\left( {\text{г}} \right) + {\text{Mn}}{{{\text{F}}}_{3}}\left( {\text{к}} \right) = {\text{V}}{{{\text{F}}}_{5}}\left( {\text{г}} \right) + {\text{Mn}}{{{\text{F}}}_{2}}\left( {\text{к}} \right),$Таблица 1.
Расчет энтальпий реакций (2), (3) (в кДж/моль) и активностей (a) фторидов марганца в системе MnF3–VF3
| T, K | K ° ((2), 0) | ΔrH ° ((2), 0) | ΔΔrH °(2) | a(MnF2) | a(MnF3) | ΔrH °((3), 0) |
|---|---|---|---|---|---|---|
| [12] | Настоящая работа | |||||
| 957 | 0.69 | –17.5 | –10.8 | 0.26 | 1 | 10.8 |
| 957 | 0.71 | –17.7 | –10.9 | 0.25 | 1 | 10.9 |
| 957 | 0.88 | –19.4 | –12.6 | 0.20 | 1 | 12.6 |
| 957 | 0.76 | –18.3 | –11.5 | 0.24 | 1 | 11.5 |
| 957 | 0.64 | –16.9 | –10.1 | 0.28 | 1 | 10.1 |
| 967 | 0.65 | –17.2 | –10.4 | 0.27 | 1 | 10.4 |
| 967 | 0.62 | –16.8 | –10.1 | 0.29 | 1 | 10.1 |
| 967 | 0.53 | –15.6 | –8.8 | 0.33 | 1 | 8.8 |
| [10] | Настоящая работа | |||||
| 823 | 1.2 | –19.3 | –12.5 | 0.16 | 1 | 12.5 |
| 873 | 0.055 | 2.3 | 9.1 | 1 | 0.28 | 9.1 |
| 1013 | 0.049 | 3.9 | 10.6 | 1 | 0.28 | 10.6 |
| 1013 | 0.053 | 3.1 | 9.9 | 1 | 0.31 | 9.9 |
Видно, что и в этом случае в пределах разброса значений величина ${{\Delta }_{r}}H_{0}^{^\circ }$ (2) различается не только в [12] и [10], но и в самой работе [10]. Кроме того, она не согласуется с рассчитанной по энтальпиям образования фторидов ванадия [11] и кристаллических ди- и трифторидов марганца и равна ΔrH °((2), 0) = –6.8 кДж/моль. Энтальпии образования при 0 K кристаллических дифторида (–852.1 ± 5.0 кДж/моль) и трифторида марганца (–1046.2 ± 6.0 кДж/моль) получены пересчетом энтальпий равновесий из работы [15].
Это объясняется изменением в ходе опыта исходного состава системы, близкого к MnF3, из-за расхода фтора на реакции с фторидами ванадия на состав, близкий к MnF2. При этом активности фторидов марганца равны единице, если соединение Mn2F5 не образуется, и плавно меняются от единицы до нуля и от нуля до единицы при неограниченной растворимости компонентов. При образовании соединения Mn2F5 существуют две области: 100 мол. % MnF3–50 мол. % MnF2, где a(MnF3) = 1 и a(MnF2) < 1, и 50 мол. % MnF3–100 мол. % MnF2, где a(MnF3) < 1 и a(MnF2) = 1.
По результатам измерений получены две группы со средними значениями ${{\Delta }_{r}}H_{0}^{^\circ }$(2) –17.7 ± 0.9 и 3.1 ± 1.9 кДж/моль. Отклонения ΔΔrH °(2) от рассчитанного выше значения ΔrH°((2), 0) составляют –17.7 – (–6.8) = –10.9 и 3.1 – (–6.8) = = 9.9 кДж/моль. Использование этих отклонений позволяет рассчитать величины активностей фторидов марганца из соотношения ΔΔrH°(2) = = ‒RT ln(K°(2)/K°(2)'), где K°(2) соответствует единичным активностям MnF2 и MnF3, а K°(2)' – их реальным активностям (отношения парциальных давлений VF4 и VF5 в обоих случаях одно и то же). Таким образом, для положительных отклонений lna(MnF3) = –ΔΔrH°(2)/RT, а для отрицательных – lna(MnF2) = ΔΔrH°(2)/RT (табл. 1).
Понижение активностей объясняется образованием в системе MnF2–MnF3 соединения Mn2F5(к), энтальпия образования которого ${{\Delta }_{f}}H_{0}^{^\circ }$(Mn2F5(к)) = = –1909.0 ± 7.8 кДж/моль вычисляется по энтальпии реакции
K°(3) = a(MnF2) × a(MnF3)/a(Mn2F5), ΔrH° ((3), 0) = = 10.6 ± 0.8 кДж/моль. Расчет по II-му закону термодинамики дает из температурной зависимости lnK°((3), T) = –(1984 ± 589) + (0.746 ± 0.625), ΔrH°((3), T) = 16.5 ± 4.9 кДж/моль и ΔrS°((3), T) = = 6.2 ± 5.2 Дж/(моль K).СИСТЕМА FeF3–FeF2
В [12] масс-спектрометрическим методом была исследована ионная составляющая насыщенного пара над системой FeF3–AlF3 начального мольного состава 1 : 0.023. Испарение проводили из платиновой эффузионной камеры. После завершения эксперимента РФА не показал однозначного присутствия в остатке ни FeF2, ни Fe2F5. Возможно, остаток представлял оксифторид FeOF или твердый раствор перечисленных веществ.
Рассчитанная по данным [12] энтальпия реакции
(4)
${\text{Fe}}{{{\text{F}}}_{3}}\left( {\text{к}} \right) + {\text{AlF}}_{4}^{ - }\left( {\text{г}} \right) = {\text{Al}}{{{\text{F}}}_{3}}\left( {\text{к}} \right) + {\text{FeF}}_{4}^{ - }\left( {\text{г}} \right)$Таблица 2.
Рассчитанные по данным [12] термодинамические характеристики реакции (4), ΔrH °((4), 0), кДж/моль
| T, K | K°(4) | ΔrH° (4) | a(FeF3) |
|---|---|---|---|
| 701 | 0.135 | 12.6 | 0.54 |
| 722 | 0.191 | 11.4 | 0.45 |
| 734 | 0.170 | 12.7 | 2.0 |
| 775 | 0.070 | 20.4 | 0.91 |
| 775 | 0.254 | 12.1 | 0.93 |
| 798 | 0.393 | 10. 3 | 0.76 |
| 798 | 0.274 | 12.7 | 0.75 |
| 816 | 0.190 | 16.0 | 1.0 |
| 837 | 0.158 | 18.4 | 1.3 |
| 837 | 0.128 | 19.9 | 1.3 |
| 857 | 0.069 | 25.5 | 0.41 |
| 888 | 0.088 | 25.7 | 0.34 |
| 907 | 0.036 | 33.6 | 0.29 |
| 907 | 0.120 | 24.6 | 0.18 |
| 878 | 0.082 | 25.5 | 0.20 |
| 878 | 0.206 | 18.8 | 0.18 |
| 878 | 0.073 | 26.4 | 0.06 |
| 878 | 0.088 | 25.0 | 0.14 |
| 927 | 0.113 | 26.3 | 0.17 |
| 927 | 0.087 | 28.4 | 0.25 |
Активности a(FeF3) рассчитаны по отклонениям от средней величины ΔrH°((4), 0) = 12.2 ± ± 0.2 кДж/моль внутри интервала 701–837 K, где принято, что a(FeF3) = 1. В интервале 837–857 K происходит статистически достоверный рост ΔrH°((4), 0) до 25.1 ± 0.3 кДж/моль, a(FeF3) при этом практически скачком падает и мало меняется с ростом температуры до 927 K. Кратковременное нагревание системы, когда из-за испарения состав изменялся очень мало, это подтвердило, причем снижение температуры до ~720 K приводило к восстановлению величины K°(4). При вскрытии эффузионной камеры обнаружено, что поверхность образца покрыта тонким слоем вещества желто-коричневого цвета, под которым находились зеленые кристаллы трифторида железа. Анализ налета не проводили, поэтому однозначно утверждать, что образовался дифторид железа и установилось равновесие реакции
(5)
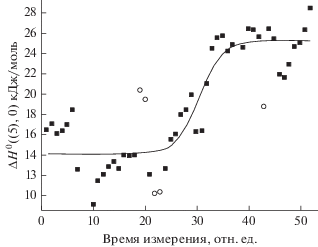
${\text{F}}{{{\text{e}}}_{2}}{{{\text{F}}}_{5}}\left( {\text{к}} \right) = {\text{Fe}}{{{\text{F}}}_{3}}\left( {\text{к}} \right) + {\text{Fe}}{{{\text{F}}}_{2}}\left( {\text{к}} \right),$Особенно наглядно это видно на рис. 1. Здесь значения ${{\Delta }_{r}}H_{0}^{^\circ }$(5) последовательно и равномерно размещены по времени проведения опыта (измерения проводили через примерно одинаковый временной интервал). Полученная зависимость аппроксимирована (при аппроксимации значения энтальпий, обозначенные черными кружками, удалены) сигмоидальной функцией. Разность энтальпий между участками, параллельными оси абсцисс (11.1 кДж/моль), является поправкой к измеряемой энтальпии сублимации FeF3 из препаратов, сравнимых по содержанию воды и качеству.
Прежде всего это относится к работам [16, 17], в которых эффузионным методом (сдвоенная платиновая камера, стандартное вещество KF) c масс-спектрометрическим анализом состава пара определено давление p(FeF3) = 2.2 × 10–5 атм при 1002 K. Эта величина соответствует энтальпии сублимации 275.0 кДж/моль, а с учетом поправки ΔsH °(FeF3, 0) = 263.9 кДж/моль. Близкое значение 265.2 ± 2.2 кДж/моль получено в [13, 18] методом точек кипения. Рекомендованная в настоящей работе величина равна среднему арифметическому ΔsH°(FeF3, 0) = 264.5 ± 2.2 кДж/моль и заметно отличается от принятой в [16, 17].
Из рассмотренного материала следует вывод: необходимо работать с чистыми препаратами FeF3 в условиях, исключающих попадание в них гигроскопической воды. Такие условия были созданы в работах [19, 20] при масс-спектрометрическом изучении взаимодействия трифторида железа с металлическими платиной, никелем и железом.
Так, в [19] показано, что навеска трифторида железа полностью испаряется из платиновой эффузионной камеры без разложения. Полученный масс-спектр практически совпал с данными [16, 17] (в скобках): ${\text{FeF}}_{3}^{ + }$ : ${\text{FeF}}_{2}^{ + }$ : FeF+ : Fe+ = = 0.21 (0.193) : 1 : 0.24 (0.24) : 0.203 (0.18).
В присутствии никеля на начальной стадии происходит разложение трифторида железа, как помещенного в инертный контейнер, так и при непосредственном контакте [20]. Одновременно идет образование новой фазы Fe2F5(к) и накопление FeF2(к). Активность FeF3 при этом меньше единицы, а в масс-спектре насыщенного пара регистрируются молекулы FeF3 и FeF2. Расшифровку суммарного масс-спектра, приведенного в табл. 3, проводили по индивидуальным масс-спектрам FeF3 и FeF2 [17]. Последний (в скобках) совпал с полученным в опыте по полному испарению дифторида железа из платиновой эффузионной камеры [19]: ${\text{FeF}}_{2}^{ + }$ : FeF+ : Fe+ = 0.53 (0.538) : 1 : 0.30 (0.267). В этом опыте также определено давление насыщенного пара FeF2, равное 9.24 × 10–5 атм при 1080 K. Рассчитанная по этому значению ΔsH°(FeF2, 0) = 267.5 кДж/моль хорошо согласуется с величиной, полученной в [13] по данным [21] эффузионным и торзионным методами (‒269.9 ± 1.9 кДж/моль). Среднее арифметическое значение ΔsH°(FeF2, 0) = 268.7 ± 1.9 кДж/моль принято в данной работе как рекомендованная величина.
Таблица 3.
Масс-спектры насыщенного пара при испарении фторида Fe(III) в различных условиях, активности a(FeF3) и энтальпии реакций (5, 7) при 0 K (в кДж/моль)
| [20] | Настоящая работа | ||||||
|---|---|---|---|---|---|---|---|
| T, K | i(Fe${\text{F}}_{3}^{ + }$) | i(Fe${\text{F}}_{2}^{ + }$) | I(FeF+) | a(FeF3) | ΔrH°(5) | K°(7) | ΔrH°(7) |
| FeF3 в платиновом контейнере, помещенном в никелевую эффузионную камеру | |||||||
| 1019 | 0.16 | 1.0 | 0.256 | 11.6 | |||
| 1021 | 0.17 | 1.0 | 0.391 | 7.97 | |||
| 1023 | 0.19 | 1.0 | 3.36 | –10.3 | |||
| 1055 | 0.11 | 1.0 | 0.074 | 22.8 | |||
| 1056 | 0.14 | 1.0 | 0.149 | 16.7 | |||
| 1056 | 0.23 | 1.0 | –0.350 | ||||
| 1063 | 0.16 | 1.0 | 0.276 | 11.4 | |||
| 1063 | 0.16 | 1.0 | 0.31 | 0.276 | 11.4 | ||
| 1080 | 0.19 | 1.0 | 3.71 | –11.8 | |||
| 1081 | 0.20 | 1.0 | –1.68 | ||||
| 1097 | 0.19 | 1.0 | 3.82 | –12.2 | |||
| 984 | 0.20 | 1.0 | 0.24 | –1.42 | |||
| 984 | 0.19 | 1.0 | 3.14 | –9.36 | |||
| 988 | 0.14 | 1.0 | 0.28 | 0.132 | 16.6 | ||
| 1049 | 0.20 | 1.0 | –1.59 | ||||
| 1050 | 0.19 | 1.0 | 3.52 | –11.0 | |||
| 1050 | 0.06 | 0.80 | 1.0 | 0.036 | 29.2 | ||
| 1050 | 0.02 | 0.50 | 1.0 | 0.015 | 36.9 | 68.7 | –41.5 |
| 1075 | 0.01 | 0.63 | 1.0 | 0.005 | 47.0 | 192 | –51.9 |
| 1082 | 0.02 | 0.43 | 1.0 | 0.019 | 35.8 | 53.6 | –40.8 |
| 1086 | 0.02 | 0.60 | 1.0 | 0.012 | 39.7 | 80.9 | –44.7 |
| 1086 | 0.01 | 0.40 | 1.0 | 0.009 | 42.7 | 113 | –47.8 |
| 1093 | 0.01 | 0.41 | 1.0 | 0.009 | 43.2 | 115 | –48.3 |
| 1095 | 0.02 | 0.69 | 1.0 | 0.011 | 41.4 | 94..1 | –46.5 |
| 1095 | 0.01 | 0.59 | 1.0 | 0.006 | 46.9 | 173 | –52.1 |
| 1097 | 0.02 | 0.56 | 1.0 | 0.014 | 39.1 | 73.0 | –44.3 |
| 1101 | 0.01 | 0.60 | 1.0 | 0.006 | 47.2 | 174 | –52.5 |
| 1101 | 0.01 | 0.62 | 1.0 | 0.006 | 47.6 | 181 | –52.8 |
| FeF3 в никелевой эффузионной камере | |||||||
| 933 | 0.20 | 1.0 | 0.60 | –1.44 | |||
| 1000 | 0.15 | 1.0 | 0.76 | 0.178 | 14.4 | ||
| 1017 | 0.15 | 1.0 | 0.50 | 0.183 | 14.3 | ||
| 1023 | 0.14 | 1.0 | 0.60 | 0.140 | 16.7 | ||
| 1042 | 0.15 | 1.0 | 0.50 | 0.191 | 14.3 | ||
| 1044 | 0.15 | 1.0 | 0.45 | 0.192 | 14.3 | ||
| 1055 | 0.15 | 1.0 | 0.60 | 0.196 | 14.3 | ||
| 1073 | 0.14 | 1.0 | 0.43 | 0.153 | 16.8 | ||
| 1086 | 0.13 | 1.0 | 0.60 | 0.122 | 19.0 | ||
| 1086 | 0.13 | 1.0 | 1.07 | 0.122 | 19.0 | ||
| 1089 | 0.04 | 1.0 | 1.95 | 0.0156 | 37.7 | 64.3 | –42.8 |
| 1089 | 0.03 | 1.0 | 2.00 | 0.0110 | 40.9 | 91.3 | –46.0 |
| 1114 | 0.03 | 1.0 | 2.00 | 0.0114 | 41.4 | 87.5 | –46.8 |
| 1145 | 0.02 | 1.0 | 1.90 | 0.0076 | 46.5 | 132 | –52.3 |
В [20] не указан состав конденсированной фазы, к которому относятся измерения в табл. 3. Ниже рассмотрены два варианта расчета включенных в нее величин.
1) Парциальные давления FeF3 в области составов FeF2–Fe2F5 рассчитывали по формулам p(FeF2) = p°(FeF2) и p(FeF3) = p°(FeF2) × C. Отношения парциальных давлений три- и дифторидов железа (C) рассчитывали по отношениям полных ионных токов молекул с учетом полных сечений ионизации. В свою очередь, отношения полных ионных токов находили из отношений токов молекулярных ионов и их долей в масс-спектрах из [17]. Следует отметить, что использование масс-спектров из [19, 20] принципиально не меняет величины активностей (и энтальпий реакций) в табл. 3. Давление насыщенных паров FeF2 и FeF3 вычислено по принятым в данной работе энтальпиям сублимации и использовано для расчета активностей.
2) Подобный расчет для области составов Fe2F5–FeF3 дает физически абсурдные величины активностей фторида железа(III).
Следовательно, представленные в табл. 3 активности FeF3 относятся к области составов FeF2–Fe2F5 с единичными активностями и позволяют рассчитать K°((5), T) = a(FeF2) × a(FeF3)/a(Fe2F5) и ΔrH°((5), 0) = 13.9 ± 1.7 кДж/моль (подчеркнуты в табл. 3). Погрешности измерений ионных токов и расшифровки масс-спектров, особенно при малом вкладе в суммарный масс-спектр ионных токов из молекул FeF2, приводят в некоторых случаях к физически нереальным активностям FeF3 и из расчетов исключены. Результаты, полученные на завершающих стадиях опытов, рассмотрены в разделе “Обсуждение результатов”. Энтальпия образования ΔfH°(Fe2F5(к), 0) = –1716.3 ± 4.4 кДж/моль рассчитана по данным [12] и настоящей работы.
Результаты опыта по взаимодействию фторида железа(III) с металлическим железом [19] не приведены, так как равновесия интересующих реакций не устанавливали.
СИСТЕМА NiF3–NiF2
Система NiF3–NiF2 подробно рассмотрена в [22]. Энтальпии образования ΔfH°(Ni2F5(к), 0) = = –1370.5 ± 8 и ΔfH°(NiF3(к), 0) = –699.8 ± ± 3 кДж/моль дают энтальпию реакции
ΔrH°(0) = 10.6 ± 1.1 кДж/моль.СИСТЕМА CoF3–CoF2
Какие-либо данные о термодинамических характеристиках Co2F5 или полезных для их расчета нами не найдены. Вряд ли завышенную в [23] энтальпию сублимации CoF3 по сравнению с [24] можно однозначно объяснить образованием кристаллического Co2F5. В лучшем случае ее можно рассматривать как оценку сверху ΔrH°(0) ≤ 19 кДж/моль реакции
(6)
${\text{C}}{{{\text{o}}}_{2}}{{{\text{F}}}_{5}}\left( {\text{к}} \right) = {\text{Co}}{{{\text{F}}}_{3}}\left( {\text{к}} \right) + {\text{Co}}{{{\text{F}}}_{2}}\left( {\text{к}} \right).$В [25] возможность образования Co2F5(к) не учитывалась, поэтому величины энтальпий образования Co2F5(к) и CoF3(к) следует скорректировать. При выбранных для них термодинамических функциях разности [ΔfH°(CoF3(к), 0) – ΔfH°(CoF2(к), 0)] в [25] и [2 × ΔfH°(CoF3(к), 0) – ΔfH°(Co2F5(к), 0)] численно равны 189.1 кДж/моль. Комбинация ΔrH°((6), 0) и последней разности дает Δf H °(CoF3(к), 0) = –872.3 ± 10 и ΔfH °(Co2F5(к), 0) = = –1555.4 ± 11 кДж/моль.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Характерной особенностью кристаллических M2F5 являются практически одинаковые малые энтальпия и энергия Гиббса реакции
Приведем еще два примера. Визуальные наблюдения показывают превращение при нагревании черного NiF3(к) до температур, не сильно превышающих комнатную, в красно-коричневый Ni2F5(к) [6]. В [26] отмечено его легкое разложение до NiF2(к). В [5] найдено, что при медленном разложении фторида кобальта(III) в никелевом капилляре, когда края капилляра плотно сжаты, образуется Co2F5(к). При таких же условиях, но в потоке аргона образуется только фторид кобальта(II). Трудно сказать, насколько этим требованиям удовлетворяет эффузионная камера с конкретными параметрами. В связи с этим желательно подтверждение установления термодинамического равновесия в опытах [19, 20].
Ожидать в присутствии восстановителя сохранения единичной активности FeF3 не приходится. Так, для реакции
(7)
${\text{Fe}}{{{\text{F}}}_{3}}\left( {\text{к}} \right) + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{\text{Ni}}\left( {\text{к}} \right) = {\text{Fe}}{{{\text{F}}}_{2}}\left( {\text{к}} \right) + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{\text{Ni}}{{{\text{F}}}_{2}}\left( {\text{к}} \right)$ЗАКЛЮЧЕНИЕ
Рассчитанные в этой работе по литературным данным результаты подтверждают существование термически малоустойчивых кристаллических смешанных фторидов (M2F5) марганца, железа, кобальта и никеля. Их рекомендованные энтальпии образования, а также газообразного FeF3 представляются достаточно надежными и могут быть включены в базы справочных данных для использования в термодинамических расчетах. Диаграммы состояния рассмотренных систем нуждаются в дальнейшем исследовании с учетом существования малоустойчивых соединений M2F5(к).
Список литературы
Brauer G., Eichner M.Z. // Z. Anorg. Allg. Chem. 1958. Bd. 296.
Stainfenk H., Burns J.H. // Acta Crystallogr. 1964. V. 17. P. 823. https://doi.org/10.1107/S0365110X64002237
Ипполитов Е.Г., Трипольская Т.А. // Журн. неорган. химии. 1987. Т. 25. № 3. С. 775.
Циклаури Ц.Г., Ипполитов Е.Г., Жигарновский Б.М. и др. // Сообщения АН Груз. ССР. 1973. Т. 69. № 3. С. 593.
Rau J.V., Albertini V.R., Chilingarov N.S. et al. // Bull. Chem. Soc. Jpn. 2003. V. 76. № 6. P. 1165.
Tramšek M., Žemva B. // Acta Chim. Slov. 2002. V. 49. P. 209.
Жеронкина О.Г., Софронов В.Л., Буйновский А.С. и др. // Актуальные вопросы добычи, производства и применения редкоземельных элементов в России. Тез. докл. 19–21 ноября 2013 г. Томск. 2013. С. 87.
Сазонова Л.Р., Андреев В.А. // XII Междунар. конф. студентов и молодых ученых “Перспективы развития фундаментальных наук”. Россия, Томск. 21–24 апреля, 2015. С. 514.
Igolkina N.A., Nikitin M.I. Boltalina O.V. et al. // High. Temp. Sci. 1986. V. 21. P. 111.
Nikitin M.I., Zbezhneva S.G. // Russ. High Temperature. 2014. V. 52. № 5. P. 778. [Никитин М.И., Збежнева С.Г. // ТВТ. 2014. Т. 52. № 5. С. 800.] https://doi.org/10.7868/S0040364414050135
Nikitin M.I., Zbezhneva S.G. // Russ. High Temperature. 2014. V. 52. № 6. P. 809. [Никитин М.И., Збежнева С.Г. // ТВТ. 2014. Т. 52. № 6. С. 809.] https://doi.org/10.7868/S0040364414060106
Иголкина Н.А. Отрицательные ионы в парах фторидов металлов первого переходного ряда. Дис. канд. хим. наук. М.: Изд-во Моск. ун-та, 1983. 133 с.
Термодинамические свойства индивидуальных веществ. Электронное справочное издание. Т. 5. Элементы Mn, Cr, V, Sc и их соединения (https://www.chem.msu.su/rus/tsiv/).
Гурвич Л.В., Вейц И.В., Медведев В.А. и др. Термодинамические свойства индивидуальных веществ. Справочное издание в 4-х томах. М.: Наука, 1978–1982.
Никитин М.И., Раков Э.Г., Цирельников В.И., Хаустов С.В. // Журн. неорган. химии. 1997. Т. 42. № 7. С. 1154.
Журавлева Л.В., Алиханян А.С., Сидоров Л.Н. // Журн. физ. химии. 1976. Т. 50. № 7. С. 1349.
Журавлева Л.В., Алиханян А.С., Сидоров Л.Н. Рукопись деп. ВИНИТИ. № 459-76. М., 1976.
Johansen H.G. Ph. D. Thesis. Trondheim: Univ. of Trondheim Norway, Dept. 1975.
Рау Д.В. Масс-спектральное исследование реакций атомарного фтора с фторидами кобальта и железа. Дис. … канд. хим. наук. М., 1990. 147 с.
Чилингаров Н.С., Скокан У.В., Рау Д.В. // Журн. физ. химии. 1994. Т. 68. № 7. С.1183.
Bardi G., Brunetti B., Piacente V.G. // Chem. Eng. Data. 1996. V. 41. № 1. P. 14.
Nikitin M.I., Alikhanyan A.S. // Russ. J. Inorg. Chem. 2019. V. 64. № 5. P. 641. [Никитин М.И., Алиханян А.С. // Журн. неорган. химии. 2019. Т. 64. № 5. С. 528.] https://doi.org/10.1134/S0036023619050139
Никулин В.В., Попов А.И., Зайцева И.Г. и др. // Журн. неорган. химии. 1984. Т. 29. № 1. С. 38.
Osina E.V., Chilingarov N.S., Osin S.B. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 2. P. 185. [Осина Е.Л., Чилингаров Н.С., Осин С.Б. и др. // Журн. физ. химии. 2019. Т. 93. № 2. С. 163.] https://doi.org/10.1134/S0036024419020195
Nikitin M.I., Chilingarov N.S., Alikhanyan A.S. // Russ. J. Inorg. Chem. 2019. V. 64. № 3. P. 377. [Никитин М.И., Чилингаров Н.С., Алиханян А.С. // Журн. неорган. химии. 2019. Т. 64. № 3. С. 302.] https://doi.org/10.1134/S0036023619030136
Vasiliev A.A., Bezmelnitsin V.N., Siniansri V.F. et al. // J. Fluor. Chem. 1999. V. 95. № 1–2. P. 153. https://doi.org/10.1016/S0022-1139(99)00015-9
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии