Журнал неорганической химии, 2021, T. 66, № 12, стр. 1700-1705
Синтез, кристаллическая структура и термодинамические свойства CuSm2Ge2O8
Л. Т. Денисова a, *, М. С. Молокеев a, b, Ю. Ф. Каргин c, Л. А. Иртюго a, Н. В. Белоусова a, В. М. Денисов a
a Сибирский федеральный университет
660041 Красноярск, пр-т Свободный, 79, Россия
b Институт физики им. А.В. Киренского ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок, 50, Россия
c Институт металлургии и материаловедения им. А.А. Байкова РАН
119991 Москва, Ленинский пр-т, 49, Россия
* E-mail: ldenisova@sfu-kras.ru
Поступила в редакцию 28.04.2021
После доработки 08.06.2021
Принята к публикации 28.06.2021
Аннотация
Твердофазным методом с использованием в качестве компонентов CuO, Sm2O3 и GeO2 выполнен синтез на воздухе при конечной температуре обжига 1273 K (200 ч) германата меди-самария состава CuSm2Ge2O8 и определена его кристаллическая структура (пр. гр. Cm; a = 9.7592(2), b = 15.2608(4), c = 8.2502(2) Å, β = 148.2566(8)°, V = 646.46(3) Å3). На температурной зависимости молярной теплоемкости Cp = f(T), измеренной в интервале температур 350–1000 K, установлено наличие экстремума с максимумом при Tmax = 498.5 K, связанного с фазовым переходом. По экспериментальным данным рассчитаны термодинамические свойства.
ВВЕДЕНИЕ
При исследовании систем CuO–M2O3–ЭO2 (M = Al, Ga, Fe, Cr, Bi, Y; Э = Si, Ge) при 1273 K установлено образование трех новых соединений: CuY2Ge2O8, CuY2Ge4O12 и CuY2Si4O12 [1]. Позднее этими же авторами замещением Y на редкоземельные элементы (за исключением Ce и Lu) получены соединения CuR2Ge2O8 (R = La–Yb) [2]. К настоящему времени они исследованы крайне мало. Имеются сведения об их оптических (R = Sm–Tm, Y [3], CuNd2Ge2O8 [4]) и магнитных свойствах (CuNd2Ge2O8, CuY2Ge2O8 и CuLa2Ge2O8 [5], CuR2Ge2O8 (R = Pr, Nd, Sm, Eu) [6]). По данным [2], структура CuY2Ge2O8 является моноклинной с возможными пр. гр. $C\frac{2}{m}$, Cm и С2. Существует мнение, что CuY2Ge2O8, CuLa2Ge2O8 [5] и CuR2Ge2O8 (R = Pr, Nd, Sm, Eu) [6] имеют пр. гр. I1m1. Согласно [2, 4–6], германаты РЗЭ одинакового состава CuR2Ge2O8 и даже одни и те же соединения могут иметь разные пространственные группы (например, [2, 4] и [5, 6]). Теплофизические свойства германатов CuR2Ge2O8 ограничены лишь данными по теплоемкости при очень низких температурах: до 15 K CuY2Ge2O8 [5] и до 20 K CuR2Ge2O8 (R = Pr, Nd, Sm, Eu) [6]. Диаграммы состояния систем CuO–R2O3–GeO2 не построены. Для оптимизации условий синтеза и уточнения фазовых равновесий методами термодинамического моделирования необходимы сведения о термодинамических свойствах всех образующихся соединений в таких системах. Эти данные в литературе отсутствуют.
В связи с этим целью настоящей работы был синтез CuSm2Ge2O8, определение его кристаллической структуры, измерение высокотемпературной теплоемкости и расчет термодинамических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Германат CuSm2Ge2O8 получали твердофазным синтезом с использованием CuO (Alfa Aesor) – 99.9995%, Sm2O3 – 99.96% и GeO2 – 99.999% в качестве исходных компонентов. Стехиометрические смеси предварительно прокаленных исходных оксидов перетирали в агатовой ступке и прессовали в форме таблеток. Зная, что при высоких температурах, при которых ведется твердофазный синтез, происходит частичное испарение оксида германия [7], синтез проводили в закрытых тиглях, как и в работе [8]. Количественный состав сложных оксидных соединений подтверждали с помощью атомно-эмиссионной спектроскопии на спектрометре с индуктивно связанной плазмой Optima 5300 DV фирмы Perkin Elmer. Спрессованные образцы последовательно обжигали на воздухе при 1223, 1248 (по 10 ч) и 1273 K (200 ч). Для увеличения глубины протекания твердофазной реакции через каждые 10 ч проводили перетирание спека с последующим прессованием. Контроль фазового состава образцов осуществляли после каждой ступени синтеза соединения с использованием дифрактометра Bruker D8 Advance (CuKα-излучение) с линейным детектором Vantec. Установлено, что полученные образцы содержат следовое количество примеси в виде Sm2Ge2O7. Уточнение кристаллической структуры и определение параметров элементарной ячейки CuSm2Ge2O8 проводили методом Ритвельда с помощью программы TOPAS 4.2 [9].
Дифференциальный термический анализ и измерение высокотемпературной теплоемкости CuSm2Ge2O8 проводили на термоанализаторе STA 449 C Jupiter (Netzcsh, Германия) в атмосфере воздуха. При этом для измерения теплоемкости использовали специальные держатели TG + + DSC 6.226.1–72 + S и платиновые тигли с крышкой. Экспериментальные результаты обрабатывали с помощью пакета программ Netzsch Proteus Thermal Analysis. Математическую обработку данных проводили при помощи лицензионной программы Systat Sigma Plot 12. Методика экспериментов аналогична описанной в работах [10, 11]. Ошибка экспериментов не превышала 2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 приведена дифрактограмма полученного германата меди-самария. Почти все пики на рентгенограмме проиндицированы в моноклинной ячейке (пр. гр. Cm) с параметрами, близкими к таковым для CuNd2Ge2O8 [4], поэтому структура этого кристалла была взята в качестве стартовой модели для уточнения, в которой позицию Nd заменили на ион Sm. Тепловые параметры всех атомов уточняли в изотропном приближении. Координаты x, z атома Ge2 не уточняли, это требуется для фиксации начала координат в группе Cm. Уточнение шло стабильно и привело к низким значениям R-факторов (табл. 1). Координаты атомов и основные длины связей в элементарной ячейке кристалла CuSm2Ge2O8 представлены в табл. 2 и 3 соответственно.
Рис. 1.
Экспериментальный (1), расчетный (2) и разностный (3) профили рентгенограмм CuSm2Ge2O8 (штрихи указывают расчетное положение рефлексов).

Таблица 1.
Параметры элементарной ячейки CuSm2Ge2O8
| Состав | Настоящая работа | [2] |
|---|---|---|
| Пр. гр. a, Å c, Å b, Å β, град V, Å3 Z 2θ, град Rwp, % Rp, % Rexp, % RB, % χ2 |
Cm 9.7592(2) 15.2608(4) 8.2502(2) 148.2566(8) 646.46(3) 4 10–105 5.17 4.11 4.72 0.79 1.07 |
Cm 9.675(1) 15.259(1) 8.25(1) 147.95(1) 4 |
Таблица 2.
Атомные координаты и изотропные тепловые параметры (Å2) кристалла CuSm2Ge2O8
| Атом | x | y | z | Biso |
|---|---|---|---|---|
| Sm1 Sm2 Ge1 Ge2 Ge3 Cu1 O1 O2 O3 O4 O5 O6 O7 O8 O9 O10 |
0.479(13) 0.488(14) 0.427(7) 0.509 0.490(13) 0.494(14) 0.21(3) 0.21(3) 0.23(4) 0.22(4) 0.14(3) 0.15(3) 0.31(3) 0.32(3) 0.19(2) 0.160(17) |
0.1199(6) 0.1199(6) 0.5 0.5 0.290(2) 0.292(3) 0.5 0 0 0.5 0.091(8) 0.330(9) 0.404(8) 0.170(10) 0.237(5) 0.236(4) |
0.227(17) 0.742(18) 0.431(9) 0.0106 0.504(19) 0.962(18) 0.05(4) 0.38(4) 0.06(5) 0.39(5) 0.63(3) 0.16(3) 0.80(3) 0.34(4) 0.52(3) 0.85(2) |
0.2(3) 0.2(3) 0.2(12) 0.2(12) 0.2(7) 0.2(10) 0.3(5) 0.3(5) 0.3(5) 0.3(5) 0.3(5) 0.3(5) 0.3(5) 0.3(5) 0.3(5) 0.3(5) |
Таблица 3.
Основные длины связей в структуре CuSm2Ge2O8
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Sm1–O3 Sm1–O4i Sm1–O5ii Sm1–O6iii Sm1–O7iii Sm1–O8 Sm1–O9iii Sm1–O10ii Sm1–O1iv Sm2–O2 Sm2–O5 Sm2–O6v Sm2–O7iii Sm2–O8 Sm2–O9 Sm2–O10iii Ge1–O1 |
2.34(8) 2.30(7) 2.77(14) 2.29(9) 2.63(14) 2.51(6) 2.53(10) 2.46(9) 2.27(11) 2.42(12) 2.69(9) 2.39(13) 2.77(9) 2.24(16) 2.44(8) 2.43(6) 1.74(17) |
Ge1–O4 Ge1–O5vi Ge2–O2vi Ge2–O3vi Ge2–O7ii Ge3–O5iii Ge3–O6 Ge3–O8 Ge3–O9iii Ge3–O10iii Cu1–O6v Cu1–O7 Cu1–O8v Cu1–O9 Cu1–O10 Cu1–O10iii |
1.74(5) 1.77(12) 1.72(16) 1.82(5) 1.79(12) 1.98(13) 1.85(14) 2.03(16) 1.89(3) 1.73(11) 2.05(15) 1.96(13) 1.82(18) 2.10(14) 2.66(4) 2.49(4) |
Сравнение полученных нами параметров кристаллической структуры CuSm2Ge2O8 с данными работы [2] показывает (табл. 1), что они в целом согласуются между собой.
Влияние температуры на теплоемкость CuSm2Ge2O8 в интервале температур 350–1000 K иллюстрирует рис. 2. Из рисунка видно, что на кривой Cp = f(T) имеется экстремум с Tmax = 498.5 K (ΔHфп = 506 Дж/моль, ΔSфп = 1 Дж/(моль K)). Причиной его появления может быть термическая нестабильность соединения или фазовый переход. Данные о влиянии температуры на превращение Cu(II) → Cu(I) в соединении CuSm2Ge2O8 в литературе отсутствуют. Имеются многочисленные сведения о фазовых равновесиях и термодинамике систем Cu–O и CuO–Cu2O [12–18]. В единственной работе [1] есть информация о термической стабильности изоформульного соединения CuY2Ge2O8 в атмосфере аргона (разложение наблюдается начиная с T = 1253 K). В последней работе отмечено, что для многих оксидных соединений, содержащих в своем составе CuO, разложение в воздушной атмосфере начинается при температурах на 100‒200 K выше, чем в атмосфере аргона. Поэтому можно принять, что наличие экстремума на кривой Cp = f(T) не связано с нестабильностью CuSm2Ge2O8. В пользу последнего свидетельствует проведенное нами гравиметрическое исследование этого соединения. В интервале температур 320‒1000 K изменение массы образцов не зарегистрировано. На кривой дифференциального термического анализа CuSm2Ge2O8 имеется очень маленький размытый экстремум в области от 472 до 518 K (ΔH = = –0.15 кДж/моль). Следует отметить, что аналогичные результаты получены для соединения CuLa2Ge2O8 [2].
Рис. 2.
Влияние температуры на молярную теплоемкость CuSm2Ge2O8 (1, 2) и Sm2Ge2O7 (3); 1 – экспериментальные (линия – аппроксимирующая кривая), 2 – расчетные данные.
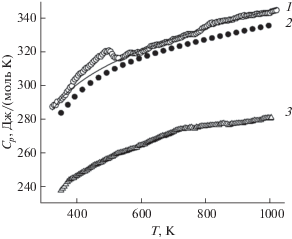
При исследовании влияния температуры на параметры элементарной ячейки CuLa2Ge2O8 выявлен плавный переход моноклинной структуры в орторомбическую, который заканчивается при 548 K [2]. В указанной работе отмечено, что объемно-центрированная орторомбическая ячейка легко получается из гранецентрированной моноклинной ячейки, а возможные моноклинные пространственные группы являются подгруппами орторомбических. Не исключено, что аналогичная картина наблюдается и в нашем случае для CuSm2Ge2O8.
С учетом близости структур CuSm2Ge2O8 до и после перехода зависимость Cp = f(T) в области исследованных температур (350–1000 K) описана уравнением Майера–Келли [19]:
которое для данного германата без учета фазового перехода имеет следующий вид (Дж/(моль K)):(2)
$\begin{gathered} {{C}_{p}} = \left( {302.3 \pm 1.1} \right) + \left( {45.54 \pm 1.10} \right) \times {\text{ }}{{10}^{{--3}}}T-- \\ - \,\,\left( {32.30 \pm 1.19} \right) \times {{10}^{5}}{{T}^{{--2}}}.~~~ \\ \end{gathered} $Коэффициент корреляции для уравнения (2) равен 0.9973, максимальное отклонение экспериментальных точек от аппроксимирующей кривой – 0.96%.
С использованием полинома (2) и известных уравнений [20] для CuSm2Ge2O8 рассчитаны его термодинамические свойства (табл. 4).
Таблица 4.
Сглаженные значения теплоемкости и термодинамические свойства CuSm2Ge2O8
| T, K | Cp, Дж/(моль K) | H°(T) – H°(350 K), кДж/моль | S°(T) – S°(350), Дж/(моль K) | –ΔG/T*, Дж/(моль K) |
|---|---|---|---|---|
| 350 400 450 500 550 600 650 700 750 800 850 900 950 1000 |
291.9 300.0 306.8 312.1 316.6 320.6 324.2 327.5 330.7 333.6 336.5 339.2 341.9 344.5 |
–
14.82
30.00 45.48 61.20 77.14 93.26 109.6 126.0 142.6 159.4 176.3 193.3 210.5 |
–
39.55
75.32 107.9 137.9 165.6 191.4 215.6 238.3 259.7 280.0 299.3 317.8 335.4 |
– 2.508.6516.9426.6337.0347.9259.0370.30 81.45 92.47 103.1 114.3 123.9 |
Поскольку имеющиеся в литературе сведения о теплоемкости CuSm2Ge2O8 ограничены только температурами до 20 K [6], проведено сравнение наших результатов со значениями, рассчитанными по различным моделям: Неймана–Коппа (НК) [21, 22] (в этом случае учтены два варианта: расчет с использованием данных по теплоемкости оксидов CuO, Sm2O3, GeO2 [21] (НК1) или CuO [21] и Sm2Ge2O8 [23] (НК2)), инкрементный метод Кумока (ИМК) [24], групповых вкладов (ГВ) [25], Келлога (Кел) [26]. Согласно результатам, обобщенным в табл. 5, лучшее согласие с экспериментом дает метод Кумока.
Таблица 5.
Сопоставление полученных данных по теплоемкости CuSm2Ge2O8 при 298 K (уравнение (2)) с рассчитанными значениями (Дж/(моль K))
| Ур. (2) | НК1 | Δ, % | НК2 | Δ, % | ИМК | Δ, % | ГВ | Δ, % | Кел | Δ, % |
|---|---|---|---|---|---|---|---|---|---|---|
| 279.5 | 262.0 | –6.2 | 264.0 | –5.5 | 273.4 | –2.2 | 265.9 | –4.9 | 262.5 | –6.1 |
Отметим, что модели НК, ИМК и Кел подробно описаны в монографиях [26–28]. В то же время метод групповых вкладов [25] не так часто используется на практике. Он основан на использовании уравнения:
коэффициенты a, b, c и d для конкретного соединения находят путем суммирования ионных вкладов составляющих ионов, образующих это соединение (значения коэффициентов a, b, c и d для ионов приведены в работе [25]). Анализ метода ГВ, предложенный для прогнозирования теплоемкости твердых оксидов [25], выполнен авторами [29]. Установлено, что для 113 оксидов средняя ошибка расчета Cp при 298 K равна 4.8%, а максимальная погрешность – 26.3%. На основании этого анализа в [29] сделано заключение, что метод групповых вкладов не всегда дает надежное прогнозирование температурной зависимости теплоемкости оксидов. Следует отметить, что метод ГВ может быть использован для расчета Cp = = f(T) сложных оксидов, когда другая дополнительная информация отсутствует.На рис. 2 приведена зависимость Cp = f(T) для Sm2Ge2O7 [23]. Можно отметить, что в этом случае значения молярной теплоемкости меньше таковых для CuSm2Ge2O8. Используя данные по температурной зависимости теплоемкости CuO [30] и Sm2Ge2O7 [23], мы рассчитали Cp = f(T) для CuSm2Ge2O8 (рис. 2, кривая 2). Полученные значения близки к экспериментальным, за исключением области экстремума, обусловленного фазовым превращением. Последнее можно было ожидать априори, так как на кривых Cp = f(T) для CuO и Sm2Ge2O7 экстремумы отсутствуют.
ЗАКЛЮЧЕНИЕ
Синтезировано сложное оксидное соединение CuSm2Ge2O8 и определена его кристаллическая структура. Исследовано влияние температуры в интервале 350–1000 K на молярную теплоемкость германата меди-самария. На температурной зависимости молярной теплоемкости Cp = f(T) установлено наличие экстремума с максимумом при Tmax = 498.5 K, связанного с фазовым переходом. По экспериментальным данным рассчитаны основные термодинамические функции (зависимости энтропии, приращения энтальпии и энергии Гиббса от температуры) германата меди-самария.
Список литературы
Lambert U., Eysel W. // Powder Diff. 1986. V. 1. № 2. P. 45.
Lambert U., Eysel W. // Powder Diff. 1986. V. 1. № 3. P. 256.
Baran E.J., Cascales C. // J. Raman Spectrosc. 1999. V. 30. P. 77.
Campa J.A., Gutiérez-Puebla E., Monge M.A. et al. // J. Solid State Chem. 1995. V. 120. P. 254.
Cho H., Kratochvilova M., Sim H. et al. // Phys. Rev. B. 2017. V. 95. P. 144404-1. https://doi.org/10.1103/PhysRevB.95.144404
Cho H., Kratochvilova M., Lee N. et al. // Phys. Rev. B. 2017. V. 96. P. 224427-1. https://doi.org/10.1103/PhysRevB.96.224427
Becker U.W., Felsche J. // J. Less-Common. Metals. 1987. V. 128. P. 269.
Денисова Л.Т., Каргин Ю.Ф., Иртюго Л.А. и др. // Журн. неорган. химии. 2020. Т. 65. № 5. С. 581. [Denisova L.T., Kargin Yu.F., Irtyugo L.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 5. P. 631.] https://doi.org/10.1134/S0036023620050071
Bruker AXS TOPAS V4: General profile and structure analysis software for powder diffraction data. Userʼs Manual. Bruker AXS, Karlsruhe, Germany, 2008.
Денисова Л.Т., Иртюго Л.А., Белоусова Н.В. и др. // Журн. физ. химии. 2019. Т. 93. № 3. С. 476. [Denisova L.T., Irtyugo L.A., Belousova N.V. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 3. P. 598.] https://doi.org/10.1134/S003602441903004X10.1134/S003602441903004Xhttps://doi.org/10.1134/S004445371903004X
Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Неорган. материалы. 2017. Т. 53. № 1. С. 71. [Denisova L.T., Irtyugo L.A., Beletskii V.V. et al. // Inorg. Mater. 2017. V. 53. № 1. P. 93.] https://doi.org/10.1134/S002016851701004610.1134/S0020168517010046https://doi.org/10.7868/S0002337X17010043
Lubu A. // J. Thermal. Analysis. 1970. V. 2. P. 445.
Hallstedt B., Risold D., Gauckler L.J. // J. Phase Equilibria. 1994. V. 15. № 5. P. 483.
Моисеев Г.К., Ватолин Н.А. // Журн. физ. химии. 1998. Т. 72. № 9. С. 1554.
Kosenko A.V., Emelʼchenko G.A. // J. Phase Equilibria. 2001. V. 22. P. 12. https://doi.org/10.1007/s11669-001-0050-x
Buch A.A., Shkuratov V.Ya., Kuzʼmenko A.B. et al. // Crystallogr. Rep. 2002. V. 47. № 2. P. 335. https://doi.org/10.1134/1.1466514
Hallstedt B., Gauckler L.J. // Calphad: Comput. Phase Diagram. Thermochem. 2003. V. 27. P. 177. https://doi.org/10.1016/S0364-5916(03)00050-6
Schramm L., Behr G., Löser W. et al. // J. Phase Equilib. Diff. 2005. V. 26. № 6. P. 605. https://doi.org/10.1007/s11669-005-0005-8
Maier C.G., Kelley K.K. // J. Am. Chem. Soc. 1932. V. 54. № 8. P. 3243. https://doi.org/10.1021/ja01347a029
Чудненко К.В. Термодинамическое моделирование в геохимии: теория, алгоритмы, программное обеспечение, приложения. Новосибирск: Академическое изд-во “Гео”, 2010. 287 с.
Leitner J., Chuchvalec P., Sedmidubský D. et al. // Thermochim. Acta. 2003. V. 395. P. 27. https://doi.org/10.1016/S0040-6031(02)00176-6
Leitner J., Voñka P., Sedmidubský D. et al. // Thermochim. Acta. 2010. V. 497. P. 7. https://doi.org/10.1016/j.tca.2009.08.002
Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Неорган. материалы. 2018. Т. 54. № 2. С. 193. [Denisova L.T., Irtyugo L.A., Beletskii V.V. et al. // Inorg. Mater. 2018. V. 54. № 2. P. 167.] https://doi.org/10.1134/S002016851802004810.1134/S0020168518020048https://doi.org/10.7868/S0002337X18020100
Кумок В.Н. Прямые и обратные задачи химической термодинамики. Новосибирск: Наука, 1987. 108 с.
Mostafa A.T.M.G., Eakman J.M., Montoya M.M. et al. // Ind. Eng. Chem. Res. 1996. V. 35. P. 343. https://doi.org/10.1021/ie9501485
Кубашевский О., Олкокк С.Б. Металлургическая термохимия. М.: Металлургия, 1982. 392 с.
Морачевский А.Г., Сладков И.Б., Фирсова Е.Г. Термодинамические расчеты в химии и металлургии. СПб.: Лань, 2018. 2018 с.
Моисеев Г.К., Ватолин Н.А., Маршук Л.А. и др. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных АСТРА. OWN). Екатеринбург: УрО РАН, 1987. 230 с.
Leitner J., Sedmidubský D., Chuchvalec P. // Ceramics – Silikáty. 2002. V. 46. № 1. P. 29.
Leitner J., Sedmidubský D., Doušova B. et al. // Thermochim. Acta. 2000. V. 348. P. 49. https://doi.org/10.1016/S0040-6031(00)00352-X
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


