Журнал неорганической химии, 2021, T. 66, № 6, стр. 807-813
РАСТВОРИМОСТЬ КОМПОНЕНТОВ В ВОДНОЙ СИСТЕМЕ УКСУСНАЯ КИСЛОТА–МОНОЭТАНОЛАМИН
Ж. С. Шукуров a, *, Э. С. Хусанов a, М. Ш. Мухитдинова a, А. С. Тогашаров a
a Институт общей и неорганической химии АН РУз
100170 Ташкент, ул. Мирзо Улугбека, 77-а, Узбекистан
* E-mail: kumush1984@mail.ru
Поступила в редакцию 24.12.2020
После доработки 22.01.2021
Принята к публикации 25.01.2021
Аннотация
Изучено взаимное влияние компонентов в водной системе, состоящей из моноэтаноламина и уксусной кислоты, в широком интервале концентраций при температуре от –72.1 до 0°С. Построена диаграмма растворимости, выделено новое соединение ацетат моноэтаноламмония, которое идентифицировано методами химического, рентгенофазового, термогравиметрического и рентгеноструктурного анализа.
ВВЕДЕНИЕ
Известно, что этаноламины, аминоспирты и карбоновые кислоты [1], а также их производные обладают физиологической активностью [2, 3]. Благодаря наличию в их составе молекул этиленовой –СН2–СН2-группы они проявляют ретардантные свойства [4, 5], увеличивая содержание этилена в зоне опадения листьев [6].
Настоящая работа является продолжением наших систематических исследований по взаимодействию уксусной кислоты с моноэтаноламинами [7, 8]. Этаноламины входят в состав действующих веществ ряда стимуляторов роста и развития [9], являются эффективными синергистами для хлоратсодержащих дефолиантов [10], усиливая их дефолиирующую активность [11–13].
С целью определения температурно-концентрационных параметров синтеза физиологически активных веществ нами изучена растворимость в водной системе, включающей уксусную кислоту и моноэтаноламин, в широком интервале температур и концентраций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали уксусную кислоту и моноэтаноламин квалификации “ч.”, дополнительно очищенный перегонкой в вакууме.
Для исследования растворимости системы применяли визуально-политермический метод [14]. Содержание моноэтаноламина определяли по амидному азоту спектрофотометрическим методом (ГОСТ 20851), элементный анализ на углерод, азот, водород проводили согласно [15].
Для выяснения характера взаимодействия между составляющими компонентами синтезированных соединений нами выполнен ИК-спектроскопический анализ. ИК-спектры поглощения исходных компонентов и исследуемых соединений регистрировали на спектрофотометре Specord IR-75 в области частот 4000–400 см–1. Образцы готовили с помощью прессования таблеток с бромидом калия [16].
Термический анализ новых фаз проводили на дериватографе системы Паулик–Паулик–Эрдей при атмосферном давлении и скорости нагрева 10 град/мин (навеска вещества 100 мг, чувствительность гальванометров ДТА 1/5, ДТГ 1/10, 900°С). Эталоном служил прокаленный оксид алюминия [17].
Рентгенофазовый анализ проводили на дифрактометре ДРОН-3 в отфильтрованном излучении медного анода при напряжении 40 кВ, силе тока 20 мА, скорости движения диска счетчика 2 град/мин. Значения межплоскостных расстояний находили по справочнику согласно углу отражения, а интенсивность дифракционных линий оценивали по стобалльной шкале [18, 19].
Для подтверждения индивидуальности соединений использовали рентгеноструктурный анализ. Эксперименты проводили на дифрактометре Oxford Diffraction (CuKα-излучение, графитовый монохроматор). Структуры расшифрованы прямым методом с помощью комплекса программ SHELXS-97 [20] и уточнены с помощью SHELXL-97 [21].
Для физико-химического обоснования процесса синтеза производных этаноламинов, используемых в качестве этиленпродуцирующих добавок [22–25] к хлоратсодержащим дефолиантам, представляет интерес изучение поведения моноэтаноламина и уксусной кислоты в системе CH3COOH–NH2C2H4OH2–H2O в широком интервале температур и концентраций.
Составляющие данную систему бинарные системы уксусная кислота–вода и моноэтаноламин–вода изучены авторами. Полученные нами данные согласуются с литературными.
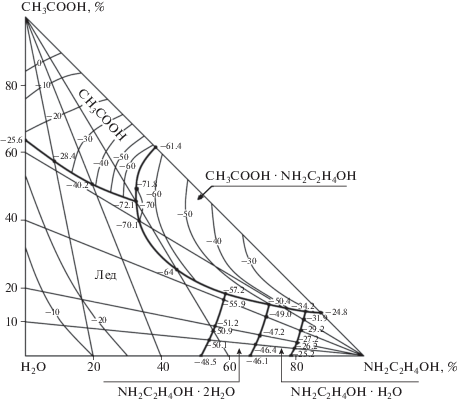
Растворимость в системе CH3COOH–NH2C2H4OH2–H2O изучена нами визуально-политермическим методом в интервале температур от –72.1 до 0°C. На ее политермической диаграмме растворимости разграничены поля кристаллизации льда, уксусной кислоты, двух- и одноводного моноэтаноламина, моноэтаноламина и ацетата моноэтаноламмония (рис. 1).
Установлены четыре тройные точки системы, для которых определены температуры кристаллизации и составы равновесных растворов (табл. 1).
Таблица 1.
Двойные и тройные точки системы уксусная кислота–моноэтаноламин–вода
| Состав жидкой фазы, % | tкрист, °С | Твердая фаза | ||
|---|---|---|---|---|
| NH2C2H4OH | CH3COOH | H2O | ||
| – | 63.6 | 36.4 | –25.6 | Лед + CH3COOH |
| 8.8 | 57.0 | 34.2 | –28.4 | » |
| 19.6 | 50.8 | 29.6 | –40.2 | » |
| 32.4 | 45.2 | 22.4 | –72.1 | Лед + CH3COOH + NH2C2H4OH ⋅ CH3COOH |
| 38.4 | 61.6 | – | –61.4 | CH3COOH + NH2C2H4OH ⋅ CH3COOH |
| 32.8 | 47.6 | 19.6 | –71.8 | » |
| 34 | 39.6 | 26.4 | –70.1 | Лед + NH2C2H4OH ⋅ CH3COOH |
| 44.8 | 25.6 | 29.6 | –64.0 | » |
| 59.0 | 18.4 | 22.6 | –57.2 | Лед + NH2C2H4OH ⋅ CH3COOH + NH2C2H4OH ⋅ 2H2O |
| 72.0 | 15.0 | 13.0 | –50.4 | NH2C2H4OH ⋅ CH3COOH + NH2C2H4OH ⋅ 2H2O + + NH2C2H4OH ⋅ H2O |
| 82.8 | 13.2 | 6.0 | –34.2 | NH2C2H4OH ⋅ CH3COOH + NH2C2H4OH ⋅ H2O + NH2C2H4OH |
| 87.22 | 12.8 | – | –24.8 | NH2C2H4OH ⋅ CH3COOH + NH2C2H4OH |
| 58.4 | 16.8 | 24.8 | –55.9 | Лед + NH2C2H4OH ⋅ 2H2O |
| 55.8 | 9.0 | 35.2 | –51.2 | » |
| 55.2 | 7.8 | 37.0 | –50.9 | » |
| 54.0 | 4.6 | 41.4 | –50.1 | » |
| 52.0 | – | 48.0 | –48.5 | » |
| 71.0 | 12.0 | 17.0 | –49.0 | NH2C2H4OH ⋅ 2H2O + NH2C2H4OH ⋅ H2O |
| 69.0 | 6.4 | 75.4 | –47.2 | » |
| 7.8 | 3.2 | 89 | –46.4 | » |
| 66.4 | – | 33.6 | –46.1 | » |
| 82.0 | 10.8 | 7.2 | –31.9 | NH2C2H4OH ⋅ H2O + NH2C2H4OH |
| 81.2 | 7.8 | 11.0 | –29.2 | » |
| 80.0 | 4.0 | 16.0 | –27.2 | » |
| 79.2 | 2.0 | 81.2 | –26.2 | » |
| 78.4 | – | 21.6 | –25.2 | » |
Из диаграммы растворимости системы уксусная кислота–моноэтаноламин–вода видно, что интервал температур –61.4…–24.8°C отвечает совместной кристаллизации соединения NH2C2H4OH ⋅ CH3COOH со льдом, уксусной кислотой, двух- и одноводным моноэтаноламином, моноэтаноламином.
В интервале температур –48.5…–55.9°C из равновесного раствора кристаллизуется двухводный моноэтаноламин совместно со льдом, в интервале температур –46.1…–49.0°C – двухводный моноэтаноламин с одноводным моноэтаноламином. Лед и уксусная кислота совместно кристаллизуются в интервале температур –25.6…–40.2°C.
Синтезированное соединение было выделено из предполагаемой области кристаллизации, идентифицировано и подтверждено современными методами химического и физико-химического анализа.
Ниже представлены результаты химического анализа полученного соединения.
| Nамид | C | H | О | |
| Найдено, мас. %: | 11.65; | 39.61; | 9.07; | 39.67. |
| Для NH2C2H4OH · CH3COOH | ||||
| вычислено, мас. %: | 11.57; | 39.64; | 9.09; | 39.70. |
Рентгенофазовый анализ показал, что полученное соединение состава NH2C2H4OH ⋅ CH3COOH характеризуется собственными значениями межплоскостных расстояний, подтверждающими его индивидуальность (рис. 2).
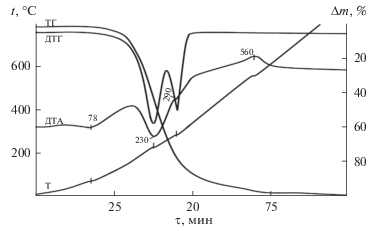
Кривая нагревания соединения NH2C2H4OH ⋅ ⋅ CH3COOH характеризуется тремя эндотермическими эффектами с максимумами при 78, 230 и 290°C и одним экзоэффектом при 560°C (рис. 3).
Эндотермический эффект при 78°C соответствует плавлению соединения, а эндоэффект при 230°C – началу его разложения, потеря массы при этом составляет 33.94%. Экзотермический эффект при 560°C отвечает дальнейшему разложению соединения, потеря массы составляет 73.79%. Последующие эффекты связаны с продолжением разложения и горением продуктов термолиза.
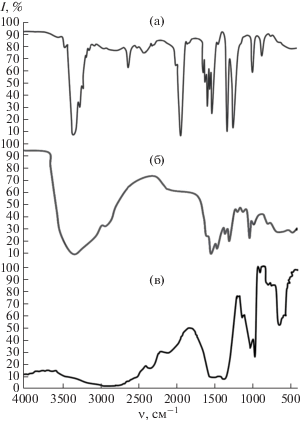
В ИК-спектре моноэтаноламина наблюдаются полосы при 3360 см–1, соответствующие валентным колебаниям ОН-групп, связанных водородными связями, 3290 и 3190 см–1, отвечающие асимметричным (νas) и симметричным (νs) колебаниям NH- и NH2-групп, 1590 см–1, связанные с деформационными (β) колебаниями NH2-группы, полосы при 1360 см–1, характеризующие плоские колебания β(ОН) и С–О, 1085 см–1 – ν(CN), 1040 см–1 – ν(С–О), 1170 см–1 – β(ОН), 870 см–1, соответствующие неплоским колебаниям β(NH2).
В ИК-спектре полученного соединения NH2C2H4OH · CH3COOH отсутствуют полосы поглощения, характерные для группы NH2 (рис. 4, табл. S1 ). При 3240 и 3110 см–1 появляются новые полосы, которые относятся к валентным асимметричным и симметричным колебаниям иона ${\text{NH}}_{3}^{ + }$, и полосы при 1580 и 1500 см–1, отвечающие деформационным колебаниям ${\text{NH}}_{3}^{ + }$. Валентные колебания группы ${\text{NH}}_{3}^{ + }$ проявляются в виде широкой полосы поглощения в области ~3120 см–1, которая обычно перекрывается с полосой валентных колебаний СН-групп. В ИК-спектре NH2C2H4OH · CH3COOH остаются без изменения полосы, соответствующие валентным и деформационным колебаниям СН2-групп, появляется ряд новых полос, которые отсутствуют в спектрах исходных соединений.
Следовательно, при взаимодействии моноэтаноламина с уксусной кислотой происходит протонизация азота с образованием ацетата моноэтаноламмония. Это подтверждается появлением полос поглощения при 1600 и 1430 см–1, принадлежащих валентным асимметричным и симметричным колебаниям СОО–-группы. Таким образом, все это свидетельствует о том, что одна из групп (СООН) молекулы уксусной кислоты находится в ионизированном состоянии. Происходит сдвиг в низкочастотную область полос колебаний ОН–-группы моноэтаноламина, указывающий на образование водородных связей между молекулой амина и кислотой.
Индивидуальность ацетата моноэтаноламмония подтверждена также методом рентгеноструктурного анализа. Для исследования был отобран кристалл размером 0.64 × 0.55 × 0.52 мм. Поскольку ацетат моноэтаноламмония является гигроскопичным веществом, для предотвращения поглощения влаги извне его покрывали пленкой эпоксидной смолы. Определение параметров элементарной ячейки и сбор экспериментальных данных проводили на дифрактометре Bruker SMART APEX CCD, оснащенном криосистемой (Оксфорд), при 293 K (2069 отражений, CuKα-излучение, графитовый монохроматор). Основные кристаллографические данные ацетата моноэтаноламмония приведены в табл. 2.
Таблица 2.
Кристаллографические данные, параметры эксперимента и уточнения структуры соединения ацетата моноэтаноламмония
| Параметр | Значение |
|---|---|
| Брутто-формула | ${\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{ - }}{\text{NH}}_{{\text{3}}}^{{\text{ + }}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}}$ |
| М | 121.14 |
| Сингония | Моноклинная |
| Пр. гр. | P21/n (№ 14) |
| α, β, γ, град | 90, 104.84(3), 90 |
| Параметры элементарных ячеек a, b, c, Å | 7.7040(15), 9.1409(18), 9.846(2) |
| Z | 4 |
| V, Å3 | 670.2 (2) |
| ρвыч, г/см3 | 1.201 |
| Сбор экспериментальных данных | |
| Излучение (λ, Å) | CuKα (1.54178) |
| Т, K | 293 |
| Область сканирования 2θ (min, max), град | 6.5, 62.0 |
| Диапазон индексов данных | –4 ≤ h ≤ 8, –9 ≤ k ≤ 10, –11 ≤ l ≤ 10 |
| Дифрактометр | Bruker SMART APEX CCD |
| Ihkl изм./независ./Rint | 2069/1024/0.041 |
| Наблюдаемые отражения [I > 2.0 σ(I)] | 758 |
| Уточнение | |
| Nref, Npar | 1024, 86 |
| R, wR2, GOOF | 0.0830, 0.2881, 2.11 |
| Остаточные экстремумы, e/Å3 | –0.41, 0.28 |
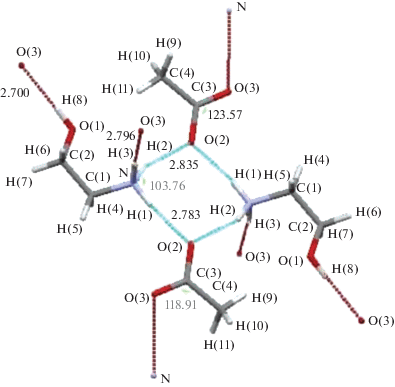
Кристаллическая структурa построена из катиона моноэтаноламмония с протонированной NH2-группой и аниона уксусной кислоты. На рис. 5 показана проекция кристаллической структуры ацетата моноэтаноламмония на плоскость. Кислород О(3) карбоксильной группы образует водородные связи с атомами О(1) и N первой молекулы моноэтаноламина длиной 2.700 и 2.796 Å соответственно. Атом О(2) образует водородные связи с атомами N первой и второй молекулы моноэтаноламина. Это единственный атом кислорода группы СОО–, который посредством водородной связи одновременно связан с первой и второй молекулами моноэтаноламина.
Таким образом, у атомов О(2) и О(3) имеется по два, у атома О(1) – один, а у атома N – по три контакта, образованных водородными связями (при этом учитываются только межмолекулярные водородные связи). Кристаллическая структура характеризуется сложной сетью водородных связей (табл. 3).
Таблица 3.
Параметры водородных связей в структуре ацетата моноэтаноламмония
| Связь | D–Н, Å | Н…A, Å | D…A, Å |
|---|---|---|---|
| O(1)–H(8)…O(3) | 0.8200 | 1.8800 | 2.700 (4) |
| N–H(1)…O(2) | 0.88 (2) | 1.91(2) | 2.783 (4) |
| N–H(2)…O(2) | 0.86 (3) | 2.02(3) | 2.835 (4) |
| N–H(3)…O(3) | 1.09 (4) | 1.72(4) | 2.796 (4) |
Длины контактов водородной связи О–Н….O, N–Н….О имеют следующие значения: О(1)–Н(8)…О(3) 2.700 Å, N–H(1)…O(2) 2.783 Å, N–H(2)…O(2) 2.835 Å, N–H(3)…O(3) 2.796 Å.
Ацетат моноэтаноламмония – белое кристаллическое вещество. Эмпирическая формула NH2C2H4OH · CH3COOH, М = 121.14. Температура плавления равна 78°С. Растворимость его в воде при температуре –40, –30, –20, –10, 10, 20, 30, 40, 50, 60, 70,0°С составляет соответственно 62.8, 73.0, 78.6, 80.2, 85.0, 87.1, 89.2, 91.8, 93.9, 96.0, 98.2%.
ЗАКЛЮЧЕНИЕ
Таким образом, в изученной системе установлено образование нового соединения состава NH2C2H4OH · CH3COOH, которое идентифицировано методами химического и физико-химического анализа. В системе наблюдается взаимное высаливающее действие компонентов с ростом температуры. Полученные данные представляют интерес и являются физико-химической основой для дальнейшей разработки технологии получения физиологически активного вещества для сельскохозяйственных культур.
Список литературы
Rajaeian S.O., Ehsanpour A.A. // Russ. J. Plant. Physiol. 2015. V. 62. P. 246. https://doi.org/10.1134/S1021443715020156
Цыпленкова А.Ю., Кольцова О.В., Лобанов Н.Н. и др. // Бутл. сообщ. 2013. Т. 36. № 11. С. 146. https://roi: jbc-01/13-36-11-146]
Скворцов В.Г., Кольцова О.В., Пыльчикова Ю.Ю. и др. // Вестн. Чуваш. гос. педаг. ун-та им. И.Я. Яковлева. 2009. № 2. С. 101.
Веселова С.В., Бурханова Г.Ф., Нужная Т.В. и др.// Физиол. раст. 2016. Т. 63. С. 649. [Veselova S.V., Burkhanova G.F., Nuzhnaya T.V. et al. // Russ. J. Plant. Physiol. 2016. V. 63. P. 609. https://doi.org/10.1134/S1021443716050150]
Веселова С.В., Бурханова Г.Ф., Нужная Т.В. и др. // Биомика. 2018. Т. 10. № 4. С. 387. https://doi.org/10.31301/2221-6197.bmcs.2018-50
Raghavendra T., Rama Reddy Y. // Indian J. Agrico. Res. 2020. V. 54. P. 404. https://doi.org//10.18805/IJARe.A-5288
Balabaev N.K., Rodnikova M.N., Solonina I.A. et al. // Russ. J. Phys. Chem. 2017. V. 91. P. 195. https://doi.org/10.1134/S0036024417010058
Ibragimov A.B., Ashurov Z.M., Ibragimov A.B. et al. // Russ. J. Coord. Chem. 2017. V. 43. P. 380. https://doi.org/10.1134/S1070328417060021
Broekgaarden C., Caarls L., Vos I.A. et al. // Plant Physiol. 2015. V. 169. P. 2371. https://doi.org/10.1104/pp15.01020
Shukurov Z.S., Ishankhodzhaev S.S., Askarova M.K. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 3. P. 463. https://doi.org/10.1134/S0036023611010207 [Шукуров Ж.С., Ишанходжаев С.С., Аскарова М.К. и др. // Журн. неорган. химии. 2011. Т. 56. № 3. С. 502.]
Умаров А.А., Кутянин Л.И. Новые дефолианты: поиск, свойства, применения. М.: Химия, 2000. 143 с.
Sidikov A.A., Toghasharov A.S., Shukurov J.S. et al. // Int. J. Adv. Res. Sci. Eng. Tech. 2020. V. 7. № 5. P. 13619.
Хамдамова Ш.Ш., Тухтаев С., Дадамухамедова Н. // Universum: техн. науки. 2018. Т. 55. № 10. С. 42. https://7universum.com/ru/tech/archive/item/6412
Трунин А.С. Петрова Д.Г. Визуально-политермический метод. Куйбышев, 1977.
Полуэктов Н.С. Методы анализа по фотометрии пламени. М.: Химия, 1967.
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991.
Берг Л.Г., Бурмистрова Н.П., Озерова М.И. и др. Практическое руководство по термографии. Казань, 1976.
Ковба Л.М., Трунов В.К. Рентгенофазовый анализ. М., 1969.
Недома И. Расшифровка рентгенограмм порошков. М.: Металлургия, 1975.
Sheldrick G.M. // Acta Crystallogr. 1990. V. 46. P. 467.
Sheldrick G.M. SHELXL-97. Program for the Refinement of Crystal Structures. University of Göttingen, Germany. 1997.
Shukurov Z.S., Askarova M.K., Tukhtaev S. // Russ. J. Inorg. Chem. 2018. V. 63. № 2. P. 275. [Шукуров Ж.С., Аскарова М.К., Тухтаев С. // Журн. неорган. химии. 2018. Т. 63. № 2. С. 261.] https://doi.org/10.1134/S0036023618020201
Toghasharov A.S., Askarova M.K. Tukhtaev S. // East Europ. Sci. J. Wschodnioeur. Czasop. Nauk. 2016. V. 3. № 8. P. 56.
Khamdamova Sh.Sh. // Proc. Universe. Appl. Chem. Biotech. 2017. V. 7. № 2. P. 9. https://doi.org/10.21285/2227-2925-2017-7-2-9-15
Хамдамова Ш.Ш. Разработка технологии получения комплексно действующего хлораткальцийсодержащего дефолианта с использованием промышленных отходов. Автореф. … канд. хим. наук. Ташкент, 2018.
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Частота колебаний и отнесения полос поглощения NH2C2H4OH, CH3COOH, NH2C2H4OH · CH3COOH в ИК-спектрах
Инструменты
Журнал неорганической химии