Журнал неорганической химии, 2022, T. 67, № 10, стр. 1446-1452
Фазовые равновесия в стабильном тетраэдре LiF–LiCl–Li2CrO4–KCl четырехкомпонентной взаимной системы Li, K||F, Cl, CrO4
М. А. Демина a, Е. М. Егорова a, *, И. К. Гаркушин a, Е. О. Игнатьева a
a Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 244, Россия
* E-mail: dvoryanova_kat@mail.ru
Поступила в редакцию 07.02.2022
После доработки 03.03.2022
Принята к публикации 27.03.2022
- EDN: NGAVSZ
- DOI: 10.31857/S0044457X22100154
Аннотация
Четырехкомпонентные системы на основе галогенидов и хроматов щелочных металлов используются в качестве расплавляемых электролитов для химических источников тока, теплоаккумулирующих материалов, сред для синтеза различных соединений и др. Проанализирована четырехкомпонентная взаимная система Li, K||F, Cl, CrO4. Проведено ее разбиение на симплексы с использованием теории графов. Построено древо фаз системы, на основании которого осуществлен прогноз числа и состава кристаллизующихся фаз в стабильных элементах. В стабильном треугольнике LiF–KCl–K2CrO4 с помощью рентгенофазового анализа подтверждены кристаллизующиеся фазы. Методом дифференциального термического анализа исследованы фазовые равновесия в стабильном тетраэдре LiF–LiCl–Li2CrO4–KCl, установлены характеристики четырехкомпонентной эвтектики (экв. %): LiF – 1.0, LiCl – 29.8, Li2CrO4 – 45.5, KCl – 23.7, температура плавления 305°С.
ВВЕДЕНИЕ
В современной науке и технике увеличивается практическое использование расплавленных солевых смесей, представляющих собой в большинстве случаев многокомпонентные системы. Исследование солевых конденсированных систем проводится в России и за рубежом, при этом результаты экспериментального изучения четырех-, пятикомпонентных и более систем в основном встречаются в российских источниках [1–4]. Композиции на основе солей применяются для получения расплавляемых электролитов химических источников тока, теплоаккумулирующих материалов, сред для синтеза различных соединений, электролитных сред для электроосаждения редкоземельных элементов [5–11]. Расплавленные галогенидные соли с высокой ионной проводимостью и термической стабильностью являются основными электролитами для стационарных жидкометаллических батарей [12].
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
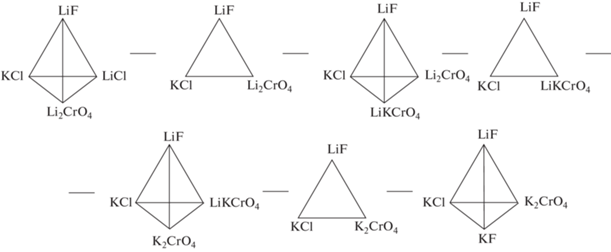
Объектом исследования являлась четырехкомпонентная взаимная система Li, K||F, Cl, CrO4, треугольная призма и развертка граневых элементов, которой представлены на рис. 1. На первом этапе изучения системы разбивали на симплексы с применением теории графов [13]. Объект Li, K||F, Cl, CrO4 состоит из девяти двухкомпонентных, двух трехкомпонентных и трех трехкомпонентных взаимных систем, данные о характере ликвидусов которых взяты из источников [14–20].
Рис. 1.
Призма составов и развертка граневых элементов четырехкомпонентной взаимной системы Li, K||F, Cl, CrO4.
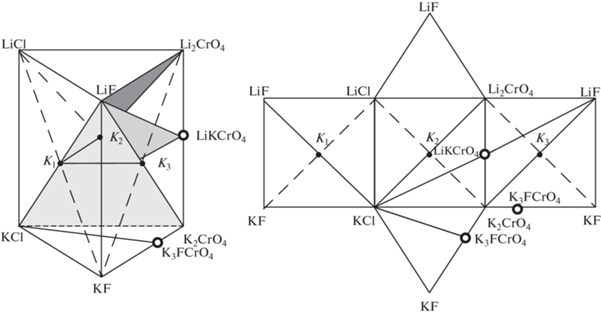
В трехкомпонентных взаимных системах в точках конверсии (на рис. 1 обозначены K1, K2, K3) протекают реакции ионного обмена, для которых рассчитаны ${{\Delta }_{r}}H_{{298}}^{^\circ }$ и ${{\Delta }_{r}}G_{{298}}^{^\circ }{\text{:}}$
точка K1 (система Li, K||F, Cl)
точка K2 (система Li, K||Cl, CrO4)
точка K3 (система Li, K||F, CrO4)
Продукты реакций являются стабильными диагоналями в трехкомпонентных взаимных системах (на рис. 1 секущие LiF–KCl, KCl–Li2CrO4, LiF–K2CrO4). В двухкомпонентных системах Li2CrO4–K2CrO4 и KF–K2CrO4 образуются соединения конгруэнтного плавления LiKCrO4 и K3FCrO4. В трехкомпонентной взаимной системе Li, K||F, CrO4 соединение K3FCrO4 выклинивается, следовательно, секущая LiF–K3FCrO4 отсутствует [20]. Информация об элементах огранения и стабильных диагоналях служит основой для составления матрицы смежности системы Li, K||F, Cl, CrO4 (табл. 1).
Таблица 1.
Матрица смежности системы Li, K||F, Cl, CrO4
| Вещество | Индекс | X1 | X2 | X3 | X4 | X5 | X6 | X7 |
|---|---|---|---|---|---|---|---|---|
| LiCl | X1 | 1 | 1 | 1 | 0 | 1 | 0 | 0 |
| Li2CrO4 | X2 | 1 | 1 | 0 | 1 | 1 | 0 | |
| LiF | X3 | 1 | 1 | 1 | 1 | 1 | ||
| KF | X4 | 1 | 1 | 0 | 1 | |||
| KCl | X5 | 1 | 1 | 1 | ||||
| LiKCrO4 | X6 | 1 | 1 | |||||
| K2CrO4 | X7 | 1 |
На основании табл. 1 составлено логическое выражение, представляющее собой произведение сумм индексов несмежных вершин:
После всех преобразований с учетом закона поглощения получен набор однородных несвязных графов:
Путем выписывания недостающих вершин для несвязных графов получен набор стабильных ячеек и отвечающие им соли:
Общие элементы каждой пары смежных симплексов образуют секущие элементы (стабильные треугольники): LiF–KCl–LiKCrO4, LiF–Li2CrO4–KCl и LiF–KCl–K2CrO4. Четырехкомпонентная взаимная система Li, K||F, Cl, CrO4 разбивается тремя секущими треугольниками на четыре стабильных тетраэдра: LiF–LiCl–Li2CrO4–KCl, LiF–Li2CrO4–KCl–LiKCrO4, LiF–KCl–K2CrO4–LiKCrO4, LiF–KF–KCl–K2CrO4.
Исходя из проведенного разбиения системы Li,K||F,Cl,CrO4, построено древо фаз (рис. 2), на основании которого можно осуществить прогноз числа и состава кристаллизующихся фаз в секущих и стабильных элементах системы. Поскольку в ограняющих системах присутствует эвтектический тип взаимодействия и твердых растворов замещения не образуется, можно прогнозировать, что количество кристаллизующихся фаз будет равно мерности симплекса: в стабильных треугольниках три фазы, а в тетраэдрах – четыре. Вершины фигур – это кристаллизующиеся фазы, например, в треугольнике LiF–KCl–LiKCrO4 будут кристаллизоваться три фазы: фторид лития, хлорид калия и соединение LiKCrO4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальные исследования проводили методом дифференциального термического анализа (ДТА) в платиновых микротиглях с использованием комбинированной Pt–Pt/Rh-термопары в интервале температур 300–900°С. Холодные спаи термопар термостатировали при 0°С в сосуде Дьюара с тающим льдом. Масса навесок составляла 0.3 г. Все составы – эквивалентные доли, выраженные в процентах [21–24]. Исходные реактивы имели квалификацию “х. ч.” (LiCl), “ч. д. а.” (LiF, KCl), “ч.” (Li2CrO4, K2CrO4), индифферентное вещество – свежепрокаленный оксид алюминия. Температуры плавления веществ и полиморфных переходов (α ⇄ β(Li2CrO4) = = 430°С, α ⇄ β(K2CrO4) = 666°С) соответствовали справочным данным [25, 26]. Рентгенофазовый анализ (РФА) составов проводили на дифрактометре ARL X'TRA. Съемку дифрактограмм осуществляли при CuKα-излучении с никелевым β-фильтром.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
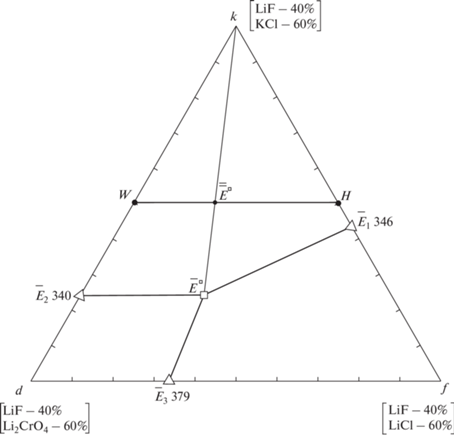
Изучен стабильный тетраэдр LiF–LiCl–Li2CrO4–KCl, развертка граневых элементов которого приведена на рис. 3. Все двухкомпонентные и трехкомпонентные системы характеризуются эвтектическим типом плавления: LiCl–KCl [14], LiF–LiCl [15], LiCl–Li2CrO4 [16], Li2CrO4–KCl [20], LiF–LiCl–Li2CrO4 [16], LiCl–L2CrO4–KCl [20], LiF–LiCl–KCl [19]. Стабильный треугольник LiF–Li2CrO4–KCl исследован ранее, в нем определена трехкомпонентная эвтектика [27]. Планирование эксперимента в системе LiF–LiCl–Li2CrO4–KCl проведено в соответствии с правилами проекционно-термографического метода. Исходя из расположения точек нонвариантного равновесия в системах низшей мерности, для определения температуры плавления и состава четырехкомпонентной эвтектики выбрано политермическое сечение kdf, треугольник которого представлен на рис. 4: k[LiF – 40%; KCl – 60%]–d[LiF – 40%; Li2CrO4 – 60%]–f[LiF – 40%; LiCl – 60%]. Сечение kdf расположено в объеме кристаллизации фторида лития. Точки ${{\bar {Е}}_{1}},$ ${{\bar {Е}}_{2}},$ ${{\bar {Е}}_{3}}$ являются проекциями соответствующих эвтектик, нанесенных из вершины фторида лития на стороны сечения kdf.
Рис. 3.
Развертка граневых элементов тетраэдра LiF–LiCl–Li2CrO4–KCl четырехкомпонентной взаимной системы Li, K||F, Cl, CrO4.
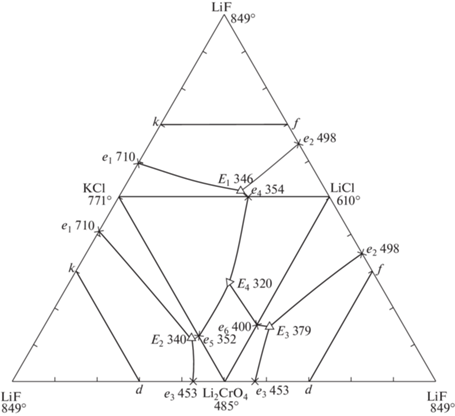
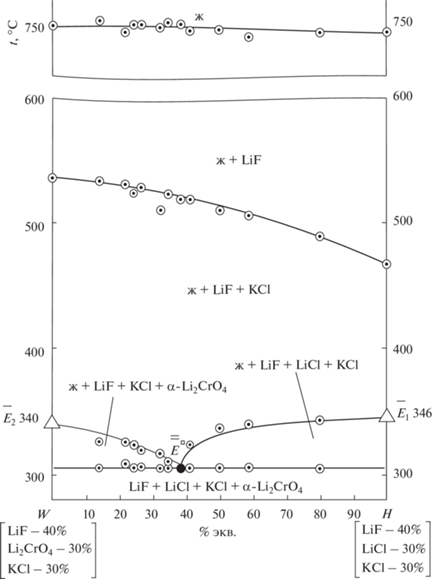
В сечении kdf для экспериментального изучения выбран одномерный политермический разрез WH: W[LiF – 40%; Li2CrO4 – 30%; KCl – 30%]–H[LiF – 40%; LiCl – 30%; KCl – 30%], Т–х-диаграмма которого приведена на рис. 5. На основании Т–х-диаграммы разреза WH установлено направление на проекцию четырехкомпонентной эвтектики ${{\bar {\bar {Е}}}^{\square }}$ и соотношение концентраций хлорида и хромата лития в эвтектике.
В результате исследования политермического разреза k → ${{\bar {\bar {Е}}}^{\square }}$ → ${{\bar {Е}}^{\square }}$ (рис. S1 ) определен состав сплава, отвечающий точке ${{\bar {Е}}^{\square }},$ которая является проекцией четверной эвтектики на двумерное политермическое сечение kdf. Точка ${{\bar {Е}}^{\square }}$ характеризуется определенным соотношением компонентов – хлорида и хромата лития, хлорида калия.
Определение состава четырехкомпонентной эвтектики сводилось к постепенному уменьшению концентрации фторида лития без изменения известных соотношений других компонентов по разрезу, выходящему из вершины фторида лития и проходящему через точку ${{\bar {Е}}^{\square }}$ (рис. S2 ). Состав эвтектики (экв. %): LiF – 1.0, LiCl – 29.8, Li2CrO4 – 45.5, KCl – 23.7 с температурой плавления 305°С.
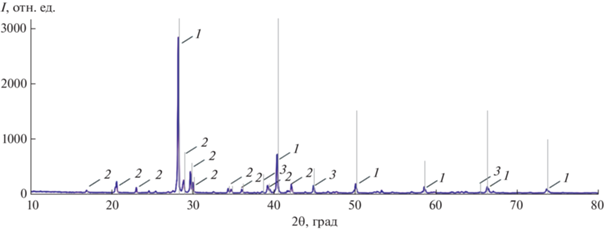
Кристаллизующиеся фазы в четырехкомпонентной взаимной системе Li, K||F, Cl, CrO4 подтверждены РФА для стабильного элемента древа фаз – треугольника LiF–KCl–K2CrO4 (рис. 6). Дифрактограмма показала наличие трех кристаллических фаз в сплаве: фторида лития, хлорида калия и низкотемпературной полиморфной модификации хромата калия.
ЗАКЛЮЧЕНИЕ
Установлено, что при фазовом переходе из жидкого в кристаллическое состояние число кристаллизующихся фаз в стабильных элементах четырехкомпонентной взаимной системы Li, K||F, Cl, CrO4 равно мерности симплексов (в треугольниках – три фазы, в тетраэдрах – четыре). Тетраэдр LiF–LiCl–Li2CrO4–KCl состоит из четырех объемов кристаллизации: фторида, хлорида, хромата лития (низкотемпературная модификация) и хлорида калия. Фазовая реакция, отвечающая четырехкомпонентной эвтектике:
Список литературы
Ахмедова П.А., Гасаналиев А.М., Гаматаева Б.Ю. и др. // Журн. неорган. химии. 2017. Т. 62. № 10. С. 1393. [Akhmedova P.A., Gasanaliev A.M., Gamataeva B.Y. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 10. P. 1390.] https://doi.org/10.7868/S0044457X17100154
Ахмедова П.А., Гасаналиев А.М., Гаматаева Б.Ю. и др. // Журн. неорган. химии. 2018. Т. 63. № 6. С. 791. [Akhmedova P.A., Gasanaliev A.M., Gamataeva B.Y. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 6. P. 837.] https://doi.org/10.7868/S0044457X1806020X
Алиев А.Р., Ахмедов И.Р., Какагасанов М.Г. и др. // Журн. физ. химии. 2018. Т. 92. № 3. С. 403. [Aliev A.R., Akhmedov I.R., Kakagasanov M.G. et al. // Russ. J. Phys. Chem. 2018. V. 92. № 3. P. 470.] https://doi.org/10.7868/S0044453718030020
Гаркушин И.К., Губанова Т.В., Фролов Е.И. и др. // Журн. неорган. химии. 2015. Т. 61. № 1. С. 374. [Garkushin I.K., Gubanova T.V., Frolov E.I. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 3. P. 324.] https://doi.org/10.7868/S0044457X15030034
Пройдакова В.Ю., Александров А.А., Воронов В.В. и др. // Журн. неорган. химии. 2020. Т. 65. № 6. С. 764. [Proydakova V.Y., Alexandrov A.A., Voronov V.V. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 6. P. 834.] https://doi.org/10.31857/S0044457X20060161
Fujiwara S., Inaba M., Tasaka A. // J. Power Sources. 2010. P. 7691. https://doi.org/10.1016/j.jpowsour.2010.05.032
Mantha D., Wang T., Reddy R.G. // J. Phase Equilib. Diffus. 2012. V. 33. № 2. P. 110. https://doi.org/10.1007/s11669-012-0005-4
Jian L.-X., Wu X.-Y., Tan Y.-Q. // J. Hum. Un. Nat. Sciences. 2014. V. 41. № 12. P. 75.
Ghosh S., Ganesan R., Sridharan R. // J. Phase Equilib. Diffus. 2018. V. 39. P. 916. https://doi.org/10.1007/s11669-018-0695-3
Masset P., Poinso J.-Y., Schoeffert S. et al. // J. Electrochem. Soc. 2005. V. 152. № 2. P. A405. https://doi.org/10.1149/1.1850861
Sveinbjörnsson D., Christiansen A.S., Viskinde R. et al. // J. Electrochem. Soc. 2014. V. 161. № 9. P. A1432. https://doi.org/10.1149/2.1061409jes
Gong Q., Ding W., Bonk A. et al. // J. Power Sources. 2020. V. 475. P. 228674. https://doi.org/10.1016/j.jpowsour.2020.228674
Оре О. Теория графов. М.: Наука, 1980. 336 с.
Диаграммы плавкости солевых систем / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. Ч. II. 416 с.
Диаграммы плавкости солевых систем / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. Ч. III. 204 с.
Гаркушин И.К., Губанова Т.В., Петров А.С. и др. Фазовые равновесия в системах с участием метаванадатов некоторых щелочных металлов. М.: Машиностроение-1, 2005. 118 с.
Воскресенская Н.К., Евсеева Н.Н., Беруль С.И. и др. Справочник по плавкости систем из безводных неорганических солей. М.: Изд-во АН СССР, 1961. Т. 1. 845 с.
Воскресенская Н.К., Евсеева Н.Н., Беруль С.И. и др. Справочник по плавкости систем из безводных неорганических солей. М.: Изд-во АН СССР, 1961. Т. 2. 585 с.
Диаграммы плавкости солевых систем. Тройные взаимные системы / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Xимия, 1977. 392 с.
Бухалова Г.А., Топшиноева З.Н. Системы Li, K||Cl, CrO4, Li, K||Br, CrO4 // Журн. неорган. химии. 1973. Т. 18. № 5. С. 1375.
Егунов В.П. Введение в термический анализ. Самара, 1996. 270 с.
Wagner M. Thermal Analysis in Practice: Fundamental Aspects. Hanser Publications, 2018. P. 158.
Мощенский Ю.В. Приборы и техника эксперимента. М., 2003. Т. 46. № 6. С. 143.
Федотов С.В., Мощенский Ю.В. Интерфейсное программное обеспечение DSCTool. Самара: Самар. гос. техн. ун-т, 2004. 23 с.
Термические константы веществ. Справочник / Под ред. В.П. Глушко. М.: ВИНИТИ, 1981. Вып. X. Ч. 1. 300 с.
Термические константы веществ. Справочник / Под ред. В.П. Глушко. М.: ВИНИТИ, 1981. Вып. X. Ч. 2. 300 с.
Демина М.А., Гаркушин И.К., Бехтерева Е.М. // Сб. тр. XIV Междунар. конф. по термическому анализу и калориметрии в России (RTAC-2013). СПб.: СПб. гос. политехн. ун-т, 2013. С. 133.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1. Рис.1-Рис.2
Инструменты
Журнал неорганической химии