Журнал неорганической химии, 2022, T. 67, № 9, стр. 1251-1257
Исследование сорбции стронция аморфным силикатом кальция
С. Б. Ярусова a, b, *, П. С. Гордиенко a, О. О. Шичалин c, Е. К. Папынов c, Е. А. Нехлюдова a, b, А. В. Перфильев b, С. Ю. Будницкий d, Н. В. Зарубина d, Ю. А. Паротькина a, А. Н. Драньков a, С. Б. Буланова a, Н. В. Иваненко b
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
b Владивостокский государственный университет экономики и сервиса
690014 Владивосток, ул. Гоголя, 41, Россия
c Дальневосточный федеральный университет
690922 Владивосток, п. Аякс,10, о. Русский, Россия
d Дальневосточный геологический ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
* E-mail: yarusova_10@mail.ru
Поступила в редакцию 06.03.2022
После доработки 28.03.2022
Принята к публикации 30.03.2022
- EDN: DRUOQJ
- DOI: 10.31857/S0044457X22090197
Аннотация
Представлены данные по сорбционным характеристикам синтетического рентгеноаморфного силиката кальция, полученного в модельной многокомпонентной системе CaCl2–Na2SiO3–H2O. Приведены изотермы сорбции ионов Sr2+ из водных растворов без солевого фона с концентрацией ионов Sr2+ от 0.016 до 1.22 ммоль/л при температурах 20, 40 и 60°С и соотношении твердой и жидкой фаз т : ж = 1 : 400. Определены максимальная сорбционная емкость синтетического рентгеноаморфного силиката кальция и степень извлечения ионов Sr2+ при различных соотношениях т : ж из растворов без солевого фона и из растворов, имитирующих определенный состав пресной воды. Впервые исследована кинетика сорбции ионов Sr2+ при различных температурах, определена энергия активации процесса сорбции. Полученные данные могут быть использованы при выработке практических рекомендаций по получению и применению исследуемого материала в процессах сорбции и иммобилизации стронция.
ВВЕДЕНИЕ
Из радиоактивных изотопов стронция наибольший вклад в загрязнение окружающей среды вносят 89Sr и 90Sr. Короткоживущий изотоп 89Sr (τ ~ 50.5 сут) прослеживается в окружающей среде на начальном этапе техногенной аварии [1, 2]. 90Sr является β-излучателем с высокой удельной активностью, характеризуется большим периодом полураспада (τ ~ 28 лет), т.е. является одним из основных компонентов радиоактивного загрязнения в первые десятилетия после аварии, в связи с чем представляет опасность для природных экосистем и биосферы в целом. Через биоаккумуляцию радионуклиды накапливаются в конечных звеньях пищевых цепей, представляя опасность для здоровья организмов и вызывая изменения в структуре популяций видов. Остеотропный 90Sr прочно удерживается в основном в костях скелета человека и животных (особенно при недостатке кальция). Биологическое действие радиоактивного стронция в районах радиоактивного загрязнения многообразно и связано с его химической формой, путем поступления, распределением поступившего в организм нуклида и формируемых доз – у высших животных и человека проявляются острые и хронические лучевые поражения с соответствующими гематологическими нарушениями, развитием лейкозов и костных опухолей [3–5].
В научной литературе проблеме выделения и иммобилизации стронция посвящено большое число работ. Среди многообразия неорганических сорбентов, предлагаемых для извлечения стронция из водных сред, природные и синтетические силикаты, а также композиционные материалы на их основе представляют определенный научно-практический интерес [6–10]. В работе российских ученых приведен подробный обзор и собственные исследования по материалам, разработанным для извлечения стронция из природных сред, в том числе из морской воды [11].
При исследовании сорбции стронция силикаты и алюмосиликаты щелочноземельных металлов выделяют в перспективный класс сорбентов [12–18].
Так, исследованию сорбционных свойств силикатов кальция по отношению к ионам Sr2+ посвящен ряд отечественных и зарубежных работ [16–19]. Исследуются такие силикаты кальция, как 11 Å тоберморит, тобермориты с различным содержанием Al3+, ксонотлит, волластонит. Значения максимальной сорбционной емкости варьируют в диапазоне 0.017–1.8 ммоль/г в зависимости от условий сорбции (температура, соотношение твердой и жидкой фаз, pH, солевой фон).
Цель работы – исследование сорбционных свойств материала на основе гидросиликата кальция, полученного в модельной многокомпонентной системе CaCl2–Na2SiO3–H2O, по отношению к ионам Sr2+, в том числе из раствора сложного солевого состава.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез сорбента. Для синтеза гидросиликата кальция в модельной системе CaCl2–Na2SiO3–H2O использовали силикат натрия квалификации “х. ч.” с содержанием кремния 22.4% (силикатный модуль SiO2/Na2O = 1) и кальций хлористый двухводный CaCl2·2H2O (ТУ 2152-069-00206457-2003, содержание CaCl2·2H2O не менее 98.3%). Компоненты смешивали в водной среде в открытых емкостях, руководствуясь рекомендациями работы [20]. Полученный объемный осадок белого цвета тщательно промывали, отфильтровывали через фильтр “синяя лента” и сушили при 85°С.
Опыты по сорбции. Опыты по сорбции проводили в статических условиях при соотношении твердой и жидкой фаз, равном 1 : 400, и температуре 20, 40 и 60°С из водных растворов хлорида стронция (SrCl2⋅6Н2О) без солевого фона с различными начальными концентрациями ионов Sr2+ в диапазоне от 0.016 до 1.22 ммоль/л при перемешивании на магнитной мешалке RT 15 power (Ika Werke, ФРГ) в течение 3 ч. Для получения кинетических кривых сорбции при аналогичных условиях в серию пробирок помещали навески сорбента, заливали их водным раствором SrCl2·6H2O с начальной концентрацией ионов Sr2+ 1.22 ммоль/л и встряхивали от 1 до 180 мин.
Проведены опыты по сорбции ионов Sr2+ из растворов, имитирующих состав пресной воды, используемой в работе [21] (далее ИПВ), мг/л: Sr2+–10–12; Ca2+ – 100; Mg2+ – 75; Na+ – 132; K+ – 15; Cl– – 82; ${\text{SO}}_{4}^{{2 - }}$ – 650 (рН раствора 7.6). Соотношения твердой и жидкой фаз т : ж = 1 : 40, 1 : 100, 1 : 400, 1 : 1000, 1 : 2000.
При приготовлении раствора ИПВ использовали сульфат калия K2SO4 (ос. ч.), сульфат натрия Na2SO4 (о. с. ч.), сульфат магния MgSO4·7H2O (ч. д. а.), хлорид кальция СаCl2 (х. ч.), хлорид стронция SrCl2·6H2O (х. ч.).
Методы анализа. Рентгенограммы осадков снимали на автоматическом дифрактометре D8 Advance (Германия) с вращением образца в СuKα-излучении. Рентгенофазовый анализ (РФА) проводили с использованием программы поиска EVA с банком порошковых данных PDF-2.
Удельную поверхность образцов определяли методом низкотемпературной адсорбции азота с использованием прибора Сорбтометр-М (Россия).
Измерения pH раствора производили на pH-метре/иономере Мультитест ИПЛ-102 со стеклянным электродом ЭСК-10601/7 (Россия), стандартизированным по буферным растворам.
Содержание ионов Sr2+ в исходных растворах и фильтратах после сорбции определяли методом атомно-абсорбционной спектрометрии (ААС) на двухлучевом спектрометре SOLAAR M6 (Thermo Scientific, США) по аналитической линии 460.7 нм. Предел обнаружения ионов стронция в водных растворах составляет 0.002 мкг/мл, кальция – 0.0005 мкг/мл. Погрешность определения стронция в растворах в диапазоне концентраций 0.001–10 мг/л составляет 20%.
Часть проб на содержание ионов Sr2+ была проанализирована методом масс-спектрометрии с индуктивно связанной плазмой на спектрометре Agilent 8800 (Agilent Techn., США).
Сорбционную емкость (Ас, ммоль/г) исследуемых образцов рассчитывали по формуле:
где Сисх – исходная концентрация ионов Sr2+ в растворе, ммоль/л; Ср – равновесная концентрация ионов Sr2+ в растворе, ммоль/л; V – объем раствора, л; m – масса сорбента, г.Степень извлечения ионов Sr2+ (α, %) рассчитывали по формуле:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика сорбента
В табл. 1 приведены данные по фазовому составу и удельной поверхности осадка, полученного в исследуемой многокомпонентной системе. Более подробно данные по составу, морфологии и термическому поведению продукта в исследуемой системе приведены в работе [22].
Таблица 1.
Фазовый состав продуктов синтеза в системе CaCl2–Na2SiO3–H2O
| Образец | Фазовый состав | Удельная поверхность, м2/г |
|---|---|---|
| После сушки при 85°С | Аморфная фаза, кальцит CaCO3 | 105.9 |
| После обжига при 900°С | Волластонит CaSiO3, оксид кальция CaO | 8.2 |
Как видно из табл. 1, состав полученного осадка свидетельствует о том, что в рассматриваемой системе необходимо учитывать следующие реакции:
(3)
${\text{SrC}}{{{\text{l}}}_{2}} + {\text{CaSi}}{{{\text{O}}}_{{\text{3}}}} + {\text{C}}{{{\text{O}}}_{2}} \to {\text{SrC}}{{{\text{O}}}_{3}} + {\text{Si}}{{{\text{O}}}_{2}} + {\text{CaC}}{{{\text{l}}}_{{\text{2}}}},$(4)
${\text{SrC}}{{{\text{l}}}_{2}} + {\text{CaC}}{{{\text{O}}}_{3}} \to {\text{SrC}}{{{\text{O}}}_{3}} + {\text{CaC}}{{{\text{l}}}_{2}},$(5)
$2{\text{CaSi}}{{{\text{O}}}_{3}} + 2{\text{SrC}}{{{\text{l}}}_{2}} = {\text{S}}{{{\text{r}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{4}} + 2{\text{CaC}}{{{\text{l}}}_{2}} + {\text{Si}}{{{\text{O}}}_{2}}{{,}_{~}}$(6)
$\begin{gathered} {\text{CaSi}}{{{\text{O}}}_{3}} + {\text{CaC}}{{{\text{O}}}_{3}} + 2{\text{SrC}}{{{\text{l}}}_{2}} = \\ = {\text{S}}{{{\text{r}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{4}} + 2{\text{CaC}}{{{\text{l}}}_{2}} + {\text{C}}{{{\text{O}}}_{2}},~ \\ \end{gathered} $(7)
$\begin{gathered} {\text{CaSi}}{{{\text{O}}}_{3}} + {\text{CaC}}{{{\text{O}}}_{3}} + 2{\text{SrC}}{{{\text{l}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \hfill \\ = 2{\text{Sr}}{{\left( {{\text{OH}}} \right)}_{2}} + 2{\text{CaC}}{{{\text{l}}}_{2}} + {\text{Si}}{{{\text{O}}}_{2}} + {\text{C}}{{{\text{O}}}_{2}}, \hfill \\ \end{gathered} $(8)
${\text{SrC}}{{{\text{l}}}_{2}} + {\text{CaSi}}{{{\text{O}}}_{3}} \to {\text{SrSi}}{{{\text{O}}}_{3}} + {\text{CaC}}{{{\text{l}}}_{2}}.~$Реакция катионного обмена ионов Ca2+ и Sr2+ в исследуемой системе возможна по уравнениям (3) и (7), $\Delta G_{{{\text{х}}{\text{.р}}}}^{^\circ }$ составляет –63.3 и –86.7 кДж соответственно. Расчет значения $\Delta G_{{{\text{х}}{\text{.р}}}}^{^\circ }$ для реакции (3), возможной в рассматриваемых условиях, ранее был подтвержден авторами с помощью данных рентгенофазового анализа, рентгеновской фотоэлектронной спектроскопии и спектроскопии комбинационного рассеяния [18].
Однако, учитывая значения произведения растворимости (справочные и расчетные данные) для соединений, участвующих в реакциях в данной многокомпонентной системе, возможно образование метасиликата и ортосиликата стронция (табл. 2).
Таблица 2.
Произведения растворимости исходных соединений и продуктов реакции в системе CaSiO3–CaСO3–SiO2–SrCl2
| Соединение | Произведение растворимости |
|---|---|
| Исходные соединения | |
| CaCO3 | 3.8 × 10–9 |
| CaSiO3 | 7.4 × 10–11 |
| Продукты реакции | |
| SrCO3 | 1.1 × 10–10 |
| Sr2SiO4 | 5.1 × 10–7 |
| SrSiO3 | 1.0 × 10–13 |
| Sr(OH)2 | 3.2 × 10–4 |
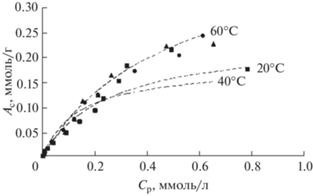
На рис. 1 приведены изотермы сорбции ионов Sr2+ из растворов хлорида стронция без солевого фона при температурах 20, 40 и 60°С. Видно, что с повышением температуры сорбционная емкость исследуемого сорбента возрастает. Наибольшее увеличение сорбционной емкости наблюдается при температуре 60°С. При 20 и 40°С различия в изотермах практически не наблюдаются в пределах ошибки определения ионов Sr2+ методом ААС.
Для оценки сорбционных свойств полученные изотермы анализировали в координатах уравнения Ленгмюра и эмпирического уравнения Фрейндлиха.
Уравнение Ленгмюра:
(9)
$\frac{{{{С}_{{\text{p}}}}}}{{{{A}_{{\text{c}}}}}} = \frac{1}{{{{A}_{{\text{m}}}}k}} + \frac{{{{С}_{{\text{р}}}}}}{{{{A}_{{\text{m}}}}}},$Константы уравнения были рассчитаны из наклона и пересечения прямых на графике в соответствующих координатах линейного уравнения Ср/Ас от Ср.
Логарифмическую форму уравнения Фрейндлиха применяли для построения линейной зависимости и lnAc–lnCр и графического определения параметров KF и n:
где KF – константа равновесия уравнения Фрейндлиха, относящаяся к сорбционной емкости; 1/n – параметр, указывающий на интенсивность взаимодействия сорбент–сорбат.Найденные графическим способом параметры уравнений Ленгмюра и Фрейндлиха представлены в табл. 3.
Таблица 3.
Параметры уравнений Ленгмюра и Фрейндлиха при сорбции ионов Sr2+ силикатом кальция
| Температура, °C | Параметры уравнения Ленгмюра | Параметры уравнения Фрейндлиха | ||||
|---|---|---|---|---|---|---|
| Am, ммоль/г | k, л/ммоль | R2 | KF, (ммоль/г) (л/ммоль)1/n |
1/n | R2 | |
| 20 | 0.28 | 3.07 | 0.8123 | 2.997 | 0.78 | 0.973 |
| 40 | 0.37 | 2.71 | 0.8591 | 2.48 | 0.7759 | 0.9902 |
| 60 | 0.41 | 2.1 | 0.9589 | 2.43 | 0.8214 | 0.9933 |
Из представленной таблицы видно, что процесс сорбции ионов Sr2+ силикатом кальция наилучшим образом описывается уравнением Фрейндлиха, о чем свидетельствуют соответствующие коэффициенты корреляции. Величина максимальной сорбционной емкости Am, рассчитанная по уравнению Ленгмюра, возрастает с увеличением температуры от 0.28 до 0.41 ммоль/г.
На рис. 2 приведены кинетические кривые сорбции ионов Sr2+ силикатом кальция при температурах 20, 40 и 60°С.
Рис. 2.
Кинетические зависимости сорбции ионов Sr2+ силикатом кальция при различных температурах: 1 – 20, 2 – 40, 3 – 60°С.

Как видно из представленных на рис. 2 зависимостей, при различных температурах значительных изменений в кинетике извлечения Sr2+ не наблюдается, поэтому кинетические кривые разделены на два графика.
На рис. 3 приведены экспериментальные данные по кинетике сорбции в виде логарифмических зависимостей в соответствии с уравнением Колмогорова–Ерофеева после двойного логарифмирования:
Линейные зависимости, наблюдаемые в логарифмических координатах, указывают на постоянство n в приведенных интервалах времени. Обработанные по обобщенному топохимическому уравнению кинетические данные приведены в табл. 4.
Таблица 4.
Порядок реакции (n) и константа скорости (k), полученные при анализе кинетических данных в соответствии с уравнением Колмогорова–Ерофеева
| Температура, °С | Параметры уравнения | ||
|---|---|---|---|
| n | lnk | R2 | |
| 20 | 0.1204 | 0.2282 | 0.8828 |
| 40 | 0.1143 | 0.2494 | 0.8689 |
| 60 | 0.1231 | 0.2042 | 0.817 |
Как видно из табл. 4, для анализируемого температурного диапазона порядок реакции n сорбции ионов Sr2+ меньше единицы, что характерно для реакций, сопровождаемых диффузионными процессами.
По найденным из температурных зависимостей величинам lnk, согласно уравнению Аррениуса, в логарифмической форме:
где Q – энергия активации; R – газовая постоянная (8.3145 Дж/(моль K)); Т – температура, графически определена энергия активации процесса сорбции ионов Sr2+.Энергия активации процесса сорбции, рассчитанная по экспериментальным данным, равна 0.44 кДж/моль. Это довольно низкая величина, и характерной особенностью таких процессов является незначительное изменение скорости реакции катионного обмена с изменением температуры, что и подтверждено экспериментами.
Полученные кинетические данные анализировали в соответствии с уравнением кинетики, предложенным в работе [23]:
(13)
${{\alpha }_{\tau }} = {{\alpha }_{{\text{m}}}}K\tau \left[ {\frac{1}{{(1 + k\tau )}}} \right],$Примененное уравнение кинетики топохимических реакций с минимальными отклонениями описывает процессы сорбции ионов металлов сорбентами, механизм сорбции для которых связан с ионным обменом, кинетику реакции получения гидросиликатов кальция, кинетику сорбции микроорганизмов [24, 25].
В табл. 5 приведены параметры, полученные графически при представлении экспериментальных данных по кинетике в виде зависимостей обратной величины степени прохождения реакции (в данном случае степени извлечения стронция) от обратной величины времени процесса. Видно, что предложенное уравнение подходит для описания кинетики исследуемых процессов, о чем свидетельствуют соответствующие коэффициенты корреляции.
Таблица 5.
Данные по кинетике процесса сорбции ионов Sr2+ силикатом кальция
| Температура, °С | Уравнение и его параметры | ||
|---|---|---|---|
| Y = ax + b (R2) | k, мин–n | Am, ммоль/г | |
| 20 | y = 0.0252x + 4.0677 (0.8875) | 161.42 | 0.25 |
| 40 | y = 0.0283x + 3.8775 (0.9373) | 137.01 | 0.26 |
| 60 | y = 0.0341x + 3.817 (0.9919) | 111.9 | 0.262 |
Для определения энергии активации экспериментальные данные величин lnk представлены в виде зависимости от обратной абсолютной температуры (1/Т) (рис. 4), которая описывается уравнением прямой y = 0.9x + 2.0267 с коэффициентом корреляции R2 = 0.9959.
Рис. 4.
Температурная зависимость логарифма константы скорости реакции lnk от обратной абсолютной температуры при извлечении ионов Sr2+.

Энергия активации процесса сорбции, рассчитанная по экспериментальным данным в соответствии с предложенным уравнением, составляет 7.5 кДж/моль. Это значение более достоверно, поскольку коэффициенты корреляции, полученные при анализе экспериментальных данных, выше, чем в соответствии с уравнением Колмогорова–Ерофеева.
В табл. 6 приведены значения степени извлечения стронция при сорбции из раствора без солевого фона (дистиллированной воды) и из раствора ИПВ при различном соотношении твердой и жидкой фаз.
Таблица 6.
Значения степени извлечения стронция при сорбции из раствора без солевого фона (дистиллированной воды) и из раствора ИПВ
| т : ж | Раствор без солевого фона | Раствор ИПВ | ||
|---|---|---|---|---|
| Sr2+, мкг/мл | степень извлечения ионов Sr2+ (α, %) | Sr2+, мкг/мл | степень извлечения ионов Sr2+ (α, %) | |
| Исходный раствор | 10.86 | – | 10.8 | – |
| 1 : 40 | 0.35 | 96.8 | 3.2 | 70.4 |
| 1 : 100 | 1.02 | 90.6 | 5.6 | 48.1 |
| 1 : 400 | 1.52 | 86.0 | 4.8 | 55.6 |
| 1 : 1000 | 2.9 | 73.3 | 6.9 | 36.1 |
| 1 : 2000 | 3.5 | 67.8 | 7.55 | 30.1 |
Как видно из представленной таблицы, степень очистки водного раствора на основе дистиллированной воды при соотношениях твердой и жидкой фаз, равных 1 : 40, 1 : 100 и 1 : 400, составляет 96.8, 90.6 и 86.0% соответственно, что говорит об эффективности используемого силикатного сорбента в данных условиях. Степень очистки из раствора ИПВ ниже, чем из раствора на основе дистиллированной воды. При соотношениях твердой и жидкой фаз, равных 1 : 40, 1 : 100 и 1 : 400, степень очистки составляет 70.4, 48.1, 55.6% соответственно, что говорит о влиянии солевого фона на процесс сорбции.
ЗАКЛЮЧЕНИЕ
Изучены сорбционные свойства материала на основе гидросиликата кальция, содержащего карбонат кальция, с удельной поверхностью 105.9 м2/г, полученного в модельной многокомпонентной системе CaCl2–Na2SiO3–H2O, по отношению к ионам Sr2+, в том числе из раствора сложного солевого состава.
Выявлено, что с повышением температуры сорбционная емкость исследуемого сорбента возрастает. Наибольшее увеличение сорбционной емкости наблюдается при температуре 60°С.
Показано, что процесс сорбции ионов Sr2+ силикатом кальция наилучшим образом описывается уравнением Фрейндлиха, о чем свидетельствуют соответствующие коэффициенты корреляции. Величина максимальной сорбционной емкости Am, рассчитанная по уравнению Ленгмюра, возрастает с увеличением температуры от 0.28 до 0.41 ммоль/г.
Установлено, что с увеличением температуры значительных изменений в кинетике извлечения Sr2+ не наблюдается.
Энергия активации процесса сорбции, рассчитанная по экспериментальным данным, характеризуется довольно низким значением (до 7.5 кДж/моль), что говорит о незначительном изменении скорости реакции катионного обмена с изменением температуры, это подтверждено и экспериментальными данными.
Показано, что степень очистки водного раствора на основе дистиллированной воды при соотношениях твердой и жидкой фаз, равных 1 : 40, 1 : 100 и 1 : 400, составляет 96.8, 90.6 и 86.0%. Степень очистки из раствора ИПВ ниже, чем из раствора на основе дистиллированной воды, и не превышает 70.4%.
Список литературы
Casacuberta N., Masque P., Garcia-Orellana J. et al. // Biogeosciences Discuss. 2013. V. 10. P. 3649. https://doi.org/10.5194/bg-10-3649-2013
Василенко И.Я., Василенко О.И. // Энергия: экономика, техника, экология. 2002. № 4. С. 26.
Strontium Contamination in the Environment // The Handbook of Environmental Chemistry / Eds. Pathak P., Gupta D.K. Springer, 2020. V. 88. 250 p. https://doi.org/10.1007/978-3-030-15314-4
Бахвалов А.В., Лаврентьева Г.В., Сынзыныс Б.И. // Биосфера. 2012. Т. 4. № 2. С. 206.
Алейникова М.Л., Клименко И.А. // Лабораторные и технологические исследования и обогащение минерального сырья. М.: ВИЭМС, 1980. 23 с.
Voronina A.V., Noskova A.Yu., Semenishchev V.S. et al. // J. Environ. Radioact. 2020. V. 217. Art. 106210. https://doi.org/10.1016/j.jenvrad.2020.106210
Shubair T., Eljamal O., Tahara A. et al. // J. Mol. Liq. 2019. V. 288. P. 111026. https://doi.org/10.1016/j.molliq.2019.111026
Freire C.B., Tello C.C.O. // Rev. Brasileira de Pesquisa e Desenvolvimento. 2008. № 1. P. 1.
Milyutin V.V., Nekrasova N.A., Yanicheva N.Yu. et al. // Radiochem. 2017. V. 59. № 1. P. 65. https://doi.org/10.1134/S1066362217010088
Рябухина В.Г., Воронина А.В. // X Рос. конф. с международным участием “Радиохимия 2018”: Сб. тез. Санкт-Петербург, 17–21 сент. 2018 г. Санкт-Петербург, 2018. С. 249.
Bezhin N.A., Dovhyi I.I., Kapranov S.V. et al. // J. Radioanal. Nucl. Chem. 2021. V. 328. P. 1199. https://doi.org/10.1007/s10967-021-07718-8
Сокольницкая Т.А., Авраменко В.А., Бурков И.С. и др. // Журн. физ. химии. 2004. Т. 78. № 3. С. 497.
Тананаев И.Г., Авраменко В.А. // Журн. Белорус. гос. ун-та. Экология. 2017. № 4. С. 33.
Gordienko P.S., Shabalin I.A., Yarusova S.B. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 12. P. 1579. [Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Журн. неорган. химии. 2019. Т. 64. № 12. С. 1326.]https://doi.org/10.1134/S0036023619120052
Gordienko P.S., Shabalin I.A., Suponina A.P. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 8. P. 946. [Гордиенко П.С., Шабалин И.А., Супонина А.П. и др. // Журн. неорган. химии. 2016. Т. 61. № 8. С. 993.]https://doi.org/10.1134/S003602361608009X
Coleman N.J., Brassington D.S., Raza A. et al. // Waste Manage. 2006. V. 26. P. 260. https://doi.org/10.1016/j.wasman.2005.01.019
Shrivastava O.P., Shrivastava R. // Cem. Concr. Res. 2001. V. 31. P. 1251.
Гордиенко П.С., Ярусова С.Б., Крысенко Г.Ф. и др. // Техника и технология силикатов. 2012. Т. 19. № 1. С. 2.
Акатьева Л.В. Синтез и физико-химические свойства ксонотлита и волластонита. Дис. … канд. хим. наук. М., 2003. 233 с.
Лотов В.А., Верещагин В.И., Косинцев В.И. и др. // Пат. РФ № 2133218. Опубл. 20.07.99. Бюл. № 20.
Баранова О.Ю. Защита водных объектов от техногенных радионуклидов сорбентами на основе опалкристобалитовых пород. Автореф. … канд. тех. наук. Екатеринбург, 2006. 19 с.
Ярусова С.Б., Гордиенко П.С., Охлопкова А.А. и др. // Хим. технология. 2019. Т. 20. № 14. С. 661. https://doi.org/10.31044/1684-5811-2019-20-14-661-666
Gordienko P.S., Shabalin I.A., Yarusova S.B. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 11. P. 2284. [Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Журн. физ. химии. 2019. Т. 93. № 11. С. 1724.]https://doi.org/10.1134/S0036024419110116
Gordienko P.S., Yarusova S.B., Buravlev I.Yu. et al. // Russ. J. Phys. Chem. A. 2021. V. 95. № 1. P. 38. [Гордиенко П.С., Ярусова С.Б., Буравлев И.Ю. и др. // Журн. физ. химии. 2021. Т. 95. № 1. С. 23.]https://doi.org/10.1134/S003602442101009X
Yarusova S.B., Somova S.N., Kharchenko U.V. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 8. P. 1135. [Ярусова С.Б., Сомова С.Н., Харченко У.В. и др. // Журн. неорган. химии. 2021. Т. 66. № 8. С. 1025.]https://doi.org/10.1134/S0036023621080313
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии