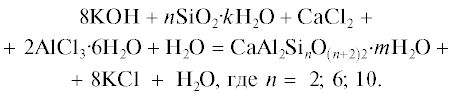Журнал неорганической химии, 2022, T. 67, № 9, стр. 1258-1265
Синтез алюмосиликатов кальция из наноструктурированных синтетических цеолитов Na-формы и исследование их сорбционных свойств
П. С. Гордиенко a, С. Б. Ярусова a, b, *, И. А. Шабалин a, А. Б. Слободюк a, Е. А. Нехлюдова a, b, О. О. Шичалин c, Е. К. Папынов c, В. Г. Курявый a, Н. В. Полякова a, Ю. А. Паротькина a
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
b Владивостокский государственный университет экономики и сервиса
690014 Владивосток, ул. Гоголя, 41, Россия
c Дальневосточный федеральный университет
690922 Владивосток, о. Русский, п. Аякс, 10, Россия
* E-mail: yarusova_10@mail.ru
Поступила в редакцию 21.03.2022
После доработки 28.03.2022
Принята к публикации 30.03.2022
- EDN: XNTVSR
- DOI: 10.31857/S0044457X22090045
Аннотация
Синтезированы и охарактеризованы алюмосиликаты кальция, полученные путем химического модифицирования из синтетических наноструктурированных цеолитов Na-форм. Приведены данные по сорбционным свойствам алюмосиликатов кальция с соотношением SiO2 : Al2O3 = 2 : 1; 4 : 1; 6 : 1; 8 : 1 и 10 : 1. Показано, что максимальная сорбционная емкость данных соединений в статических условиях из растворов без солевого фона по отношению к ионам Cs+ достигает 1.45 ммоль/г (192.7 мг/г). Результаты, полученные в работе, позволяют рассматривать данные соединения как материалы, перспективные для сорбции и иммобилизации долгоживущих радионуклидов.
ВВЕДЕНИЕ
Долгоживущие радионуклиды представляют опасность для живых организмов при аккумулировании выше допустимых норм, и по многим элементам накоплено достаточно данных, доказывающих их негативное влияние на биологические объекты [1, 2]. Для устранения негативного воздействия на биосферные биологические объекты используются различные методы и материалы, позволяющие их концентрировать в форме высокостабильных соединений с последующей переработкой и захоронением. В связи с этим представляет интерес получение эффективных материалов для сорбции и иммобилизации долгоживущих радионуклидов, в частности 137Cs.
Широкое применение в качестве таких материалов нашли различные природные и синтетические алюмосиликаты (цеолиты) [3–10].
В работах [11–13] представлены данные по сорбции ионов Сs+ рентгеноаморфными наноструктурированными алюмосиликатами калия (KAlSixOy·nH2O, где х = 1–5, y = 2(х + 1)) в статических условиях, в том числе из растворов с различным солевым фоном. Изучены кинетические параметры сорбции и определена энергия активации процесса сорбции. Установлено, что максимальная сорбционная емкость по отношению к ионам Сs+ в статических условиях при сорбции из растворов без солевого фона для КАlSi3O8⋅1.5H2O достигает 3.7 ммоль/г, а коэффициент межфазного распределения (Кd) ионов при соотношении т : ж = 1 : 4000 достигает значения 1 × 105 мл/г. При этом алюмосиликаты аналогичного состава могут быть получены из различных кремнийсодержащих отходов, например, из отходов растительного производства [14].
В [15, 16] представлены результаты исследования сорбционных свойств синтетических алюмосиликатов кальция (АСК) по отношению к ионам Sr2+ и Cs+ из различных по ионному составу водных растворов в статических условиях. Для получения АСК с соотношениями Al : Si = 2 : 2; 2 : 6; 2 : 10 первоначально синтезировали соли поликремниевой кислоты с заданным соотношением SiO2 : M2O (М – щелочной металл калий). Полученный раствор жидкого калиевого стекла смешивали с приготовленным раствором хлоридов кальция и алюминия в соотношении со стехиометрическими коэффициентами согласно уравнению (1):
Авторами работы было замечено, что при описанном методе получения алюмосиликатов соотношение SiO2 : Al2O3 выполняется в пределах ошибки измерений заданных мольных отношений по оксидам кремния и алюминия, но если суммарный заряд катионов превышает содержание алюминия в синтезируемом алюмосиликате, то из этого следует, что в составе получаемого вещества могут присутствовать другие фазы – гидроксиды или карбонаты. Если алюминий при замещении кремния находится в тетраэдрическом окружении кислорода в виде анионного комплекса, то в спектрах, по данным ЯМР, присутствуют пики, относящиеся к алюминию в октаэдрическом окружении кислорода, это является подтверждением наличия в исследуемом составе гидроксида алюминия. Полученные таким методом алюмосиликаты не являются однофазными, в составе конечных продуктов присутствуют и нерастворимые карбонаты кальция, которые взаимодействуют с сорбатом.
Данные соединения, получаемые из водных растворов низкотемпературным и быстрым способом, представляют перспективу в качестве сорбционного материала для извлечения 137Cs из различных водных сред, а также могут использоваться в качестве неорганической основы для получения твердотельных матриц с целью надежной иммобилизации данного радионуклида, например, при кондиционировании отработанной формы сорбента [17–20]. Силикаты как сырье для таких матриц удовлетворяют предъявляемым к ним требованиям (высокая химическая и радиационная устойчивость и механическая прочность) [21].
Известно, что соли поликремниевых (алюмокремниевых) кислот, к которым относятся алюмосиликаты, легко подвергаются химическому модифицированию, связанному с замещением катионов, компенсирующих избыточный заряд алюмокислородного тетраэдра, катионами солей более сильных кислот.
Авторами настоящей работы синтезированы алюмосиликаты Nа-формы с заданным отношением SiO2 : Al2O3, равным 2 : 1; 4 : 1; 6 : 1; 8 : 1; 10 : 1 с последующим их химическим модифицированием ионами кальция. Химическое модифицирование алюмосиликатов Nа-формы осуществляли путем обработки в растворе соли кальция при температуре не более 100°С. После модифицирования было проведено сравнение степени замещения ионов Na+ кальцием, при одинаковых условиях обработки были получены данные по составу, морфологии, сорбционным свойствам алюмосиликатов кальция с различным отношением SiO2 : Al2O3 по отношению к ионам Cs+.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и химическое модифицирование образцов. В качестве исходных веществ для синтеза алюмосиликатов с заданными соотношениями SiO2 : Al2O3 = 2 : 1; 4 : 1; 6 : 1; 8 : 1; 10 : 1 использовали следующие реагенты: АlCl3·6Н2О (ч., ГОСТ 2463-80), кислоту кремниевую водную SiO2 · ⋅ nН2О (ГОСТ 4214-78), NaОН (ч. д. а.), CaCl2 (ч.).
Образцы алюмосиликатного состава M2Al2Si2kO2(2k + 2)⋅nH2O (M = Na; k = 1, 2, 3, 4, 5) с изменяющимся соотношением компонентов SiO2 : : Al2O3 (2 : 1; 4 : 1; 6 : 1; 8 : 1; 10 : 1) были синтезированы путем растворения кремнезема в гидроксиде натрия с получением жидкого стекла с заданным силикатным модулем Mж = SiO2/M2O (M = = Na) и последующим смешением полученного раствора с раствором хлорида алюминия. Соотношения компонентов рассчитывали таким образом, чтобы получать алюмосиликаты с заданным значением k = Si/Al и конечным значением рН раствора, равным 7. На рис. 1 приведена зависимость состава алюмосиликата (точки пересечения с осью абсцисс) от модуля жидкого стекла при получении из растворов с конечным значением рН раствора, равным 7.
Рис. 1.
Зависимость состава алюмосиликатов с заданным k от Mж жидкого стекла для системы М2О–SiO2–АlCl3–Н2О: 1 – МAlSiO4; 2 – МAlSi2O6; 3 – МAlSi3O8; 4 – МAlSi4O10; 5 – MAlSi5O12.

Выбранные условия выполняются, если приготовленный раствор жидкого стекла имеет модуль Mж = 1/2k, а компоненты взяты согласно стехиометрическим коэффициентам уравнения (2):
(2)
$\begin{gathered} 4{{{\text{M}}}_{{\text{2}}}}{\text{О}} + 2k{\text{Si}}{{{\text{O}}}_{2}} + 2{\text{АlC}}{{{\text{l}}}_{3}} = \\ = {{{\text{M}}}_{{\text{2}}}}{\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{S}}{{i}_{{2k}}}{{{\text{О}}}_{{2\left( {2k + 2} \right)}}} + 6{\text{MCl}}. \\ \end{gathered} $Образовавшийся осадок отделяли от раствора через фильтр “синяя лента”; при промывке в фильтрате проводили контроль на наличие ионов хлора. Осадки высушивали до постоянного веса при температуре 100–105°С.
Для получения цеолитов Са-формы исходные алюмосиликаты Na-формы выдерживали в насыщенном растворе хлорида кальция в течение 2 ч при слабом кипении. Затем осадок отделяли от раствора через фильтр “синяя лента”, промывали дистиллированной водой до отрицательной реакции на ионы хлора и сушили при температуре 105°С.
Опыты по сорбции. Опыты по сорбции ионов Cs+ проводили в статических условиях при соотношении твердой и жидкой фаз, равном 1 : 100, и температуре 20°С из водных растворов хлорида цезия без солевого фона с различными начальными концентрациями ионов Cs+ до 75 ммоль/л при перемешивании на магнитной мешалке RT 15 power (Ika Werke, Германия) в течение 3 ч.
Методы анализа. Количество кристаллизационной воды в полученных цеолитах (табл. 1) определяли по разнице веса образца, высушенного при температуре 100–105°С, и образца, отожженного при 800°С. Расчет кристаллизационной воды проводили и по термограммам, полученным с использованием дериватографа Q-1500 D системы Ф. Паулик, П. Паулик, Л. Эрдей фирмы МОМ (Венгрия) (точность определения температуры ±5°С) при отжиге образцов до 800°С при скорости 5 град./мин в открытом платиновом тигле на воздухе.
Таблица 1.
Элементный состав, содержание кристаллизационной воды и удельная поверхность алюмосиликатов Na-формы
| Формула | Н2Окрист, моль | Элементный состав, мас. % | Удельная поверхность Sуд, м2/г | ||
|---|---|---|---|---|---|
| Na | Si | Al | |||
| NаAl2Si2O8 | 3.0 | 18.7 | 42.1 | 39.0 | 254.5 |
| NаAl2Si4O12 | 3.4 | 13.3 | 56.8 | 29.8 | 143.9 |
| NаAl2Si6O16 | 4.5 | 13.7 | 63.5 | 22.6 | 225.6 |
| NаAl2Si8O20 | 5.5 | 9.5 | 70.9 | 19.5 | 154.0 |
| NаAl2Si10O24 | 6.0 | 6.9 | 77.0 | 16.1 | 304.9 |
Для количественного определения элементного состава синтезированных алюмосиликатов применяли энергодисперсионный рентгенофлуоресцентный метод с использованием спектрометра Shimadzu EDX 800 HS (Япония). Навеску образца растирали в агатовой ступке с борной кислотой (2 : 1 по весу) и помещали в пресс-форму диаметром 20 мм. Таблетку-излучатель прессовали в течение 2 мин при давлении 5000 кг, после чего помещали в спектрометр и проводили измерения. Время экспозиции 100 с в каждом энергетическом канале, источник излучения рентгеновская трубка с Rh-анодом, расчет концентрации элементов производили по методу фундаментальных параметров с помощью программного комплекса спектрометра без учета легких элементов. Относительная погрешность определения элементного состава не превышала ±10%.
Удельную поверхность образцов определяли методом низкотемпературной адсорбции азота с использованием прибора Сорбтометр-М (Россия).
Рентгенограммы осадков снимали на автоматическом дифрактометре D8 Advance (Германия) с вращением образца в СuKα-излучении. Рентгенофазовый анализ (РФА) проводили с использованием программы поиска EVA с банком порошковых данных PDF-2.
Изучение морфологических характеристик и подтверждение локального элементного состава выполнены на электронном микроскопе высокого разрешения Hitachi S5500 (Япония).
Спектры ЯМР 27Al, 29Si, 1Н записывали на спектрометре Bruker Avance AV-300 (B0 = 7 Тл) (Германия) с применением методики вращения образца под магическим углом (ВМУ) со скоростью 12 кГц. Регистрацию спектров ЯМР 27Al проводили методом эха Хана, в качестве внешнего эталона использовали разбавленные водные растворы AlCl3 · 6H2O (ион [Al(H2O)6]3+) и NaCl. Для регистрации спектров 29Si применяли метод кросс-поляризации 29Si-{1H} с подавлением взаимодействий 29Si–1H, а химические сдвиги 29Si и 1H отсчитывали от сигнала тетраметилсилана. Точность определения химических сдвигов составляла 1 м.д., определения интегральных интенсивностей сигналов – 10%.
Содержание ионов Cs+ в исходных растворах и фильтратах после сорбции определяли методом атомно-абсорбционной спектрометрии на двухлучевом спектрометре Solaar M6 (Thermo Scientific, США) по аналитической линии 852.1 нм. Предел обнаружения ионов цезия в водных растворах составляет 0.01 мкг/мл.
Сорбционную емкость (Ас, ммоль/г) исследуемых образцов рассчитывали по формуле:
где Сисх – исходная концентрация ионов Cs+ в растворе, ммоль/л; Ср – равновесная концентрация ионов Cs+ в растворе, ммоль/л; V – объем раствора, л; m – масса сорбента, г.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика исходных и модифицированных алюмосиликатов
На всех рентгенограммах образцов алюмосиликатов Nа-формы с соотношением SiO2 : Al2O3 от 2 до 10 наблюдаются широкие максимумы в диапазоне малых углов 2θ. Отсутствие четких брэгговских пиков подтверждает рентгеноаморфность образцов, что определяется их низкой степенью кристаллизации и наноразмерностью кристаллитов. Установлено, что с увеличением соотношения SiO2 : Al2O3 в ряду отношений 2 : 1, 4 : 1, 6 : 1, 8 : 1, 10 : 1 последовательно увеличиваются межплоскостные расстояния от 3.359 до 3.711 Å.
Данные по составу, удельной поверхности и содержанию кристаллизационной воды в полученных образцах приведены в табл. 1.
Полученные образцы состава M2Al2SixO2(x+ 4)⋅nH2O (M = Na) представляют собой нанодисперсные порошки с развитой поверхностью, состоящие из частиц размером 10–20 нм, сросшихся в агломераты. На рис. 2 приведены СЭМ-изображения образца наноструктурированного алюмосиликата натрия с соотношением SiO2 : Al2O3 = 2 : 1. Принципиальных различий в морфологии образцов с различным соотношением SiO2 : Al2O3 не обнаружено.
Для исследуемых алюмосиликатов натрия установлено увеличение удельной поверхности с ростом отношения SiO2 : Al2O3, которое достигает более 300 м2/г (табл. 1).
Элементный состав цеолитов Са-формы, полученных в результате модифицирования алюмосиликатов Na-формы, с соответствующим соотношением SiO2 : Al2O3 приведен в табл. 2.
Таблица 2.
Элементный состав цеолитов Са-формы, полученных в результате модифицирования алюмосиликатов Na-формы
| Соотношение SiO2 : Al2O3 в исходном алюмосиликате Na-формы | Предполагаемая формула | Элементный состав, мас. % (моль) | |||
|---|---|---|---|---|---|
| Na | Са | Si | Al | ||
| 2 : 1 | CаAl2Si2O8 | – | 27.0 (0.67) | 28.5 (1.0) | 32.6 (1.2) |
| 4 : 1 | CаAl2Si4O12 | – | 24.4 (0.61) | 50.9 (1.8) | 24.1 (0.89) |
| 6 : 1 | CаAl2Si6O16 | – | 22.0 (0.55) | 53.1 (1.9) | 21.2 (0.78) |
| 8 : 1 | CаAl2Si8O20 | – | 19.6 (0.49) | 63.8 (2.3) | 15.9 (0.58) |
| 10 : 1 | CаAl2Si10O24 | – | 14.4 (0.36) | 68.5 (2.5) | 17.1 (0.63) |
При таком методе химического модифицирования исходного алюмосиликата натрия в полученных образцах алюмосиликатов кальция натрия не обнаружено, удельная поверхность образцов уменьшается в 2–2.5 раза. Полное замещение катионов натрия кальцием в алюмосиликатах Nа-формы следует объяснить близостью ионных радиусов (Са – 0.104 нм, Nа – 0.116 нм). Морфология алюмосиликатов кальция после модифицирования от исходных алюмосиликатов Na-формы не отличается.
ЯМР-исследование алюмосиликатов
Спектры ЯМР 27Al (рис. 3а, табл. 3) содержат сигналы вблизи ~0 и ~50 м.д., которые могут быть отнесены к окта- и тетракоординированным атомам алюминия соответственно [22, 23]. Сигналы тетракоординированных атомов имеют большую интенсивность и более заметны вследствие их меньшей ширины. Интенсивность этих сигналов увеличивается с ростом содержания кремния в образце, и для состава СаAl2Si10O24 определить наличие сигнала вблизи 0 м.д. становится затруднительным.
Рис. 3.
Спектры ЯМР ВМУ исследованных алюмосиликатов кальция: а – 27Al, б – 29Si, в – 1Н (SiO2 : Al2O3 = 2 : 1 (1); 4 : 1 (2); 6 : 1 (3); 8 : 1 (4); 10 : 1 (5)).

Таблица 3.
Параметры ЯМР спектров 27Al
| № соединения |
Соединение | Компонент 1 (тетраэдр) | Компонент 2 (октаэдр) | ||
|---|---|---|---|---|---|
| х. с.*, м. д. | площадь, % | х. с., м. д. | площадь, % | ||
| 1 | CaAl2Si2O8 | 47 | 60 | –6 | 40 |
| 2 | CaAl2Si4O12 | 44 | 58 | –11 | 42 |
| 3 | CaAl2Si6O16 | 48 | 76 | –5 | 24 |
| 4 | CaAl2Si8O20 | 48 | 80 | –8 | 20 |
| 5 | CaAl2Si10O24 | 49 | 85 | –6 | 15 |
Спектры ЯМР ВМУ 29Si исследованных соединений (рис. 3б) содержат по одному широкому сигналу, положение которого систематически зависит от состава образца и определяется соотношением структурных фрагментов Si–O–Si и Si–O–Al. Если для состава CaAl2Si10O24 сигнал имеет сдвиг – 98.5 м.д., то для CaAl2Si2O8 положение сигнала составляет – 86.5 м.д.
Спектры MAS ЯМР 1H содержат сигналы в области 4.6–4.8 м.д., составные для образцов CaAl2Si6O16 и CaAl2Si8O20.
Исходя из данных элементного состава и спектров ЯМР, содержание ионов Ca2+ в образцах находится в избытке. Если учесть, что часть атомов Al находится в тетраэдрической координации (до 60–80%) и относится к цеолиту, то такое же количество зарядов в мольном отношении должно быть компенсировано зарядами катионов, в данном случае кальция, а избыточную часть кальция следует отнести к карбонату кальция, получаемому в процессе синтеза, что подтверждается экспериментами. Остаточную долю Al (20–40%), находящегося в октаэдрической координации с кислородом, следует отнести к гидроксиду Al(OH)3.
Таким образом, полученные соединения следует представить в виде фазового и элементного состава, представленного в табл. 4.
Таблица 4.
Фазовый, элементный состав и удельная поверхность алюмосиликатов кальция (образцы после сушки при температуре 105°С)
| Брутто-формула | H2Oкрист, моль | Элементный состав, мас. % (моль) | Фазовый состав, % | Удельная поверхность Sуд, м2/г (относительная плотность d, г/см3) | ||
|---|---|---|---|---|---|---|
| Si | Al | Ca | ||||
| Са0.67Al1.20Si1.0О3.44(ОН)1.44(СО3)0.31 | 4 | 28.5 (1.0) | 32.6 (1.2) | 27.0 (0.67) | Аморфная фаза (68.5%), гидроокись Al(OH)3 (23.8%), кальцит CaCO3 (7.7%) | 81.0 (2.08) |
| Са0.61Al0.89Si1.8О4.63(ОН)1.12(СО3)0.35 | 5 | 50.9 (1.8) | 24.1 (0.89) | 24.4 (0.61) | Аморфная фаза (77%), гидроокись Al(OH)3 (15.5%), кальцит CaCO3 (7.5%) | 67.5 (2.2) |
| Са0.55Al0.78Si1.9О4.98(ОН)0.56(СО3)0.25 | 6 | 53.1 (1.9) | 21.2 (0.78) | 22.0 (0.55) | Аморфная фаза (86.1%), гидроокись Al(OH)3 (8.3%), кальцит CaCO3 (5.6%) | 71.8 (2.03) |
| Са0.49Al0.58Si2.3О5.53(ОН)0.35(СО3)0.26 | 7 | 63.8 (2.3) | 15.9 (0.58) | 19.6 (0.49) | Аморфная фаза (89.6%), гидроокись Al(OH)3 (5%), кальцит CaCO3 (5.4%) | 123.3 (1.99) |
| Са0.36Al0.63Si2.5О6.07(ОН)0.28(СО3)0.09 | 8 | 68.5 (2.5) | 17.1 (0.63) | 14.4 (0.36) | Аморфная фаза (94.4%), гидроокись Al(OH)3 (3.8%), кальцит CaCO3 (1.8%) | 134.3 (2.0) |
Сорбция ионов Cs+
Зависимости сорбционной емкости образцов алюмосиликатов кальция от исходной концентрации ионов Cs+ в растворе приведены на рис. 4.
Рис. 4.
Изотермы сорбции ионов Cs+ образцами алюмосиликатов кальция с соотношением SiO2 : Al2O3 = = 2 : 1 (1); 4 : 1 (2); 6 : 1 (3); 8 : 1 (4); 10 : 1 (5).

Для определения параметров изотерм экспериментальные данные по сорбции были обработаны в координатах линейного уравнения Ленгмюра:
(4)
$1{\text{/}}{{А}_{{\text{с}}}} = [{1 \mathord{\left/ {\vphantom {1 {({{А}_{{\text{m}}}}{{K}_{{\text{л}}}}{{С}_{{\text{р}}}})}}} \right. \kern-0em} {({{А}_{{\text{m}}}}{{K}_{{\text{л}}}}{{С}_{{\text{р}}}})}}] + 1{\text{/}}{{А}_{{\text{m}}}},\,\,\,\,\,(у = aх + b),~$Найденные графическим способом параметры уравнений Ленгмюра представлены в табл. 5. Видно, что модель Ленгмюра является подходящей для описания сорбции ионов Cs+ исследуемыми соединениями, о чем свидетельствуют соответствующие коэффициенты корреляции.
Таблица 5.
Параметры уравнений Ленгмюра при сорбции ионов Cs+ алюмосиликатами
| Соединение | Параметры уравнения Ленгмюра | ||
|---|---|---|---|
| Am, ммоль/г | k, л/ммоль | R2 | |
| CаAl2Si2O8 | 0.841 | 0.11 | 0.9842 |
| CаAl2Si4O12 | 0.844 | 0.21 | 0.9900 |
| CаAl2Si6O16 | 1.45 | 1.18 | 0.9924 |
| CаAl2Si8O20 | 1.37 | 0.55 | 0.9776 |
| CаAl2Si10O24 | 1.34 | 0.39 | 0.9772 |
Полученные данные показывают определенные различия в величинах максимальной сорбционной емкости между образцами в зависимости от соотношения SiO2 : Al2O3. Для алюмосиликатов 3–5 сорбционная емкость по ионам Cs+ выше, чем для образцов 1 и 2. Наибольшее значение сорбционной емкости Amax установлено для образца 3 и достигает значения 1.45 ммоль/г (192.7 мг/г) (рис. 4).
ЗАКЛЮЧЕНИЕ
Синтезирован и изучен ряд наноструктурированных алюмосиликатов кальция, полученных из алюмосиликатов Na-формы с соотношением SiO2 : Al2O3 = 2 : 1, 4 : 1, 6 : 1, 8 : 1, 10 : 1. Установлено, что алюмосиликаты кальция рентгеноаморфны, имеют величину удельной поверхности от 67 до 134 м2/г, которая увеличивается с ростом соотношения SiO2 : Al2O3. Определен фазовый, элементный состав, изучена морфология полученных соединений.
Процесс сорбции ионов Cs+ в рассматриваемых условиях описывается уравнением Ленгмюра. Максимальная сорбционная емкость наблюдается у синтезированного алюмосиликата кальция с отношением SiO2 : Al2O3 = 6 : 1 и составляет 1.45 ммоль/г (192.7 мг/г).
Показано, что сорбенты на основе алюмосиликатов кальция, полученные путем химического модифицирования алюмосиликатов Na-формы при их обработке в растворе хлорида кальция, могут быть рекомендованы в качестве эффективных сорбентов для очистки водных растворов в статических условиях от ионов Cs+.
Список литературы
Impact of Cesium on Plants and the Environment / Eds. Gupta D.K., Walther C. Switzerland: Springer Int. Publ., 2017. 319 p. https://doi.org/10.1007/978-3-319-41525-3
Strontium Contamination in the Environment // The Handbook of Environmental Chemistry / Eds. Pathak P., Gupta D.K. Switzerland: Springer Nature Switzerland AG, 2020. V. 88. 250 p. https://doi.org/10.1007/978-3-030-15314-4
Borai E.H., Harjula R., Malinen L. et al. // J. Hazard. Mater. 2009. V. 172. P. 416. https://doi.org/10.1016/j.jhazmat.2009.07.033
Singh B.K., Tomar Radha, Kumar Sumit et al. // J. Hazard. Mater. 2010. V. 178. P. 771. https://doi.org/10.1016/j.jhazmat.2010.02.007
Durrant C.B., Begg J.D., Kersting A.B. et al. // Sci. Total Environ. 2018. V. 610–611. P. 511. https://doi.org/10.1016/j.scitotenv.2017.08.122
Lee N.K., Khalid H.R., Lee H.K. // Microporous Mesoporous Mater. 2017. V. 242. P. 238. https://doi.org/10.1016/j.micromeso.2017.01.030
Милютин В.В., Некрасова Н.А., Каптаков В.О. // Радиоактивные отходы. 2020. № 4. С. 80. https://doi.org/10.25283/2587-9707-2020-4-80-89
Леонтьева Т.Г., Москальчук Л.Н., Баклай А.А. и др. // Сорбционные и хроматографические процессы. 2018. Т. 18. № 5. С. 726. https://doi.org/10.17308/sorpchrom.2018.18/599
Palchik N.A., Razvorotneva L.I., Moroz T.N. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 3. P. 308. [Пальчик Н.А., Разворотнева Л.И., Мороз Т.Н. и др. // Журн. неорган. химии. 2019. Т. 64. № 3. С. 251.]https://doi.org/10.1134/S003602361903015X
Gordienko P.S., Shabalin I.A., Yarusova S.B. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 12. P. 1579. [Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Журн. неорган. химии. 2019. Т. 64. № 12. С. 1326.]https://doi.org/10.1134/S0036023619120052
Gordienko P.S., Yarusova S.B., Shabalin I.A. et al. // Radiochemistry. 2014. V. 56. № 6. P. 607. [Гордиенко П.С., Ярусова С.Б., Шабалин И.А. и др. // Радиохимия. 2014. Т. 56. № 6. С. 518.]https://doi.org/10.1134/S1066362214060051
Gordienko P.S., Shabalin I.A., Yarusova S.B. et al. // Theor. Found. Chem. Eng. 2018. V. 52. № 4. P. 581. [Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Хим. технология. 2017. Т. 18. № 1. С. 2.]https://doi.org/10.1134/S0040579518040127
Gordienko P.S., Shabalin I.A., Yarusova S.B. et al. // Inorg. Mater. 2018. V. 54. № 11. P. 1151. [Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Неорган. материалы. 2018. Т. 54. № 11. С. 1217.]https://doi.org/10.1134/S0020168518110079
Yarusova S.B., Gordienko P.S., Panasenko A.E. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 2. P. 333. [Ярусова С.Б., Гордиенко П.С., Панасенко А.Е. и др. // Журн. физ. химии. 2019. Т. 93. № 2. С. 278.]https://doi.org/10.1134/S003602441902033X
Gordienko P.S., Shabalin I.A., Suponina A.P. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 8. P. 946. [Гордиенко П.С., Шабалин И.А., Супонина А.П. и др. // Журн. неорган. химии. 2016. Т. 61. № 8. С. 993.]https://doi.org/10.1134/S003602361608009X
Gordienko P.S., Shabalin I.A., Yarusova S.B. et al. // Russ. J. Phys. Chem. A. 2016. V. 90. № 10. P. 2022. [Гордиенко П.С., Шабалин И.А., Ярусова С.Б. и др. // Журн. физ. химии. 2016. Т. 90. № 10. С. 1534.]https://doi.org/10.1134/S0036024416100125
Shichalin O.O., Papynov E.K., Maiorov V.Yu. et al. // Radiochemistry. 2019. V. 61. № 2. P. 185. [Шичалин О.О., Папынов Е.К., Майоров В.Ю. и др. // Радиохимия. 2019. Т. 61. № 2. С. 135.]https://doi.org/10.1134/S1066362219020097
Yarusova S.B., Shichalin O.O., Belov A.A. et al. // Ceramics Int. 2022. V. 48. № 3. P. 3808. https://doi.org/10.1016/j.ceramint.2021.10.164
Papynov E.K., Shichalin O.O., Mayorov V.Yu. et al. // J. Hazard. Mater. 2019. V. 369. P. 25. https://doi.org/10.1016/j.jhazmat.2019.02.016
Papynov E.K., Belov A.A., Shichalin O.O. et al. // Nucl. Eng. Technol. 2021. V. 53. № 7. P. 2289. https://doi.org/10.1016/j.net.2021.01.024
Orlova A.I., Ojovan M.I. // Materials. 2019. V. 12. P. 2638. https://doi.org/10.3390/ma12162638
Fitzgerald J., Piedra G., Dec S. et al. // J. Am. Chem. Soc. 1997. V. 119. P. 7832. https://doi.org/10.1021/ja970788u
Ejeckam R.B., Sheriff B.L. // Can. Mineral. 2005. V. 43. P. 1131. https://doi.org/10.2113/gscanmin.43.4.1131
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии