Журнал неорганической химии, 2023, T. 68, № 2, стр. 221-228
Комплексы скандия(III) и железа(III) с 3-метил-2,4-пентандионом – предшественники для химических газофазных процессов: синтез, структура, термические свойства
А. М. Макаренко a, Н. В. Куратьева a, Д. П. Пищур a, К. В. Жерикова a, *
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: ksenia@niic.nsc.ru
Поступила в редакцию 16.08.2022
После доработки 15.09.2022
Принята к публикации 22.09.2022
- EDN: LPGSNT
- DOI: 10.31857/S0044457X22601444
Аннотация
Синтезированы комплексы Sc(Meacac)3 и Fe(Meacac)3 (Meacac = 3-метил-2,4-пентандионат-анион), методом рентгеноструктурного анализа впервые определены их кристаллические структуры. Изучена летучесть и термическая стабильность полученных соединений. Методом дифференциальной сканирующей калориметрии определена температура, энтальпия и энтропия плавления комплексов. Методом потока получена температурная зависимость давления насыщенного пара Sc(Meacac)3 в диапазоне 414–472 K, из которой рассчитаны термодинамические характеристики процесса сублимации при средней температуре (${{{{\Delta }}}_{{{\text{субл}}}}}H_{{443}}^{^\circ }$ = 132.8 ± 1.8 кДж/моль, ${{{{\Delta }}}_{{{\text{субл}}}}}S_{{443}}^{^\circ }$ = 226.1 ± ± 4.6 Дж/(K моль)) и при 298.15 K (${{{{\Delta }}}_{{{\text{субл}}}}}H_{{298.15}}^{^\circ }$ = 143.9 ± 2.6 кДж/моль, ${{{{\Delta }}}_{{{\text{субл}}}}}S_{{298.15}}^{^\circ }$ = 256.5 ± ± 6.4 Дж/(K моль)). Изученные вещества могут быть использованы в качестве предшественников в процессе химического газофазного осаждения, а набор полученных термодинамических данных – для подбора оптимальных условий осаждения.
ВВЕДЕНИЕ
Процесс химического газофазного осаждения активно применяется в науке и индустрии с целью получения высококачественных пленочных материалов разнообразного назначения. Процесс имеет множество видов, которые различаются типом химических реакций и условиями протекания. Однако принцип осаждения един и основан на доставке соединения, содержащего необходимые элементы (предшественника), в виде паров к покрываемому объекту (подложке), где происходит его превращение в целевой материал путем разложения, окисления или других химических реакций. Вариант, в котором в качестве предшественника выступают соединения металлов с органическими лигандами, получил название MOCVD (химическое осаждение из газовой фазы соединений металлов с органическими лигандами). В классической разновидности MOCVD необходимую концентрацию паров металлсодержащего предшественника, подаваемых в зону реакции, определяет режим испарителя в реакторе, параметры которого устанавливают исходя из совокупности термических свойств соединения – летучести и поведения в конденсированной фазе. Количественным выражением летучести комплексов, позволяющим осуществлять контроль прецизионно, является давление их насыщенных паров и термодинамические характеристики процессов парообразования, а при исследовании конденсированной фазы особое внимание уделяется прежде всего термической устойчивости и фазовым переходам.
Среди предшественников, используемых в процессах MOCVD, β-дикетонатные комплексы металлов прочно занимают лидирующие позиции не столько из-за относительной простоты их синтеза и стабильности на воздухе, сколько из-за структуры иона лиганда ([R1C(O)(R')C(O)CR2]–), в котором существует несколько позиций, позволяющих путем множественного варьирования заместителей (R1, R2, R') получать соединения с необходимыми термическими свойствами. Моноядерным соединениям с простейшим β-дикетоном – ацетилацетоном (Hacac, R1=R2=CH3, R'=H) и β‑дикетонами с различными концевыми заместителями R1 и R2 (CH3-, CF3-, C4H9-, C6H6-группы и др.), а также влиянию этого типа варьирования на летучесть и упаковку комплексов посвящено множество работ, например [1–6]. Работ по изучению эффекта введения алкильных групп в γ-положение лиганда (R') на структурные и термические свойства таких комплексов, а также на их термодинамические параметры очень мало [7–13]. Тем не менее наличие, например, метильной группы при γ-углероде приводит к значительному увеличению значения энтальпии сублимации [7, 13].
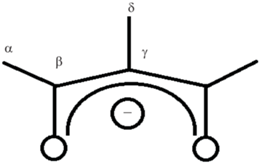
Настоящая работа посвящена синтезу, кристаллохимическому анализу и исследованию термических свойств комплексов скандия(III) и железа(III) с 3-метил-2,4-пентандионом (Н(Meacac), рис. 1), включая изучение термической устойчивости, измерение давления насыщенных паров и определение термодинамических характеристик процессов сублимации и плавления.
Выбор скандия и железа в качестве центральных атомов обусловлен необходимостью продолжения наших исследований, посвященных влиянию концевых заместителей β-дикетонатных лигандов в ряду трис-комплексов этих металлов [14–16]. С практической точки зрения полученные соединения расширят палитру предшественников MOCVD для получения Sc- и Fe-содержащих пленок, востребованных в различных областях. В частности, хорошо известно, что покрытия, содержащие оксид скандия, широко используются в сфере оптики [17] и являются перспективными материалами для микроэлектроники [18, 19], а железосодержащие материалы проявляют отличные ферромагнитные свойства [20] и могут применяться в качестве катализаторов [21].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали дистиллированную воду, этанол (ОАО “Кемеровская фармацевтическая фабрика”, 95%), изопропанол (х. ч.), гексагидрат хлорида скандия(III) (ООО “Далхим”, 99%), гексагидрат хлорида железа(III) (АО “ЛенРеактив”, 98%), 3-метил-2,4-пентандион (Alfa Aesar, 95%), гидроксид натрия (ООО “Торговая компания АНТ”, 98%) без дополнительной очистки.
Элементный анализ на содержание C и H проводили с использованием CHNS-анализатора Vario Micro Cube по стандартной методике, погрешности определения содержания элементов не превышали 0.5%. Спектры ЯМР регистрировали на спектрометре Bruker Avance 500 Plus (1H, 500 МГц), химические сдвиги (δ, ppm) были отнесены к сигналам растворителя (δH = 7.26 для CDCl3), стандартное отклонение составило 0.01 ppm.
Sc(Meacac)3 получали аналогично другим β-дикетонатам скандия(III) [14, 15]. Гексагидрат хлорида скандия(III) (ScCl3 · 6H2O) (1.36 г, 5.2 ммоль) растворяли в 50%-ном водно-этанольном растворе с последующим добавлением 2.4 мл 3-метил-2,4-пентандиона (HMeacac) (0.021 моль). Затем медленно (несколько дней) по каплям добавляли 1 М раствор гидроксида натрия (NaOH) до достижения pH 6. Белый осадок отфильтровывали и промывали холодным изопропанолом (i-PrOH). Комплекс очищали тройной сублимацией (483 K, 6.7 Па). Выход 1.40 г (70%). Tпл = 486–488 K. Спектр 1H ЯМР (CDCl3), δ, м.д.: 2.072 (18H, CαH3), 1.854 (9H, CδH3).
Fe(Meacac)3 получали аналогичным образом из гексагидрата хлорида железа(III) (FeCl3 · 6H2O) (1.35 г, 5.0 ммоль) и 2.3 мл HMeacac (0.020 моль). Очистку проводили тройной сублимацией при 463 K и 6.7 Па. Выход 0.80 г (40%). Tпл = 474–476 K. Спектр 1H ЯМР (CDCl3), δ, м.д.: 2.088 (18H, CαH3), 1.808 (9H, CδH3).
Монокристаллы, пригодные для рентгеноструктурного анализа (РСА), получены в процессе сублимации в вакуумной печи. РСА комплексов выполнен по стандартной методике на автоматическом четырехкружном дифрактометре Bruker-Nonius X8Apex, оснащенном двухкоординатным CCD-детектором, при комнатной температуре (293 K) для обоих соединений с использованием молибденового излучения (λ = 0.71073 Å) и графитового монохроматора. Интенсивности отражений измерены методом φ-сканирования узких (0.5°) фреймов. Поглощение учтено полуэмпирически по программе SADABS [22]. Структуры расшифрованы прямым методом и уточнены полноматричным МНК в анизотропном для неводородных атомов приближении по комплексу программ SHELXTL [23], детали экспериментов и уточнения приведены в табл. 1. Атомы водорода уточнены в приближении жесткого тела. Кристаллографические данные по Sc(Meacac)3 и Fe(Meacac)3 депонированы в Кембриджском банке структурных данных (CCDC 2201649 и 2201650 соответственно; https://www.ccdc.cam.ac.uk/structures/). Основные межатомные расстояния и валентные углы представлены в табл. 2.
Таблица 1.
Кристаллографические данные для Sc(Meacac)3 и Fe(Meacac)3 при 293(2) K
| Параметр | Sc(Meacac)3 | Fe(Meacac)3 |
|---|---|---|
| Брутто-формула | C18H27ScO6 | C18H27FeO6 |
| M, г/моль | 384.35 | 395.24 |
| Сингония, пр. гр. | Моноклинная, C2/c | Моноклинная, P21/n |
| a, Å b, Å c, Å |
15.7953(7) 9.6085(4) 13.2458(5) |
8.2860(2) 8.2010(2) 29.4940(6) |
| β, град | 101.865(1) | 97.528(1) |
| V, Å3 | 1967.35(14) | 1986.95(8) |
| Z | 4 | 4 |
| ρвыч, г/см3 | 1.298 | 1.321 |
| μ, мм−1 | 0.402 | 0.787 |
| F(000) | 816 | 836 |
| Размеры кристалла, мм | 0.42 × 0.30 × 0.28 | 0.40 × 0.40 × 0.18 |
| Диапазон сбора данных по θ, град | 2.496–26.383 | 2.662–26.471 |
| Диапазон hkl | –19 ≤ h ≤ 19, –12 ≤ k ≤ 12, –16 ≤ l ≤ 16 |
–10 ≤ h ≤ 10, –10 ≤ k ≤ 10, –35 ≤ l ≤ 36 |
| Число рефл. Измер./независ. | 8077/2012 | 14376/4084 |
| Rint | 0.0303 | 0.0280 |
| Полнота сбора данных по θ = 25.25°, % | 99.8 | 99.6 |
| Число рефлексов/огр./параметров | 2012/0/120 | 4084/0/235 |
| GOOF по F2 | 1.081 | 1.116 |
| Rhkl [I > 2σ(I)] | R1 = 0.0364, wR2 = 0.1117 | R1 = 0.0390, wR2 = 0.0939 |
| Rhkl (по всем данным) | R1 = 0.0413, wR2 = 0.1156 | R1 = 0.0432, wR2 = 0.0954 |
| Остаточная электронная плотность (max/min), e/A3 | 0.209/–0.170 | 0.209/–0.353 |
Таблица 2.
Основные межатомные расстояния (d, Å) и валентные углы (ω, град) в структурах Sc(Meacac)3 и Fe(Meacac)3 при 293(2) K
| Sc(Meacac)3 | Fe(Meacac)3 | ||
|---|---|---|---|
| Связь d, Å | Связь d, Å | ||
| Sc(1)–O(1) | 2.0664(12) × 2 | Fe(1)–O(11) | 1.9774(17) |
| Fe(1)–O(12) | 1.9796(15) | ||
| Sc(1)–O(2) | 2.0841(13) × 2 | Fe(1)–O(21) | 1.9966(15) |
| Fe(1)–O(22) | 1.9825(16) | ||
| Sc(1)–O(11) | 2.0746(11) × 2 | Fe(1)–O(31) | 1.9802(14) |
| Fe(1)–O(32) | 1.9879(16) | ||
| d(Sc–O)ср | 2.075(7) | d(Fe–O)ср | 1.984(7) |
| Угол ω, град | Угол ω, град | ||
| O(1)Sc(1)O(2) | 79.69(5) ×2 | O(11)Fe(1)O(12) | 85.28(7) |
| O(11)Sc(1)O(11)#1 | 78.81(6) | O(21)Fe(1)O(22) | 85.34(7) |
| #1 –x, y, –z + 1/2 | O(31)Fe(1)O(32) | 84.52(6) | |
| θ(OScO)ср | 79.4(4) | θ(OFeO)ср | 85.1(4) |
Рентгенофазовый анализ (РФА) выполнен на дифрактометре Shimadzu XRD-7000 (CuKα-излучение, Ni-фильтр, диапазон 2θ = 3°–40°, шаг 0.03°, накопление 1 с, комнатная температура). Однофазность полученных соединений установлена в результате индицирования порошковых рентгенограмм по аналогии с расчетными дифрактограммами комплексов, изученных методом рентгеноструктурного анализа.
Комплексный термический анализ, включавший одновременно термогравиметрический (ТГ) и дифференциальный термический анализ (ДТА), проводили на приборе TG 209 F1 фирмы Netzsch. Эксперименты выполняли в атмосфере гелия (30 мл/мин) в тиглях из Al2O3, скорость нагрева составляла 10 град./мин в диапазоне температур 303–620 K.
Термодинамику фазовых превращений в конденсированной фазе исследовали на дифференциальном сканирующем калориметре (ДСК) Netzsch DSC 204 F1 Phoenix. Измерения образцов проводили методом теплового потока при постоянной скорости нагрева 9 K мин–1, масса образцов 3–7 мг, тигли Al2O3 закрытого типа. Сигнал базовой линии, полученной при нагреве двух пустых тиглей, вычитали из экспериментальных результатов. Обработку экспериментальных данных и определение температуры Tonset и энтальпии ΔH переходов осуществляли в программном пакете Netzsch Proteus Analysis. Температуру плавления определяли как точку пересечения касательной к началу тепловой аномалии и соответствующей базовой линии. Калибровку датчика теплового потока и градуировку температурной шкалы осуществляли плавлением стандартных веществ (циклогексан, адамантан, Hg, бензойная кислота, KNO3, In, Sn, Zn). Стандартная неопределенность в измерениях теплового эффекта, предсказанная на основе калибровочных экспериментов (индий, олово, цинк), составила <1% (свидетельство о поверке № С-С/02-02-2022/129404261).
Давление насыщенных паров над твердым Sc(Meacac)3 измеряли методом потока в атмосфере инертного газа-носителя (аргона). Подробное описание экспериментальной установки и методики эксперимента можно найти в [24]. Давление паров pi было рассчитано с использованием уравнения:
где mi и Mi – масса и молярная масса исследуемого вещества соответственно, R – универсальная газовая постоянная, V – объем протекающего газа при температуре окружающей среды Ta и атмосферном давлении Pa, в котором содержится nAr и ni молей газа-носителя и исследуемого соединения соответственно. Погрешность в измерении давления пара составила <4%.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Описание структур комплексов. Впервые выполнено монокристальное рентгеноструктурное исследование Fe(Meacac)3 и Sc(Meacac)3. Оба вещества имеют структуру с изолированными молекулярными комплексными частицами (рис. 2 и 3). Первая координационная сфера катиона металла состоит из шести атомов кислорода трех бидентатных β-дикетонатных лигандов. Параметры координационного окружения металлов в комплексах приведены в табл. 2. Нумерация атомов углерода представлена на рис. 1. При температуре 293(2) K средние длины связей C–O, Cα–Cβ, Cβ–Cγ и Cγ–Cδ фрагмента Meacac в Sc(Meacac)3 и Fe(Meacac)3 близки и составили 1.272(1) и 1.270(4), 1.510(4) и 1.505(7), 1.400(7) и 1.391(7), 1.526(9) и 1.527(2) Å соответственно. Однако замена центрального атома скандия на железо приводит к укорочению координационных связей M–O с 2.075(7) до 1.984(7) Å и увеличению валентных углов c 79.4(4)° до 85.1(4)°. Металлоциклы обоих комплексов неплоские, углы перегиба вдоль линии O…O составляют 0.8°, 9.1°, 9.1° для Sc(Meacac)3 и 5.2°, 1.9°, 16.3° для Fe(Meacac)3. Оказалось, что длины связей в обоих комплексах близки к соответствующим длинам связей в ацетилацетонатах скандия(III) и железа(III): 1.25(1) и 1.262(4) (C–O), 1.51(1) и 1.504(5) (Cα–Cβ), 1.381(8) и 1.382(5) (Cβ–Cγ) [25, 26]. Таким образом, введение метильной группы в γ-положение практически не влияет на длины связей комплексов. При этом валентные углы у обоих веществ несколько меньше, чем у ацетилацетонатов скандия(III) и железа(III) (81.0(2)° и 87.43(9)°). Упаковки для обоих соединений молекулярные. В упаковке можно выделить искаженные гексагональные слои в семействах плоскостей (–1 1 1) для Sc(Meacac)3 и (1 0 1) для Fe(Meacac)3, устройство слоев показано на рис. 2б и 3б. Кратчайшие расстояния металл–металл внутри слоя равны 7.708 Å для Sc(Meacac)3 и 8.201 Å для Fe(Meacac)3.
В спектрах 1H ЯМР обоих комплексов наблюдаются два характерных сигнала, относящихся к группам CαH3 и CδH3, с соотношением площадей пиков 2 : 1, для Fe(Meacac)3 наблюдается уширение пиков вследствие его парамагнетизма. Одинаковое положение пиков свидетельствует о том, что центральный атом практически не влияет на строение молекул.
Термическое исследование. Согласно данным РФА, образцы соединений являются однофазными, это позволило изучить их термические свойства – стабильность и летучесть.
Термическое поведение комплексов в конденсированной фазе исследовали методами ТГ/ДТА и ДСК. По данным ТГ (рис. 4), оба соединения обладают сравнимой летучестью: в условиях термогравиметрического эксперимента парообразование комплексов начинается при 440 K и завершается при 490–500 K, переход в газовую фазу описывается одноступенчатым видом кривой. При этом Sc(Meacac)3 демонстрирует хорошую термическую стабильность, практически количественно переходя в газовую фазу (масса нелетучего остатка составляет <2%), тогда как Fe(Meacac)3 разлагается в процессе испарения (потеря массы составляет <83%). На кривых ДТА эндотермические пики, температуры начала которых составляют 485 и 470 K, связаны с процессами плавления Sc(Meacac)3 и Fe(Meacac)3 соответственно, что согласуется с данными визуального наблюдения на столике Кофлера (см. экспериментальную часть) и результатами дифференциальной сканирующей калориметрии (см. ниже).
Согласно калориметрическим исследованиям, соединения не претерпевают эндотермических фазовых переходов в диапазоне температур от комнатной до плавления. Однако, в отличие от ацетилацетонатов обсуждаемых металлов, плавление которых является обратимым фазовым переходом [14–16, 27, 28], плавление исследуемых комплексов с метильной группой в γ-положении лиганда приводит к их разложению, постепенному в случае Sc(Meacac)3 и значительному в случае Fe(Meacac)3. В случае железного комплекса кривая ДСК указывает на начало его разложения до плавления, что согласуется с вышеописанными результатами ТГ-эксперимента. Такая термическая нестабильность затрудняет определение термодинамических характеристик процесса плавления, в связи с чем при работе с Fe(Meacac)3 были использованы тигли неплотного прилегания, и полученные термодинамические характеристики могут считаться лишь оценочными. Проведено несколько экспериментов с разными навесками комплексов, обработку проводили по данным только первого нагрева. В результате получены следующие значения температуры (Tпл) и термодинамических характеристик энтальпии $\left( {{{\Delta }_{{{\text{пл}}}}}H_{{{{T}_{{{\text{пл}}}}}}}^{^\circ }} \right)$ и энтропии $\left( {{{\Delta }_{{{\text{пл}}}}}S_{{{{T}_{{{\text{пл}}}}}}}^{^\circ }} \right)$ плавления с погрешностями для 95%-ного доверительного интервала: Tпл = = 484.0 ± 0.8 K, ${{\Delta }_{{{\text{пл}}}}}H_{{{{T}_{{{\text{пл}}}}}}}^{^\circ }$ = 43.7 ± 1.4 кДж/моль, ${{\Delta }_{{{\text{пл}}}}}S_{{{{T}_{{{\text{пл}}}}}}}^{^\circ }$ = 90.3 ± 2.9 Дж/(K моль) для Sc(Meacac)3; Tпл = 470.4 ± 1.0 K, ${{\Delta }_{{{\text{пл}}}}}H_{{{{T}_{{{\text{пл}}}}}}}^{^\circ }$ = 34.8 ± 3.8 кДж/моль, ${{\Delta }_{{{\text{пл}}}}}S_{{{{T}_{{{\text{пл}}}}}}}^{^\circ }$ = 74.0 ± 7.4 Дж/(K моль) для Fe(Meacac)3.
Давление насыщенных паров Sc(Meacac)3 измерено методом потока в интервале температур 414–472 K, всего получено 15 точек (рис. 5). Экспериментальные данные обработаны с помощью уравнения [29, 30]:
(2)
${\text{R}}\ln ({p \mathord{\left/ {\vphantom {p {{{p}_{o}}}}} \right. \kern-0em} {{{p}_{o}}}}) = {{a + b} \mathord{\left/ {\vphantom {{a + b} T}} \right. \kern-0em} T} + {{\Delta }_{{{\text{субл}}}}}C_{{\text{p}}}^{^\circ }\ln ({T \mathord{\left/ {\vphantom {T {{{T}_{o}}}}} \right. \kern-0em} {{{T}_{o}}}}),$(3)
${{{{\Delta }}}_{{{\text{субл}}}}}H_{T}^{^\circ } = - b + {{{{\Delta }}}_{{{\text{субл}}}}}C_{{\text{p}}}^{^\circ }T,$(4)
${{{{\Delta }}}_{{{\text{субл}}}}}S_{T}^{^\circ } = {{{{{{\Delta }}}_{{{\text{субл}}}}}H_{T}^{^\circ }} \mathord{\left/ {\vphantom {{{{{{\Delta }}}_{{{\text{субл}}}}}H_{T}^{^\circ }} T}} \right. \kern-0em} T} + R\ln \left( {\frac{{{{p}_{i}}}}{{{{{10}}^{5}}{{p}_{0}}}}} \right).$В отсутствие данных по ${{{{\Delta }}}_{{{\text{субл}}}}}C_{p}^{^\circ }$ уравнение (2) сворачивается в классическое двухпараметрическое линейное уравнение Клаузиуса–Клапейрона, и значения энтропии и энтальпии сублимации относятся к средней температуре экспериментального интервала: ${{{{\Delta }}}_{{{\text{субл}}}}}H_{{443}}^{^\circ }$ = 132.8 ± 1.8 кДж/моль, ${{{{\Delta }}}_{{{\text{субл}}}}}S_{{443}}^{^\circ }$ = 226.1 ± 4.6 Дж/(K моль) (погрешности приведены для 95%-ного доверительного интервала). По предложенной нами методике, детально описанной в [16, 31, 32], проведена оценка значения ${{{{\Delta }}}_{{{\text{субл}}}}}C_{p}^{^\circ }$ = 76.9 Дж/(K моль) с использованием необходимых данных из [33]. С помощью полученного значения рассчитаны термодинамические характеристики сублимации при эталонной температуре 298.15 K: ${{{{\Delta }}}_{{{\text{субл}}}}}H_{{298.15}}^{^\circ }$ = 143.9 ± ± 2.6 кДж/моль, ${{{{\Delta }}}_{{{\text{субл}}}}}S_{{298.15}}^{^\circ }$ = 256.5 ± 6.4 Дж/(K моль) (комбинированные погрешности для 95%-ного доверительного интервала рассчитаны в соответствии с методикой, описанной в [34]).
ЗАКЛЮЧЕНИЕ
Синтезированы и охарактеризованы два комплекса скандия(III) и железа(III) с 3-метил-2,4-пентандионом. Впервые определены кристаллические структуры соединений и исследованы их термические свойства. Сравнение с ацетилацетонатами соответствующих металлов позволило проследить влияние введения метильной группы при Cγ на кристаллохимические параметры и термические свойства соединений. Показано, что присутствие метильной группы в γ-положении лиганда практически не оказывает влияния на структурные параметры молекул, лишь несколько уменьшая валентные углы, но приводит к понижению термической стабильности и летучести соединений. Изученные соединения расширяют палитру предшественников для различных вариантов химических газофазных процессов, а набор термодинамических данных, полученных по процессам плавления и сублимации, может быть использован для контроля количества вещества и оптимизации условий осаждения в процессах MOCVD.
Список литературы
Игуменов И.К., Чуманенко Ю.В., Земсков С.В. Проблемы химии и применения β-дикетонатов металлов / Под ред. Спицына В.И. М.: Наука, 1982. С. 100.
Громилов С.А. Байдина И.А. // Журн. структур. химии. 2004. Т. 45. № 6. С. 1076.
Moshier R.W., Sievers R.E. Gas Chromotography of Metal Chelates: International series of monographs in analytical chemistry. Pergamon Press: Oxford, 1967.
Жаркова Г.И., Стабников П.А., Сысоев С.А. и др. // Журн. структур. химии. 2005. Т. 46. № 2. С. 328.
Варнек В.А., Игуменов И.К., Стабников П.А. и др. // Журн. структур. химии. 2001. Т. 42. № 5. С. 1024.
Igumenov I.K., Basova T.V., Belosludov V.R. Application of Thermodynamics to Biological and Materials Science / Ed. Tadashi M. London: InTech, 2011. P. 521.
Stabnikov P.A., Alferova N.I., Korolkov I.V. et al. // J. Struct. Chem. 2020. V. 61. № 10. P. 1615. https://doi.org/10.1134/S0022476620100145
Robertson I., Truter M.R. // Inorg. Phys. Theor. 1967. P. 309.
Шапкин Н.П., Алехина О.Г., Реутов В.А. и др. // Журн. общ. химии. 1992. Т. 62. № 3. С. 505.
Abrahams B.F., Hoskins B.F., McFadyen D.W. et al. // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 1998. V. 54. № 12. P. 1807. https://doi.org/10.1107/S0108270198008592
Döhring A., Goddard R., Jolly P.W. et al. // Inorg. Chem. 1997. V. 36. № 2. P. 177. https://doi.org/10.1021/ic960441c
Berg M.A.G., Ritchie M.K., Merola J.S. // Polyhedron. 2012. V. 38. № 1. P. 126. https://doi.org/10.1016/j.poly.2012.02.024
Ribeiro da Silva M.A.V., Ferrao M.L.C.C.H., Silva R.M.G.E. da // J. Chem. Thermodyn. 1992. V. 24. P. 1293.
Zherikova K.V., Zelenina L.N., Chusova T.P. et al. // Phys. Procedia. 2013. V. 46. P. 200. https://doi.org/10.1016/j.phpro.2013.07.068
Zelenina L.N., Zherikova K.V., Chusova T.P. et al. // Thermochim. Acta. 2020. V. 689. P. 178639. https://doi.org/10.1016/j.tca.2020.178639
Zherikova K.V., Verevkin S.P. // RSC Adv. 2020. V. 10. № 63. P. 38158. https://doi.org/10.1039/d0ra06880b
Kong P., Pu Y., Ma P. et al. // Thin Solid Films. 2020. V. 714. P. 1. https://doi.org/10.1016/j.tsf.2020.138357
De Rouffignac P., Yousef A.P., Kim K.H. et al. // Electrochem. Solid-State Lett. 2006. V. 9. № 6. P. 45. https://doi.org/10.1149/1.2191131
Smirnova T.P., Yakovkina L.V., Borisov V.O. et al. // J. Struct. Chem. 2017. V. 58. № 8. P. 1573. https://doi.org/10.1134/S0022476617080145
Stognii A.I., Serokurova A.I., Smirnova M.N. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 12. P. 1822. https://doi.org/10.1134/S0036023621120196
Bumagin N.A. // Russ. J. Gen. Chem. 2022. V. 92. № 5. P. 832. https://doi.org/10.1134/S1070363222050127
Bruker AXS Inc. (2004). APEX2 (Version 1.08), SAINT (Version 7.03), and SADABS (Version 2.11). Bruker Advanced X-ray Solutions, Madison, Wisconsin, USA.
Sheldrick G.M. // Acta Crystallogr. 2015. V. C71. P. 3.
Zherikova K.V., Makarenko A.M., Karakovskaya K.I. et al. // Russ. J. Gen. Chem. V. 91. № 10. P. 1990. https://doi.org/10.1134/S1070363221100108
Anderson T.J., Neuman M.A., Melson G.A. // Inorg. Chem. 1973. V. 12. № 4. P. 927. https://doi.org/10.1021/ic50122a046
Diaz-Acosta I., Baker J., Cordes W. et al. // J. Phys. Chem. A. 2001. V. 105. № 1. P. 238. https://doi.org/10.1021/jp0028599
Beech G., Lintonbon R.M. // Thermochim. Acta. 1971. V. 3. P. 97.
Sabolović J., Mrak Ž., Koštrun S. et al. // Inorg. Chem. 2004. V. 43. № 26. P. 8479. https://doi.org/10.1021/ic048900u
Kulikov D., Verevkin S.P., Heintz A. // J. Chem. Eng. Data. 2001. V. 46. № 6. P. 1593. https://doi.org/10.1021/je010187p
Kulikov D., Verevkin S.P., Heintz A. // Fluid Phase Equilib. 2001. V. 192. № 1–2. P. 187. https://doi.org/10.1016/S0378-3812(01)00633-1
Zherikova K.V., Verevkin S.P. // Fluid Phase Equilib. 2018. V. 472. P. 196. https://doi.org/10.1016/j.fluid.2018.05.004
Verevkin S.P., Emel’yanenko V.N., Zherikova K.V. et al. // Chem. Phys. Lett. 2020. V. 739. P. 136911. https://doi.org/10.1016/j.cplett.2019.136911
Melia T.P., Merrifield R. // J. Inorg. Nucl. Chem. 1970. V. 32. P. 2573.
Verevkin S.P., Sazonova A.Y., Emel’yanenko V.N. et al. // J. Chem. Eng. Data. 2015. V. 60. P. 89. https://doi.org/doi.org/10.1021/je500784s
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии