Журнал неорганической химии, 2023, T. 68, № 2, стр. 209-220
Термодинамические свойства керамики на основе оксидов гафния и редкоземельных элементов при высоких температурах
В. А. Ворожцов a, b, В. Л. Столярова a, *, С. А. Кириллова b, c, С. И. Лопатин a, b
a Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
b Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Адмирала Макарова, 2, Россия
c Санкт-Петербургский государственный электротехнический университет “ЛЭТИ” им. В.И. Ульянова (Ленина)
197022 Санкт-Петербург, ул. Профессора Попова, 5, лит. Ф, Россия
* E-mail: v.stolyarova@spbu.ru
Поступила в редакцию 01.07.2022
После доработки 29.08.2022
Принята к публикации 31.08.2022
- EDN: LOJKSH
- DOI: 10.31857/S0044457X22601055
Аннотация
Рассмотрены полученные ранее экспериментальные данные о процессах испарения и термодинамические свойства керамики на основе оксидов гафния и редкоземельных элементов при высоких температурах. Масс-спектрометрическим эффузионным методом Кнудсена впервые изучена система La2O3–Sm2O3 при температуре 2323 K. В результате идентифицирован состав пара над исследованными образцами керамики, определены концентрационные зависимости парциальных давлений молекулярных форм пара над рассматриваемой системой и термодинамических свойств в конденсированной фазе, таких как активности компонентов и избыточная энергия Гиббса. С привлечением полинома Вильсона определена энтальпия образования из оксидов и избыточная энтропия системы La2O3–Sm2O3 при указанной температуре. На основе полученных данных рассчитаны термодинамические свойства в четырехкомпонентных системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 по данным о равновесиях в соответствующих бинарных системах полуэмпирическими методами Колера, Редлиха–Кистера и Вильсона при температуре 2330 K. Результаты выполненного расчета сопоставлены с соответствующими величинами, оцененными ранее полуэмпирическими методами на примере систем La2O3–Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2. Показано, что в системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 наилучшее соответствие с экспериментальными значениями активностей оксидов лантаноидов может быть получено при расчете на основе метода Вильсона.
ВВЕДЕНИЕ
Системы на основе оксидов циркония, гафния и редкоземельных элементов (РЗЭ) являются составной частью многокомпонентной керамики, представляющей значительный интерес для создания современных материалов высшей огнеупорности, благодаря высоким температурам плавления, низкой летучести, устойчивости к высокотемпературному окислению и высокотемпературной фазовой стабильности [1–5]. В частности, введение оксидов лантана и самария для стабилизации фазового состава керамики на основе ZrO2 и HfO2 перспективно для разработки материалов нового поколения, предназначенных для литья лопаток газотурбинных двигателей на основе никелевых сплавов и ниобиевых композитов [6, 7], а также для получения современных термобарьерных покрытий с повышенной термической стабильностью [8–10]. Однако повышение эксплуатационных температур выше 2000 K может приводить к избирательному испарению оксидов лантаноидов из указанных высокотемпературных материалов на основе оксидов гафния, циркония и РЗЭ, что, как правило, сопровождается изменением комплекса физико-химических свойств и потерей эксплуатационных характеристик керамики высшей огнеупорности.
При высокотемпературном изучении процессов испарения и термодинамических свойств многокомпонентных систем, содержащих оксиды гафния, циркония и РЗЭ, показано [11], что наиболее легколетучими компонентами являются оксиды лантаноидов, в частности оксиды лантана и самария. Этим продиктована необходимость изучения процессов испарения и термодинамических свойств системы La2O3–Sm2O3 с целью получения достоверной информации для дальнейшего исследования и разработки огнеупорных материалов на основе ZrO2 и HfO2, содержащих указанные оксиды лантаноидов. Полученные данные могут быть востребованы при синтезе керамических покрытий на основе рассматриваемых систем, например методами осаждения из газовой фазы, при выборе составов и условий применения получаемых материалов, а также для прогнозирования физико-химических свойств многокомпонентной оксидной керамики в рамках различных модельных подходов, включая моделирование фазовых равновесий в рамках подхода CALPHAD [12].
Фазовые равновесия в системе La2O3–Sm2O3 были неоднократно изучены экспериментально [13–15], а также рассчитаны в рамках подхода CALPHAD [16] с использованием только данных о фазовых равновесиях и в предположении о том, что термодинамические свойства всех твердых фаз подчиняются модели регулярных растворов, а расплав представляет идеальный раствор. В системе La2O3–Sm2O3 наблюдались твердые растворы на основе полиморфных модификаций индивидуальных оксидов. Полиморфные модификации, известные как у La2O3, так и у Sm2O3, такие как низкотемпературная гексагональная модификация А-La2O3 и А-Sm2O3, высокотемпературная гексагональная модификация Н-La2O3 и Н-Sm2O3, а также высокотемпературная кубическая модификация X-La2O3 и X-Sm2O3, формируют на фазовой диаграмме непрерывные твердые растворы от одного до второго компонента рассматриваемой системы [13–15]. Твердый раствор на основе моноклинной фазы B-Sm2O3, неизвестной для La2O3, имеет ограниченную область гомогенности и отделен от твердого раствора на основе A-модификаций оксидов лантаноидов двухфазной областью A + B. Показано [13–15], что максимальная температура существования моноклинного раствора в рассматриваемой системе соответствует температуре полиморфного превращения между моноклинной и гексагональной модификациями индивидуального Sm2O3, равной 2173 ± 30 K [16]. При оптимизации фазовых равновесий в системе La2O3–Sm2O3 наблюдались положительные отклонения от идеального поведения во всех твердых растворах, существующих в данной системе [16].
Известно [17], что индивидуальные оксиды лантана и самария испаряются с диссоциацией до монооксида лантаноида и кислорода. В паре над Sm2O3 также идентифицирован атомарный самарий:
(1)
$\left[ {{\text{L}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{3}}} \right] = 2\left( {{\text{LnO}}} \right) + \left( {\text{O}} \right),$(2)
$\left[ {{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{3}}} \right] = 2\left( {{\text{Sm}}} \right) + 3\left( {\text{O}} \right),~$Температурная зависимость парциального давления молекулярной формы LaO в паре над La2O3 неоднократно изучалась ранее [18–23]. Процессы испарения индивидуального Sm2O3, включая температурные зависимости парциального давления пара SmO и Sm, определены масс-спектрометрическим эффузионным методом Кнудсена в работе [24].
Таким образом, в настоящей работе проиллюстрированы потенциальные возможности полуэмпирических методов Колера, Редлиха–Кистера и Вильсона для расчета термодинамических свойств четырехкомпонентных систем на основе оксидов гафния и РЗЭ по данным о равновесиях в бинарных системах. Имеющаяся экспериментальная информация об изученных ранее бинарных системах на основе оксидов РЗЭ дополнена впервые полученными сведениями о высокотемпературном поведении системы La2O3–Sm2O3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы в системе La2O3–Sm2O3 получены методом твердофазного синтеза на основе индивидуальных оксидов лантана и самария (ООО “Неваторг”, Санкт-Петербург, Россия). Количество реагентов, взятых для синтеза, выбирали таким образом, чтобы получить образцы следующего химического состава (в мол. д.): 0.70La2O3–0.30Sm2O3 (образец 1) и 0.30La2O3–0.70Sm2O3 (образец 2).
Синтез образцов проводили по традиционной методике. Оксиды лантана и самария в выбранных соотношениях перетирали в присутствии этилового спирта в агатовой ступке. Продолжительность перетирания составила 1 ч на 1 г смеси порошков. Для получения таблеток образцов перед термической обработкой порошки прессовали под давлением 5 МПа. Термическую обработку образцов проводили в закрытых платиновых тиглях на воздухе в муфельной печи. Термическую обработку продолжали 24 ч при температуре 1573 K. Для дополнительной гомогенизации химического и фазового состава образцы подвергали повторному перетиранию с последующей термической обработкой. После промежуточного перетирания и прессования образцов в таблетки проводили отжиг в муфельной печи при температуре 1793 K в течение 10 ч. Охлаждение образцов осуществляли в режиме закалки на воздухе при комнатной температуре.
Элементный анализ синтезированных образцов в системе La2O3–Sm2O3 выполняли с использованием программно-аналитического комплекса на основе портативного рентгенофлуоресцентного кристалл-дифракционного сканирующего спектрометра Спектроскан МАКС-GF2E (НПО “Спектрон”, Санкт-Петербург, Россия). Определенное содержание компонентов в изученных образцах, пересчитанное на формулы устойчивых оксидов лантаноидов, составило для образцов 1 и 2 0.66La2O3–0.34Sm2O3 и 0.27La2O3–0.73Sm2O3 (мол. д.) соответственно. Меньшее, чем предполагалось по синтезу, содержание La2O3 в исследованных образцах может быть связано с повышенной гигроскопичностью этого оксида и, как следствие, присутствием в нем абсорбированной воды, учет которой при расчете масс навесок для синтеза не проводился.
Фазовый состав полученных образцов идентифицирован методом рентгенофазового анализа на рентгеновском дифрактометре Rigaku Corporation SmartLab 3 (Rigaku Corporation, Токио, Япония) с CuKα-излучением. Идентификация пиков на порошкограммах выполнена на основе программного комплекса PDWin 4.0 и пакета Crystallographica Search-Match (порошковая база данных ICDD PDF-2). Качественный и полуколичественный анализ фазового состава исследуемых образцов также проводился с использованием программы Rigaku SmartLab Studio II и базы данных Crystallography Open Database (COD). Полученные дифрактограммы изучаемых образцов системы La2O3–Sm2O3 приведены на рис. 1.
Рис. 1.
Дифрактограммы изученных образцов в системе La2O3–Sm2O3, полученные в настоящей работе методом рентгенофазового анализа: 1 – экспериментальный спектр образца 1 0.66La2O3–0.34Sm2O3 (мол. д.), 2 – штрих-диаграмма эталона La2O3 (номер эталонa в картотеке JCPDS #83-1345), 3 – штрих-диаграмма эталона La(OH)3 (JCPDS #75-1900), 4 – экспериментальный спектр образца 2 0.27La2O3–0.73Sm2O3 (мол. д.), 5 – штрих-диаграмма эталона (Sm2O3)0.77(La2O3)0.23 (JCPDS #77-2316), 6 – штрих-диаграмма эталона Sm2O3 (JCPDS #42-1464).

На рентгеновской дифрактограмме образца 1 присутствуют рефлексы, соответствующие твердому раствору на основе гексагональной модификации A-La2O3. Для сопоставления на рис. 1 приведена штрих-диаграмма эталона A-La2O3 (номер эталонa в картотеке JCPDS – #83-1345). Кроме того, по форме дифрактограммы образца 1 можно предположить частичную гидратацию образца из-за контакта с влагой атмосферы с образованием фазы La(OH)3.
На рентгеновской дифрактограмме образца 2 идентифицированы рефлексы, соответствующие фазе (Sm2O3)x(La2O3)1 –x (твердый раствор на основе моноклинной модификации B-Sm2O3). На рисунке приведена штрих-диаграмма эталона (Sm2O3)0.77(La2O3)0.23 (JCPDS #77-2316) как наиболее близкая по мольному соотношению содержания ионов металлов Sm3+ : La3+. Несмотря на некоторое несоответствие соотношений интенсивностей пиков, топология дифрактограммы отвечает указанной фазе. Несоответствие соотношений интенсивностей рефлексов на порошкограмме образца и штрих-диаграмме эталона (Sm2O3)0.77(La2O3)0.23 может быть связано с тем, что состав образца 2, как показано выше, отличается по соотношению содержания ионов Sm3+ : La3+ от указанного в карточке эталона. Кроме того, возможна частичная гидратация изученного образца.
Таким образом, результаты рентгенофазового анализа свидетельствуют о том, что фазовый состав полученных образцов 1 и 2 не противоречит известным данным о фазовых равновесиях в системе La2O3–Sm2O3. Это позволило использовать указанные образцы для изучения термодинамических свойств рассматриваемой системы масс-спектрометрическим эффузионным методом Кнудсена [25, 26].
Основные сведения о применении масс-спектрометрического эффузионного метода Кнудсена и особенности использованного оборудования для изучения процессов испарения и термодинамических свойств труднолетучих оксидных систем неоднократно приводились ранее [25–28]. По этой причине ниже будут описаны только наиболее важные особенности методики исследования, выполненного в настоящей работе.
Парциальное давление молекулярных форм пара над изученными образцами было определено методом сравнения ионных токов [25, 29] с использованием индивидуального La2O3 в качестве внешнего стандарта:
(3)
${{p}_{i}} = {{p}_{s}}\frac{{{{I}_{{{{i}^{ + }}}}}{{T}_{i}}{{\sigma }_{s}}{{\gamma }_{{{{s}^{ + }}}}}{{f}_{{{{s}^{ + }}}}}}}{{{{I}_{{{{s}^{ + }}}}}{{T}_{s}}{{\sigma }_{i}}{{\gamma }_{{{{i}^{ + }}}}}{{f}_{{{{i}^{ + }}}}}}},$Сечения ионизации σi, необходимые для получения парциального давления молекулярных форм пара над образцами системы La2O3–Sm2O3 по уравнению (3), определяли согласно рекомендациям из работы [26]. Коэффициенты вторичного электронного умножителя ${{\gamma }_{{{{i}^{ + }}}}}$ приняты пропорциональными обратному квадратному корню из молекулярной массы иона i+.
Парциальное давление молекулярной формы пара LaO над La2O3 (ps) может быть найдено из литературных данных [18–23]. При температуре 2323 K соответствующая величина составляет 0.56 [18], 0.61 [19], 1.11 [20], 1.40 [21], 1.61 [22], 2.21 [23] и 2.24 Па [20]. Из-за существенного разброса приведенных литературных значений ps, LaO целесообразно определить парциальное давление пара LaO над La2O3 в настоящей работе по уравнению (3) с использованием золота [30] в качестве внутреннего стандарта. Полученное значение ps, LaO над La2O3 составило (1.11 ± 0.09) Па при температуре 2323 K. Указанная величина использована в настоящей работе для определения парциального давления пара над системой La2O3–Sm2O3 по уравнению (3) с использованием La2O3 в качестве внешнего стандарта.
Активности La2O3 в изученной системе определены методом дифференциальной масс-спектрометрии [25, 29]:
(4)
${{a}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} = \frac{{p_{{{\text{LaO}}}}^{2}{{p}_{{\text{O}}}}}}{{p_{{{\text{LaO}}}}^{{^\circ 2}}p_{{\text{O}}}^{^\circ }}},$Преимущественное избирательное испарение La2O3 из образцов системы La2O3–Sm2O3 позволило оценить тенденцию изменения состава конденсированной фазы при изотермической выдержке образцов при температуре 2323 K методом полного изотермического испарения [32, 33]. Для оцененных составов конденсированной фазы системы La2O3–Sm2O3 было определено парциальное давление молекулярных форм пара и активности La2O3 при указанной температуре по уравнениям (3) и (4) соответственно.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение термодинамических свойств системы La2O3–Sm2O3
В масс-спектрах пара над образцом 1 системы La2O3–Sm2O3 начиная с температуры 2030 K идентифицированы ионы LaO+ и La+ с соотношением интенсивностей ионных токов 12 ± 2 при энергии ионизирующих электронов 25 эВ. При увеличении температуры до 2323 K в масс-спектре пара над указанным образцом зарегистрированы ионы LaO+ и La+ с соотношением интенсивностей ионных токов 10 ± 1, а также ионы SmO+ и Sm+ с соотношением интенсивностей ионных токов 1.1 ± 0.1. Указанное соотношение интенсивностей ионных токов LaO+ и La+ в масс-спектре пара над образцом 1 не противоречит соответствующему соотношению в масс-спектре пара над индивидуальным La2O3, которое при температуре 2323 K составило 10.3 ± 0.9. Как и ранее [23, 24], показано, что ионы LaO+, SmO+ и Sm+ соответствуют прямой ионизации молекулярных форм пара LaO, SmO и Sm над образцами системы La2O3–Sm2O3. Ионы La+ в масс-спектрах пара над изученными образцами керамики признаны осколочными, т.е. образовавшимися в результате диссоциации LaO при ионизации электронами. Следовательно, состав газовой фазы над исследованными образцами соответствует молекулярным формам в паре над индивидуальными La2O3 и Sm2O3 [17].
Интенсивности ионных токов в масс-спектрах пара над образцами 1 и 2 измеряли до полного испарения указанных образцов, что позволило оценить методом полного изотермического испарения [32, 33] динамику изменения состава конденсированной фазы исследуемой системы La2O3–Sm2O3 в результате преимущественного испарения La2O3. Временные зависимости интенсивностей ионных токов в масс-спектрах пара над образцами 1 и 2 представлены на рис. 2.
Рис. 2.
Временные зависимости интенсивностей ионных токов в масс-спектрах пара над образцами 1 (а) и 2 (б), содержащими 0.66La2O3–0.34Sm2O3 и 0.27La2O3–0.73Sm2O3 соответственно (мол. д.): 1 – LaO+, 2 – La+, 3 – SmO+, 4 – Sm+. Числа в верхней части рисунка соответствуют мольной доле La2O3, оцененной в конденсированной фазе системы методом полного изотермического испарения [33].
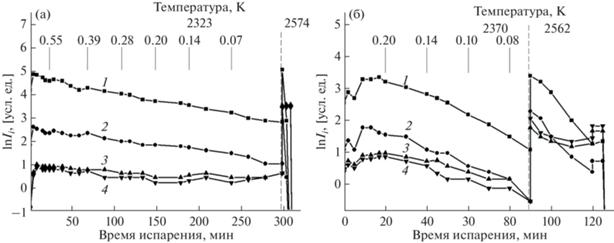
Вследствие преимущественного испарения La2O3 из образца 1 (рис. 2а) мольная доля La2O3 в конденсированной фазе системы La2O3–Sm2O3, определенная методом полного изотермического испарения [32, 33], уменьшается от 0.66 до 0.02 при температуре 2323 K. Это позволило получить концентрационную зависимость парциального давления молекулярных форм пара LaO, SmO и Sm в системе La2O3–Sm2O3 по уравнению (3), приведенную в табл. 1.
Таблица 1.
Парциальные давления (pi) молекулярных форм пара LaO, SmO, Sm, О и активности La2O3$\left( {{{a}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}} \right)$ в системе La2O3–Sm2O3, полученные в настоящей работе масс-спектрометрическим эффузионным методом Кнудсена при испарении образца 1 при температуре 2323 K и образца 2 при температуре 2370 K
| Содержание компонентов, мол. д. |
pi, Па | ${{a}_{{{\text{L}}{{{\text{a}}}_{2}}{{{\text{O}}}_{3}}}}}$ | ||||
|---|---|---|---|---|---|---|
| La2O3 | Sm2O3 | LaO | SmO | Sm | O | |
| 0.57 | 0.43 | 0.80 ± 0.06 | 0.07 ± 0.01 | 0.038 ± 0.006 | 0.16 ± 0.01 | 0.46 ± 0.11 |
| 0.55 | 0.45 | 0.78 ± 0.06 | 0.07 ± 0.01 | 0.038 ± 0.006 | 0.15 ± 0.01 | 0.42 ± 0.10 |
| 0.53 | 0.47 | 0.74 ± 0.06 | 0.06 ± 0.01 | 0.034 ± 0.006 | 0.15 ± 0.01 | 0.36 ± 0.09 |
| 0.49 | 0.51 | 0.73 ± 0.06 | 0.07 ± 0.01 | 0.036 ± 0.006 | 0.15 ± 0.01 | 0.35 ± 0.09 |
| 0.45 | 0.55 | 0.67 ± 0.05 | 0.07 ± 0.01 | 0.035 ± 0.006 | 0.136 ± 0.009 | 0.28 ± 0.07 |
| 0.42 | 0.58 | 0.58 ± 0.05 | 0.07 ± 0.01 | 0.035 ± 0.006 | 0.120 ± 0.008 | 0.18 ± 0.05 |
| 0.39 | 0.61 | 0.58 ± 0.05 | 0.06 ± 0.01 | 0.035 ± 0.006 | 0.120 ± 0.009 | 0.18 ± 0.05 |
| 0.34 | 0.66 | 0.48 ± 0.04 | 0.06 ± 0.01 | 0.025 ± 0.003 | 0.098 ± 0.007 | 0.10 ± 0.03 |
| 0.28 | 0.72 | 0.46 ± 0.04 | 0.05 ± 0.01 | 0.027 ± 0.003 | 0.095 ± 0.007 | 0.09 ± 0.02 |
| 0.26 | 0.74 | 0.44 ± 0.04 | 0.05 ± 0.01 | 0.027 ± 0.003 | 0.092 ± 0.007 | 0.08 ± 0.02 |
| 0.23 | 0.77 | 0.36 ± 0.04 | 0.05 ± 0.01 | 0.027 ± 0.003 | 0.080 ± 0.006 | 0.05 ± 0.01 |
| 0.23* | 0.77* | – | – | – | – | 0.09 ± 0.02* |
| 0.21* | 0.79* | – | – | – | – | 0.09 ± 0.02* |
| 0.20 | 0.80 | 0.32 ± 0.03 | 0.041 ± 0.004 | 0.020 ± 0.002 | 0.067 ± 0.006 | (3.0 ± 0.9) × 10–2 |
| 0.20* | 0.80* | – | – | – | – | 0.06 ± 0.02* |
| 0.17* | 0.83* | – | – | – | – | (2.9 ± 0.8) × 10–2* |
| 0.15 | 0.85 | 0.28 ± 0.03 | 0.040 ± 0.004 | 0.020 ± 0.002 | 0.062 ± 0.005 | (2.3 ± 0.7) × 10–2 |
| 0.14 | 0.86 | 0.26 ± 0.03 | 0.044 ± 0.009 | 0.021 ± 0.002 | 0.059 ± 0.005 | (1.8 ± 0.6) × 10–2 |
| 0.14* | 0.86* | – | – | – | – | (1.6 ± 0.4) × 10–2* |
| 0.13* | 0.87* | – | – | – | – | (9 ± 2) × 10–3* |
| 0.12* | 0.88* | – | – | – | – | (1.0 ± 0.3) × 10–2* |
| 0.11 | 0.89 | 0.22 ± 0.02 | 0.056 ± 0.009 | 0.024 ± 0.002 | 0.053 ± 0.004 | (1.1 ± 0.3) × 10–2 |
| 0.10* | 0.90* | – | – | – | – | (5.6 ± 1.5) × 10–3* |
| 0.09* | 0.91* | – | – | – | – | (2.2 ± 0.6) × 10–3* |
| 0.08* | 0.92* | – | – | – | – | (9.7 ± 2.6) × 10–4* |
| 0.07 | 0.93 | 0.19 ± 0.02 | 0.040 ± 0.004 | 0.020 ± 0.002 | 0.047 ± 0.003 | (8 ± 2) × 10–3 |
| 0.05 | 0.95 | 0.15 ± 0.01 | 0.040 ± 0.004 | 0.022 ± 0.002 | 0.042 ± 0.003 | (4.5 ± 1.2) × 10–3 |
| 0.04 | 0.96 | 0.13 ± 0.01 | 0.040 ± 0.004 | 0.025 ± 0.003 | 0.040 ± 0.003 | (3.3 ± 0.9) × 10–3 |
| 0.02 | 0.98 | 0.12 ± 0.01 | 0.044 ± 0.009 | 0.027 ± 0.006 | 0.039 ± 0.004 | (2.4 ± 0.7) × 10–3 |
Как следует из данных табл. 1, парциальное давление пара LaO над системой La2O3–Sm2O3 при температуре 2323 K уменьшается по мере обеднения конденсированной фазы оксидом лантана. При снижении мольной доли La2O3 в конденсированной фазе от 0.57 до 0.02 соотношение парциального давления молекулярной формы пара LaO к сумме парциальных давлений пара SmO и Sm уменьшается от 7 ± 1 до 1.7 ± 0.3. Следовательно, при температуре 2323 K наблюдается преимущественное испарение La2O3 из образцов системы La2O3–Sm2O3 при обогащении конденсированной фазы Sm2O3.
Активности La2O3 в системе La2O3–Sm2O3 определены по уравнению (4) при температурах 2323 и 2370 K при испарении образцов 0.66La2O3–0.34Sm2O3 и 0.27La2O3–0.73Sm2O3 (мол. д.) соответственно. Полученные данные свидетельствуют об отрицательном отклонении от идеальности в изученной системе.
Для определения активностей Sm2O3 и избыточной энергии Гиббса в исследованной системе проведена аппроксимация экспериментальных значений активностей La2O3 полиномами Редлиха–Кистера [34] и Вильсона [35, 36] в предположении о существовании непрерывного твердого раствора в изученных концентрационных и температурных интервалах системы La2O3–Sm2O3:
(5)
$\begin{gathered} \ln \frac{{{{a}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}}{{{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}} = x_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}^{2}[B + C(4{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} - 1) + \\ + \,\,D({{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} - {{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}})(5{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} - {{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}})], \\ \end{gathered} $(6)
$\begin{gathered} \ln \frac{{{{a}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}}{{{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}} = - \ln ({{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + {{\Lambda }_{{{\text{LS}}}}}{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}) + \\ + \,\,{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}\left( {\frac{{{{\Lambda }_{{{\text{LS}}}}}}}{{{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + {{\Lambda }_{{{\text{LS}}}}}{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}} - \frac{{{{\Lambda }_{{{\text{SL}}}}}}}{{{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + {{\Lambda }_{{{\text{SL}}}}}{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}}} \right), \\ \end{gathered} $Показано, что при использовании полинома Редлиха–Кистера с тремя коэффициентами коэффициенты C и D становятся статистически незначимыми на уровне значимости 0.05. По этой причине для описания концентрационной зависимости активностей La2O3 в исследованной системе в уравнении (5) целесообразно использовать два ненулевых коэффициента B и C, равных 2.47 ± 0.23 и 0.87 ± 0.39 соответственно. В этом случае корень квадратный из оценки дисперсии ошибок σ равен 0.54 для натурального логарифма коэффициента активности La2O3 и 0.02 для активностей La2O3. Коэффициент детерминации R2 для активностей La2O3 составил 0.98.
Значения коэффициентов полинома Вильсона (уравнение (6)) составили ΛLS = 2.040 и ΛSL = = 3.768. Корень квадратный из оценки дисперсии ошибок σ равен 0.56 для натурального логарифма коэффициента активности La2O3 и 0.03 для активностей La2O3. Коэффициент детерминации R2 для активностей La2O3 составил 0.98.
Концентрационные зависимости активностей La2O3 и Sm2O3 в системе La2O3–Sm2O3 при температуре 2323 K, полученные в соответствии с полиномами Редлиха–Кистера и Вильсона, представлены на рис. 3а в сопоставлении с экспериментально найденными значениями активности La2O3 из табл. 1.
Рис. 3.
Концентрационные зависимости: а – активностей La2O3 (1, 2) и Sm2O3 (3, 4), б – избыточной энергии Гиббса (5, 6) в системе La2O3–Sm2O3 при температуре 2323 K согласно полиномам Редлиха–Кистера (1, 3, 5) и Вильсона (2, 4, 6). ◼ и ⚪ – значения активности La2O3, полученные масс-спектрометрическим эффузионным методом Кнудсена при испарении образцов 1 и 2 соответственно.

Полиномы Редлиха–Кистера (5) и Вильсона (6) для активностей La2O3 соответствуют следующим концентрационным зависимостям избыточной энергии Гиббса в системе La2O3–Sm2O3 при температуре 2323 K (рис. 3б):
(7)
$\Delta {{G}^{E}} = RT{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}[B + C({{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} - {{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}})],$(8)
$\begin{gathered} \Delta {{G}^{E}} = RT( - {{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}\ln ({{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + {{\Lambda }_{{{\text{LS}}}}}{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}) - \\ - \,\,{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}\ln ({{\Lambda }_{{{\text{SL}}}}}{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + {{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}})), \\ \end{gathered} $Ранее показано [34], что полином Редлиха–Кистера с двумя коэффициентами B и C однозначно соответствует концентрационной зависимости избыточной энергии Гиббса бинарной системы в рамках модели субрегулярных растворов [37]. Следовательно, величины термодинамических свойств в системе La2O3–Sm2O3, полученные в настоящей работе при температуре 2323 K, свидетельствуют об отрицательных отклонениях от идеального поведения в рассматриваемой системе и могут быть описаны с привлечением модели субрегулярных растворов [37]. При этом ранее [16] при моделировании фазовых равновесий в рамках подхода CALPHAD в системе La2O3–Sm2O3 были показаны положительные отклонения от идеальности и предполагалось, что термодинамические свойства в указанной системе подчиняются модели регулярных растворов [38]. Наблюдаемое несоответствие свидетельствует о необходимости проведения дальнейшей оптимизации высокотемпературных равновесий в системе La2O3–Sm2O3 с учетом не только данных о фазовых равновесиях, как в работе [16], но и впервые полученных в настоящем исследовании экспериментальных значений термодинамических свойств.
Известно [35, 36], что использование полинома Вильсона для описания концентрационной зависимости избыточной энергии Гиббса в бинарной системе позволяет в рамках допущений, принятых в методе Вильсона, таких как вид выражения связи аппроксимационных коэффициентов ΛLS и ΛSL с энергетическими параметрами взаимодействия компонентов λLS, λLL и λSS, а также независимость разности энергетических параметров λLS – λLL и λLS – λSS от температуры, оценить энтальпию образования из оксидов (ΔH) и избыточную энтропию (ΔSE) системы. В системе La2O3–Sm2O3 с привлечением метода Вильсона были получены следующие концентрационные зависимости ΔH и ΔSE при температуре 2323 K:
(9)
$\begin{gathered} \Delta H = - 15.979\frac{{2.040{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}}{{{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + 2.040{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}} - \\ - \,\,23.411\frac{{3.768{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}}{{3.768{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + {{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}}, \\ \end{gathered} $(10)
$\begin{gathered} \Delta S = R({{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}\ln ({{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + 2.040{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}) + \\ + \,\,{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}\ln (3.768{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + {{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}})) - \\ - \,\,\frac{{2.040{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}}{{({{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + 2.040{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}})}}\frac{{15.979}}{{2.323}} - \\ - \,\,\frac{{3.768{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}{{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}}{{(3.768{{x}_{{{\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} + {{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}})}}\frac{{23.411}}{{2.323}}, \\ \end{gathered} $Рис. 4.
Энтальпия образования из оксидов (ΔH, 1), избыточная энтропия, умноженная на температуру (TΔSE, 2), и избыточная энергия Гиббса (ΔGE, 3), оцененные в настоящей работе в системе La2O3–Sm2O3 при температуре 2323 K с привлечением метода Вильсона.

Как следует из данных, представленных на рис. 4, энтальпия образования из оксидов в системе La2O3–Sm2O3 отрицательна, т.е. процесс взаимодействия La2O3 и Sm2O3 в устойчивых полиморфных модификациях при температуре 2323 K с образованием твердых растворов рассматриваемой системы сопровождается выделением теплоты. Избыточная энтропия изученной системы также отрицательна и достигает –1.2 Дж/(моль K) при мольной доле La2O3, равной 0.23. Это свидетельствует о том, что энтропия образования из оксидов твердых растворов на основе системы La2O3–Sm2O3 меньше, чем энтропия образования из оксидов идеального раствора. По-видимому, это может быть связано с некоторой агрегацией разноименных компонентов (отклонением от случайного распределения) в исследованных твердых растворах по сравнению со случайным распределением компонентов в идеальном растворе. При этом энтропия смешения в системе La2O3–Sm2O3 остается положительной при всех содержаниях компонентов, достигая величины 4.85 Дж/(моль K) при мольной доле La2O3, равной 0.53. Таким образом, отклонение свойств твердых растворов в системе La2O3–Sm2O3 от закономерностей поведения идеального раствора в основном обусловлено энтальпией смешения при образовании растворов из индивидуальных оксидов, взятых в устойчивых модификациях при температуре 2323 K, при незначительном уменьшении энтропии смешения от величины, характерной для идеального раствора, вследствие отклонения от случайного распределения компонентов в твердых растворах.
Расчет термодинамических свойств в многокомпонентных системах на основе HfO2 и оксидов РЗЭ
Полученные в настоящей работе концентрационные зависимости избыточной энергии Гиббса в системе La2O3–Sm2O3 (уравнения (7) и (8)) позволили рассчитать термодинамические свойства четырехкомпонентных систем La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 на основании данных о равновесиях в бинарных системах полуэмпирическими методами Колера [39], Редлиха–Кистера [34] и Вильсона [36] с использованием соответственно следующих уравнений:
(11)
$\Delta {{G}^{E}} = \sum\limits_{i,j = 1,i < j}^4 {{{{\left[ {\Delta G_{{ij}}^{E}} \right]}}_{{\frac{{{{x}_{i}}}}{{{{x}_{j}}}}}}}} {{({{x}_{i}} + {{x}_{j}})}^{2}},$(12)
$\begin{gathered} \Delta {{G}^{E}} = \\ = \,\,RT\sum\limits_{i,j = 1,i < j}^4 {{{x}_{i}}{{x}_{j}}} \left[ {{{B}_{{ij}}} + {{C}_{{ij}}}({{x}_{i}} - {{x}_{j}})\, + \,{{D}_{{ij}}}{{{({{x}_{i}}\, - \,{{x}_{j}})}}^{2}}\, + \,...} \right], \\ \end{gathered} $(13)
$\Delta {{G}^{E}} = - RT\sum\limits_{i = 1}^4 {{{x}_{i}}\ln } \left[ {\sum\limits_{j = 1}^4 {{{x}_{j}}{{\Lambda }_{{ij}}}} } \right],$Активности оксидов лантаноидов в системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 были оценены по уравнению Даркена [41] на основе величин избыточных энергий Гиббса, рассчитанных полуэмпирическими методами Колера, Редлиха–Кистера и Вильсона при температуре 2330 K. Кроме того, активности компонентов в рассматриваемых системах были рассчитаны на основе обобщенной решеточной теории ассоциированных растворов (ОРТАР) [42] при оптимизации значений термодинамических свойств в соответствующих бинарных системах. Экспериментальные и рассчитанные данные об активностях оксидов лантаноидов в системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 приведены в табл. 2 в сопоставлении с ранее полученными величинами активностей компонентов в образцах четырехкомпонентных систем La2O3–Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2 [40].
Как следует из данных, приведенных в табл. 2 , активности оксидов лантаноидов в образцах 5–8 систем La2O3–Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2, рассчитанные полуэмпирическими методами, были меньше экспериментальных данных в среднем в 24 раза в случае метода Колера, в 23 раза в случае метода Редлиха–Кистера и в 7 раз в случае метода Вильсона. Активности La2O3, рассчитанные на основе ОРТАР в системе La2O3–Y2O3–ZrO2–HfO2, были в среднем в 2 раза выше экспериментальных величин, а активности Sm2O3 в системе Sm2O3–Y2O3–ZrO2–HfO2 – в 2 раза ниже данных, найденных масс-спектрометрическим эффузионным методом Кнудсена. Таким образом, подход ОРТАР может быть рекомендован для оценки значений термодинамических свойств в системах La2O3–Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2 по данным о равновесиях в соответствующих бинарных системах. Одной из причин несоответствия экспериментальных данных и рассчитанных значений термодинамических свойств могут быть значительные взаимодействия в рассматриваемых системах, которые не учитываются при расчете полуэмпирическими методами и приводят к отклонению экспериментально полученных значений термодинамических свойств от величин, рассчитанных при аддитивном учете вкладов бинарных систем.
Другая ситуация наблюдалась при рассмотрении активностей оксидов лантаноидов в образцах 1–4 систем La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2. Активности La2O3, рассчитанные полуэмпирическими методами в образцах 1–4 при температуре 2330 K, были как больше, так и меньше экспериментальных данных. В среднем значения активностей La2O3, рассчитанные методами Колера, Редлиха–Кистера и Вильсона, отличались от экспериментальных величин в 1.6, 1.7 и 1.2 раза соответственно. Соответствующие значения, рассчитанные на основе ОРТАР в системе La2O3–Sm2O3–Y2O3–HfO2, были в среднем в 3 раза выше экспериментальных величин, а в системе La2O3–Sm2O3–ZrO2–HfO2 – в 23 раза выше экспериментальных данных. Таким образом, в системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 полуэмпирический метод Вильсона приводит к наилучшему соответствию с экспериментальными данными об активностях La2O3 не только среди других использованных полуэмпирических методов, как в случае систем La2O3–Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2 [40], но и по сравнению с подходом ОРТАР.
Большее соответствие с экспериментальными данными активностей La2O3, рассчитанных с привлечением полуэмпирических методов, по сравнению с результатами моделирования на основе подхода ОРТАР отмечено впервые. Ранее, как в случае систем La2O3–Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2 [40], при сопоставлении с экспериментальными величинами наблюдалось преимущество подхода ОРТАР для оценки значений термодинамических свойств в многокомпонентных оксидных системах по данным о равновесиях в соответствующих бинарных системах.
По-видимому, это связано с тем, что термодинамические свойства в системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 в основном определяются парными взаимодействиями компонентов с незначительным влиянием содержания других компонентов на параметры парного взаимодействия, что позволяет рассчитывать термодинамические характеристики указанных систем по аддитивности соответствующих величин в бинарных системах. С учетом вышесказанного, можно заключить, что подход ОРТАР целесообразно использовать для расчета термодинамических свойств в системах, в которых сильные взаимодействия компонентов увеличивают значения термодинамических свойств по сравнению с величинами, определяемыми только через независимые парные взаимодействия компонентов, т.е. суммой вкладов бинарных систем. Полуэмпирические методы, наоборот, могут успешно применяться для оценки термодинамических свойств в многокомпонентных системах, термодинамические характеристики которых складываются аддитивно из независимых вкладов бинарных систем.
Активности Sm2O3, рассчитанные в образцах 1–4 по данным о равновесиях в соответствующих бинарных системах полуэмпирическими методами Колера, Редлиха–Кистера, Вильсона и на основе подхода ОРТАР, отличаются от экспериментальных данных в среднем в 6 раз, 6 раз, 3 раза и 2.6 раза соответственно. Следовательно, для расчета активностей Sm2O3 в системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 целесообразно использовать подход ОРТАР и полуэмпирический метод Вильсона, причем метод Вильсона является менее трудоемким и приводит к большему соответствию с экспериментальными данными в случае расчета активностей La2O3 в рассматриваемых четырехкомпонентных системах.
ЗАКЛЮЧЕНИЕ
В данной работе рассмотрены имеющиеся экспериментальные данные о процессах испарения и термодинамических свойствах многокомпонентной керамики на основе оксидов гафния и редкоземельных элементов при высоких температурах, найденные с участием авторов настоящего исследования. Проведено исследование процессов испарения и термодинамических свойств системы La2O3–Sm2O3 при температуре 2323 K масс-спектрометрическим эффузионным методом Кнудсена. Впервые идентифицирован состав пара над изученными образцами керамики, определены парциальные давления молекулярных форм пара и активности La2O3 в рассматриваемой системе в концентрационном интервале 2–57 мол. % La2O3. Аппроксимация величин активностей La2O3 полиномами Редлиха–Кистера и Вильсона позволила определить концентрационные зависимости активностей Sm2O3 и избыточной энергии Гиббса при указанной температуре. Использование полинома Вильсона дало возможность впервые оценить энтальпию образования из оксидов и избыточную энтропию в системе La2O3–Sm2O3.
С привлечением полученной информации о концентрационной зависимости термодинамических свойств в системе La2O3–Sm2O3 рассчитаны значения активностей оксидов лантаноидов при температуре 2330 K в системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 полуэмпирическими методами Колера, Редлиха–Кистера и Вильсона, а также на основе обобщенной решеточной теории ассоциированных растворов (подхода ОРТАР) по данным о равновесиях в соответствующих бинарных системах. При сопоставлении с данными, полученными ранее при изучении систем La2O3–Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2 [40], выявлено, что оптимальным подходом для оценки активностей оксидов лантаноидов в системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 по данным о равновесиях в соответствующих бинарных системах является метод Вильсона, а в системах La2O3–Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2 – подход ОРТАР.
Следует подчеркнуть, что полученные в настоящей работе экспериментальные данные представляют существенный интерес как для дальнейшей оптимизации высокотемпературного описания системы La2O3–Sm2O3, так и для моделирования фазовых равновесий в многокомпонентных системах, включающих изученную бинарную систему. Результаты тестирования применимости полуэмпирических методов и подхода ОРТАР для расчета термодинамических свойств многокомпонентных систем по соответствующим данным в бинарных системах могут быть рекомендованы для рассмотрения в международных базах термодинамических данных и моделей, применяемых при оптимизации высокотемпературных равновесий в оксидных системах.
Таблица 2.
Активности оксидов лантаноидов $\left( {{{a}_{{{\text{L}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}} \right)$ в системах La2O3–Sm2O3–Y2O3–HfO2 и La2O3–Sm2O3–ZrO2–HfO2 при температуре 2330 K, полученные масс-спектрометрическим эффузионным методом Кнудсена (I) и рассчитанные полуэмпирическими методами Колера (II), Редлиха–Кистера (III) и Вильсона (IV), а также на основе подхода ОРТАР (V) по данным о равновесиях в соответствующих бинарных системах, при сопоставлении с ранее полученными величинами в образцах четырехкомпонентных систем La2O3–Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2 при температуре 2373 K [40]
| Образец | Содержание оксидов, мол. % | ${{a}_{{{\text{L}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}$ | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| La2O3 | Sm2O3 | Y2O3 | ZrO2 | HfO2 | I | II | III | IV | V | |
| 1 | 9.1 | 20.2 | 43.6 | – | 27.1 | (1.4 ± 0.3) × 10–2 | 2.2 × 10–2 | 1.8 × 10–2 | 1.3 × 10–2 | 3.5 × 10–2 |
| 2 | 18.1 | 10.2 | 44.1 | – | 27.6 | (1.6 ± 0.3) × 10–2 | 3.6 × 10–2 | 3.2 × 10–2 | 2.6 × 10–2 | 6.0 × 10–2 |
| 3 | 8.3 | 18.6 | – | 46.8 | 26.3 | (9.5 ± 1.9) × 10–4 | 1.1 × 10–3 | 5.7 × 10–4 | 8.9 × 10–4 | 3.0 × 10–2 |
| 4 | 17.0 | 9.4 | – | 47.5 | 26.1 | (1.7 ± 0.4) × 10–3 | 1.1 × 10–3 | 8.6 × 10–4 | 2.0 × 10–3 | 2.5 × 10–2 |
| 5* | 12.0 | – | 20.0 | 43.3 | 24.8 | (9 ± 2) × 10–3 | 1.6 × 10–3 | 1.2 × 10–3 | 3.1 × 10–3 | 3.0 × 10–2 |
| 6* | 20.4 | – | 9.3 | 42.9 | 27.4 | (5.2 ± 1.6) × 10–2 | 1.1 × 10–3 | 1.2 × 10–3 | 4.2 × 10–3 | 5.1 × 10–2 |
| – | ${{a}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}$ | |||||||||
| 1 | 9.1 | 20.2 | 43.6 | – | 27.1 | (6.7 ± 1.8) × 10–2 | 5.1 × 10–3 | 5.5 × 10–3 | 1.2 × 10–2 | 5.8 × 10–2 |
| 2 | 18.1 | 10.2 | 44.1 | – | 27.6 | (1.0 ± 0.5) × 10–2 | 1.5 × 10–3 | 1.6 × 10–3 | 3.2 × 10–3 | 3.2 × 10–2 |
| 3 | 8.3 | 18.6 | – | 46.8 | 26.3 | (1.7 ± 0.4) × 10–2 | 4.2 × 10–3 | 4.9 × 10–3 | 7.1 × 10–3 | 1.9 × 10–2 |
| 4 | 17.0 | 9.4 | – | 47.5 | 26.1 | (2.7 ± 1.4) × 10–3 | 2.9 × 10–3 | 2.6 × 10–3 | 2.7 × 10–3 | 1.4 × 10–2 |
| 7* | – | 12.8 | 19.7 | 42.9 | 24.6 | (4.1 ± 1.3) × 10–2 | 1.8 × 10–3 | 1.8 × 10–3 | 6.7 × 10–3 | 2.1 × 10–2 |
| 8* | – | 19.1 | 9.5 | 43.6 | 27.8 | (7 ± 2) × 10–2 | 3.5 × 10–3 | 3.8 × 10–3 | 1.0 × 10–2 | 3.2 × 10–2 |
* Результаты работы [40] при температуре 2373 K.
Список литературы
Wang J., Li H.P., Stevens R. // J. Mater. Sci. 1992. V. 27. № 20. P. 5397. https://doi.org/10.1007/BF00541601
Clarke D.R., Phillpot S.R. // Mater. Today. 2005. V. 8. № 6. P. 22. https://doi.org/10.1016/S1369-7021(05)70934-2
Andrievskaya E.R. // J. Eur. Ceram. Soc. 2008. V. 28. № 12. P. 2363. https://doi.org/10.1016/j.jeurceramsoc.2008.01.009
Pan W., Phillpot S.R., Wan C. et al. // MRS Bull. 2012. V. 37. № 10. P. 917. https://doi.org/10.1557/mrs.2012.234
Darolia R. // Int. Mater. Rev. 2013. V. 58. № 6. P. 315. https://doi.org/10.1179/1743280413Y.0000000019
Каблов Е.Н. Литые лопатки газотурбинных двигателей: сплавы, технологии, покрытия. М.: Наука, 2006. 632 с.
Петрушин Н.В., Оспенникова О.Г., Светлов И.Л. // Авиац. материалы и технологии. 2017. Т. 49. С. 72.
Cao X.Q., Vassen R., Stoever D. // J. Eur. Ceram. Soc. 2004. V. 24. № 1. P. 1. https://doi.org/10.1016/S0955-2219(03)00129-8
Чубаров Д.A., Матвеев П.В. // Авиац. материалы и технологии. 2013. Т. 29. № 4. С. 43. https://www.elibrary.ru/item.asp?id=20421193
Vassen R., Jarligo M.O., Steinke T. et al. // Surf. Coat. Technol. 2010. V. 205. № 4. P. 938. https://doi.org/10.1016/j.surfcoat.2010.08.151
Казенас Е.К. Термодинамика испарения двойных оксидов. М.: Наука, 2004. 551 с. https://elibrary.ru/item.asp?id=19468800
Lukas H.L., Fries S.G., Sundman B. Computational thermodynamics: The Calphad method. Cambridge: Cambridge University Press, 2007. 313 p. https://doi.org/10.1017/CBO9780511804137
Schneider S.J., Roth R.S. // J. Res. Natl. Bur. Stand. A. Phys. Chem. 1960. V. 64A. № 4. P. 317. https://doi.org/10.6028/JRES.064A.031
Coutures J., Rouanet A., Verges R., Foex M. // J. Solid State Chem. 1976. V. 17. № 1–2. P. 171. https://doi.org/10.1016/0022-4596(76)90218-8
Корнієнко О.А. // Укр. хім. журн. 2018. Т. 84. № 3. С. 28.
Zinkevich M. // Prog. Mater. Sci. 2007. V. 52. № 4. P. 597. https://doi.org/10.1016/J.PMATSCI.2006.09.002
Казенас Е.К., Цветков Ю.В. Термодинамика испарения оксидов. М.: Изд-во ЛКИ, 2008. 480 с. https://elibrary.ru/item.asp?id=19470483
Гурвич Л.В., Вейц И.В., Медведев В.А. и др. Термодинамические свойства индивидуальных веществ. Справочное издание / Отв. ред. Глушко В.П. М.: Наука, 1982. Т. IV. Кн. 2. 560 с.
Shugurov S.M., Kurapova O.Y., Lopatin S.I. et al. // Rapid Commun. Mass Spectrom. 2017. V. 31. № 23. P. 2021. https://doi.org/10.1002/rcm.7997
Ackermann R.J., Rauh E.G. // J. Chem. Thermodyn. 1971. V. 3. № 4. P. 445. https://doi.org/10.1016/S0021-9614(71)80027-7
Walsh P.N., Goldstein H.W., White D. // J. Am. Ceram. Soc. 1960. V. 43. № 5. P. 229. https://doi.org/10.1111/J.1151-2916.1960.TB14589.X
Goldstein H.W., Walsh P.N., White D. // J. Phys. Chem. 1961. V. 65. № 8. P. 1400. https://doi.org/10.1021/J100826A029
Vorozhtcov V.A., Stolyarova V.L., Lopatin S.I. et al. // J. Alloys Compd. 2018. V. 735. P. 2348. https://doi.org/10.1016/J.JALLCOM.2017.11.319
Stolyarova V.L., Vorozhtcov V.A., Lopatin S.I., Shugurov S.M. // Russ. J. Gen. Chem. 2020. V. 90. № 5. P. 874. [Столярова В.Л., Ворожцов В.А., Лопатин С.И., Шугуров С.М. // Журн. общ. химии. 2020. Т. 90. № 5. С. 787. https://doi.org/10.31857/S0044460X20050194]https://doi.org/10.1134/S1070363220050199
Hilpert K. // Rapid Commun. Mass Spectrom. 1991. V. 5. № 4. P. 175. https://doi.org/10.1002/rcm.1290050408
Drowart J., Chatillon C., Hastie J., Bonnell D. // Pure Appl. Chem. 2005. V. 77. № 4. P. 683. https://doi.org/10.1351/pac200577040683
Lopatin S.I., Shugurov S.M., Tyurnina Z.G., Tyurnina N.G. // Glass Phys. Chem. 2021. V. 47. № 1. P. 38. [Лопатин С.И., Шугуров С.М., Тюрнина З.Г., Тюрнина Н.Г. // Физика и химия стекла. 2021. Т. 47. № 1. С. 50. https://doi.org/10.31857/S0132665121010078]https://doi.org/10.1134/S1087659621010077
Lopatin S.I. // Glass Phys. Chem. 2022. V. 48. № 2. P. 117. [Лопатин С.И. // Физика и химия стекла. 2022. Т. 48. № 2. С. 163. https://doi.org/10.31857/S0132665122020056]https://doi.org/10.1134/S1087659622020055
Семенов Г.А., Николаев Е.Н., Францева К.Е. Применение масс-спектрометрии в неорганической химии. Л.: Химия. Ленингр. отд-ние, 1976. 151 с.
Paule R.C., Mandel J. // Pure Appl. Chem. 1972. V. 31. № 3. P. 371. https://doi.org/10.1351/pac197231030371
Zeifert P.L. // High Temperature Technology. N.Y.: John Wiley, 1956. P. 485.
Сидоров Л.Н., Акишин П.А. // Докл. АН СССР. 1963. № 151. № 1. С. 136.
Sidorov L.N., Shol’ts V.B. // Int. J. Mass Spectrom. Ion Phys. 1972. V. 8. № 5. P. 437. https://doi.org/10.1016/0020-7381(72)80014-7
Redlich O., Kister A.T. // Ind. Eng. Chem. 1948. V. 40. № 2. P. 345. https://doi.org/10.1021/ie50458a036
Wilson G.M. // J. Am. Chem. Soc. 1964. V. 86. № 2. P. 127. https://doi.org/10.1021/ja01056a002
Orye R. V., Prausnitz J.M. // Ind. Eng. Chem. 1965. V. 57. № 5. P. 18. https://doi.org/10.1021/ie50665a005
Hardy H.K. // Acta Metall. 1953. V. 1. № 2. P. 202. https://doi.org/10.1016/0001-6160(53)90059-5
Hildebrand J.H. // J. Am. Chem. Soc. 1929. V. 51. № 1. P. 66. https://doi.org/10.1021/ja01376a009
Kohler F. // Monatsh. Chem. 1960. V. 91. № 4. P. 738. https://doi.org/10.1007/BF00899814
Vorozhtcov V.A., Kirillova S.A., Shilov A.L. et al. // Mater. Today Commun. 2021. V. 29. P. 102952. https://doi.org/10.1016/j.mtcomm.2021.102952
Darken L.S. // J. Am. Chem. Soc. 1950. V. 72. № 7. P. 2909. https://doi.org/10.1021/ja01163a030
Barker J.A. // J. Chem. Phys. 1952. V. 20. № 10. P. 1526. https://doi.org/10.1063/1.1700209
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


