Журнал неорганической химии, 2023, T. 68, № 5, стр. 613-622
Синтез смешанных оксидных систем на основе магния и алюминия методами низкого и высокого насыщения
В. В. Фадеев a, *, А. П. Тронов a, А. В. Толчев a, Д. М. Галимов b, В. Е. Живулин b, Р. С. Морозов b, В. В. Авдин b
a Челябинский государственный университет
454136 Челябинск, ул. Молодогвардейцев, 70Б, Россия
b Южно-Уральский государственный университет
454080 Челябинск, Ленинский пр-т, 76, Россия
* E-mail: vladislav_fadeev98@mail.ru
Поступила в редакцию 29.11.2022
После доработки 30.01.2023
Принята к публикации 31.01.2023
- EDN: SNEVVM
- DOI: 10.31857/S0044457X22602036
Аннотация
Методами высокого и низкого насыщения синтезированы и проанализированы слоистые двойные гидроксиды магния-алюминия и смешанные оксиды на их основе. Показано, что существенное влияние на фазовый состав и формирование наноразмерных частиц с большой площадью поверхности оказывает скорость введения магний-алюминиевых систем в среду осаждаемого вещества. Все полученные образцы исследованы методами термогравиметрического анализа с масс-спектрометрическим детектированием, рентгеновской дифрактометрии, электронно-растровой микроскопии, энергодисперсионной рентгеновской и инфракрасной спектроскопии.
ВВЕДЕНИЕ
В настоящее время смешанные оксиды магния-алюминия на основе слоистых двойных гидроксидов привлекают все большее внимание исследователей с целью создания экологически безопасных катализаторов вследствие их большой площади поверхности [1, 2], кислотно-основных свойств [3–5], структурной стойкости, простоте и дешевизне синтеза и способности к легкой регенерации после эксплуатации [6]. Эти материалы содержат высокодисперсные компоненты, способствующие проведению сложных бифункциональных реакций. Существует множество источников, в которых сообщалось, что смешанные оксиды Mg–Al способны катализировать различные органические реакции с высокой селективностью и выходом продукта. К таким превращениям можно отнести конденсацию Клайзена–Шмидта [7], конденсацию Кнёвенагеля [8], альдольную конденсацию [9], различные процессы изомеризации олефинов [10], алкилирование [11] и реакцию Мервейна–Пондорфа–Верлея, в которой происходит восстановление альдегидов и кетонов до соответствующих спиртов [12–14]. Кислотно-основные свойства смешанных оксидов Mg–Al, которые, как известно, важны для каталитической активности и селективности, сильно зависят от их химического состава и способов получения. На данный момент изучено множество механизмов синтеза смешанных оксидов из слоистых двойных гидроксидов (СДГ) соответствующих металлов, но одними из перспективных за счет простоты и дешевизны получения являются методы низкого (НН) и высокого насыщения (ВН) смеси [15]. Эти методы отличаются друг от друга мольными соотношениями добавляемых реагентов, концентрацией и природой щелочного агента, в котором происходит осаждение, временем полного осаждения и “старения”, температурой прокаливания и др.
Цель настоящей работы – сравнение и анализ полученных соединений на всех этапах синтеза смешанных оксидных систем магния-алюминия методами высокого и низкого насыщения с целью получения высокопористых материалов с большой площадью поверхности как перспективных сорбентов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов для исследования проводили по двум методикам. По методу ВН готовили раствор, содержащий соли магния и алюминия, взятые в мольных соотношениях 3 : 1. Для этого в мерной колбе на 25 мл растворяли Mg(NO3)2 · ⋅ 6H2O массой 7.692 г (0.03 моль) и Al(NO3)3 · 9H2O массой 3.751 г (0.01 моль). Далее раствор солей прибавляли по каплям к 75 мл раствора Na2CO3 · ⋅ 10H2O с концентрацией 1.5 моль/л со скоростью 5.0 мл/мин. В ходе добавления раствора солей происходило изменение рН. Для поддержания рН системы в диапазоне 9.5–10.0 использовали раствор NaOH с концентрацией 1.6 моль/л. Процесс осаждения осуществляли при перемешивании со скоростью 400 об/мин и температуре 60°C. После внесения раствора солей полученную суспензию выдерживали при 80°C в течение 4 ч при постоянном перемешивании. После выдержки суспензию разделяли центрифугированием со скоростью 3500 об/мин, промывая осадок теплой дистиллированной водой до достижения нейтральной среды (рН 7.0–7.5) маточного раствора. Осадки сушили при пониженной влажности воздуха (в эксикаторе с CaCl2) в течение 96 ч (образец ВН), а затем подвергали прокаливанию в муфельной печи в течение 4 ч при 500°C (образец ВН-500).
По методу НН готовили раствор, содержащий соли магния и алюминия, взятые в тех же мольных соотношениях 3 : 1. В данном случае в мерной колбе на 75 мл растворяли Mg(NO3)2 · 6H2O массой 19.2 г (0.075 моль) и Al(NO3)3 · 9H2O массой 9.4 г (0.025 моль). Раствор солей прибавляли по каплям со скоростью 0.5 мл/мин в колбу, наполненную 50 мл Na2CO3 · 10H2O с концентрацией 0.2 моль/л. Условия поддержания pH, промывания осадка, сушки и прокаливания образцов проводили по аналогии с предыдущей методикой. Полученные образцы обозначили как НН – осадок после сушки и НН-500 – после прокаливания при 500°C.
Рентгенофазовый анализ слоистых двойных гидроксидов и продуктов их прокаливания проводили с использованием порошкового дифрактометра Rigaku Ultima IV (CuKa-излучение). Средний размер кристаллитов и величину микронапряжений вычисляли по стандартным методикам [16]. Удельную площадь поверхности и поровые характеристики образцов измеряли методом капиллярной конденсации азота на приборе ASAP-2020. Морфологию поверхности и элементный состав образцов изучали с помощью электронно-растрового микроскопа высокого разрешения Jeol JSM-7001F, снабженного рентгеновским флуоресцентным анализатором EDS Oxford INCA X-max 80. Термический анализ образцов проводили с предварительным двукратным предвакуумированием в атмосфере воздуха (30 мл/мин) в корундовых микротиглях (85 мкл) с держателем для ТГ/ДСК типа S на синхронном термическом анализаторе Netzsch Jupiter STA 449 F3. Газообразные продукты термолиза анализировали в квадрупольном масс-спектрометре QMS 403C Aёolos. ИК-спектроскопию проводили на аппарате Shimadzu IRAffinity-1S.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
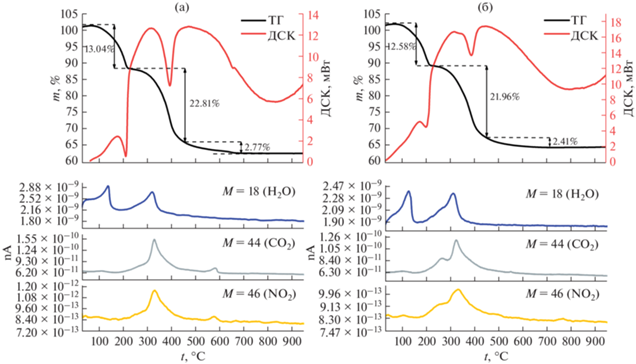
Изменение массы образцов ВН и НН при термической обработке и анализ газообразных продуктов термолиза регистрировали при скорости нагрева 1 град/мин в диапазоне температур от 30 до 950°C. Полученные кривые ТГ–ДСК–МС изображены на рис. 1. По ним видно, что у образцов имеются три последовательных этапа разложения, на которых происходит потеря массы. Первый этап наблюдается в интервале 80–220°C, он соответствует удалению воды, адсорбированной на поверхности вещества, а также находящейся в межслоевом пространстве СДГ. Потеря массы составляет 13.04% для образца ВН и 12.58% для образца НН. Второй этап наблюдается в интервале температур 220–460°C. Он характеризуется удалением гидроксильных групп, координированных с катионами металлов Mg2+и Al3+ в межслоевом пространстве. Также на этом этапе образовывались газообразные продукты термолиза – CO2 и NO2. Это позволяет предположить, что СДГ в своей структуре имел смешанные анионы как карбонатов, так и нитратов, находящихся в межслоевом пространстве молекулы. Количество нитратных групп по сравнению с остальными группами существенно мало. Можно заметить, что удаление в образце НН карбонат- и нитрат-анионов проходит в две стадии. Первая стадия фиксируется при температуре 260°C, а вторая, наибольшая по количеству удаляемых анионов, – при 325°C. Потеря массы образцами на втором этапе составляет 22.81 и 21.96% соответственно. Третий этап, протекающий при температурах выше 460°C, характеризуется фазовыми переходами в образцах, в ходе которых образуются смешанные оксидные системы [3]. Следует отметить, что у образца ВН при 580°C наблюдается второй этап удаления карбонатов и нитратов в небольших количествах. Потеря массы на этом этапе составляет 2.77 и 2.41% для образцов ВН и НН соответственно. Суммарная потеря массы в ходе термолиза образцов ВН и НН составила 38.62 и 36.95%.
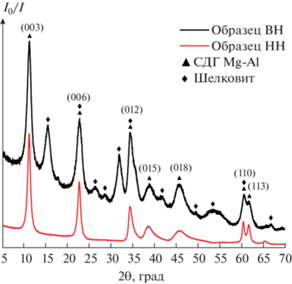
На рис. 2 представлены фрагменты рентгенограмм образцов ВН и НН. На них можно наблюдать набор дифракционных максимумов, которые соответствуют фазе слоистого двойного гидроксида магния-алюминия (СДГ Mg–Al) [17, 18]. Для рефлексов фазы СДГ Mg–Al приведены индексы Миллера. Образец НН, в отличие от образца ВН, имеет острые симметричные максимумы. Образец, полученный методом ВН, является двухфазным и содержит фазу СДГ Mg–Al, а также фазу минерала шелковита, имеющего формулу Mg7(CO3)5(OH)4 ⋅ 24H2O (ICCD card № 47-1880) [19].
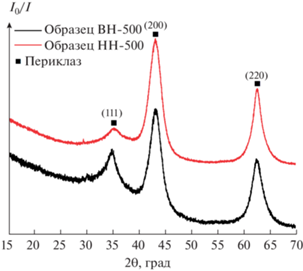
На рис. 3 представлены фрагменты рентгенограмм образцов ВН и НН, прокаленных при 500°C, на которых наблюдается только набор уширенных дифракционных максимумов, характерных для фазы минерала периклаза MgO [20] со средним размером кристаллов D(200) = 33 ± 3 Å. Рефлексы, относящиеся к оксидным соединениям Al2O3, не наблюдаются, что свидетельствует об их рентгеноаморфном состоянии. В литературе [21, 22] указывается на возможность образования твердого раствора, в котором катионы Al3+ находятся в кристаллической решетке MgO. Нами по рефлексу (220) был рассчитан параметр кубической элементарной ячейки MgO для образцов НН-500 и ВН-500, который в обоих случаях составил a = 4.18 ± 0.05 Å. Следует отметить, что полученное значение отличается от такового для чистого MgO, которое составляет а = 4.21 Å (ICCD card № 45-946). Таким образом, изменение параметров элементарной ячейки MgO в образцах НН-500 и ВН-500 свидетельствует в пользу образования твердого раствора, о котором упоминается в литературе [21, 22].
В табл. 1 представлены результаты рентгенографических исследований образцов, средний размер кристаллитов и величина микронапряжений. Проведена оценка среднего размера кристаллитов этих фаз, откуда следует, что эти фазы близки к нанонокристаллическим.
Таблица 1.
Рентгенографические данные образцов
| Образец | 2θ, град | d, Å | hkl | I/I0, % | Кристаллическая фаза. Средний размер кристаллитов D, Å. Величина микронапряжений ε, % |
|---|---|---|---|---|---|
| ВН | 11.4 | 7.80 | 003 | 100 |
[Mg2+]1 – x[Al3+]x(OH)2[(An)$_{{x/n}}^{ - }$]x ·
⋅ nH2O (СДГ Mg-Al) D(003) = 85 ± 5 ε = 3.44 * Mg7(CO3)5(OH)4 ⋅ 24H2O (Шелковит) |
| 15.5 | 5.72* | 100 | 58 | ||
| 22.8 | 3.90 | 006 | 61 | ||
| 26.2 | 3.39* | 041 | 28 | ||
| 28.8 | 3.10* | 131 | 25 | ||
| 32.1 | 2.77* | 013 | 44 | ||
| 34.6 | 2.59 | 012 | 55 | ||
| 35.5 | 2.52* | 233 | 40 | ||
| 38.8 | 2.32 | 015 | 30 | ||
| 42.5 | 2.12* | 123 | 25 | ||
| 46.1 | 1.97 | 018 | 31 | ||
| 53.4 | 1.71* | 145 | 18 | ||
| 60.8 | 1.52 | 110 | 25 | ||
| 61.7 | 1.50 | 113 | 21 | ||
| НН | 11.4 | 7.80 | 003 | 100 |
[Mg2+]1 – x[Al3+]x(OH)2[(An)$_{{x/n}}^{ - }$]x ·
⋅ nH2O (СДГ Mg-Al) D(003) = 85 ± 5 ε = 3.44 |
| 22.8 | 3.90 | 006 | 58 | ||
| 34.6 | 2.59 | 012 | 36 | ||
| 38.9 | 2.32 | 015 | 18 | ||
| 45.5 | 1.99 | 018 | 15 | ||
| 60.4 | 1.53 | 110 | 22 | ||
| 61.8 | 1.50 | 113 | 19 | ||
| ВН-500 | 34.7 | 2.58 | 111 | 72 | MgO (Периклаз) D(200) = 33 ± 3 ε = 3.00 |
| 43.0 | 2.10 | 200 | 100 | ||
| 62.6 | 1.48 | 220 | 64 | ||
| НН-500 | 35.1 | 2.56 | 111 | 37 | MgO (Периклаз) D(200) = 33 ± 3 ε = 2.98 |
| 43.2 | 2.09 | 200 | 100 | ||
| 62.6 | 1.48 | 220 | 65 |
Морфологию частиц полученных образцов изучали с помощью электронно-растровой микроскопии. На рис. 4 представлены электронные изображения исходных образцов ВН и НН и прокаленных при 500°C. Так, у образца ВН наблюдаются крупные агрегаты различной формы, размер которых варьируется от 0.5 до 5 мкм. Те, в свою очередь, состоят из более мелких частиц, размер которых изменяется в диапазоне от 150 до 800 нм.
Рис. 4.
СЭМ-изображения образцов при различных увеличениях: (а, б) ВН; (в) ВН-500; (г, д) НН; (е) НН-500.

В случае образца НН также наблюдаются крупные агрегаты различной формы, размер которых варьируется от 1 до 15 мкм. Они состоят из более мелких чешуйчатых частиц, имеющих тенденцию к гексагональной огранке. Их размер изменяется от 500 до 700 нм в поперечнике, толщина варьируется в интервале 50–100 нм.
По данным электронной микроскопии, существенных изменений в морфологии и размерах частиц в результате прокаливания образцов ВН и НН при 500°С не наблюдается. Стоит отметить, что в работе [23] прокаливание СДГ Mg-Al при 500°C в течение 3 ч приводило к заметным изменениям в морфологии – полному исчезновению чешуйчатых частиц в образце.
Методом энергодисперсионной рентгеновской спектроскопии изучен элементный состав прокаленных образцов. Результаты приведены в табл. 2, из которой можно сделать вывод, что образец ВН-500 имеет состав Mg1.82AlO4.71, а образец НН-500 – Mg2.56AlO5.71. Отношение элементов Mg : Al для образца ВН-500 изменилось до 2 : 1, а для НН-500 осталось неизменным – 3 : 1. Избыточную атомную массу кислорода можно объяснить большим количеством поверхностных дефектов, на что указывается в работе [19].
Таблица 2.
Элементный состав образцов
| Образец | Атомная масса, % | |||
|---|---|---|---|---|
| Mg | Al | O | сумма | |
| ВН-500 | 24.1(8) | 13.2(7) | 62.5(5) | 100 |
| НН-500 | 27.6(2) | 10.7(8) | 61.6(0) | 100 |
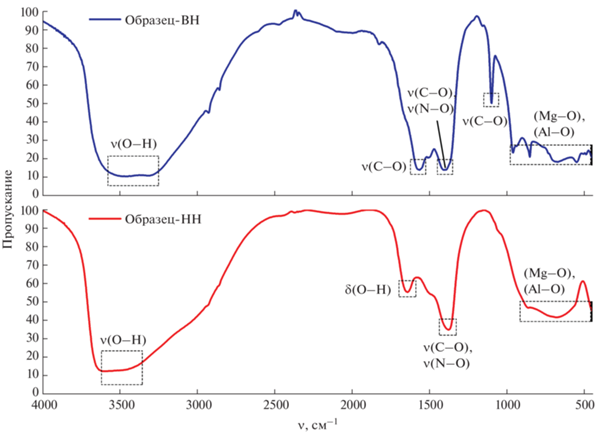
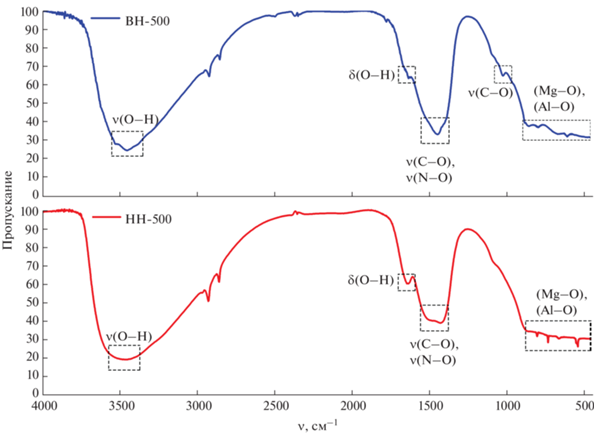
Результаты ИК-спектроскопии полученных образцов представлены на рис. 5, 6. Так, в спектрах образцов ВН и НН наблюдается широкая полоса с максимумом при 3450 см–1, соответствующая валентным колебаниям связей O–H, которые можно отнести как к гидроксильным группам, так и к молекулам воды, адсорбированным на поверхности, а также находящимся в межслоевом пространстве СДГ. Интенсивные полосы поглощения в области 1370–1400 см–1 в спектрах обоих образцов относятся к валентным симметричным колебаниям связей C–O и N–O, которые характеризуют карбонат- и нитрат-анионы в межслоевом пространстве [24–27]. Полоса поглощения при 1096 см–1 соответствует валентным колебаниям связи C–O [25, 28, 29]. Соседний максимум в интервале 1560–1630 см–1 характеризует деформационные колебания связи O–H [30–32]. Предположительно, он перекрывается полосой поглощения валентной асимметричной связи C–O [25, 26]. Максимумы в области низких частот (550–960 см–1) свидетельствуют о наличии колебаний в решетках октаэдрических пространств СДГ. К ним относятся различные колебания связей Mg–O и Al–O.
ИК-спектры прокаленных при 500°C образцов (рис. 6) фиксируют ослабление максимумов при 1430 см–1, все еще указывающих на наличие нитратов и карбонатов в молекуле смешанного оксида. Учитывая данные масс-спектрометрии при термолизе (рис. 1), следует отметить, что полное удаление анионов возможно лишь при более высоких температурах (⁓600°C). Похожий вывод сформулирован в работе [33]. Максимумы в областях 3450 и 1630 см–1, характеризующие колебания связи O–H, также заметно ослабевают, что объясняется частичным удалением молекул воды в ходе прокаливания.
На рис. 7 приведены кривые изотермы адсорбции-десорбции азота и распределение мезопор и микропор для всех полученных образцов. По классификации ИЮПАК, изотермы можно отнести к кривым физической сорбции типа IV(а) с петлей гистерезиса типа H3, что свидетельствует о наличии в структуре пластинчатых слоев, сеть пор которых составляют макропоры, не полностью заполненные поровым конденсатом [34]. Результаты анализов методом БЭТ приведены в табл. 3.
Рис. 7.
Кривые изотермы адсорбции-десорбции азота (a), распределения мезопор (б) и микропор по размерам (в).
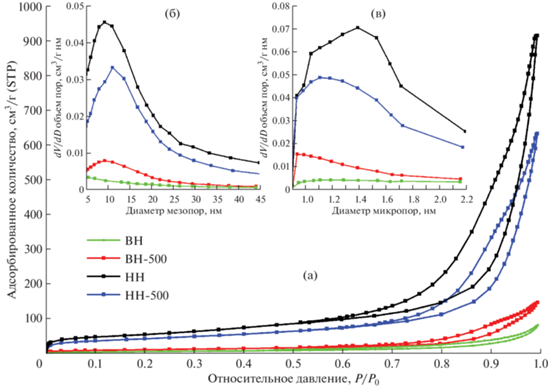
Таблица 3.
Удельная поверхность и поровые характеристики образцов
| Образец | Удельная поверхность, м2/г | Объем мезопор, см3/г | Объем микропор, см3/г |
|---|---|---|---|
| ВН | 22.80 | 0.0710 | 0.0049 |
| ВН-500 | 41.57 | 0.1481 | 0.0118 |
| НН | 197.74 | 0.9322 | 0.0630 |
| НН-500 | 153.46 | 0.6494 | 0.0474 |
Кривая распределения пор по размерам для всех образцов характеризуется наличием мезопор (рис. 7б) с диаметром пор от 5 до 45 нм и микропор (рис. 7в) диаметром от 0.9 до 2.2 нм. Для образца ВН удельная площадь поверхности, объем мезопор и микропор составили 22.8 м2/г, 0.0710 и 0.0049 см3/г соответственно. Образец ВН-500 обладает лучшими поровыми характеристиками, чем его предшественник, что указывает на благоприятное влияние термической обработки на формирование пористой структуры. Так, площадь поверхности увеличилась и составила 41.57 м2/г, объем мезо- и микропор составил 0.1481 и 0.0118 см3/г соответственно. Преобладают мезопоры диаметром 5–20 нм, наибольшее количество мезопор имеет диаметр 9 нм. Что касается микропор, то наблюдается преобладание пор диаметром от 0.9 до 1.5 нм. Наибольшее количество микропор составили поры диаметром 0.94 нм. Образцы, синтезированные по методу низкого насыщения, характеризуются более высокими значениями поровых характеристик. Так, для образца НН удельная площадь поверхности, объем мезопор и микропор составили 197 м2/г, 0.9322 и 0.0630 см3/г соответственно. Кривая распределения пор по размерам характеризуется наличием мезопор с диаметром пор от 5 до 45 нм и микропор диаметром от 0.9 до 2.2 нм. Наибольшее количество мезопор имеет диаметр 9 нм, микропор – 1.4 нм. После прокаливания при 500°C поровые характеристики, в отличие от образцов, синтезированных по методу высокого насыщения, уменьшились. Так, площадь поверхности образца НН-500 составила 153.46 м2/г, объем мезопор и микропор – 0.6494 и 0.0474 см3/г соответственно. Наибольшее количество мезопор составили поры с диаметром 11 нм, микропор – с диаметром 1.1 нм.
Наименьшие результаты поровых характеристик в методике высокого насыщения связаны, по-видимому, с большой скоростью зародышеобразования, при которой первичные частицы не успевают полностью сформироваться, а на их поверхности уже образуются новые продукты реакции. Это отчетливо видно из результатов исследований морфологии образцов, полученных методом электронно-растровой микроскопии.
ЗАКЛЮЧЕНИЕ
В ходе исследования проведено сравнение и выполнен анализ методов получения смешанных оксидов магния-алюминия на основе слоистых двойных гидроксидов соответствующих металлов. Обнаружено, что существенное влияние на поровые характеристики и формирование большей удельной поверхности оказывает скорость подачи раствора-осадителя.
Показано, что в случае высокого насыщения происходит образование смеси фаз слоистого двойного гидроксида Mg–Al и шелковита, что снижает сорбционные характеристики материала. Однако последующая термическая обработка при 500°C оказывает благоприятное воздействие на формирование пористой структуры.
Образец, синтезированный по методу низкого насыщения, представляет собой однофазный слоистый двойной гидроксид магния-алюминия, который характеризуется большей площадью поверхности по сравнению с двухфазным образцом, полученным методом высокого насыщения.
Установлено, что дальнейшее прокаливание при 500°C ведет к снижению пористости образца, полученного методом низкого насыщения, в то время как для образца, полученного методом высокого насыщения, пористость после прокаливания возрастает.
Список литературы
Hájek M. // Chem. Eng. J. 2015. V. 263. P. 160. https://doi.org/10.1016/j.cej.2014.11.006
Tanaka R., Ogino. I., Mukai S.R. // ACS Omega. 2018. V. 3. № 12. P. 16916. https://doi.org/10.1021/acsomega.8b02557
Kuljiraseth J. // Appl. Catal. B. 2019. V. 243. P. 415. https://doi.org/0.1016/j.apcatb.2018.10.073
Kocík J. // J. Mol. Catal. 2021. V. 516. P. 111946. https://doi.org/10.1016/j.mcat.2021.111946
Octavian D.P., Didier Tichit I.C.M. // Appl. Clay Sci. 2012. V. 61. P. 52. https://doi.org/10.1016/j.clay.2012.03.006
Dixit M., Manish D., Manish M. et al. // Chem. Eng. Ind. J. 2013. V. 19. № 2. P. 458. https://doi.org/10.1016/j.jiec.2012.08.028
Climent M.J., Corma A., Iborra S., Primo J. // J. Catal. 1994. V. 151. № 1. P. 60. https://doi.org/10.1006/jcat.1995.1008
Pérez C.N. // Química Nova. 2009. V. 32. № 9. P. 2341. https://doi.org/10.1590/S0100-40422009000900020
Hora L. // Catalysis Today. 2014. V. 223. P. 138. https://doi.org/10.1016/j.cattod.2013.09.022
Jorge P., Joseph L., François F. // Catalysis J. 2002. V. 211. № 1. P. 150. https://doi.org/10.1006/jcat.2002.3706
Bolognini M. // Catal. Today. 2002. V. 75. № 1–4. P. 103. https://doi.org/10.1016/S0920-5861(02)00050-0
Xiao Z. // Mol. Catal. 2017. V. 436. P. 1. https://doi.org/10.1016/j.mcat.2017.04.016
Cosano D., Hidalgo-Carrillo J., Esquivel D. et al. // J. Porous Mater. 2020. V. 27. № 2. P. 441. https://doi.org/10.1007/s10934-019-00825-8
Quesada J., Faba L., Diaz E., Ordonez S. // Appl. Catal. A. 2017. V. 542. P. 271. https://doi.org/10.1016/j.apcata.2017.06.001
He J., Wei M., Li B. et al. // Structure and Bonding Layered Double Hydroxides. 2006. V. 89–119. https://doi.org/10.1007/430/006
Горелик С.С., Расторгуев Л.Н., Скаков Ю.А. Рентгенографический и электронно-оптический анализ. М.: МИСИС, 1994. 328 с.
Kong L. // Chem. Eng. J. 2019. V. 371. P. 893. https://doi.org/10.1016/j.cej.2019.04.116
Leont`eva N.N., Drozdov V.D., Bel`skaya O.B., Cherepanova S.V. // Russ. J. Gen. Chem. 2020. V. 90. № 3. P. 509. https://doi.org/10.1134/S1070363220030275
Nguyễn K.D.H., Hoàng N.D. // Vietnam J. Sci. Technol. 2015. V. 52. № 6. P. 755. https://doi.org/10.15625/0866-708X/52/6/3636
Libor Č., Petr K., Lucie S., Martin H. // Top. Catal. 2013 V. 56. № 9–10. P. 586. https://doi.org/10.1007/s11244-013-0008-3
Débora L.C., Roberto R.A., Michelly T.R. et al. // Appl. Catal. A. 2012. V. 415–416. P. 96. https://doi.org/10.1016/j.apcata.2011.12.009
Kikhtyanin O., Capek L., Smoláková L. et al. // Ind. Eng. Chem. Res. 2017. V. 56. № 45. P. 13411. https://doi.org/10.1021/acs.iecr.7b03367
Masoud S., Afshin T.M., Seyed A.H., Sakineh M. // J. Water Environ. Nanotechnol. 2021. V. 6. № 1. P. 72. https://doi.org/10.22090/jwent.2021.01.007
Huang P.P. // RSC. Adv. 2015. V. 5. № 14. P. 10412. https://doi.org/10.1039/C4RA15160G
Varga G., Szabados M., Kukovecz Á. et al. // Mater. Res. Lett. 2020. V. 8. № 2. P. 68. https://doi.org/10.1080/21663831.2019.1700199
Abniki M., Moghimi A., Azizinejad F. // JSCS. 2020. V. 85. № 9. P. 1223. https://doi.org/10.2298/JSC191011004A
Chen L., Sun B., Wang X. et al. // J. Mater. Chem. B. 2013. V. 1. № 17. P. 2268. https://doi.org/10.1039/C3TB00044C
Huang P.-P., Cao C.-Y., Wei F. et al. // RSC Adv. 2015. V. 5. № 14. P. 10412. https://doi.org/10.1039/C4RA15160G
Cardinale A.M., Carbone C., Consani S. et al. // Crystals. 2020. V. 10. № 6. P. 443. https://doi.org/10.3390/cryst10060443
Hag-Soo K., Yohtaro Y., Je-Deok K. et al. // Solid State Ionics. 2010. V. 181. № 19–20. P. 883. https://doi.org/10.1016/j.ssi.2010.04.037
Wang X., Zhu X., Meng X. // RSC Adv. 2017. V. 7. № 56. P. 34984. https://doi.org/10.1039/c7ra04646d
Aisawa S., Nakada C., Hirahara H. et al. // Appl. Clay Science. 2019. V. 180. P. 105205. https://doi.org/0.1016/j.clay.2019.105205
Zaghouane-Boudiaf H., Boutahala M., Arab L. // Chem. Eng. J. 2012. V. 187. P. 142. https://doi.org/10.1016/j.cej.2012.01.112
Thommes M., Kaneko K., Neimark A.V. et al. // Pure Appl. Chem. 2015. V. 87. № 9–10. P. 1051. https://doi.org/10.1515/pac-2014-1117
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии