Журнал неорганической химии, 2023, T. 68, № 5, стр. 664-671
Экстракция РЗЭ(III) смесями 2,4,6-трис(диарилфосфорил)-1,3,5-триазинов и пикролоновой кислоты
А. Н. Туранов a, В. К. Карандашев b, О. И. Артюшин c, Е. В. Смирнова c, *, Г. В. Бодрин c, В. К. Брель c
a Институт физики твердого тела им. Ю.А. Осипьяна РАН
142432 Черноголовка, ул. Академика Осипьяна, 2, Россия
b Институт проблем технологии микроэлектроники и особо чистых материалов РАН
142432 Черноголовка, ул. Академика Осипьяна, 6, Россия
c Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119334 Москва, ул. Вавилова, 28, Россия
* E-mail: matveeva@gmail.com
Поступила в редакцию 09.12.2022
После доработки 19.01.2023
Принята к публикации 20.01.2023
- EDN: SNIRMA
- DOI: 10.31857/S0044457X22602139
Аннотация
Обнаружен значительный синергетический эффект при экстракции ионов РЗЭ(III) из хлоридных растворов смесями пикролоновой кислоты и трис(диарилфосфорил)-1,3,5-триазинов в 1,2-дихлорэтане, связанный с образованием гидрофобных смешанолигандных комплексов РЗЭ(III). Определены параметры экстракционного равновесия и стехиометрия образующихся комплексов. Изучено влияние на них состава водной фазы, природы органического растворителя и строения экстрагента. Наибольший синергетический эффект наблюдается в системе с трис(дитолилфосфорил)-1,3,5-триазином.
ВВЕДЕНИЕ
Редкоземельные элементы (РЗЭ) в настоящее время чрезвычайно востребованы как в индивидуальном состоянии, так и в виде разнообразных соединений. Находившие ранее применение только в военной технике, сейчас они применяются как в различных отраслях промышленности, так и в бытовой технике, а также в медицине для получения контрастных соединений для компьютерной томографии и радиофармацевтических препаратов, в том числе для лечения онкологических заболеваний. Рост потребления РЗЭ требует наращивания их добычи, в том числе из сырья с низким их содержанием и техногенных отходов [1–3]. Наиболее эффективными при выделении и разделении РЗЭ в настоящее время являются экстракционные технологии с использованием нейтральных моно- и полидентатных соединений [4–8]. Среди фосфорорганических экстрагентов по своей эффективности заметно выделяются фосфоразотные соединения, такие как фосфорилированные пиридины [9, 10] и пиразины [11]. Ближайшие их аналоги – синтетически более доступные трис(диарилфосфорил)-1,3,5-триазины – существенно уступают им в экстракционной активности [12]. Одним из способов увеличения продуктивности процесса извлечения РЗЭ(III) из водных растворов является использование смеси экстрагентов. За счет синергетического эффекта такие системы позволяют применять более доступные и экономически выгодные реагенты с отличной конечной результативностью [13]. Так, высокий синергетический эффект был ранее обнаружен при экстракции РЗЭ(III) смесями кислотных соединений – β-дикетонов или ацилпиразолонов с нейтральными донорно-активными реагентами [14]. Поскольку с увеличением кислотных свойств экстрагентов возрастает их комплексообразующая способность [15], хорошего отклика следовало ожидать от использования 1-п-нитрофенил-3-метил-4-нитро-5-пиразолона (пикролоновой кислоты (HP), pKa = 2.52 [16]), содержащего в молекуле две нитрогруппы (для сравнения у 1-фенил-3-метил-4-бензоил-5-пиразолона pKa = 3.92 [15]). Действительно, HP обладает высокой комплексообразующей способностью в отношении различных ионов металлов, что приводит к значительному увеличению экстракции РЗЭ(III) при использовании смесей HP с трибутилфосфатом, триалкилфосфиноксидами [16, 17], карбамоилметилфосфиноксидами (КМФО) [18], тетрафенилметилендифосфиндиоксидом [19], а также фосфорилированными азаподандами [20]. Вместе с тем изучение экстракции РЗЭ(III) растворами HP в смесях со сравнительно легкодоступными и недорогими трис(диарилфосфорил)-1,3,5-триазинами ранее не проводилось.
Представляло интерес оценить возможность положительного отклика при использовании растворов триазинов 1, 2, а также близких им по структуре трифосфорилированных пиридина 3 и бензола 4 в органических растворителях при экстракции РЗЭ(III) из хлоридных растворов как в индивидуальном состоянии, так и в смесях с HP. В настоящей работе представлены результаты таких исследований.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1H и 13C регистрировали в растворах CDCl3 на приборе Bruker Avance 400 (1H, 400.13 и 13C, 100.61 МГц) при использовании сигнала остаточных протонов дейтерированного растворителя в качестве внутреннего эталона. Спектры ЯМР 31P регистрировали на приборе Bruker Avance 300 (121.49 МГц) в растворах CDCl3, используя в качестве внешнего стандарта 85%-ную Н3РО4. Для записи ИК-спектров (таблетки с KBr) был использован инфракрасный Фурье-спектрометр Magna-IR 750 (Nicolet), разрешение 2 см–1, число сканов 128.
Пикролоновую кислоту (Chemapol, Польша) и органические растворители отечественного производства (1,2-дихлорэтан, хлороформ и толуол марки “х. ч.” или “ч. д. а.”) использовали без дополнительной очистки. Растворы экстрагентов в органических растворителях готовили по точным навескам.
Синтез соединения 4 описан в работе [21]; 2,4,6-трис(диарилфосфорил)-1,3,5-триазины 1, 2 были получены реакцией Арбузова из соответствующих эфиров кислот трехвалентного фосфора с цианурхлоридом по методике [22] и имели температуры плавления, совпадающие с литературными данными [12]. Поскольку в литературе отсутствуют спектральные характеристики данных соединений, мы приведем их ниже.
2,4,6-Трис(дифенилфосфорил)-1,3,5-триазин (1). 31Р ЯМР-спектр (δP, м.д.): 23.08. 1H ЯМР-спектр (δН, м.д.): 7.71–7.43, 7.55–7.57, 7.75–7.79 (все м, 12H + 6H + 12H, 6C6H5). 13С ЯМР-спектр (δС, м.д.): 128.42 (д, ipso-С в C6H5P, 1JPC = 107.5 Гц); 128.50 (д, м-С в C6H5P, 3JPC = 13.0 Гц); 132.21 (д, o-С в C6H5P, 2JPC = 10.0 Гц); 132.67 (с, п-С в C6H5P); 177.40 (дт, C(2), C(4), С(6), 1JPC = 138.9 Гц, 3JPC = = 8.7 Гц). ИК-спектр (KBr), ν, см–1: 539, 696, 1118, 1197 (P=O), 1438, 1482, 3054.
2,4,6-Трис(п-толилфосфорил)-1,3,5-триазин (2). 31Р ЯМР-спектр (δP, м.д.): 20.33. 1H ЯМР-спектр (δН, м.д.): 2.41 (с, 18H, CH3); 7.19–7.21 (м, 12H, м-СH в C6H4); 7.66 (дд, 12H, о-СH в C6H4, 3JНН = 8.0 Гц, 3JHP = 11.8 Гц). 13С ЯМР-спектр (δС, м.д.): 21.71 (CH3); 125.64 (д, ipso-С в C6H4P, 1JPC = = 109.3 Гц); 129.26 (д, м-С в C6H4P, 3JPC = 13.3 Гц); 132.45 (д, o-С в C6H4P, 2JPC = 10.3 Гц); 143.24 (с, CH3–С в C6H4P); 176.97 (дт, C(2), C(4), С(6), 1JPC = 137.9 Гц, 3JPC = 8.5 Гц). ИК-спектр (KBr), ν, см–1: 535, 665, 806, 1119, 1199 (P=O), 1482, 1602, 3055.
2,4,6-Трис(дифенилфосфорил)пиридин (3) получен в две стадии через соответствующий фосфин:
1. 2,4,6-Трис(дифенилфосфинил)пиридин. К раствору дифенилфосфина (2.45 г, 13.2 ммоль) в 30 мл ТГФ прибавляли натрий (0.30 г, 13.2 ммоль), раскатанный в фольгу. Перемешивали при 20°C до полного растворения натрия (⁓4 ч), после чего охлаждали до –10°C и прибавляли за 20 мин раствор 2,4,6-трифторпиридина (0.47 г, 3.53 ммоль) в 5 мл ТГФ. Перемешивали при –10°C 2 ч, после чего охлаждение снимали и оставляли на ночь. Перемешивали 3 ч при 60°C, охлаждали до 20°C и прибавляли 3 мл метанола, затем 10 мл воды, после чего отгоняли растворители в вакууме. Остаток перекристаллизовывали из смеси бензол–этанол (1 : 1), получали 1.9 г (95%) фосфина, tпл = 135–136°C. Найдено, %: C 77.64; H 4.95; N 2.03; P 14.59. Вычислено для С41Н32NР3, %: C 77.96; H 5.11; N 2.22; P 14.71. 31Р ЯМР-спектр (δP, м.д.): –5.96 (P(2)–C(4)); –3.32 (P(1)–C(2) и P(3)–C(6)). 1H ЯМР-спектр (δН, м.д.): 6.89 (д, 2H, C5H2N, 3JHP = 6.3 Гц); 7.18–7.35 (м, 30H, 6C6H5). 13С ЯМР-спектр (δС, м.д.): 128.18 (д, м-С в C6H5P(1) и C6H5P(3), 3JPC = 7.6 Гц); 128.56 (д, м-С в C6H5P(2), 3JPC = 7.5 Гц); 128.64 (с, п-С в C6H5P(1) и C6H5P(3)); 129.23 (с, п-С в C6H5P(2)); 129.47 (дд, C(3), C(5), 2JPC = 22.0 Гц, 2JPC = 15.1 Гц); 133.84 (д, o-С в C6H5P(2), 2JPC = = 20.4 Гц); 133.98 (д, o-С в C6H5P(1) и C6H5P(3), 2JPC = 20.0 Гц); 134.25 (д, ipso-С в C6H5P(2), 1JPC = = 10.1 Гц); 135.94 (д, ipso-С в C6H5P(1) и C6H5P(3), 1JPC = 10.9 Гц); 148.11 (дт, C(4), 1JPC = 20.1 Гц, 3JPC = 3.1 Гц); 163.53 (дд, C(2), C(6), 1JPC = 10.5 Гц, 3JPC = 2.5 Гц). ИК-спектр (KBr), ν, см–1: 537, 697, 1120, 1187 (P=O), 1204, 1437, 3056.
2. 2,4,6-Трис(дифенилфосфорил)пиридин. К раствору 2,4,6-трис(дифенилфосфинил)пиридина (1.4 г, 2.2 ммоль) в 20 мл CHCl3 прибавляли в течение 15 мин 30%-ную H2O2 (1.5 мл, 13.2 ммоль), при этом реакционная смесь разогревалась до 40°C. Перемешивали при 20°C 2 ч, прибавляли 20 мл воды, органический слой отделяли и сразу упаривали в вакууме досуха. Остаток сушили в вакууме до постоянного веса. Выход 1.5 г (колич.), tпл = 220–221°C. Найдено, %: C 72.33; H 4.86; N 2.15; P 13.71. Вычислено для С41Н32NO3Р3, %: C 72.46; H 4.75; N 2.06; P 13.67. 31Р ЯМР-спектр (δP, м.д.): 20.47, 20.49 (P(1)–C(2), P(3)–C(6)); 25.95 (P(2)–C(4)). 1H ЯМР-спектр (δН, м.д.): 7.33–7.36, 7.51–7.62, 7.68–7.73 (все м, 8H + 18H + 4H, 6C6H5); 8.62–8.66 (м, 2H, C5H2N). 13С ЯМР-спектр (δС, м.д.): 128.33 (д, м-С в C6H5P(1) и C6H5P(3), 3JPC = 12.7 Гц); 128.90 (д, м-С в C6H5P(2), 3JPC = 12.5 Гц); 129.68 (д, ipso-С в C6H5P(2), 1JPC = 106.3 Гц); 130.43 (ддд, C(3), C(5), 2JPC = 20.5 Гц, 2JPC = 8.3 Гц, 4JPC = 3.0 Гц); 130.98 (д, ipso-С в C6H5P(1) и C6H5P(3), 1JPC = 105.1 Гц); 131.84 (д, o-С в C6H5P(1) и C6H5P(3), 2JPC = 10.0 Гц); 131.86 (д, o-С в C6H5P(2), 2JPC = 10.3 Гц);131.95 (уш. с, п-С в C6H5P(1) и C6H5P(3)); 132.76 (уш. с, п-С в C6H5P(2)); 144.65 (дт, C(4), 1JPC = 91.2 Гц, 3JPC = 7.3 Гц); 157.98 (ддд, C(2), С(6), 1JPC = 125.7 Гц, 3JPC = 16.5 Гц, 3JPC = 7.6 Гц). ИК-спектр (KBr), ν, см–1: 537, 697, 1120, 1187 (P=O), 1204, 1437, 3056.
Исходные водные растворы хлоридов РЗЭ(III) готовили растворением соответствующих солей в воде с последующим добавлением растворов HCl до требуемой концентрации. Все ионы РЗЭ(III) (кроме Pm) присутствовали в растворе, исходная концентрация каждого из них составляла 2 × 10–6 моль/л.
Опыты по экстракции проводили в пробирках с пришлифованными пробками при температуре 22 ± 1°С, соотношение объемов органической и водной фаз составляло 1 : 1. Контакт фаз осуществляли в роторном миксере со скоростью вращения 60 об/мин в течение 1 ч. Предварительно было установлено, что этого времени достаточно для установления постоянных значений коэффициентов распределения.
Концентрацию РЗЭ(III) в исходных и равновесных водных растворах определяли масс-спектральным методом с ионизацией пробы в индуктивно связанной плазме с использованием масс-спектрометра XSeries II (Thermo Scientific, США). Концентрацию РЗЭ(III) в органической фазе определяли как разницу между их концентрациями до и после экстракции. Величины DLn рассчитывали как отношение концентраций РЗЭ(III) в равновесных органической и водной фазах. Погрешность определения DLn не превышала 10%. Концентрацию HCl в равновесных водных фазах определяли методом потенциометрического титрования раствором NaOH.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предварительно установлено, что РЗЭ(III) практически не экстрагируются 0.01 М растворами соединений 1–4 и HP в дихлорэтане из 0.3 М раствора HCl (значения величин коэффициентов распределения РЗЭ(III) (DLn) не превышают 10–2). В то же время при использовании смесей соединений 1–4 и HP наблюдается значительное увеличение экстракции ионов РЗЭ(III) в органическую фазу. Прослеживаемый синергетический эффект может быть связан с увеличением гидрофобности экстрагируемых комплексов РЗЭ(III) за счет вытеснения молекул воды из координационной сферы гидратированных пикролонатов LnP3 · 3H2O [23] лигандами 1–4.
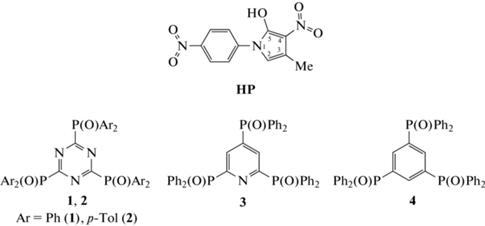
При экстракции смесями соединений 1–4 и HP в дихлорэтане отмечена зависимость значений DLn от атомного номера (Z) РЗЭ (рис. 1). Наблюдаемое уменьшение величины коэффициентов распределения с увеличением Z в ряду РЗЭ(III) от La(III) к Lu(III) может быть связано с увеличением энергии гидратации ионов Ln3+ по мере увеличения Z вследствие уменьшения их ионных радиусов [24].
Рис. 1.
Коэффициенты распределения РЗЭ(III) при экстракции из 0.3 М растворов HCl смесями соединений 1–4 (0.01 моль/л) и пикролоновой кислоты (0.01 моль/л) в дихлорэтане.
Структура соединений 1–4 оказывает существенное влияние на эффективность экстракции РЗЭ(III) смесями этих соединений и HP. 1,3,5-Трис(дифенилфосфорил)бензол 4 менее эффективен при экстракции, чем 2,4,6-трис(дифенилфосфорил)пиридин 3 (рис. 1). Фосфорилзамещенные триазины 1 и 2 в смеси с HP экстрагируют РЗЭ(III) значительно более эффективно, чем фосфорилзамещенный пиридин 3. При этом соединение 2 с п-толильными заместителями при атомах фосфора проявляет более высокую экстракционную способность, чем соединение 1 с фенильными заместителями (рис. 1), что связано с повышением донорной способности фосфорильного атома кислорода в молекуле экстрагента при снижении электроотрицательности заместителей при атомах фосфора [25]. Кроме того, более высокая липофильность лиганда 2 способствует повышению гидрофобности экстрагируемых комплексов РЗЭ(III).
Проведено сравнение значений DLn при экстракции РЗЭ(III) из 0.1 М раствора HCl смесями HP с фосфорилзамещенным триазином 2 и смесями НР с фосфорилзамещенным азаподандом BuN[CH2CH2OCH2CH2P(O)Ph2]25 [20], КМФО Ph2P(O)CH2C(O)NBu26 [19], а также с монодентатным триоктилфосфиноксидом (ТОФО) в дихлорэтане. Как видно из данных табл. 1, экстракционная способность соединения 2 по отношению к La(III)–Ho(III) в системе с НР выше, чем азаподанда 5 и значительно превышает таковую ТОФО, что, вероятно, обусловлено полидентатной координацией фосфорилзамещенных триазинов 1, 2 с ионами РЗЭ(III) в процессе образования смешанных комплексов Ln(III). Более того, рост величины фактора разделения La(III) и Lu(III) (βLa/Lu = DLa/DLu) в ряду соединений ТОФО (0.6) < 6 (1.7) < 5 (5.2) < 2 (249) указывает на высокую селективность экстракции РЗЭ(III) соединением 2.
Таблица 1.
Коэффициенты распределения РЗЭ(III) при экстракции из 0.1 М растворов HCl растворами смеси фосфорилсодержащих экстрагентов (0.001 моль/л) и HP (0.003 моль/л) в 1,2-дихлорэтане
Весомый вклад в продуктивность экстракции РЗЭ(III) смесями HP и фосфорилзамещенных триазинов вносит природа органического растворителя. При экстракции растворами HP и соединения 2 величины DLn возрастают по мере снижения полярности органических растворителей в ряду 1,2-дихлорэтан < хлороформ < толуол (табл. 2). Похожая тенденция наблюдалась ранее при экстракции смесями пикролоновой кислоты и фосфорилзамещенных азаподандов [20].
Таблица 2.
Коэффициенты распределения РЗЭ(III) при экстракции из 0.3 М растворов HCl растворами смеси соединения 2 (0.005 моль/л) и HP (0.005 моль/л) в органических растворителях
| Растворитель | DLn | ||||||
|---|---|---|---|---|---|---|---|
| La | Nd | Eu | Tb | Ho | Tm | Lu | |
| Толуол | 398 | 363 | 151 | 47.8 | 13.8 | 6.3 | 2.8 |
| Хлороформ | 56.2 | 50.6 | 19.1 | 5.6 | 1.8 | 0.63 | 0.28 |
| 1,2-Дихлорэтан | 40.7 | 39.8 | 14.1 | 3.32 | 0.74 | 0.26 | 0.11 |
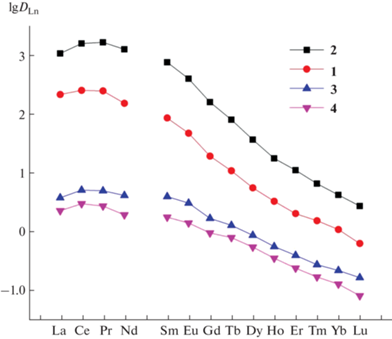
Кислотность водной фазы имеет сильное влияние на эффективность экстракции РЗЭ(III) смесями нейтральных донорно-активных веществ и кислотных хелатообразующих реагентов [15]. В случае экстракции РЗЭ(III) смесью HP и триазина 2 наблюдается уменьшение величины коэффициентов распределения с ростом концентрации HCl в равновесной водной фазе (рис. 2). При этом для всех РЗЭ(III) угловой наклон зависимости lgDLn–lg[HCl] близок к –3, что соотносится с переходом трех ионов H+ в водную фазу в процессе катионообменной экстракции.
Рис. 2.
Зависимость коэффициентов распределения РЗЭ(III) от концентрации HCl в равновесной водной фазе при экстракции смесью соединения 2 (0.01 моль/л) и HP (0.01 моль/л) в дихлорэтане.
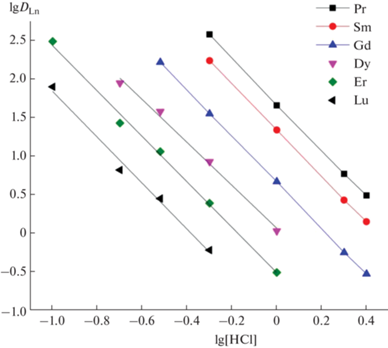
При постоянной концентрации соединения 2 в органической фазе и постоянной концентрации HCl в водной фазе тангенс угла наклона зависимости lgDLn–lg[HP] близок к 3 (рис. 3), что соответствует участию трех молекул HP в процессе экстракции ионов РЗЭ(III).
Рис. 3.
Зависимость коэффициентов распределения РЗЭ(III) от концентрации пикролоновой кислоты в дихлорэтане, содержащем 0.01 моль/л соединения 2, при экстракции из 0.3 М раствора HCl.
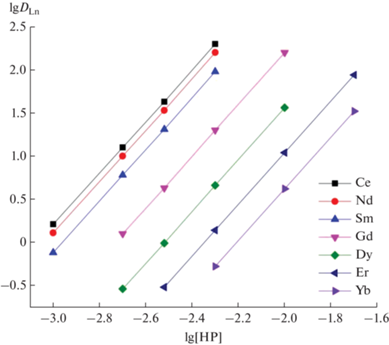
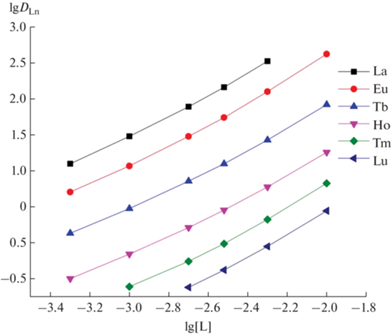
Стехиометрическое соотношение РЗЭ(III) : 2 (L) в экстрагируемых комплексах РЗЭ(III) определено методом сдвига равновесия. Нецелочисленный (1.2–1.5) угловой наклон зависимостей lgDLn–lg[L] при постоянной концентрации пикролоновой кислоты в органической фазе и HCl в водной фазе (рис. 4) указывает на извлечение комплексов с соотношением РЗЭ(III) : L = 1 : 1 и 1 : 2, в то время как соотношение Eu(III) : ТОФО при экстракции Eu(III) смесями HP и ТОФО в хлороформе составляет 1 : 2 [17]. Наблюдаемое уменьшение числа лигандов 2 в составе экстрагируемых комплексов РЗЭ(III) может говорить о бóльшей дентатности фосфорилированных триазинов по сравнению с ТОФО.
Рис. 4.
Зависимость коэффициентов распределения РЗЭ(III) от концентрации соединения 2 в дихлорэтане, содержащем 0.01 моль/л HP, при экстракции из 0.3 М раствора HCl.
С учетом найденных стехиометрических коэффициентов межфазное распределение ионов РЗЭ(III) в процессе их экстракции растворами смесей HP и фосфорилсодержащих триазинов может быть описано уравнениями:
(1)
${\text{Ln}}_{{{\text{(в)}}}}^{{{\text{3 + }}}} + {\text{3H}}{{{\text{P}}}_{{{\text{(o)}}}}} + {{{\text{L}}}_{{{\text{(o)}}}}} \rightleftarrows {\text{Ln}}{{{\text{P}}}_{{\text{3}}}}{{{\text{L}}}_{{{\text{(о)}}}}} + {\text{3H}}_{{{\text{(в)}}}}^{ + }{\text{,K}}_{1}^{{{\text{Ln}}}}{\text{,}}$(2)
${\text{Ln}}_{{{\text{(в)}}}}^{{3 + }} + {\text{3H}}{{{\text{P}}}_{{{\text{(o)}}}}} + {\text{2}}{{{\text{L}}}_{{{\text{(o)}}}}} \rightleftarrows {\text{Ln}}{{{\text{P}}}_{{\text{3}}}}{{{\text{L}}}_{{{\text{2(о)}}}}} + {\text{3H}}_{{{\text{(в)}}}}^{ + }{\text{,}}\,\,{\text{K}}_{2}^{{{\text{Ln}}}}{\text{,}}$(3)
${{{\text{D}}}_{{{\text{Ln}}}}} = \left( {K_{1}^{{{\text{Ln}}}}{{{\left[ {\text{L}} \right]}}_{{{\text{(о)}}}}} + K_{2}^{{{\text{Ln}}}}\left[ {\text{L}} \right]_{{{\text{(о)}}}}^{2}} \right){\text{ }}\left[ {{\text{HP}}} \right]_{{{\text{(о)}}}}^{3}\left[ {{{{\text{H}}}^{{\text{ + }}}}} \right]_{{{\text{(в)}}}}^{{ - 3}}{\text{.}}$В табл. 3 приведены рассчитанные методом наименьших квадратов по уравнению (3) константы экстракции РЗЭ(III) смесями HP и фосфорилсодержащего триазина 2 в дихлорэтане. Там же для сравнения приведены константы экстракции РЗЭ(III) смесями HP и диоксида Ph2P(O)CH2P(O)Ph27 [19]. Можно видеть, что значения KLn при экстракции смесями HP и диоксида 7 выше, чем в системе HP–2, что указывает на более высокую экстракционную способность диоксида 7. Однако в системе с фосфорилсодержащим триазином 2 селективность экстракции РЗЭ(III) значительно выше. Величина βLa/Lu при экстракции смесью 2 и HP в дихлорэтане превышает 200, тогда как в системе с 7 она не превышает 8 [19].
Таблица 3.
Константы экстракции смешанных комплексов РЗЭ(III) с HP и соединениями 2 и 7 состава LnP3L и LnP3L2 в дихлорэтане
| Ln(III) | HP–2 | HP–7 | ||
|---|---|---|---|---|
| lgK1Ln | lgK2Ln | lgK1Ln [19] | lgK2Ln [19] | |
| La | 9.71 ± 0.05 | 12.34 ± 0.05 | 9.21 ± 0.04 | 12.80 ± 0.06 |
| Ce | 9.81 ± 0.05 | 12.54 ± 0.05 | 9.81 ± 0.05 | 12.98 ± 0.06 |
| Pr | 9.78 ± 0.05 | 12.52 ± 0.05 | 10.04 ± 0.05 | 12.92 ± 0.06 |
| Nd | 9.57 ± 0.06 | 12.46 ± 0.06 | 10.06 ± 0.05 | 12.81 ± 0.06 |
| Sm | 9.41 ± 0.05 | 12.21 ± 0.05 | 10.34 ± 0.05 | 12.95 ± 0.06 |
| Eu | 9.39 ± 0.05 | 11.73 ± 0.05 | 10.29 ± 0.05 | 12.85 ± 0.06 |
| Gd | 8.96 ± 0.06 | 11.51 ± 0.06 | 10.06 ± 0.05 | 12.46 ± 0.06 |
| Tb | 8.78 ± 0.04 | 11.16 ± 0.04 | 10.14 ± 0.05 | 12.59 ± 0.06 |
| Dy | 8.46 ± 0.05 | 10.81 ± 0.05 | 10.02 ± 0.05 | 12.45 ± 0.06 |
| Ho | 8.15 ± 0.04 | 10.49 ± 0.04 | 9.91 ± 0.05 | 12.20 ± 0.06 |
| Er | 7.88 ± 0.05 | 10.31 ± 0.05 | 9.73 ± 0.05 | 12.06 ± 0.06 |
| Tm | 7.65 ± 0.04 | 10.24 ± 0.04 | 9.64 ± 0.05 | 11.91 ± 0.06 |
| Yb | 7.58 ± 0.05 | 10.09 ± 0.05 | 9.51 ± 0.05 | 11.72 ± 0.06 |
| Lu | 7.47 ± 0.04 | 9.66 ± 0.04 | 9.31 ± 0.04 | 11.48 ± 0.06 |
ЗАКЛЮЧЕНИЕ
Экстракция ионов РЗЭ(III) пикролоновой кислотой существенно возрастает в присутствии фосфорилзамещенных триазинов за счет синергетического эффекта, обусловленного образованием гидрофобных смешанолигандных комплексов РЗЭ(III) LnP3L и LnP3L2. По эффективности и селективности экстракции РЗЭ(III) фосфорилсодержащие триазины значительно превосходят КМФО и ТОФО.
Список литературы
Neves H.P., Ferreira G.M.D., Ferreira G.M.D. et al. // Sep. Pur. Technol. 2022. V. 282. 120064. https://doi.org/10.1016/j.seppur.2021.120064
Zhou B.L., Li Z.X., Chen C.C. // Minerals. 2017. V. 7. P. 203. https://doi.org/10.3390/min7110203
Moalla R., Gargouri M., Khmiri F. et al. // Environ. Eng. Res. 2018. V. 23. P. 36. https://doi.org/10.4491/eer.2017.055
Liu T., Chen J. // Sep. Pur. Technol. 2021. V. 276. 119263. https://doi.org/10.1016/j.seppur.2021.119263
Li D. // J. Rare Earths. 2019. V. 37. P. 468. https://doi.org/10.1016/j.jre.2018.07.016
Soukeur A., Szymczyk A., Berbar Y. et al. // Sep. Pur. Technol. 2021. V. 256. 117857. https://doi.org/10.1016/j.seppur.2020.117857
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev. 2017. V. 46. № 23. P. 7229. https://doi.org/10.1039/C7CS00574A
Сафиулина А.М., Борисова Н.Е., Лизунов А.В. и др. // Журн. неорган. химии. 2022. Т. 67. С. 513.
Matveev P.I., Borisova N.E., Andreadi N.G. et al. // Dalton Trans. 2019. V. 48. P. 2554. https://doi.org/10.1039/C8DT04729D
Artyushin O.I., Vologzhanina A.V., Turanov A.N. et al. // Mendeleev Commun. 2021. V. 31. P. 306. https://doi.org/10.1016/j.mencom.2021.04.009
Smirnova E.V., Artyushin O.I., Vologzhanina A.V. et al. // Mendeleev Commun. 2022. V. 32. P. 664. https://doi.org/10.1016/j.mencom.2022.09.032
Чмутова М.К., Матросов Е.И., Иванова Л.А. и др. // Радиохимия. 1993. Т. 35. № 1. С. 70.
Bond A.H., Dietz M.L., Chiarizia R. // Ind. Eng. Chem. Res. 2000. V. 39. P. 3442. https://doi.org/10.1021/ie000356j
Atanassova M., Kurteva V. // RSC Advances. 2016. V. 6. P. 11303. https://doi.org/10.1039/C5RA22306G
Золотов Ю.А., Кузьмин Н.М. Экстракция металлов ацилпиразолонами. М.: Наука, 1977. 140 с.
Ali A. // Radiochim. Acta. 2004. V. 92. P. 925.
Habib-ur-Rehman, Ali A., Waquar F. // J. Radioanal. Nucl. Chem. 2015. V. 303. P. 139. https://doi.org/10.1007/s10967-014-3440-3
Туранов А.Н., Карандашев В.К., Шарова Е.В. и др. // Радиохимия. 2013. Т. 55. № 2. С. 156.
Turanov A.N., Karandashev V.K. // Solv. Extr. Ion Exch. 2017. V. 35. P. 104. https://doi.org/10.1080/07366299.2017.1288044
Туранов А.Н., Карандашев В.К., Харламов А.В. и др. // Журн. неорган. химии. 2018. Т. 63. С. 1652.
Туранов А.Н., Карандашев В.К., Артюшин О.И. и др. // Журн. общ. химии. 2022. Т. 92. № 8. С. 1289.
Hewertson W., Shaw R.A., Smith B.C. // J. Chem. Soc. 1963. P. 1670.
Osman M.M., Abou Ali S.A., Ali G.A. // Pak. J. Sci. Ind. Res. 1984. V. 276. P. 85.
Nash K.L., Jensen M.P. // Sep. Sci. Technol. 2001. V. 36. № 5–6. P. 1257. https://doi.org/10.1081/SS-100103649
Розен А.М., Крупнов Б.В. // Успехи химии. 1996. Т. 65. № 11. С. 1052.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии