Журнал неорганической химии, 2023, T. 68, № 5, стр. 658-663
Экстракция актинидов и лантанидов(III) из азотнокислых растворов смесями N-(дифенилфосфорил)-N'-пропилмочевин с ω-азотсодержащими радикалами и динонилнафталинсульфокислоты
А. Н. Туранов a, В. К. Карандашев b, Т. В. Баулина c, Е. И. Горюнов c, В. К. Брель c, *
a Институт физики твердого тела им. Ю.А. Осипьяна РАН
142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 2, Россия
b Институт проблем технологии микроэлектроники и особо чистых материалов РАН
142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 6, Россия
c Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119334 Москва, ул. Вавилова, 28, стр. 1, Россия
* E-mail: v_brel@mail.ru
Поступила в редакцию 07.11.2022
После доработки 10.01.2023
Принята к публикации 13.01.2023
- EDN: SMRQXL
- DOI: 10.31857/S0044457X22601900
Аннотация
Проведены исследования, связанные с экстракцией ионов урана, тория и лантанидов(III) из азотнокислых сред смесями динонилнафталинсульфокислоты и N-(дифенилфосфорил)-N'-н-пропилмочевин, содержащих в своем составе имидазолильный, диэтиламинный, пирид-2-ил и 2-оксопирролидиновый фрагменты, в органических растворителях. Обнаружен значительный синергетический эффект при экстракции ионов металлов смесями динонилнафталинсульфокислоты и N-(дифенилфосфорил)-N'-[3-(2-оксопирролидино)пропил]мочевины. Установлена стехиометрия извлекаемых комплексов. Оценено влияние строения используемого экстрагента, природы органического разбавителя и содержания HNO3 в водной фазе на эффективность экстракции катионов металлов в органическую среду.
ВВЕДЕНИЕ
В технологических процессах переработки отработанного ядерного топлива ключевыми этапами являются процессы экстракции и разделения актинидов и лантанидов с использованием полидентатных фосфорорганических соединений различного строения [1–7], в частности, оксидов (N,N-диалкилкарбамоилметил)диарилфосфинов (КМФО) и их производных [8–10].
В последние десятилетия вырос интерес к использованию в экстракционной практике фосфорилмочевин R2P(O)NHC(O)NHR' [11–13] – соединений, молекула которых содержит Р=О- и C=O-группы, соединенные имидным линкером. На экстракционную способность таких реагентов существенно влияет природа функциональных групп у атома фосфора и терминального атома азота. Соединения с фенильными радикалами при атоме фосфора проявляют значительно более высокую экстракционную способность при извлечении актинидов и лантанидов из азотнокислых растворов, чем их аналоги, имеющие алкильные, алкоксильные или ароксильные радикалы [13]. Среди реагентов этого класса соединение Ph2P(O)NHC(O)NHC8H17-н проявляет наиболее высокую эффективность по отношению к U(VI), Th(IV) и Eu(III) [13]. Отмечалось, что экстракционная способность этого соединения выше, чем его аналога с –CH2– линкером между функциональными группами Р=О и C=O [13]. Результаты квантово-химического моделирования показали, что это связано с уменьшением торсионного угла между функциональными Р=О- и C=O-группами в комплексах Ph2P(O)NHC(O)NHC8H17-н с ионами металлов и увеличением ширины зоны молекулярных электростатических полей вокруг групп Р=О и C=O по сравнению с КМФО [13].
При модификации дифенилфосфорилмочевин путем введения азотсодержащих фрагментов в алкильный радикал при терминальном атоме азота происходит снижение экстракционной эффективности соединений I–IV при извлечении актинидов и лантанидов из растворов азотной кислоты [14]. Известно, что аналоги соединений I–III с –CH2– линкером между функциональными группами Р=О и C=O образуют гидрофобные комплексы с динонилнафталинсульфокислотой (ДННСК), которые экстрагируют лантаниды(III) из азотнокислых растворов [15].
Цель настоящей работы – исследование влияния ДННСК на эффективность экстракции актинидов и лантанидов соединениями I–IV из азотнокислых растворов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединения I–IV получали по ранее описанной методике [14]. В качестве органических растворителей использовали хлороформ, нитробензол и 1,2-дихлорэтан марки “х. ч.” (Вектон). Динонилнафталинсульфокислоту (Sigma-Aldrich) очищали по методике [16]. Растворы экстрагентов готовили по точным навескам.
Распределение Ln(III), U(VI) и Th(IV) в экстракционных системах изучали при использовании водных растворов 0.1–5.0 моль/л HNO3. Водные растворы с концентрацией каждого элемента 2 × 10–6 моль/л были приготовлены растворением соответствующих нитратов в воде с последующим доведением до требуемой концентрации путем добавления HNO3. Все Ln(III) (кроме Pm) присутствовали в исходных водных растворах. Реактивы, используемые при проведении работ, соответствовали марке “х. ч.”.
Все опыты по экстракции выполняли в закрытых пробирках при температуре 21 ± 1°С и соотношении объемов органической и водной фаз 1 : 1. Для эффективного контакта фаз использовали роторный аппарат (скорость вращения 60 об/мин), перемешивание фаз проводили в течение 1 ч. Расслаивание фаз осуществляли центрифугированием.
Содержание извлекаемых металлов как в исходных, так и в равновесных водных растворах определяли методом масс-спектрометрии с ионизацией пробы в индуктивно связанной плазме на масс-спектрометре XSeriesII (ThermoScientific, США). Содержание элементов в органической фазе определяли по разнице концентраций в водном растворе до и после экстракции. Коэффициенты распределения элементов рассчитывали как отношение их концентраций в равновесных фазах. Не менее трех параллельных опытов проводили при определении коэффициентов распределения. Погрешность определения их не превышала 10%. Концентрацию HNO3 в равновесных водных фазах определяли потенциометрическим титрованием 0.1 М раствором NaOH. Концентрацию экстрагентов в равновесных водных фазах определяли атомно-эмиссионным методом с ионизацией пробы в индуктивно связанной плазме с использованием спектрометра iCAP-6500 Duo (ThermoScientific, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предварительно исследовано распределение соединений I–IV между хлороформом и водными растворами HNO3. Увеличение концентрации HNO3 приводит к снижению коэффициента распределения экстрагентов (DL), что связано с протонированием атомов азота ω-азотсодержащих фрагментов соединений I–IV и переходом солей LHNO3 в водную фазу. При концентрации HNO3 > 1 моль/л соединения I–III практически полностью переходят в водную фазу (lgDL < –1.5). Поскольку основность атома азота в 2-оксопирролидиновом фрагменте соединения IV существенно ниже, переход его в водную фазу меньше, однако при [HNO3] = 3 моль/л величина DL составляет 1.71, т.е. более 36% экстрагента переходит в водную фазу, что ограничивает использование этого соединения в качестве экстрагента.
Однако при взаимодействии соединений I–IV (L) с ДННСК в органической среде образуются комплексы (бинарные экстрагенты [17, 18]) LHA согласно уравнению:
(1)
${{{\text{L}}}_{{\left( {\text{о}} \right)}}} + {\text{H}}{{{\text{A}}}_{{\left( {\text{о}} \right)}}} \leftrightarrows {\text{LH}}{{{\text{A}}}_{{\left( {\text{о}} \right)}}}{\text{,}}$Поскольку анион ДННСК обладает высокой гидрофобностью, происходит незначительный переход компонентов этих бинарных экстрагентов в водную фазу. Это способствует увеличению экстракции ионов Ln(III), U(VI) и Th(IV) из растворов азотной кислоты смесями соединений I–IV с ДННСК.
Природа заместителя при терминальном атоме азота мочевин I–IV оказывает существенное влияние на эффективность экстракции ионов металлов. Так, при экстракции смесями, содержащими 0.05 моль/л соединений I–IV и 0.05 моль/л ДННСК в хлороформе из раствора 1 моль/л HNO3 коэффициенты распределения Eu(III) возрастают в ряду III (0.50) < II (1.2) < I (3.9) $ \ll $ IV (>250). При экстракции U(VI) и Th(IV) из раствора 3 моль/л HNO3 смесями, содержащими 0.001 моль/л соединений I–IV и 0.005 моль/л ДННСК в хлороформе, величины DU возрастают в ряду II (5.6) ⁓ IV (5.7) < III (10.5) < I (30.2), а DTh – в ряду II (18.2) ⁓ III (18.6) < I (22.9) $ \ll $ IV (>1000). При этом коэффициент разделения Th(IV) и U(VI) (βTh/U = = DTh/DU) возрастает в ряду соединеий I (0.76) < III (1.78) < II (3.25) < IV (>170). Эти данные указывают на то, что смеси соединения IV и ДННСК проявляют наиболее высокую экстракционную способность по отношению к ионам лантанидов и селективность при экстракции Th(IV) и U(VI) в азотнокислых средах.
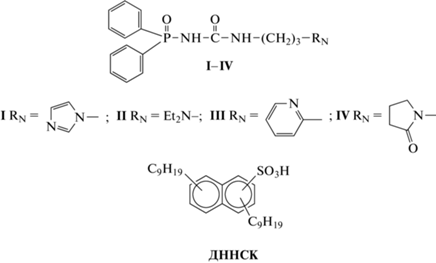
Данные по экстракции ионов металлов из раствора 3 моль/л HNO3 изомолярными смесями соединения IV и ДННСК в хлороформе (рис. 1) указывают на значительный синергетический эффект в этой системе. По-видимому, это связано с участием гидрофобных анионов ДННСК в образовании экстрагируемых комплексов.
Рис. 1.
Экстракция Th(IV) (1), U(VI) (2), La(III) (3), Ho(III) (4) и Lu(III) (5) изомолярными смесями соединения IV(L) и ДННСК в хлороформе из раствора 3 моль/л HNO3. [L] + [ДННСК], моль/л: 0.002 (1), 0.01 (2), 0.05 (3–5).
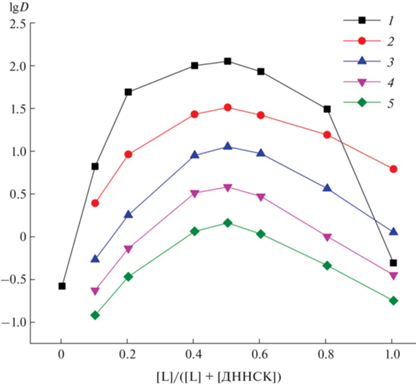
Бинарный экстрагент LHA на основе лиганда IV значительно превосходит соединение IV по своей экстракционной эффективности по отношению к катионам лантанидов(III) (рис. 2). В случае формирования экстрагируемых комплексов лантанидов катионная часть бинарного экстрагента облегчает координационную сольватацию катионов Ln3+. В свою очередь, анионная часть обеспечивает их высокую гидрофобность, что способствует переходу ионов металлов в органическую фазу.
Рис. 2.
Коэффициенты распределения Ln(III) при экстракции смесями 0.05 моль/л соединения IV и 0.05 моль/л ДННСК (1–3) и растворами 0.05 моль/л соединения IV (4, 5) в хлороформе (1, 4), дихлорэтане (2, 5) и нитробензоле (3) из раствора 3 моль/л HNO3.
По мере увеличения атомного номера лантанида (Z) наблюдается снижение экстракции соединением IV и бинарным экстрагентом на его основе (рис. 2). Аналогичная зависимость lgDLn‒Z наблюдается при извлечении лантанидов(III) из азотнокислых растворов при использовании КМФО [9, 19], что, вероятно, связано с увеличением энергии гидратации катионов Ln3+ с увеличением Z [9].
Было показано, что природа органического растворителя оказывает влияние на экстракционный процесс. Так, при экстракции эквимолярными смесями соединения IV и ДННСК из 3 М раствора HNO3 значения DLn увеличиваются в ряду нитробензол < 1,2-дихлорэтан < хлороформ (рис. 2) по мере снижения полярности органического разбавителя. В такой же последовательности изменяются величины DLn при экстракции ионов лантанидов(III) растворами соединения IV в органических растворителях (рис. 2). При экстракции ионов Ln(III) из 3 М раствора HNO3 раствором соединения IV в нитробензоле величины DLn не превышают 0.01. Отметим, что при экстракции ионов Ln(III) из азотнокислых растворов растворами КМФО [20] и бинарных экстрагентов на основе лигандов с метиленовым мостиком между функциональными группами Р=О и C=O [15] величины DLn возрастают с увеличением полярности органического разбавителя. Такое резкое отличие в поведении экстрагентов, различающихся характером линкера между двумя функциональными группами, требует дополнительного исследования.
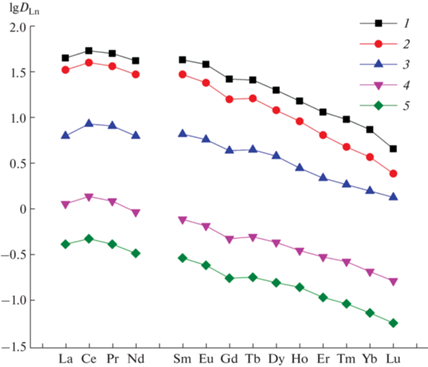
Стехиометрическое соотношение металл : лиганд IV в комплексах определено с использованием метода сдвига равновесия. При постоянных концентрациях азотной кислоты в водной фазе и ДННСК в органической фазе угол наклона зависимостей lgD–lg[L] составляет ⁓2 в случае экстракции Ln(III) и Th(IV) (рис. 3), что указывает на экстракцию этих ионов в виде дисольватов. При экстракции U(VI) угловой наклон зависимостей lgDU–lg[L] составляет 1.66 (рис. 3). Это указывает на то, что U(VI) экстрагируется в виде смеси моно- и дисольватов.
Рис. 3.
Зависимость коэффициентов распределения Th(IV) (1), U(VI) (2), La(III) (3), Tb(III) (4), Ho(III) (5), Tm(III) (6) и Lu(III) (7) от концентрации соединения IV в хлороформе, содержащем ДННСК, при экстракции из раствора 3 моль/л HNO3. [ДННСК], моль/л: 0.005 (1, 2), 0.05 (3–7).
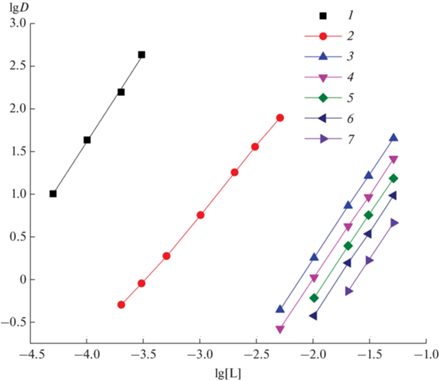
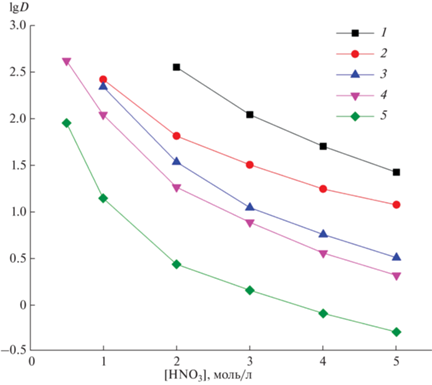
В случае постоянной исходной концентрации IV и ДННСК в органической фазе рост концентрации азотной кислоты в равновесной водной фазе приводит к снижению коэффициентов распределения Ln(III), U(VI) и Th(IV) (рис. 4), что, вероятно, связано с миграцией протонов в водную фазу в процессе экстракции этих ионов по катионообменному механизму.
Рис. 4.
Зависимость коэффициентов распределения Th(IV) (1), U(VI) (2), La(III) (3), Eu(III) (4) и Lu(III) (5) от концентрации HNO3 в равновесной водной фазе при экстракции эквимолярными смесями соединения IV и ДННСК в хлороформе. [IV] = [ДННСК], моль/л: 0.001 (1), 0.005 (2), 0.025 (3–5).
Процесс экстракции лантанидов, U(VI) и Th(IV) из растворов азотной кислоты растворами бинарного экстрагента на основе лиганда IV может быть описан уравнениями:
(2)
$\begin{gathered} {\text{Ln}}_{{{\text{(в)}}}}^{{{\text{3 + }}}}{\text{ + NO}}{{_{3}^{ - }}_{{\text{(}}}}_{{{\text{в)}}}} + {\text{2LH}}{{{\text{A}}}_{{\text{(}}}}_{{{\text{о)}}}} \leftrightarrows \\ \leftrightarrows \,\,{\text{Ln}}{{{\text{L}}}_{{\text{2}}}}{{{\text{A}}}_{{\text{2}}}}{\text{N}}{{{\text{O}}}_{{{\text{3(}}}}}_{{{\text{о)}}}}{\text{ + 2H}}_{{{\text{(в)}}}}^{ + }{\text{,}} \\ \end{gathered} $(3)
$\begin{gathered} {\text{Th}}_{{({\text{в}})}}^{{4 + }} + {\text{2NO}}{{_{3}^{ - }}_{{\left( {\text{в}} \right)}}} + {\text{2LH}}{{{\text{A}}}_{{\left( {\text{о}} \right)}}} \leftrightarrows \\ \leftrightarrows \,\,{\text{Th}}{{{\text{L}}}_{{\text{2}}}}{{{\text{A}}}_{{\text{2}}}}{{{\text{(N}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}_{{{\text{2(о)}}}}} + {\text{2H}}_{{({\text{в}})}}^{ + }{\text{,}} \\ \end{gathered} $(4)
${\text{UO}}_{{2({\text{в}})}}^{{2 + }} + {\text{2LH}}{{{\text{A}}}_{{\left( {\text{о}} \right)}}} \leftrightarrows {\text{U}}{{{\text{O}}}_{{\text{2}}}}{{{\text{L}}}_{{\text{2}}}}{{{\text{A}}}_{{{\text{2}}\left( {\text{о}} \right)}}} + {\text{ 2H}}_{{({\text{в}})}}^{ + }{\text{,}}$(5)
$\begin{gathered} {\text{UO}}_{{2({\text{в}})}}^{{2 + }} + {\text{NO}}{{_{3}^{ - }}_{{\left( {\text{в}} \right)}}} + {\text{LH}}{{{\text{A}}}_{{\left( {\text{о}} \right)}}} \leftrightarrows \\ \leftrightarrows \,\,{\text{U}}{{{\text{O}}}_{{\text{2}}}}{\text{LAN}}{{{\text{O}}}_{{{\text{3}}\left( {\text{о}} \right)}}} + {\text{H}}_{{({\text{в}})}}^{ + }{\text{.}} \\ \end{gathered} $ЗАКЛЮЧЕНИЕ
Представленные данные показали, что дифенилфосфорилмочевины с азотсодержащими фрагментами в алкильных радикалах при терминальном атоме азота взаимодействуют с динонилнафталинсульфокислотой в органических растворителях, что приводит к резкому снижению перехода этих лигандов в азотнокислые растворы. Образующиеся бинарные экстрагенты эффективно экстрагируют ионы Ln(III), U(VI) и Th(IV) из азотнокислых растворов по катионообменному механизму. Наиболее высокую экстракционную способность по отношению к ионам лантанидов, а также селективность при экстракции Th(IV) и U(VI) в азотнокислых средах показал бинарный экстрагент на основе лиганда IV с ω-(2-оксопирролидино)пропильным радикалом при терминальном атоме азота.
Список литературы
Myasoedov B.F., Kalmykov S.N., Kulyako Yu.M. et al. // Geochem. Int. 2016. V. 54. № 13. P. 1156. https://doi.org/10.1134/S0016702916130115
Аляпишев М.Ю., Бабаин В.А., Устынюк Ю.А. // Успехи химии. 2016. Т. 85. № 9. С. 943.
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev. 2017. V. 46. № 23. P. 7229. https://doi.org/10.1039/C7CS00574A
Wilson A.M., Bailey P.J., Tasker P.A. et al. // Chem. Soc. Rev. 2014. V. 43. № 1. P. 123. https://doi.org/10.1039/C3CS60275C
Werner E.J., Biros S.M. // Org. Chem. Front. 2019. V. 6. № 12. P. 2067. https://doi.org/10.1039/c9qo00242a
Bhattacharyya A., Mohapatra P.K. // Radiochim. Acta. 2019. V. 107. № 9–11. P. 931. https://doi.org/10.1515/ract-2018-3064
Розен А.М., Крупнов Б.В. // Успехи химии. 1996. Т. 65. № 11. С. 1052
Myasoedov B.F., Chmutova M.K., Kochetkova N.E. et al. // Solv. Extr. Ion Exch. 1986. V. 4. № 1. P. 61. https://doi.org/10.1080/07366298608917853
Horwitz E.P., Martin K.A., Diamond H. et al. // Solv. Extr. Ion Exch. 1986. V. 4. № 3. P. 449. https://doi.org/10.1080/07366298608917877
Чмутова М.К., Литвина М.Н., Прибылова Г.А. и др. // Радиохимия. 1999. Т. 41. № 4. С. 331.
Тананаев И.Г., Летюшов А.А., Сафиуллина А.М. и др. // Докл. АН. 2008. Т. 422. № 6. С. 762.
Safiulina A.M., Goryunov E.I., Letyushov A.A. et al. // Mendeleev Commun. 2009. V. 19. P. 263. https://doi.org/10.1016/j.mencom.2009.09.010
Сафиулина А.М., Лизунов А.В., Семенов А.А. и др. // Аналитика. 2022. Т. 12. № 2. С. 114. https://doi.org/10.22184/2227-572X.2022.12.2.114.128
Сафиулина А.М., Лизунов А.В., Борисова Н.А. и др. // Журн. неорган. химии. 2021. Т. 66. № 5. С. 631.
Туранов А.Н., Карандашев В.К., Артюшин О.И. и др. // Журн. неорган. химии. 2020. Т. 65. № 8. С. 1099.
Danesi P.R., Chiarizia R., Scibona G. // J. Inorg. Nucl. Chem. 1973. V. 35. № 11. P. 3926. https://doi.org/10.1016/0022-1902(73)80089-2
Belova V.V., Martynova M.M., Tsareva Yu.V. et al. // J. Mol. Liq. 2019. V. 293. 111568. https://doi.org/10.1016/j.molliq.2019.111568
Белова В.В. // Радиохимия. 2021. Т. 63. № 1. С. 3.
Литвина М.Н., Чмутова М.К., Мясоедов Б.Ф. и др. // Радиохимия. 1996. Т. 38. № 6. С. 525.
Шадрин А.Ю., Бабаин В.А., Киселева Р.Н. // Радиохимия. 1993. Т. 35. № 1. С. 45.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии