Журнал неорганической химии, 2023, T. 68, № 6, стр. 824-831
Синтез и кристаллическое строение (HL)2[B10Cl10] · 3CH3CN (L = Bipy, Phen)
В. В. Авдеева a, *, А. В. Вологжанина b, С. Е. Никифорова a, Г. А. Бузанов a, Е. А. Малинина a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Институт элементоорганической химии им. А.Н. Несмеянова РАН
119334 Москва, ул. Вавилова, 28, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 13.12.2022
После доработки 27.12.2022
Принята к публикации 28.12.2022
- EDN: UEPURW
- DOI: 10.31857/S0044457X22602176
Аннотация
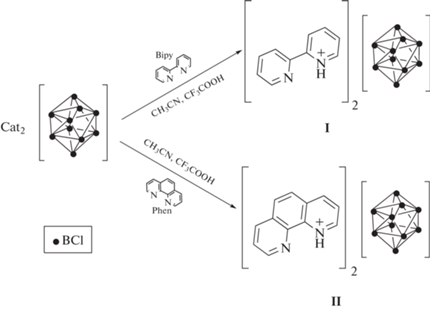
При взаимодействии (Et3NH)2[B10Cl10] и органических лигандов 2,2'-бипиридила (Bipy) и 1,10-фенантролина (Phen) в системе ацетонитрил–трифторуксусная кислота получены соединения состава (HL)2[B10Cl10] · 3CH3CN (L = Bipy, Phen). Соединения охарактеризованы методами ИК-спектроскопии, элементного и рентгеноструктурного анализа (CCDC 2224377, 2224378). Показано, что в присутствии трифторуксусной кислоты происходит протонирование органических лигандов с образованием солей бипиридилия и фенантролиния, которые стабилизируются декахлор-клозо-декаборатным анионом. Установлено, что катионы участвуют в образовании водородных связей с сольватными молекулами ацетонитрила, тогда как для кластерных анионов бора наблюдаются только слабые взаимодействия C–H…Cl и B–Cl…π.
ВВЕДЕНИЕ
Кластерные анионы бора [BnHn]2– (n = 10, 12) [1–3] обладают трехмерной ароматичностью и делокализованной электронной плотностью [4, 5], что позволяет им участвовать в реакциях комплексообразования [6–9] путем замещения концевых атомов водорода на различные функциональные группы [10–14]. Замещенные производные кластерных анионов бора также способны образовывать комплексы с атомами металлов, действуя как лиганды внутренней сферы (за счет координации B–H-групп атомом металла или за счет координации функциональной группы введенного заместителя) или противоионы [15–17].
Реакции комплексообразования с участием кластерных анионов бора [BnHn]2– (n = 10, 12) и их производных [18–22] могут сопровождаться другими конкурирующими процессами, такими как замещение экзополиэдрических атомов водорода на молекулы растворителей или лигандов [23–26], окислительно-восстановительные реакции с участием кластерных анионов бора и металлов [27–30] и процессы протонирования органических лигандов в условиях гидролиза катионов металлов [31].
Ранее в работах [31–34] описан синтез и строение солей кластерных анионов бора [BnHn]2– (n = 10, 12) с протонированными азагетероциклическими лигандами 2,2'-бипиридилом (Bipy), 1,10-фенантролином (Phen), 2,2'-бипиридиламином (BPA) и 7-NH3-4-CH3-кумарином и показано, что протонирование органических лигандов происходит с образованием катионов HL+ или H2L2+ и может протекать в системе ацетонитрил–уксусная кислота либо в водном растворе металлов, которые подвергаются гидролизу по катиону с образованием слабой кислотной среды, что приводит к частичному протонированию лигандов в реакционном растворе и образованию клозо-боратов с протонированными лигандами в качестве побочных продуктов реакций комплексообразования металлов.
В настоящей работе изучен процесс протонирования органических лигандов Bipy и Phen в присутствии декахлор-клозо-декаборатного аниона в системе ацетонитрил–трифторуксусная кислота.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ацетонитрил (HPLC grade, 99.9%), ледяную трифторуксусную кислоту CF3COOH (99%), а также твердые реагенты Bipy (99%), Phen (99%) производства Sigma-Aldrich использовали без дополнительной очистки. Соль (Et3NH)2[B10H10] получали в результате многостадийного синтеза при взаимодействии декаборана-14 с триэтиламинобораном через стадию образования 1,6-бис(триэтиламин)декаборана [35], соединение (Et3NH)2[B10Cl10] – хлорированием (Et3NH)2[B10H10] в водном растворе по методике [36].
Синтез (HL)2[B10Cl10] · 3CH3CN (L = Bipy (I), Phen (II)). К раствору (Et3NH)2[B10Cl10] (0.5 ммоль) в ацетонитриле (10 мл) добавляли раствор L (1 ммоль) в том же растворителе (10 мл). К полученным реакционным смесям по каплям добавляли ледяную трифторуксусную кислоту CF3COOH (5 мл). Реакционную смесь оставляли при комнатной температуре в стакане, накрытом часовым стеклом. Через 48 ч наблюдали образование бесцветных кристаллов I · 3H2O или II · 3H2O, которые отфильтровывали, промывали ацетонитрилом (2 × 5 мл) и высушивали на воздухе. Выход составил 78% для I и 81% для II.
| C | H | N | B | |
| Найдено, %: | 30.8; | 2.2; | 7.3; | 13.8. |
| Для C20H18N4B10Cl10 (I) вычислено, %: | 30.91; | 2.33; | 7.21; | 13.91. |
ИК-спектр (NaCl, см–1): ν(NH) 3145 ш; ν(CN) 2295; ν(BCl) 1004, 1154; ν(Bipy) 1600–700; π(CH) 761.
| C | H | N | B | |
| Найдено, %: | 34.8; | 2.1; | 6.6; | 12.9. |
| Для C24H18N4B10Cl10 (II) вычислено, %: | 34.94; | 2.20; | 6.79; | 13.10. |
ИК-спектр (NaCl, см–1): ν(NH) 3110 ш; ν(CN) 2305; ν(BCl) 1004, 1155; ν(Bipy) 1600–700; π(CH) 761.
Элементный анализ на углерод, водород и азот проводили на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba), содержание бора определяли методом ICP MS на атомно-эмиссионном спектрометре iCAP 6300 Duo с индуктивно связанной плазмой. Перед проведением экспериментов образцы высушивали до постоянной массы.
ИК-спектры синтезированных комплексов записывали на ИК-Фурье-спектрометре ИНФРАЛЮМ ФТ-02 (НПФ АП “Люмэкс”) в области 4000–600 см–1 с разрешением 1 см–1. Образцы готовили в виде суспензии исследуемого вещества в вазелиновом масле (Aldrich).
Рентгенодифракционные эксперименты выполнены на автоматическом дифрактометре с двумерным детектором Bruker Smart 1000 при 120.0(2) K. Параметры элементарной ячейки уточнены по всему массиву данных [37]. В экспериментально определенные значения интенсивности рефлексов внесены поправки на поглощение с использованием программы SADABS [38]. Структуры расшифрованы методом сопряженного пространства, реализованным в программе SHELXT [39], и уточнены полноматричным методом наименьших квадратов SHELXL-2014 [40] по F2 по всем данным в анизотропном приближении для всех неводородных атомов. Атомы H(N) определены на картах разностной электронной плотности, а атомы водорода H(C) помещены в геометрически рассчитанные позиции и уточнены в модели “наездника” с изотропными тепловыми параметрами, равными Uизо = 1.5Uэкв(C) для метильных групп и 1.2Uэкв(Х) для остальных атомов, где Uэкв(Х) – эквивалентные изотропные тепловые параметры атомов, связанных с атомом водорода.
Параметры рентгеноструктурного эксперимента и окончательные значения факторов недостоверности для кристаллов I и II приведены в табл. 1. Координаты атомов и значения температурных параметров депонированы в Кембриджском банке кристаллографических данных под номерами CCDC 2224377 и 2224378 для I и II соответственно.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II
| Параметр | I | II |
|---|---|---|
| Химическая формула | (HBipy)2[B10Cl10] · 3CH3CN | (HPhen)2[B10Cl10] · 3CH3CN |
| FW | 900.14 | 948.18 |
| Сингония, пр. гр., Z | Моноклинная, Р21/с, 4 | |
| a, Å | 10.3031(2) | 10.3566(7) |
| b, Å | 16.7003(3) | 16.6602(10) |
| c, Å | 24.0297(5) | 24.2387(15) |
| β, град | 100.022(1) | 94.533(1) |
| V, Å3 | 4071.58(14) | 4169.1(5) |
| dx, г/см3 | 1.468 | 1.511 |
| μ, мм–1 | 0.717 | 0.705 |
| F000 | 1808 | 1904 |
| T, K | 120.0(2) | |
| Излучение, λ, Å | MoKα, 0.71073 | |
| Размер образца, мм | 0.48 × 0.22 × 0.19 | 0.38 × 0.19 × 0.17 |
| θmax, град | 45.489 | 30.698 |
| Область h, k, l | −20 < h < 20 −33 < k < 32 −48 < l < 48 |
−14 < h < 14 −23 < k < 23 −34 < l < 34 |
| Число отражений: | ||
| измеренных/независимых (N1) Rint/с I > 2σ(I) (N2) |
361783/34123, 0.0511/23677 |
57142/12867, 0.0534/9833 |
| Метод уточнения | Полноматричный МНК по F2 | |
| Число уточняемых параметров | 481 | 517 |
| Весовая схема | w = 1/[σ2(Fo2) + (0.025P)2 + 2.0P], где P = (Fо2 + 2Fc2)/3 | w = 1/[σ2(Fo2) + (0.0320)2 + 3.0612P], где P = (Fо2 + 2Fc2)/3 |
| Факторы недостоверности: | ||
| wR2 по N1 | 0.0936 | 0.1039 |
| R1 по N2 | 0.0397 | 0.0410 |
| S | 1.027 | 1.012 |
| Остаточная электронная плотность Δρmax/Δρmin, е/Å3 |
0.952/–0.797 | 0.545/–0.277 |
Рентгенофазовый анализ проводили на рентгеновском дифрактометре Bruker D8 Advance в ЦКП ИОНХ РАН (CuKα-излучение) в низкофоновых кюветах с подложкой из ориентированного монокристалла кремния в интервале углов 2θ 5°–80° с шагом 0.01125°. Для получения дифрактограмм образцы I и II тщательно растирали в агатовой ступке непосредственно перед съемкой.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез целевых соединений проводили в системе ацетонитрил–трифторуксусная кислота с использованием соли (Et3NH)2[B10Cl10] и лигандов Bipy и Phen в качестве исходных соединений. Реакции протекали по схеме 1 .
Схема 1 . Синтез соединений (HL)2[B10Cl10] (L = Bipy (I); Phen (II)).
В ИК-спектрах соединений I, II присутствует уширенная полоса ν(NH) в области 3100 см–1, которая соответствует наличию NH-групп в катионной части соединений, и полосы ν(BCl) с максимумами при 1155 и 1005 см–1, связанные с наличием перхлорированного кластера в составе соединений. Кроме того, в спектрах кристаллов (HL)2[B10Cl10] · 3CH3CN (I, II) присутствуют полосы колебаний ν(CN) молекул ацетонитрила при 2300 см–1.
Согласно результатам рентгеноструктурного анализа, соединения I и II изоструктурны (табл. 1). Независимая часть ячейки содержит один декахлор-клозо-декаборатный анион, два катиона HL+ (L = Bipy, Phen) и три молекулы ацетонитрила (рис. 1). Положение всех атомов водорода, включая H(N), может быть локализовано на картах электронной плотности, это однозначно позволит установить, какие атомы участвуют в образовании водородных связей (табл. 2). В отличие от анионов [B10H12]2– и [B12H12]2–, склонных к образованию диводородных связей с участием протонированных гетероциклических органических катионов [31], в структурах I и II катионы участвуют в образовании водородных связей с сольватными молекулами ацетонитрила, тогда как для анионов наблюдаются только слабые взаимодействия C–H…Cl.
Рис. 1.
Молекулярное строение (Hbipy)2[B10Cl10] · 3CH3CN (I) (а) и (Hphen)2[B10Cl10] · 3CH3CN (II) (б) в представлении атомов эллипсоидами температурных смещений (р = 50%). Водородные связи изображены пунктиром.
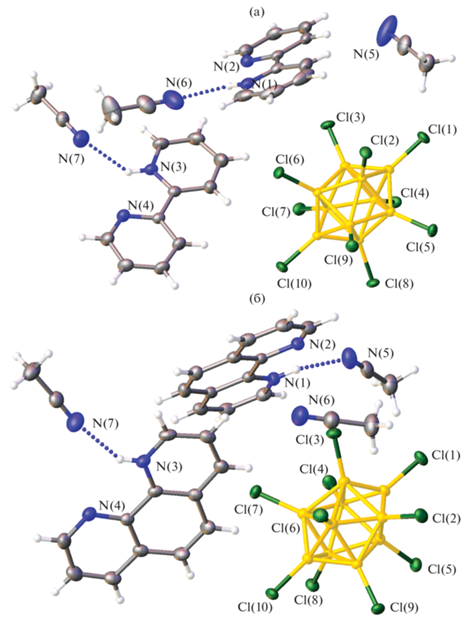
Таблица 2.
Основные геометрические параметры водородных связей в структурах I и II
| D–H…A | Расстояние, Å | Угол DHA, град | ||
|---|---|---|---|---|
| D–H | H…A | D…A | ||
| (HBipy)2[B10Cl10] · 3CH3CN (I) | ||||
| N(1)–H(1)…N(6) | 0.88 | 2.173 | 2.934(2) | 145 |
| N(3)–H(3a)…N(7) | 0.88 | 2.179 | 2.876(2) | 136 |
| (HPhen)2[B10Cl10] · 3CH3CN (II) | ||||
| N(1)–H(1)…N(5) | 0.88 | 2.152 | 2.878(3) | 142 |
| N(3)–H(3a)…N(7) | 0.88 | 2.033 | 2.800(3) | 145 |
Несмотря на отсутствие прочных межмолекулярных взаимодействий, анионы в структурах I и II полностью упорядочены. Длины связей С–Сl с апикальными атомами бора (1.782(1)–1.784(1) Å в структуре I и 1.777(2)–1.781(2) Å в структуре II) укорочены по сравнению с экваториальными атомами (в среднем 1.800 и 1.796 Å). Разница в длинах связей борсодержащего кластера еще более выражена: длины связей В–В с участием апикальных атомов бора составляют в среднем 1.688 и 1.683 Å, тогда как длины связей между экваториальными атомами изменяются от 1.827 до 1.847 Å и от 1.816 до 1.845 Å.
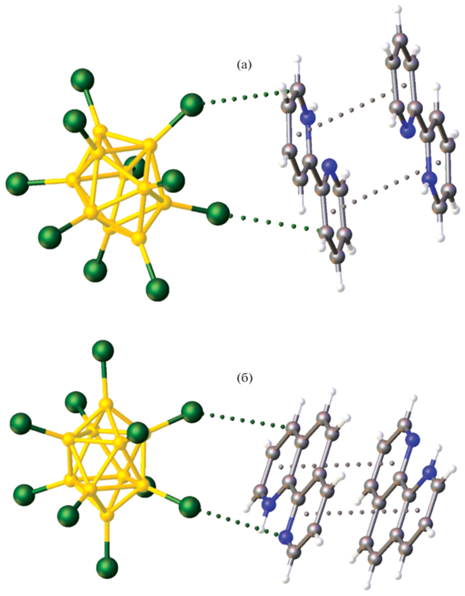
Присутствие в солях I и II в качестве катионов гетероциклических органических катионов позволяет реализовать стекинг-взаимодействие между ними. Действительно, в структурах этих соединений можно обнаружить антипараллельно расположенные катионы (рис. 2). В структуре I ближайшие атомы азота и углерода находятся на расстояниях 3.342(1) и 3.716 Å, а межплоскостное расстояние составляет 3.341(1)–3.541(4) Å. В структуре II аналогичные величины составляют 3.496–3.590(1) Å и 3.294(1)–3.432(1) Å. Можно предположить, что помимо слабых водородных связей C–H…Cl анионы участвуют в образовании контактов B–Cl…π, в которых σ-дырки экваториальных атомов галогена, расположенные на продолжении связей B–Cl, находятся над плоскостью гетероциклических фрагментов катиона.
Рис. 2.
Фрагменты кристаллической структуры I (а) и II (б), связанные между собой B–Cl…π- и π…π-взаимодействиями (изображены пунктиром).
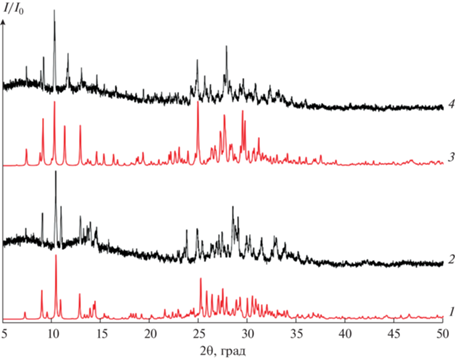
На основании данных РФА можно предположить однородность полученных образцов (рис. 3).
Рис. 3.
Экспериментальные (2, 4) и рассчитанные (1, 3) дифрактограммы соединений I (3, 4) и II (1, 2).
В работах [31–33] получены соли клозо-декаборатного и клозо-додекаборатного анионов, которые содержат моно- и дипротонированные молекулы Bipy (соединения (BipyH)2[B10H10], (BipyH2)[B10H10]) и BPA (соединение (HBPA)2(H2BPA)[B10H10]2), тогда как для Phen выделены соли (PhenH)2[B10H10] и (PhenH)2[B12H12] в системе ацетонитрил–трифторуксусная кислота и (PhenH)2(Phen)2.5[B10H10], полученное в ходе реакции комплексообразования кобальта в воде в качестве второго продукта после образования трис-хелатного комплекса [Co(Bipy)3][B10H10]. Полученные данные указывают на меньшую склонность молекулы фенантролина к протонированию и выведению полученного катиона из реакционного раствора при стабилизации кластерным анионом бора по сравнению с Bipy и BPA. В настоящей работе соединения, содержащие дипротонированные лиганды, не получены. Вероятно, они образуются в реакционном растворе, однако наименее растворимыми соединениями оказываются монопротонированные соли Bipy и Phen с декахлор-клозо-декаборатным анионом.
Отметим, что протонирование лигандов Bipy и Phen наблюдалось в ходе реакций комплексообразования меди(II), кобальта(II) и редкоземельных металлов в присутствии других анионов [41–46].
Таким образом, в настоящей работе изучен процесс протонирования органических лигандов Bipy и Phen в системе ацетонитрил–трифторуксусная кислота в присутствии декахлор-клозо-декаборатного аниона. Выделены и исследованы, в том числе методом РСА, соли (HL)2[B10Cl10] (L = Bipy (I), Phen (II)). В структурах соединений имеются водородные связи между катионами и сольватными молекулами ацетонитрила, а также слабые взаимодействия C–H…Cl и B–Cl…π между кластерными анионами бора и органическими катионами.
Список литературы
Muetterties E.L., Knoth W.H. Polyhedral Boranes. N.Y.: Dekker, 1968.
Boron Science: New Technologies and Applications / Ed. Hosmane N.S. CRC Press, 2012.
Greenwood N.N., Earnshaw A. Chemistry of the Elements. Butterworth-Heinemann, 1997.
King B.R. // Chem. Rev. 2001. V. 101. P. 1119. https://doi.org/10.1021/cr000442t
Chen Z., King R.B. // Chem. Rev. 2005. V. 105. P. 3613. https://doi.org/10.1021/cr0300892
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Coord. Chem. Rev. 2022. V. 469. P. 214636. https://doi.org/10.1016/j.ccr.2022.214636
Авдеева В.В., Короленко С.Е., Малинина Е.А., Кузнецов Н.Т. // Журн. общей химии. 2022. Т. 92. № 3. С. 443.
Alexandrova A.N., Boldyrev A.I., Zhai H.J., Wang L.S. // Coord. Chem. Rev. 2006. V. 250. P. 2811. https://doi.org/10.1039/D2QI00890D
Zhao X., Yang Z., Chen H. et al. // Coord. Chem. Rev. 2021. V. 444. P. 214042. https://doi.org/10.1016/j.ccr.2021.214042
Сиваев И.Б. // Журн. неорган. химии. 2021. Т. 66. № 9. С. 1192. [Sivaev I.B. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1289.] https://doi.org/10.1134/S0036023621090151
Nelyubin A.V., Klyukin I.N., Zhdanov A.P. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 139. https://doi.org/10.1134/S0036023621020133
Shmal’ko A.V., Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1726. https://doi.org/10.1134/S0036023619140067
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. P. 2089. https://doi.org/10.1134/S0036023610140019
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. P. 1149. https://doi.org/10.1135/cccc2010054
Avdeeva V.V., Buzanov G.A., Malinina E.A. et al. // Crystals. 2020. V. 10. P. 389. https://doi.org/10.3390/cryst10050389
Avdeeva V.V., Vologzhanina A.V., Ugolkova E.A. et al. // J. Solid State Chem. 2021. V. 296. P. 121989. https://doi.org/10.1016/j.jssc.2021.121989
Matveev E.Yu., Novikov I.V., Kubasov A.S. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 187. https://doi.org/10.1134/S0036023621020121
Matveev E.Y., Avdeeva V.V., Zhizhin K.Y. et al. // Inorganics. 2022. V. 10. P. 238. https://doi.org/10.3390/inorganics10120238
Авдеева В.В., Малинина Е.А., Жижин К.Ю., Кузнецов Н.Т. // Коорд. химия. 2021. Т. 47. № 8. С. 457.
Malinina E.A., Korolenko S.E., Zhdanov A.P. et al. // J. Clust. Chem. 2021. V. 32. P. 755. https://doi.org/10.1007/s10876-020-01840-5
Сиваев И.Б. // Журн. неорган. химии. 2019. Т. 64. № 8. С. 789.
Axtell J.C., Saleh L.M.A., Qian E.A. et al. // Inorg. Chem. 2018. V. 57. № 5. P. 2333. https://doi.org/10.1021/acs.inorgchem.7b02912
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. P. 1673. https://doi.org/10.1134/S0036023617130022
Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2011. V. 440. P. 253. https://doi.org/10.1134/S0012500811090035
Elrington M., Greenwood N.N., Kennedy J.D., Thornton-Pett M. // J. Chem. Soc., Dalton Trans. 1987. V. 2. P. 451. https://doi.org/10.1039/DT9870000451
Avdeeva V.V., Polyakova I.N., Churakov A.V. et al. // Polyhedron. 2019. V. 162. P. 65. https://doi.org/10.1016/j.poly.2019.01.051
Avdeeva V.V., Vologzhanina A.V., Goeva L.V. et al. // Z. Anorg. Allg. Chem. 2014. V. 640. P. 2149. https://doi.org/10.1002/zaac.201400137
Avdeeva V.V., Vologzhanina A.V., Goeva L.V. et al. // Inorg. Chim. Acta. 2015. V. 428. P. 154. https://doi.org/10.1016/j.ica.2014.12.029
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Polyhedron. 2015. V. 430. P. 74. https://doi.org/10.1016/j.ica.2015.02.029
Malinina E.A., Kochneva I.K., Polyakova I.N. et al. // Inorg. Chim. Acta. 2018. V. 477. P. 284. https://doi.org/10.1016/j.ica.2018.03.024
Avdeeva V.V., Vologzhanina A.V., Malinina E.A., Kuznetsov N.T. // Crystals. 2019. V. 9. P. 330. https://doi.org/10.3390/cryst9070330
Chantler C.T., Maslen E.N. // Acta Crystallogr., Sect. B. 1989. V. 45. P. 290.
Fuller D.J., Kepert D.L., Skelton B.W., White A.H. // Aust. J. Chem. 1987. V. 40. P. 2097.
Goeva L.V., Zhuchkova A.F., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2022. V. 67. P. 1144. https://doi.org/10.1134/S0036023622080149
Miller H.C., Miller N.E., Muetterties E.L. // J. Am. Chem. Soc. 1963. V. 85. P. 3885.
Kravchenko E.A., Gippius A.A., Korlyukov A.A. et al. // Inorg. Chim. Acta. 2016. V. 447. P. 22. https://doi.org/10.1016/j.ica.2016.03.025
SAINT-Plus (Version 7.68) // Bruker AXS Inc., Madison, Wisconsin, USA. 2007.
SADABS. Bruker AXS Inc., Madison, Wisconsin, USA.
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71A. № 1. P. 3.
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71C. № 1. P. 3.
Martsinko E.E., Seifullina I.I., Chebanenko E.A. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 393. https://doi.org/10.1134/S1070328418060039
Seifullina I.I., Martsinko E.E., Chebanenko E.A. et al. // J. Struct. Chem. 2017. V. 58. P. 532. https://doi.org/10.1134/S0022476617030143
Petrosyants S.P., Ilyukhin A.B. // Russ. J. Coord. Chem. 2014. V. 40. P. 825. https://doi.org/10.1134/S107032841410008X
Yin P., Xue C., Yan Y. et al. // Russ. J. Inorg. Chem. 2022. V. 67. P. 456. https://doi.org/10.1134/S0036023622040222
Chebanenko E.A., Seifullina I.I., Martsinko E.E. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1132. https://doi.org/10.1134/S0036023619090043
Petrosyants S.P., Dobrokhotova Z.V., Ilyukhin A.B. et al. // Eur. J. Inorg. Chem. 2017. V. 2017. № 29. P. 3561. https://doi.org/10.1002/ejic.201700537
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии