Журнал неорганической химии, 2023, T. 68, № 6, стр. 761-767
Синтез и строение трехзамещенного клозо-декаборана [B10H7(1-IPh)(6(7),10-NHOCCH3)]: особенности взаимодействия аниона [2-B10H9NH=C(OH)CH3]– с PhI(OAc)2
В. В. Воинова a, Н. А. Селиванов a, А. Ю. Быков a, А. С. Кубасов a, А. П. Жданов a, *, К. Ю. Жижин a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва,
Ленинский пр-т, 31, Россия
* E-mail: zhdanov@igic.ras.ru
Поступила в редакцию 06.12.2022
После доработки 23.12.2022
Принята к публикации 27.12.2022
- EDN: UEWXLM
- DOI: 10.31857/S0044457X22602309
Аннотация
Исследован процесс получения трехзамещенных клозо-декаборанов по реакции 1,2-бороксазолов с PhI(OAc)2. Показано, что данный процесс также может быть осуществлен one pot исходя из борилированного иминола. Продукты реакций охарактеризованы методами 1Н, 11В, 13С ЯМР-спектроскопии. Строение соединения [B10H7(1-IPh)(6,10-NHOCCH3)] установлено методом РСА.
ВВЕДЕНИЕ
Разнообразные производные кластерных анионов бора вследствие проявления ими ряда важных свойств (низкая токсичность [1], высокая термодинамическая стабильность [2], пространственно-ароматический характер) привлекают большое внимание исследователей, так как они используются для создания веществ, обладающих каталитической активностью [3, 4], люминесцентными [5–7] и магнитными свойствами [8], применяются в медицине [9–11]. Особый интерес представляют замещенные производные клозо-декаборатного аниона, имеющие в своем составе два различных заместителя [12, 13]. Варьирование природы этих заместителей позволяет получать соединения, объединяющие в себе различные функции: транспортную, диагностическую, терапевтическую. Такой подход позволяет рассматривать кластерные анионы бора в качестве молекулярной платформы для создания новых тераностических препаратов [14–17]. И уж тем более интересными оказываются производные с тремя различными заместителями [18–20].
В связи с этим одним из важнейших направлений в химии бора является исследование методов функционализации кластерных анионов бора. Для получения производных аниона [B10H10]2– известно большое число способов синтетических подходов. Наибольшее внимание уделяется таким методам, как прямая функционализация [21], ипсо-замещение [22–24] и модификация нитрилиевых и оксониевых заместителей [25–30]. За счет присутствия в составе заместителя активированной связи C≡N особый интерес представляют нитрилиевые производные клозо-декаборатного аниона, на основе которых реакцией нуклеофильного присоединения в мягких условиях могут быть получены соединения с заданными свойствами [31, 32].
Ранее [24] нами был изучен такой многообещающий класс соединений, как аннелированные 1,2-бороксазолы. В настоящей работе продолжено исследование процесса и условий их образования, а также изучены возможности их дальнейшей функционализации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Элементный анализ. Содержание углерода, водорода и азота определяли на элементном CHNS-анализаторе Eurovector EuroEA 3000 (Италия). На атомно-эмиссионном спектрометре с индуктивно связанной плазмой Thermo Scientific iCAP XP (Thermo Scientific, США) выполняли анализ содержания бора в образцах.
Спектры ЯМР 1H, 11B, 13C растворов исследуемых веществ в CD3CN записывали на импульсном Фурье-спектрометре Bruker Avance-300 (ФРГ) на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан или эфират трехфтористого бора.
ESI-масс-спектры растворов исследуемых веществ в CH3CN записывали на спектрометре LСМS-IT-TOF (Shimadzu, Япония). Спектры HRMS были получены в режиме прямого введения. Масс-спектры регистрировали в диапазоне m/z от 120 до 700 Да. Напряжение детектора 1.55 кВ, распыляющий газ 1.50 л/мин, температура CDL 200°C, напряжение ЭСИ 4.50 кВ. Настройку прибора (калибровку массы и проверку чувствительности) проводили перед анализом.
Рентгеноструктурный анализ. Набор дифракционных отражений для кристалла получен в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker Smart Apex2 (λMoKα, графитовый монохроматор, ω–φ-сканирование). Данные были проиндексированы и интегрированы с помощью программы SAINT [33]. Применяли поправку на поглощение, основанную на измерениях эквивалентных отражений (SADABS) [34]. Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы уточнены в анизотропном приближении, все атомы водорода – по модели “наездника” с тепловыми параметрами Uизо = 1.2Uэкв (Uизо) соответствующего неводородного атома (1.5Uизо для СН3-групп).
Все расчеты проводили с использованием программы SHELXTL [35]. Структура расшифрована и уточнена с помощью программного комплекса OLEX2 [36].
Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 2231706).
Синтез. Борилированные иминолы (Bu4N)[2-B10H9NHC(OH)CH3] (1), (Bu4N)[2-B10H9NHC(OH)iC3H7] (2) и 1,2-бороксазолы (Bu4N)[1,2-B10H8(NHOCCH3)] (3), (Bu4N)[1,2-B10H8(NHOCiC3H7)] (4) получали по методике [24].
[B10H7(1-IPh)(6(7),10-NHOCCH3)] (5). Навеску 0.2 г (0.48 ммоль) (Bu4N)[2-B10H9(NHC(OH)CH3)] и 0.46 г (1.43 ммоль) PhI(OAc)2 растворяли в 10 мл метанола. Реакционную массу перемешивали при комнатной температуре в течение 5 ч. Далее полученный реакционный раствор концентрировали на роторном испарителе, разбавляли дихлорметаном, дважды промывали раствор дистиллированной водой и сушили органическую фазу над безводным Na2SO4. Раствор целевого вещества упаривали на роторном испарителе. Полученный сухой остаток перекристаллизовывали из смеси этанола и 2-пропанола. Получено 0.150 г [B10H7(1-IPh)(6(7),10-NHOCCH3)] (83%).
11B ЯМР-спектр (CD3CN), δ, м. д.: 30.2 (c, 1B, B(10)), –4.8 (c, 1B, B(1)) –10.1 (c, 1B, B(6)), –22.5 (д, 2B, B(3, 4), JB–H = 138 Гц), –28.9 (д, 4B, B(2, 5, 7, 9), JB–H = 138 Гц), –35,0 (д, 1B, B(8), JB–H = 139 Гц); 1Н ЯМР-спектр (CD3CN), δ, м. д.: 8.04, 7.58, 7.40 (аром, 5H, NCC6H5), 6.68 (1H, NH), 2.45 (с, 3H, NCCH3); 13С ЯМР-спектр (CD3CN), δ, м. д.: 186.7 (–N=C–O), 135.3, 131.4, 130.9, 104.3 (Ph), 18.6 (NH–C–CH3); MS (ESI) m/z = 376.1204 (соответствует пику {[B10H7(IPh)(NHOCCH3)]–H}, вычислено для {[A]–H} 376,1201).
[B10H7(1-IPh)(6(7),10-NHOCiC3H7)] (6) получали по аналогичной методике. Навеску 0.2 г (0.47 ммоль) (Bu4N)[2-B10H9(NHC(OH)iC3H7)] и 0.43 г (1.34 ммоль) PhI(OAc)2 растворяли в 10 мл метанола. Получено 0.147 г [B10H7(1-IPh)(6(7),10-NHOCiC3H7)] (81%).
11B ЯМР-спектр (CD3CN), δ, м. д.: 30.2 (c, 1B, B(10)), –4.9 (c, 1B, B(1)), –10.0 (c, 1B, B(6)), –22.5 (д, 2B, B(3, 4), JB–H = 138 Гц), –28.8 (д, 4B, B(2, 5, 7, 9), JB–H = 138 Гц), –34.8 (д, 1B, B(8), JB–H = 139 Гц); 1Н ЯМР-спектр (CD3CN), δ, м.д.: 8.04, 7.58, 7.40 (аром, 5H, NCC6H5), 6.68 (1H, NH), 2.64 (септ, 1H, –CH–(CH3)2, J = 7 Гц), 1.11 (д, 6H, NC(CH3)2, J = 7 Гц); 13С ЯМР-спектр (CD3CN), δ, м. д.: 180.1 (–N=C–O), 135.3, 131.4, 130.9, 104.3 (Ph), 34.0 (NH–C–CH–(CH3)2), 18.4 (NH–C–CH–(CH3)2); HRMS (ESI) m/z = 405.1601 (соответствует иону [B10H7(IPh)(NHOCiC3H7)]–, вычислено для {[A]–} 405.1603).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
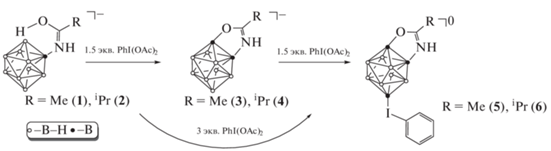
Целевые трехзамещенные клозо-декабораны получали по реакции 1,2-дибороксазолов с полуторакратным избытком PhI(OAc)2 в среде метанола. Данная реакция также может быть проведена непосредственно из соответствующего борилированного иминола one pot, минуя стадию выделения 1,2-бороксазола. Реакция требует 3-кратного избытка фенилиододиацетата и увеличения времени процесса. Для подтверждения возможности протекания данной реакции и с другими бороксазолами (иминолами) процесс проводили также с участием аниона [2-B10H9NHC(OH)iC3H7]–.
Схема 1 .
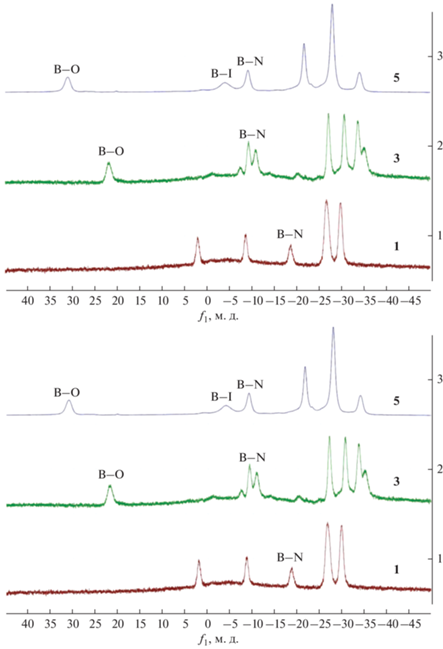
Контроль за ходом реакции осуществляли с помощью 11В ЯМР-спектроскопии (рис. 1). Так, в спектре 11В ЯМР целевого клозо-декаборана (1) наблюдаются три сигнала от замещенных позиций: при 30.2 м. д. от апикального атома кластера, связанного с кислородом бороксазольного фрагмента, сильно уширенный синглет при –4.8 м. д. от апикального атома бора с иодониевым заместителем и при –10.1 м. д. от замещенного экваториального атома бора. Незамещенные атомы бора кластерного остова проявляются в виде группы сигналов с соотношением интегральных интенсивностей 2 : 3 : 1.
Строение заместителей в полученных клозо-боранах устанавливали с помощью мультиядерной спектроскопии ЯМР. Так, в 1H ЯМР-спектре соединения 5 наблюдаются две группы сигналов от атомов водорода заместителей. Бороксазольный фрагмент представлен синглетом метильной группы (I = 3) при 2.45 м. д. и уширенным синглетом иминного протона (I = 1) при 6.68 м. д. Фенильное кольцо дает три мультиплета в области ароматических протонов при 8.04 (I = 2), 7.58 (I = 1) и 7.40 м. д. (I = 2).
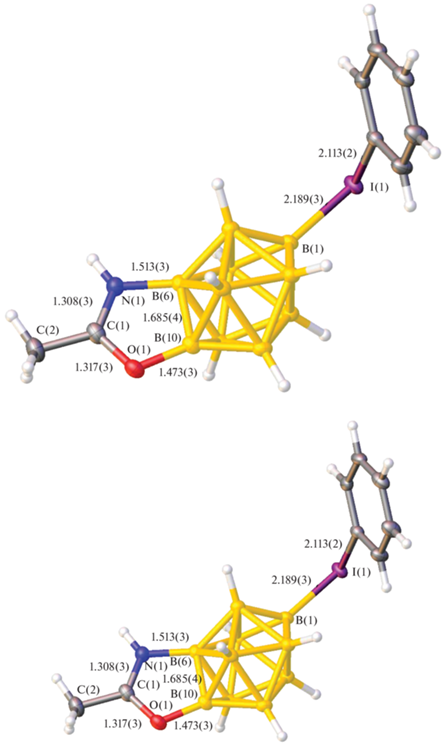
Молекулярная структура соединения [B10H7(1-IPh)(6,10-NHOCCH3)] установлена методом рентгеноструктурного анализа монокристалла (рис. 2). Данные РСА подтверждают расположение и строение заместителей. Фенилиодониевый заместитель находится в апикальном положении, а бороксазольное кольцо образовано с участием апикальной грани B(6)B(10). Длины связей B(1)I(1), B(6)N(1) и B(10)O(1) составляют 2.113(2), 1.513(3) и 1.473(3) Å соответственно, что указывает на их ординарный характер и отсутствие дополнительного сопряжения с ароматической электронной плотностью кластерного остова.
В бороксазольном фрагменте длины связей N(1)C(1) и C(1)O(1) составляют 1.308(3) и 1.317(3) Å, что указывает на промежуточный характер кратности связей [37] и наличие сопряжения в фрагменте N(1)C(1)O(1), а также делокализации на нем положительного заряда.
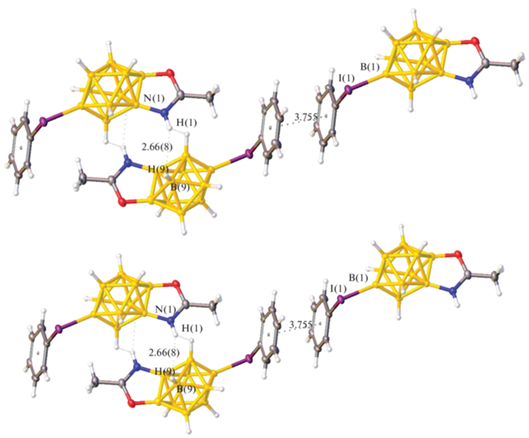
Необходимо отметить, что в структуре наблюдаются два типа слабых взаимодействий (рис. 3). Диводородные связи между протонами бороксазольных колец и атомами водорода в экваториальном поясе соседнего кластера длиной ~2.66 Å обусловливают образование центросимметричных димеров. В структуре также наблюдаются стекинг-взаимодействия между фенильными кольцами иодониевых заместителей соседних кластеров. Заместители расположены антипараллельно, межплоскостное расстояние составляет 3.755 Å со сдвигом центров на 1.614 Å.
ЗАКЛЮЧЕНИЕ
В работе впервые получен трехзамещенный нейтральный клозо-декаборан, содержащий фенилиодониевый заместитель в апикальном положении и бороксазольный цикл, аннелированный к апикальной грани B(6)B(10). Структура полученного производного установлена методом РСА. Данный класс соединений представляет удобную платформу для дальнейшей модификации клозо-декаборатного аниона.
Список литературы
Couto M., Alamón C., García M. et al. // Cells. 2020. V. 9. № 6. P. 1408. https://doi.org/10.3390/cells9061408
Golub I.E., Filippov O.A., Kulikova V.A. et al. // Molecules. 2020. V. 25. № 12. P. 2920. https://doi.org/10.3390/molecules25122920
Knapp C. Weakly Coordinating Anions: Halogenated Borates and Dodecaborates // Comprehensive Inorganic Chemistry II. Elsevier, 2013. P. 651. https://doi.org/10.1016/B978-0-08-097774-4.00125-X
Fisher S.P., Tomich A.W., Lovera S.O. et al. // Chem. Rev. 2019. V. 119. № 14. P. 8262. https://doi.org/10.1021/acs.chemrev.8b00551
Shen Y., Kong X., Yang F. et al. // Inorg. Chem. 2022. V. 61. № 42. P. 16707. https://doi.org/10.1021/acs.inorgchem.2c02467
Wang Z., Chen B., Zhang H. et al. // Mater. Chem. Front. 2022. V. 6. № 6. P. 783. https://doi.org/10.1039/D1QM01567B
Tanaka K., Gon M., Ito S. et al. // Coord. Chem. Rev. 2022. V. 472. P. 214779. https://doi.org/10.1016/j.ccr.2022.214779
Mori T. // J. Solid State Chem. 2019. V. 275. P. 70. https://doi.org/10.1016/j.jssc.2019.03.046
Ali F., S Hosmane N., Zhu Y. // Molecules. 2020. V. 25. № 4. P. 828. https://doi.org/10.3390/molecules25040828
Dymova M.A., Taskaev S.Y., Richter V.A. et al. // Cancer Commun. 2020. V. 40. № 9. P. 406. https://doi.org/10.1002/cac2.12089
Shakerzadeh E., Tahmasebi E., van Duong L. et al. // Boron Clusters in Biomedical Applications: A Theoretical Viewpoint // Characteristics and Applications of Boron. IntechOpen, 2022. https://doi.org/10.5772/intechopen.106215
Авдеева В.В., Полякова И.В., Гоева Л.В. и др. // Журн. неорган. химии. 2014. Т. 59. С. 1491.
Kapuściński S., Hietsoi O., Pietrzak A. et al. // Chem. Commun. 2022. V. 58. № 6. P. 851. https://doi.org/10.1039/D1CC06485A
Isono A., Tsuji M., Sanada Y. et al. // ChemMedChem. 2019. V. 14. № 8. P. 823. https://doi.org/10.1002/cmdc.201800793
Shi Y., Li J., Zhang Z. et al. // ACS Appl. Mater. Interfaces. 2018. V. 10. № 50. P. 43387. https://doi.org/10.1021/acsami.8b14682
Shi Y., Fu Q., Li J. et al. // ACS Appl. Mater. Interfaces. 2020. V. 12. № 50. P. 55564. https://doi.org/10.1021/acsami.0c15251
Rykowski S., Gurda-Woźna D., Orlicka-Płocka M. et al. // Int. J. Mol. Sci. 2021. V. 22. № 5. P. 1. https://doi.org/10.3390/ijms22052772
Hamilton E.J.M., Leung H.T., Kultyshev R.G. et al. // Inorg. Chem. 2012. V. 51. № 4. P. 2374. https://doi.org/10.1021/ic2023709
Laila Z., Abi-Ghaida F., al Anwar S. et al. // Main Group Chem. 2015. V. 14. № 4. P. 301. https://doi.org/10.3233/MGC-150173
Varkhedkar R., Yang F., Dontha R. et al. // ACS Cent. Sci. 2022. V. 8. № 3. P. 322. https://doi.org/10.1021/acscentsci.1c01132
Неумолотов Н.К., Селиванов Н.А., Быков А.Ю. и др. // Журн. неорган. химии. 2022. Т. 67. С. 1417.
Rzeszotarska E., Novozhilova I., Kaszyński P. // Inorg. Chem. 2017. V. 56. № 22. P. 14351. https://doi.org/10.1021/acs.inorgchem.7b02477
Kapuscinski S., Abdulmojeed M.B., Schafer T.E. et al. // Inorg. Chem. Front. 2021. V. 8. № 4. P. 1066. https://doi.org/10.1039/d0qi01353f
Voinova V.V., Selivanov N.A., Plyushchenko I.V. et al. // Molecules. 2021. V. 26. № 1. P. 248. https://doi.org/10.3390/molecules26010248
Nelyubin A.V., Klyukin I.N., Novikov A.S. et al. // Mendeleev Commun. 2021. V. 31. № 2. P. 201. https://doi.org/10.1016/j.mencom.2021.03.018
Нелюбин А.В., Селиванов Н.А., Быков А.Ю. и др. // Журн. неорган. химии. 2022. Т. 67. С. 1588.
Prikaznov A.V., Shmal’ko A.V., Sivaev I.B. et al. // Polyhedron. 2011. V. 30. № 9. P. 1494. https://doi.org/10.1016/j.poly.2011.02.055
Semioshkin A.A., Sivaev I.B., Bregadze V.I. // Dalton Trans. 2008. V. 11. № 8. P. 977. https://doi.org/10.1039/b715363e
Yorov K.E., Zhdanov A.P., Kamilov R.Kh. et al. // ACS Appl. Nano Mater. 2022. V. 5. № 8. P. 11529. https://doi.org/10.1021/acsanm.2c02550
Stepanova M., Dobrodumov A., Averianov I. et al. // Polymers (Basel). 2022. V. 14. № 18. P. 3864. https://doi.org/10.3390/polym14183864
Нелюбин А.В., Соколов М.С., Селиванов Н.А. и др. // Журн. неорган. химии. 2022. Т. 67. С. 1562.
Nelyubin A.V., Selivanov N.A., Bykov A.Yu. et al. // Int. J. Mol. Sci. 2021. V. 22. № 24. P. 13391. https://doi.org/10.3390/ijms222413391
Bruker, SAINT, Bruker AXS Inc., Madison, WI, 2018.
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Crystallogr. 2015. V. 48. № 1. P. 3. https://doi.org/10.1107/S1600576714022985
Sheldrick G.M. // Acta Crystallogr., Sect. A. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053273314026370
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. № 2. P. 339. https://doi.org/10.1107/S0021889808042726
Allen F.H., Kennard O., Watson D.G. et al. // J. Chem. Soc., Perkin Trans. II 1987. P. S1. https://doi.org/10.1039/p298700000s1
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии