Журнал неорганической химии, 2023, T. 68, № 6, стр. 808-815
β-Дикетонаты дифторида бора: строение и фосфоресценция
А. Г. Мирочник a, Е. В. Федоренко a, *, А. В. Герасименко a
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
* E-mail: gev@ich.dvo.ru
Поступила в редакцию 22.12.2022
После доработки 09.02.2023
Принята к публикации 27.02.2023
- EDN: UFTQBB
- DOI: 10.31857/S0044457X22602334
Аннотация
Систематизированы данные по фосфоресценции β-дикетонатов дифторида бора различного строения. Для молекул β-дикетонатов дифторида бора, имеющих неплоское строение, характерна инверсия S1- и T2-уровней, что способствует эффективному заселению триплетных уровней и интенсивной фосфоресценции или замедленной флуоресценции кристаллов. Для молекул плоского строения характерны классическая последовательность синглетных и триплетных уровней и копланарное расположение антипараллельных молекул, что способствует эксимерной замедленной флуоресценции.
ВВЕДЕНИЕ
В настоящее время проводятся интенсивные исследования органических красителей, обладающих фосфоресценциией и замедленной флуоресценцией при комнатной температуре [1–5]. Такие материалы перспективны для создания органических светоизлучающих диодов (OLEDs), хемосенсоров, датчиков температуры, биовизуализации и т.д. Органические фотолюминесцентные материалы обычно считаются нефосфоресцирующими из-за чрезвычайно слабой спин-орбитальной связи и высокой чувствительности к температуре и доступу кислорода [6]. β-Дикетонаты дифторида бора, как правило, обладают фосфоресценцией только при низких температурах, когда безызлучательная релаксация триплетного состояния ингибируется низкой подвижностью молекулы красителя [7, 8]. Для разработки оптических функциональных материалов, обладающих интенсивной фосфоресценцией при комнатной температуре, актуальным является выявление взаимосвязи электронного и геометрического строения люминофоров и эффективности заселения триплетных состояний молекул [9, 10].
В последнее время появились работы, посвященные фосфоресценции β-дикетонатов бора при комнатной температуре [11, 12]. β-Дикетонаты дифторида бора, в отличие от большинства органических соединений, ярко люминесцируют не только в растворе, но и в кристаллах [13, 14]. Благодаря яркой люминесценции и хорошей фотоустойчивости в кристаллическом состоянии β-дикетонаты дифторида бора могут использоваться в качестве люминофора в OLEDs [15]. Среди β-дикетонатов дифторида бора встречаются соединения, имеющие в кристаллическом состоянии люминесценцию от ярко-голубой до инфракрасной. Характерной особенностью комплексов бора является образование в кристаллах молекулярно-организованных систем, в том числе димеров, тримеров и агрегатов сопряженных молекул, супрамолекулярная архитектура которых и приводит к возникновению уникального комплекса межмолекулярных взаимодействий, включающего в себя димерное (эксимерное), междимерное и стэкинг-взаимодействие. В связи с этим для понимания особенностей люминесценции кристаллических β-дикетонатов дифторида бора необходимо сопоставление их спектральных и структурных характеристик.
В настоящей работе представлены результаты сравнительного анализа строения и люминесцентных свойств ряда β-дикетонатов дифторида бора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все соединения выделены в виде монокристаллов и параметры ячеек кристаллов соответствуют данным, указанным в работах, приведенных в табл. 1. Исследуемые комплексы получены и очищены в соответствии с методиками, приведенными в работах [16–22]: 2 и 9 – взаимодействием соответствующих β-дикетонов с эфиратом трифторида бора [16]; 1, 3–5 – ацилированием ароматических соединений уксусным ангидридом и газообразным трифторидом бора [17]; 6 и 7 – ацилированием α- и β-нафтолов уксусным ангидридом и бис-ацетатом трифторида бора [18]; 8 – ацилированием пара-ацетоксиацетофенона уксусным ангидридом и α-эфиратом трифторида бора [19]; 10, 11 – ацилированием α- и β-нафтолов уксусным ангидридом и эфиратом трифторида бора [20]; 12 – взаимодействием орто-гидроксидибензоилметана с эфиратом трифторида бора и борнобутиловым эфиром [21]; 13 – ацилированием антрацена уксусным ангидридом и газообразным трифторидом бора [22].
Таблица 1.
Люминесцентные свойства кристаллов и элементы кристаллической структуры комплексов
1–13 общей формулы 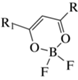
| № соединения | R | R1 | Iотн, отн. ед.** | λфл, нм | λ*ЗФ/λфос, нм | τ, мкс | Ссылка, CCDC | Структурный элемент |
|---|---|---|---|---|---|---|---|---|
| 1 | 2,4,6-(СН3)3С6Н2 | СН3 | 116 | 395 | 535 | 0.20 | [28] 794178 |
Одиночные молекулы, отсутствие стопок |
| 2 | C6H5 | СН3 | 16 | 420/450 | 480/600 | 0.06/0.31 | [30] 1118051 |
Стопка антипараллельных молекул |
| 3 | p-CH3C6H4 | СН3 | 120 | 435 | 545 | 0.14 | [31] 184216 |
Стопка параллельных молекул |
| 4 | p-CH3ОC6H4 | СН3 | 240 | 475 | 495/522 | 0.14 | [32] 184216 |
Стопка антипараллельных молекул |
| 5 |  |
СН3 | 7 | 480 | 480/520 | 0.02 | [33] 751758 |
Стопка из димеров |
| 6 | α-С10Н7 | СН3 | 423 | 463/598 | 33/10* | [18] 721686 |
Димеры | |
| 7 | β-С10Н7 | СН3 | 537 | 527/607, 667 | 8/17* | [34] 21686 |
Стопка из димеров | |
| 8 |  |
СН3 | 4 | 400/510 | 550 | 0.23 | Наст. работа | Стопка параллельных молекул |
| 9 | C6H5 | C6H5 | 1 | 460/520 | 460/550 | 0.03 | [13] 937594 |
Кирпичная кладка |
| 10 | 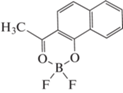 |
– | 520 | – | – | [20] QELWIO1 |
Стопка антипараллельных молекул | |
| 11 | 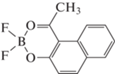 |
14 | 450 | 490 | 0.20/1.54 | [20] QELWOU |
Димеры | |
| 12 | о-НОC6H4 | C6H5 | 180 | 460 | 535 | 0.10/1.25 | [21] 1866695 |
Кирпичная кладка |
| 13 | 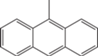 |
СН3 | 90 | 555 | 610 | 0.29/1.58 | [22] 653442 |
Стопки из антраценовых фрагментов |
1 – Бесцветные кристаллы, tпл = 103–104°С. ИК-спектр (KBr), ν, см–1: 1611, 1590 (С6Н4), 1554, 1541 (С=О, С=С), 1156, 1138 (B–F), 1072, 1050 (В–О). Найдено, %: С 61.36, Н 6.09. Вычислено для С13H15BF2O2, %: С 61.94, Н 6.00.
2 – Бесцветные кристаллы, tпл = 155–156°C; ИК-спектр (KBr), ν, см–1: 3138 (OHas), 2928 (C–HPh), 1597 (C=O), 1547(C=C), 1439 (CH3), 1367, 1358 (δs(B–O)), 1156, 1138, 1113 (δ(B–F)), 1090, 1057 (δas(B–O)). Найдено, %: С 55.96, H 4.82. Вычислено для C10H9BF2O2, %: С 55.72, Н 4.78.
3 – Бесцветные игольчатые кристаллы, tпл = = 158–159°С. ИК-спектр (KBr), ν, см–1: 1610, 1592 (С6Н4), 1550, 1510 (С=О, С=С), 1164, 1143 (B–F), 1085, 1050 (В–О). Найдено, %: С 59.32, Н 4.89. Вычислено для С11H11BF2O2, %: С 58.02, Н 4.95.
4 – Бледно-желтые полупрозрачные кристаллы, tпл = 147–149°С. ИК-спектр (KBr), ν, см–1: 1606 (С6Н4), 1561, 1511 (С=О, С=С), 1222, 1189 (B–F), 1085, 1053 (В–О). Найдено, %: С 54.55, Н 4.70. Вычислено для С11H11BF2O3, %: С 54.82, Н 4.62.
5 – Желто-оранжевые кристаллы, tпл = 260–261°С. ИК-спектр (KBr), ν, см–1: 1560, 1543 (С=О, С=С), 1152, 1128 (B–F), 1059, 1024 (В–О). Найдено, %: С 68.63, Н 4.36. Вычислено для С17H13BF2O2, %: С 68.50, Н 4.40.
6 – Бледно-желтые полупрозрачные кристаллы, tпл = 153–155°C, ИК-спектр (KBr), ν, cм–1: 3145, 3062 (С–HAr), 1627 (C10H7), 1598, 1541 (C=O, C=C), 1373 (B–O), 1184, 1155 (B–F), 1078, 1053 (B–O). Найдено, %: C 64.45, H 4.22. Вычислено для C14H11BF2O2, %: C 64.66, H 4.26.
7 – Ярко-желтые кристаллы, tпл = 182–183°C. ИК-спектр (KBr), ν, см–1: 3145, 3064 (С–HAr), 1627 (C10H7), 1598, 1542 (C=O, C=C), 1373 (B–O), 1184, 1153 (B–F), 1078, 1049 (B–O). Найдено, %: C 64.40, H 4.28. Вычислено для C14H11BF2O2, %: C 64.66, H 4.26.
8 – Палево-желтые кристаллы, tпл = 160–161°C. ИК-спектр (KBr), ν, см–1: 1756 (СH3C=O), 1586 (C6H4), 1543, 1506 (C=O, C=C), 1350 (B–O), 1197, 1172 (B–F), 1047, 1012 (B–O). Найдено, %: С 53.74, Н 4.12. Вычислено для C12H11BF2O4, %: С 53.78, Н 4.14.
9 – Бледно-желтые полупрозрачные кристаллы, tпл = 190–191°C. ИК-спектр (KBr), ν, см–1: 1595 С6H5), 1547, 1488 (C=O, C=C), 1373 (B–O), 1247, 1153 (B–F), 1103, 1045 (B–O). Найдено, %: С 66.28, Н 4.11. Вычислено для C15H11BF2O2, %: С 66.22, Н 4.08.
10 – Оранжевые кристаллы, tпл = 193–194°C. ИК-спектр (KBr), ν, см–1: 1619, 1599 (C10H7), 1565, 1530, 1459 (С=О, С=С), 1200–1170 (B–F), 1062–1044 (B–O). Найдено, %: С 61.61, Н 3.92. Вычислено для C12H9BF2O2, %: С 61.59, Н 3.88.
11 – Бледно-желтые полупрозрачные кристаллы, tпл = 156–157°C. ИК-спектр (KBr), ν, см–1: 1627, 1580 (C10H7), 1545, 1490, 1474 (С=О, С=С), 1200–1190, 1062 (B–F, B–O). Найдено, %: С 61.56, Н 3.90. Вычислено для C12H9BF2O2, %: С 61.59, Н 3.88.
12 – Палево-желтые кристаллы, tпл = 195–196°C. ИК-спектр (KBr), ν, см–1: 3459 (O–H), 1624 (C6H5, C6H4), 1566, 1539 (C=O, C=C), 1157, 1134 (B–F), 1083, 1049 (B–O). Найдено, %: C 62.36, H 3.74. Вычислено для C15H11BF2O3, %: C 62.54, H 3.85.
13 – Коричневые кристаллы, tпл = 228–229°С. ИК-спектр (KBr), ν, см–1: 1626 (С10Н7), 1571, 1541 (С=О, С=С), 1190, 1167 (B–F), 1086, 1065 (В–О). Найдено, %: С 69.27, Н 4.23. Вычислено, для С18H13BF2O2%: С 69.23, Н 4.26.
Температуру плавления определяли на приборе Buchi Melting Point B-540. ИК-спектры записывали на ИК-Фурье-спектрометре Spectrum BX 400 (Perkin Elmer, США). Спектры люминесценции и возбуждения регистрировали на спектрофлуориметре Shimadzu RF 5301 (Shimadzu, Япония). Спектры и время жизни фосфоресценции при комнатной температуре записывали на спектрометре Varian Cary Eclipse (Agilent Technologies Inc., США), при 77 K – на приборе Fluorolog 3 (Япония).
Рентгеноструктурное исследование кристалла 8, полученного перекристаллизацией из ацетонитрила, выполнено в системе SMART-1000 CCD фирмы Bruker при температуре 296(2) K с использованием МоKα-излучения. Сбор экспериментальных данных с образца проведен тремя группами по 906 кадров при значениях углов φ = 0°, 90° и 180° ω-сканированием с шагом 0.2° и экспозицией по 20 с на каждый кадр. Уточнение параметров элементарной ячейки и пересчет интегральных интенсивностей в модули структурных амплитуд проведены с помощью программного комплекса APEX2 [23].
Структура 8 определена прямым методом с последующим уточнением позиционных и тепловых параметров в анизотропном приближении для всех неводородных атомов по программам SHELXTL [24]. Положения атомов водорода определены и уточнены по модели “наездника” с расстоянием С–Н 0.93 Å.
Кристаллографические данные для C12H11O4BF2: призма (0.35 × 0.16 × 0.10 мм), моноклинная сингония, пр. гр. Сс, a = 11.6171(6), b = 11.5684(6), c = = 10.4190(5) Å, β = 122.097(2)°, V = 122.097(2) Å3, Z = 4, ρрасч = 1.501 г/см3, μ = 0.130 мм–1, MoKα-излучение (λ = 0.71073 Å), область сбора данных по θ 2.717°–31.103°, количество измеренных отражений (Rint) 13780, количество отражений с I ≥ 2σ(I) 3630, число уточняемых параметров 174, для I > 2σ(I) R1 = 0.0274, wR2 = 0.0762; для всех отражений R1 = 0.0291, wR2 = 0.0776.
Кристаллографическая информация депонирована в Кембриджском банке структурных данных под номером CCDC 2225753, откуда может быть получена по запросу на интернет-сайте: www.ccdc.cam.ac.uk/data_request/cif
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для исследования взаимосвязи кристаллической структуры и люминесцентных свойств были выбраны 13 ярко люминесцирующих кристаллических соединений, кристаллическая структура 12 из них изучена ранее, ссылки на соответствующие работы приведены в табл. 1.
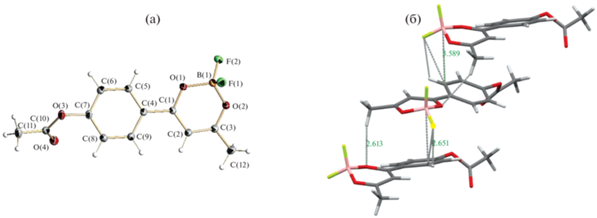
На рис. 1 представлена структура молекулы исследуемого в настоящей работе комплекса 8. С одной стороны, это соединение можно рассматривать как сложный эфир уксусной кислоты (ацетат), а с другой – как β-дикетонат дифторида бора с акцепторным заместителем. Следует отметить следующие особенности: молекула является неплоской, атом бора и центральный атом углерода дикетонатного цикла приподняты над плоскостью молекулы по типу “ванны”. Ацетатная группа находится в пара-положении фенильного кольца, угол между плоскостями фенильного кольца и ацетататной группы составляет 60°, при таком наклоне n-электроны атома О(3) слабо взаимодействуют с π-электронами фенильного кольца. В молекуле 8 присутствуют три атома, которые могут образовывать водородные связи: атомы фтора и атом кислорода карбоксильной группы, что способствует эффективному межмолекулярному взаимодействию. В кристалле 8 молекулы организованы в стопки, параллельные оси а. Внутри стопки наблюдается π–π-стекинг-взаимодействие между фенильным кольцом одной молекулы и хелатным циклом другой (1б). Взаимодействующие молекулы также связаны с соседними π–π-стекинг-взаимодействием в структуру типа “скошенная лестница”, характерную для J-агрегатов. Стопки соединяются между собой связями С–F…H и C=O…H (рис.1б), характерными для кристаллов фторорганических соединений [25–27].
Рис. 1.
Кристаллическое строение комплекса 8: строение молекулы (а), стопочный фрагмент кристалла (б).
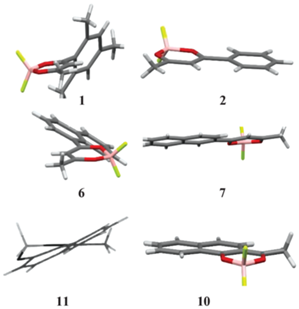
Для исследуемых кристаллов 1–13 обнаружена фосфоресценция, для ряда соединений наблюдается и замедленная флуоресценция. Среди исследуемых соединений выделяются две пары изомеров (6 и 7, 10 и 11) и соединения 1 и 2, имеющие одинаковое строение π-системы молекулы (рис. 2). При одинаковом количестве π-электронов у одинаковых атомов соединения отличаются геометрическим строением: в молекулах 1, 6, 11 ароматический заместитель находится под углом к хелатному циклу, а молекулы 2, 7, 10 их аналогов плоские.
На примере соединения 2, имеющего плоские молекулы, и соединения 1, фенильное кольцо которого развернуто на 55° относительно хелатного цикла, рассмотрим влияние геометрического фактора на пути дезактивации возбужденного состояния в кристаллах. Наличие метильных заместителей в орто-положениях фенильного кольца в 1 приводит к иному типу кристаллической упаковки по сравнению с 2 и, как следствие, к различным типам межмолекулярных взаимодействий [28].
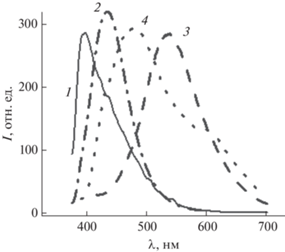
В кристаллах 1 фенильные кольца соседних молекул расположены друг к другу Т-образно, при этом перекрывание π-систем соседних молекул отсутствует. Молекулы 2 упакованы в виде стопок, параллельных оси с, с межмолекулярным расстоянием 3.44 Å, в кристалле 2 реализуется эффективное π–π-стекинг-взаимодействие. Различные виды взаимодействия в кристаллах 1 и 2 приводят к образованию различных по своей природе люминесцирующих центров. На рис. 3 представлены спектры флуоресценции и фосфоресценции кристаллов 1 и 2. Для кристаллов 1 наблюдается мономерная флуоресценция (λmaх = 395 нм) и фосфоресценция (λmax = 535 нм, τ = 0.20 мкс) (рис. 3). В спектре фосфоресценции 2 наблюдаются две полосы с максимумами при 480 и 600 нм, относящиеся к замедленной флуоресценции эксимеров и фосфоресценции соответственно.
Рис. 3.
Спектры люминесценции кристаллов 1 (1 – флуоресценция, 3 – фосфоресценция) и 2 (2 – флуоресценция, 4 – фосфоресценция).
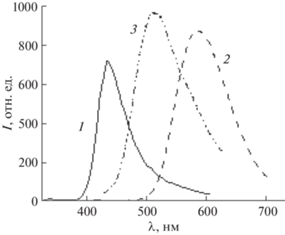
Геометрия изомеров 10 и 11 также различна. Молекулы 10 являются плоскими и упакованы в стопки с эффективным π-стекинг-взаимодействием, приводящим к эксимерной люминесценции с максимумом при 523 нм. Молекулы 11 имеют излом по линии бор–центральный атом углерода хелатного кольца и способны к образованию только димеров [20], при этом максимум спектра люминесценции кристаллов при 450 нм соответствует мономерной флуоресценции. Для 10 фосфоресценция и замедленная флуоресценция отсутствуют. Для 11 наблюдается фосфоресценция с максимумом при 590 нм (рис. 4).
Рис. 4.
Спектры люминесценции кристаллов 11 (1 – флуоресценция, 2 – фосфоресценция) и 10 (3 – флуоресценция).
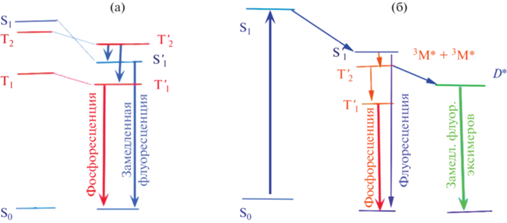
Для выявления причины различных путей дезактивации энергии электронного возбуждения в исследуемых изомерах проведено квантово-химическое моделирование молекул 10 и 11 [29]. Для 11, в отличие от 10, наблюдается инверсия уровней S1 и T2 при колебательной релаксации из геометрии S0 в оптимальную геометрию S1, что определяется пересечением поверхностей потенциальной энергии в состояниях S1 и T2. Далее следуют процессы внутренней конверсии T2 → T1 и наблюдается эмиссия при переходе T1 → S0 (рис. 5а).
Рис. 5.
Диаграмма фотофизических процессов в кристаллах неплоских молекул (а), плоских молекул β-дикетонатов дифторида бора (б).
Для кристаллов 6 и 7 кроме фосфоресценции наблюдается замедленная флуоресценция. В случае кристаллов 7 наблюдается малоинтенсивная замедленная флуоресценция и яркая фосфоресценция, а для 6, наоборот, в спектре превалирует полоса замедленной флуоресценции, совпадающая с полосой флуоресценции разбавленного раствора [18] (рис. 6).
Рис. 6.
Спектры люминесценции кристаллов: 1 – флуоресценция 6, 2 – замедленная флуоресценция 6, 3 – флуоресценция 7, 4 – фосфоресценция 7.
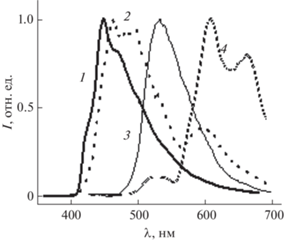
Для выявления причины различных путей дезактивации энергии электронного возбуждения в исследуемых изомерах проведено квантово-химическое моделирование молекул 6 и 7 [18]. Для 6, в отличие от 7, наблюдается инверсия уровней S1 и T2 при колебательной релаксации из геометрии S0 в оптимальную геометрию S1, что обусловливает пересечение поверхностей потенциальных энергий в состояниях S1 и T2 (рис. 5а). В случае 6 инверсия уровней S1 и T2 при релаксации из геометрии S0 в оптимальную геометрию S1 способствует заселению T2-уровня, фосфоресценции по каналу T2 → T1 → S0 и замедленной флуоресценции по каналу T2 → S1 → S0. Замедленная флуоресценция кристаллов 6, как и флуоресценция 7, является мономерной [18] (рис. 6).
Для 7 наблюдается классическое расположение синглетных и триплетных уровней (рис. 5б). Заселение T2-уровня происходит с S1 (T2 → T1 → S0). Флуоресценция кристаллов 7 (530 нм) совпадает с эксимерной флуоресценцией растворов с высокой концентрацией 7 и является эксимерной. Замедленная флуоресценция кристаллов (531 нм) также эксимерная [18]. Обращает на себя внимание значительно бόльшая интенсивность и длительность замедленной флуоресценции кристаллов 6 по сравнению 7.
Таким образом, анализ люминесцентных свойств трех пар соединений: 1 и 2, 6 и 7, 10 и 11 позволяет выявить некоторые закономерности. Неплоское строение молекулы β-дикетоната дифторида бора (1, 6, 10) способствует инверсии S1- и T2-уровней, и наблюдается интенсивная фосфоресценция, что определяется пересечением поверхностей потенциальных энергий в состояниях S1 и T2 (рис. 5а). Для молекул 3, 8, 12 и 13, не образующих характерных для β-дикетонатов дифторида бора димеров антипараллельных молекул, наблюдается только фосфоресценция (табл. 1).
В то же время плоское строение молекул, их копланарное расположение, классическая последовательность синглетных и триплетных уровней, небольшой энергетический зазор между S1, T1 и T2 способствуют эксимерной замедленной флуоресценции. Для кристаллов 2, 4, 7 и 9, молекулы которых плоские, с антипараллельным расположением в стопках, благоприятным для образования эксимеров, наблюдается интенсивная эксимерная замедленная флуоресценция P-типа, которая происходит в результате триплет-триплетной аннигиляции с образованием эксимера (рис. 5б).
ЗАКЛЮЧЕНИЕ
Систематизированы данные по фосфоресцентным свойствам β-дикетонатов дифторида бора различного строения: 1) с плоскими молекулами, когда вся молекула лежит в одной плоскости, 2) с неплоскими молекулами, когда вследствие стерических затруднений ароматический заместитель развернут под углом к хелатному циклу. Неплоское строение молекулы β-дикетоната дифторида бора способствует инверсии S1- и T2-уровней, эффективному заселению триплетных уровней и интенсивной фосфоресценции кристаллов. В то же время для молекул, имеющих плоское строение, характерна классическая последовательность синглетных и триплетных уровней, а небольшой энергетический зазор между S1, T1 и T2 способствует заселению триплетного уровня. Для плоских молекул с антипараллельным расположением в стопках, благоприятным для образования эксимеров, наблюдается интенсивная эксимерная замедленная флуоресценция P-типа, при этом происходит триплет-триплетная аннигиляция с образованием эксимера. При расположении, неблагоприятном для образования эксимеров, происходит фосфоресценция кристаллов. Полученные в работе данные могут быть полезны для разработки перспективных люминесцентных материалов, обладающих долгоживущей эмиссией.
Список литературы
Gan N., Shi H., An Z. et al. // Adv. Funct. Mater. 2018. V. 28. № 51. P. 1802657 https://doi.org/10.1002/adfm.201802657
Zhang T., Ma X., Wu H. // Angew. Chem. Int. Ed. Engl. 2020. V. 28. P. 11206. https://doi.org/10.1002/anie.201915433
Wang X., Dong M., Li Z. et al. // Dyes Pigm. 2022. V. 204. P. 110400. https://doi.org/10.1016/j.dyepig.2022.110400
Wu Z., Nitsch J., Marder T.B. // Adv. Opt. Mater. 2021. V. 9. P. 2100411. https://doi.org/10.1002/adom.202100411
Chikineva T.Y., Koshelev D.S., Medved’ko A.V. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 170. https://doi.org/10.1134/S0036023621020054
Ma H., Lv A., Fu L. et al. // Ann. Phys. 2019. V. 531. P. 1800482. https://doi.org/10.1002/andp.201800482
Chow Y.L., Johansson C.I., Zhang Y. et al. // J. Phys. Org. Chem. 1996. V. 9. P. 7.
Xu P., Chen H., Duan H. et al. // Russ. J. Gen. Chem. 2022. V. 92. P. 1814. https://doi.org/10.1134/S1070363222090225
Kozenkov V.M., Spakhov A.A., Belyaev V.V. et al. // Liq. Cryst. 2016. V. 16. № 4. P. 9. https://doi.org/10.18083/LCAppl.2016.4.9
Zhinzhilo V.A., Uflyand I.E. // Russ. J. Gen. Chem. 2022. V. 92. P. 1937. https://doi.org/10.1134/S1070363222100097
Zhang G., Chen J., Payn S.J. et al. // J. Am. Chem. Soc. 2007. V. 129. № 29. P. 8942. https://doi.org/10.1021/ja0720255
Li J., Wang X., Zhao X. et al. // Chin. J. Chem. 2022. V. 40. № 21. P. 2507. https://doi.org/10.1002/cjoc.202200354
Sakai A., Tanaka M., Ohta E. et al. // Tetrahedron Lett. 2012. V. 53. P. 4138. https://doi.org/10.1016/j.tetlet.2012.05.122
Poggi B., Lopez E., Mйtivier R. et al. // Macromol. Rapid Commun. 2022. V. 43. P. 2200134. https://doi.org/10.1002/marc.202200134
Domercq B., Grasso C., Maldnado J.-L. et al. // J. Phys. Chem. B. 2004. V. 108. P. 8647. https://doi.org/10.1021/jp036779r
Карасев В.Е., Коротких О.А. // Журн. неорган. химии. 1986. Т. 31. С. 869.
Mirochnik A.G., Puzyrkov Z.N., Fedorenko E.V. et al. // Russ. J. Inorg. Chem. 2022. V. 67. P. 1425. [Мирочник А.Г., Пузырьков З.Н., Федоренко Е.В. и др. // Журн. неорган. химии. 2022. Т. 67. № 9. С. 1292.]https://doi.org/10.1134/S003602362209008X
Fedorenko E.V., Mirochnik A.G., Gerasimenko A.V. et al. // J. Photochem. Photobiol. Chem. 2021. V. 412. P. 113220. https://doi.org/10.1016/j.jphotochem.2021.113220
US Pat. 004846; 16.20.2003 Publ.
Буквецкий Б.В., Федоренко Е.В., Мирочник А.Г. и др. // Журн. структур. химии. 2006. Т. 47. № 1. С. 60.
Fedorenko E.V., Mirochnik A.G., Gerasimenko A.V. et al. // Dyes Pigm. 2018. V. 159. P. 557. https://doi.org/10.1016/j.dyepig.2018.07.022
Fedorenko E.V., Bukvetskii B.V., Mirochnik A.G. et al. // J. Lumin. 2010. V. 130. № 5. P. 756.https://doi.org/10.1016/j.jlumin.2009.11.027
Bruker. APEX2. Bruker AXS Inc., Madison, 2012.
Sheldrick G.M. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, 1998.
Thalladi V.R., Weiss H.-C., Bla¨ser D. et al. // J. Am. Chem. Soc. 1998. V. 12. № 34. P. 8702. https://doi.org/10.1021/ja981198e
Brammer A., Bruton E., Sherwood P. // Cryst. Growth Des. 2001. V. 1. P. 277. https://doi.org/10.1021/cg015522k
Rohde D., Yan C.-J., Wan L.-J. // Langmuir. 2006. V. 22. P. 4750. https.//doi.orghttps://doi.org/10.1021/la053138+
Федоренко Е.В., Буквецкий Б.В., Мирочник А.Г. и др. // Изв. АН. Сер. хим. 2009. № 11. С. 2174.
Tikhonov S.A., Fedorenko E.V., Mirochnik A.G. et al. // Spectrochim. Acta A. 2019. V. 214. P. 67. https://doi.org/10.1016/j.saa.2019.02.002
Hanson A.W., Macaulay E.W. // Acta Crystallogr. 1972. V. 28. P. 1961.
Mirochnik A.G., Bukvetskii B.V., Gukhman E.V. et al. // J. Fluor. 2003. V. 13. № 2. P. 157. https://doi.org/10.1023/A:1022939209971
Dromzee Y., Kossanyi J., Wintgens V. // Z. Kristallogr. 1997. V. 212. P. 372. https://doi.org/10.1524/zkri.1997.212.5.372
Буквецкий Б.В., Федоренко Е.В., Мирочник А.Г. // Журн. структур. химии. 2011. Т. 52. № 1. С. 223.
Буквецкий Б.В., Федоренко Е.В., Мирочник А.Г. и др. // Журн. структур. химии. 2010. Т. 51. № 3. С. 563.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии