Журнал неорганической химии, 2023, T. 68, № 6, стр. 701-723
Борсодержащие кумарины (обзор)
Ю. Н. Ласькова a, А. А. Сердюков a, b, И. Б. Сиваев a, c, *
a Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119334 Москва, ул. Вавилова, 28, Россия
b Институт тонких химических технологий им. М.В. Ломоносова,
Российский технологический университет
119571 Москва, пр-т Вернадского, 86, Россия
c Российский экономический университет им. Г.В. Плеханова
115093 Москва, Стремянный пер., 36, Россия
* E-mail: sivaev@ineos.ac.ru
Поступила в редакцию 13.01.2023
После доработки 18.02.2023
Принята к публикации 20.02.2023
- EDN: UGAUJA
- DOI: 10.31857/S0044457X23600020
Аннотация
Обобщены методы синтеза, свойства и области применения различных борсодержащих производных кумарина. Особое внимание уделено производным с различными полиэдрическими борными кластерами в качестве заместителей, такими как карбораны, металлакарбораны и клозо-додекаборатный анион. Рассмотрены также производные кумарина с простыми борорганическими заместителями – бороновые кислоты и их эфиры.
ВВЕДЕНИЕ
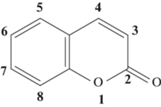
Кумари́ны – класс природных органических соединений, представляющих собой ненасыщенные ароматические лактоны, в основе которых лежит 5,6-бензо-α-пирон (кумарин) – лактон цис-орто-оксикоричной кислоты (рис. 1) [1–5]. Природные кумарины и их синтетические аналоги обладают разносторонней фармакологической активностью, проявляют спазмолитическое, противоопухолевое, антибактериальное, антивирусное, антикоагулянтное и другие виды действия [6–27]. Наряду с биологической активностью кумарины обладают уникальными флуоресцентными свойствами, что привело к их широкому использованию в медицинской химии и различных биологических исследованиях в качестве флуоресцентных зондов и меток [28].
Это обусловливает интерес к синтезу и исследованию различных борсодержащих производных кумарина, в первую очередь соединений, содержащих в своем составе борные кластеры, включая полиэдрические бороводородные анионы, карбораны и металлокарбораны, которые представляют интерес для использования в бор-нейтронозахватной терапии рака [29–31], а также для ряда других направлений использования в медицине [32–40].
В предлагаемом обзоре рассматриваем различные подходы к синтезу борсодержащих производных кумарина, включая как соединения с борными кластерами, так и типичные борорганические соединения.
ПРОИЗВОДНЫЕ КУМАРИНА С КЛОЗО-КАРБОРАНАМИ В КАЧЕСТВЕ ЗАМЕСТИТЕЛЯ
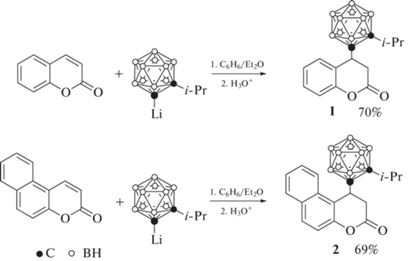
Карборансодержащие производные кумарина были первыми из описанных борсодержащих производных кумарина, что во многом обусловливается простотой их синтеза. Благодаря сильному электроноакцепторному эффекту карборанового остова, CH-группы в орто-карборане обладают кислым характером (pKa ~ 23 [41]), близким к кислотности ацетиленов [42]. Это позволяет металлировать карборан и его производные сильными металлоорганическими основаниями, такими как н-бутиллитий или реактивы Гриньяра, с образованием соответствующих C-литиевых и C-магниевых производных. Последние являются хорошими нуклеофилами и реагируют с карбонильной группой кумарина с образованием продуктов 1,4-присоединения. Так, реакции литиевого производного 1-изопропил-орто-карборана с кумарином и 6,7-бензокумарином приводят к образованию соответствующих продуктов 1,4-присоединения 1 и 2 (схема 1 ) [43–45].
Схема 1 .
Несмотря на то, что для литийорганических соединений, в отличие от реактивов Гриньяра, обычно характерны реакции 1,2-присоединения, в данных реакциях образуются только продукты 1,4-присоединения, что, по-видимому, обусловлено стерическими затруднениями со стороны изопропильной группы при соседнем атоме углерода орто-карборана.
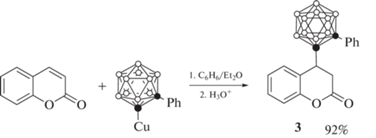
Соединения 1 и 2 также могут быть получены с использованием медного производного 1-изопропил-орто-карборана [46]. Аналогичным образом реакция медного производного 1-фенил-орто-карборана с кумарином приводит к образованию соединения 3 (схема 2 ) [46].
Схема 2 .
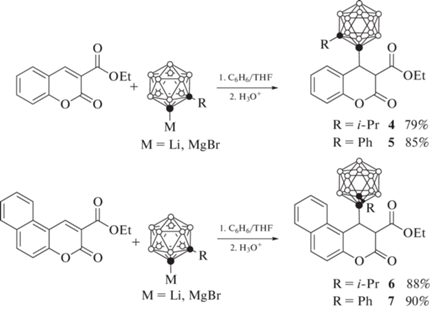
Аналогичным образом реакции литиевого и магниевого производных 1-изопропил- и 1-фенил-орто-карборана с 3-карбэтоксикумарином и 3-карбэтокси-6,7-бензокумарином приводят к образованию соответствующих продуктов 1,4-присоединения 4–7 (схема 3 ) [43–45, 47]. Соединения 5 и 6 также могут быть получены с использованием медных производных 1-фенил- и 1-изопропил-орто-карборана соответственно [46].
Схема 3 .
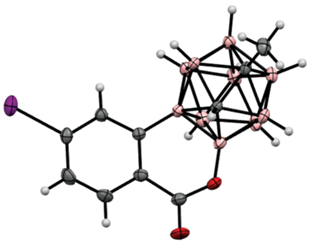
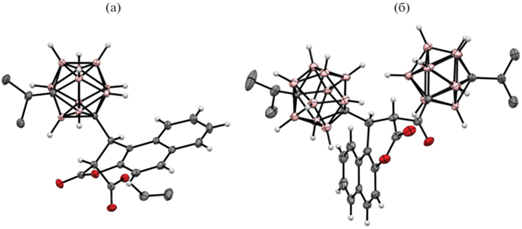
Строение орто-карборанильных производных 3-карбэтоксикумарина 5 [43] и 3-карбэтокси-6,7-бензокумарина 6 [44] подтверждено методом рентгеноструктурного анализа (рис. 2).
Рис. 2.
Молекулярная кристаллическая структура орто-карборанильных производных 3-карбэтоксикумарина 5 (а) и 3-карбэтокси-6,7-бензокумарина 6 (б).
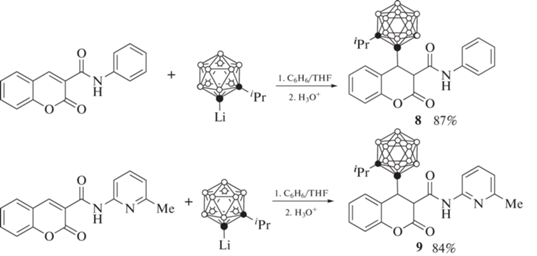
Аналогичным образом взаимодействие литиевого производного 1-изопропил-орто-карборана с 3-фенил-карбамоилкумарином и 3-(6'-метилпирид-2'-ил)карбамоилкумарином приводит к образованию соответствующих продуктов 1,4-присоединения 8 и 9 (схема 4 ) [49].
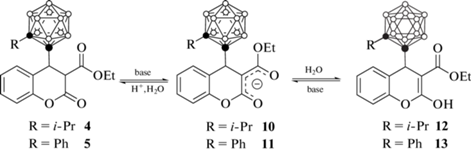
Атом водорода в α-положении к карбонильным группам производных 4 и 5 (положение 3 кумарина) обладает выраженным кислым характером и легко обратимо депротонируется в присутствии оснований (KOH, EtONa, MeNH2, Me2NH, Et3N, пиперидин, морфолин, пиридин, щелочные металлы Li, Na и K или Mg в тетрагидрофуране) с образованием соответствующих енолятов 10 и 11 (схема 5 ) [43, 46, 48, 50]. Гидролиз енолятов приводит к соответствующим гидроксипроизводным 12 и 13 (схема 5 ), которые также могут быть выделены непосредственно из реакции металлоорганических производных орто-карборана с 3-карбэтоксикумарином в отсутствие кислотной после реакционной обработки [43, 50].
Схема 4 .
Схема 5 .
Схема 6 .
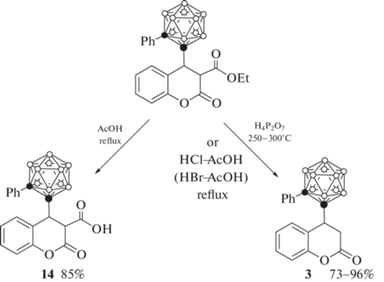
Кипячение орто-карборанильного производного 3-карбоэтоксикумарина 5 в ледяной уксусной кислоте приводит к гидролизу сложного эфира с образованием соответствующей кислоты 14, тогда как его нагревание в пирофосфорной кислоте при 250–300°C или кипячение в смеси уксусной и соляной или бромистоводородной кислот приводит к полной потере заместителя с образованием соединения 3 (схема 6 ) [43].
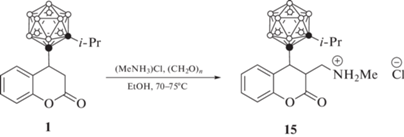
Полученные карборанильные производные кумарина могут быть подвержены дальнейшей модификации. Так, аминометилирование 3,4-дигидрокумарина 1 с использованием гидрохлорида метиламина и формальдегида приводит к амину 15 (схема 7 ) [51].
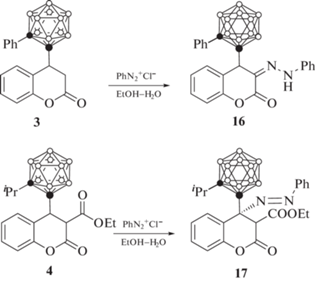
Реакция 3,4-дигидрокумарина 3 с хлоридом фенилдиазония дает гидразон 16, в то время как реакция 3-карбэтокси-3,4-дигидрокумарина 4 приводит к образованию 4-фенилдиазопроизводного 17 (схема 8 ) [51, 52].
Схема 7 .
Схема 8 .
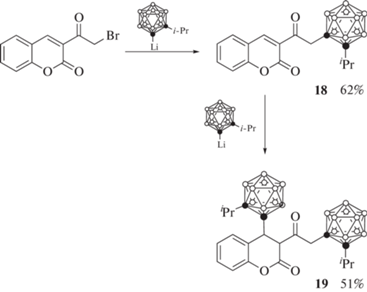
Реакция 3-бромацетилкумарина с 1 экв литиевого производного 1-изопропил-орто-карборана протекает с заменой атома брома карборанильной группой с образованием 18, в то время как реакция с 2 экв литиевого производного 1-изопропил-орто-карборана приводит к 1,4-присоединению с образованием соответствующего производного 19 с двумя карборанильными группами (схема 9 ) [49].
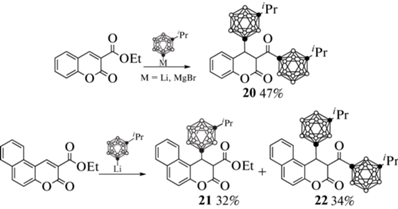
В отличие от литий- и магнийорганических производных 1-изопропил-орто-карборана, аналогичные производные 1-изопропил-мета-карборана реагируют с 3-карбоэтоксикумарином с образованием продукта двойного присоединения карборана (1,2- и 1,4-присоединения) 20, а реакция литиевого производного 1-изопропил-мета-карборана с 3-карбэтокси-6,7-бензокумарином приводит к образованию смеси продукта 1,4-присоединения 21 и продукта двойного присоединения (1,2- и 1,4-присоединение) 22, которые образуются в ходе параллельных реакций (схема 10 ) [43–45]. В то же время реакция менее активного медного производного 1-изопропил-мета-карборана с 3-карбэтокси-6,7-бензокумарином приводит исключительно к образованию продукта 1,4-присоединения 21 [46].
Схема 9 .
Схема 10 .
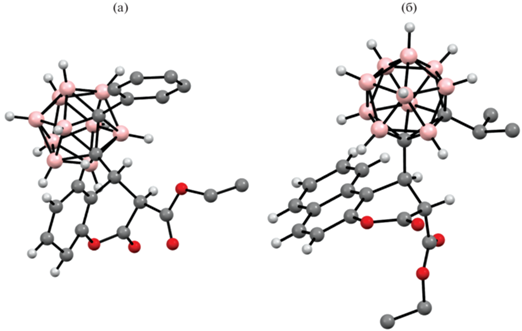
Строение мета-карборанильных производных 3-карбоэтокси-6,7-бензокумарина 21 и 22 подтверждено методом рентгеноструктурного анализа (рис. 3) [44].
Рис. 3.
Молекулярная кристаллическая структура мета-карборанильных 3-карбэтокси-6,7-бензокумарина 21 (а) и 22 (б).
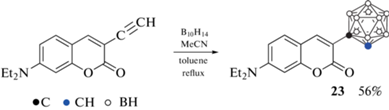
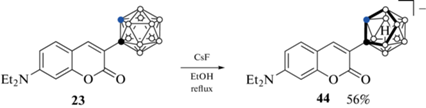
Следует отметить, что во всех рассмотренных выше примерах (за исключением соединения 18) введение карборанильной группы приводит к нарушению электронной системы лактонного кольца, что приводит к значительным изменениям фотофизических характеристик полученных производных по сравнению с исходным кумарином. Поэтому было разработано несколько подходов к получению карборанильных производных кумарина с сохранением двойной связи в лактонном кольце. Так, 3-(орто-карборан-1-ил)-7-диэтиламинокумарин 23 был получен реакцией соответствующего ацетиленового производного кумарина с декабораном в толуоле в присутствии ацетонитрила (схема 11 ) [53].
Схема 11 .
Исследование внутриклеточного накопления кумарина 23 в клетках рака легкого A549 с помощью конфокальной микроскопии продемонстрировало его высокую локализацию в липидных каплях (адипосомах). Помимо этого в неполярных растворителях, полярность которых сравнима с полярностью липидной среды, кумарин демонстрирует квантовый выход флуоресценции на два порядка больше, чем в водных растворителях, увеличивая селективность визуализации липидных капель. Таким образом, кумарин 23 может окрашивать липидные капли в адипоцитах ex vivo, а также в культивируемых клетках и может использоваться в проточной цитометрии, а также в конфокальной микроскопии [53].
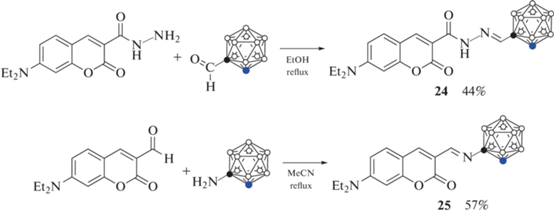
С целью изучения влияния природы спейсера между кумариновым скелетом и карборановым остовом на фотохимические характеристики соединений, взаимодействием 1-формил-орто-карборана с 3-карбогидразид-7-диэтиламинокумарином в этаноле получен карборанилгидразон 24, а реакция 1-амино-орто-карборана с 3-формил-7-диэтиламинокумарином дала соответствующее основание Шиффа 25 (схема 12 ) [54].
Схема 12 .
Полученные производные демонстрируют значительный батохромный сдвиг по сравнению с 7-диэтиламинокумарином, особенно в случае карборанилкумарина 25. Исследования внутриклеточного накопления соединений в клетках аденокарциномы A549 с помощью конфокальной микроскопии показали, что полученные карборанил-кумарины 24 и 25 локализованы в липидных каплях (адипосомах), это свидетельствует о потенциале их использования в качестве красителей для наблюдения липидных капель с помощью конфокальной микроскопии [54].
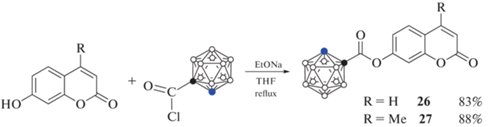
Для получения карборанильных производных кумарина могут быть использованы реакции модификации бензольного кольца. Так, взаимодействием 7-гидроксикумарина и 7-гидрокси-4-метилкумарина с хлорангидридом орто-карборан-1-ил карбоновой кислоты были получены соответствующие сложные эфиры 26 и 27 соответственно (схема 13 ) [44].
Схема 13 .
ПРОИЗВОДНЫЕ КУМАРИНА С КЛОЗО-ДОДЕКАБОРАТНЫМ АНИОНОМ В КАЧЕСТВЕ ЗАМЕСТИТЕЛЯ
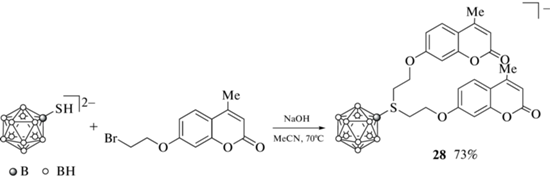
Первые борсодержащие производные кумарина, в которых в качестве борной составляющей выступает клозо-додекаборатный анион [B12H12]2–, были получены на основе меркаптопроизводного клозо-додекаборатного аниона, которое находит применение в клинической бор-нейтронозахватной терапии рака [55], а также широко используется для синтеза целого ряда биологически активных соединений на его основе [56–62]. Так, взаимодействием натриевой соли меркаптопроизводного клозо-додекаборатного аниона Na2[B12H11SH] с 7-(2'-бромэтокси)-4-метилкумарином в ацетонитриле и последующим осаждением в виде тетраметиламмониевой соли при добавлении (Me4N)I получено содержащее два кумариновых фрагмента сульфониевое производное 28 (схема 14 ) [44].
Схема 14 .
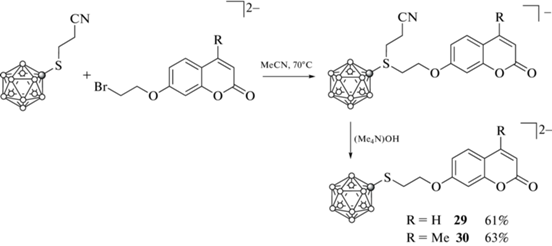
Производные с одним кумариновым фрагментом 29 и 30 были получены реакцией тетраметиламмониевой соли 2-цианоэтилтиопроизводного клозо-додекаборатного аниона (Me4N)2[B12H11SCH2CH2CN] с 7-(2'-бромэтокси)кумарином и 7-(2'-бромэтокси)-4-метилкумарином соответственно и последующей элиминацией акрилонитрила при обработке образующихся сульфониевых производных (Me4N)OH (схема 15 ) [44].
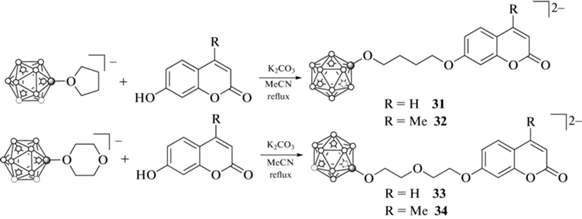
Ряд борсодержащих производных кумарина был получен раскрытием циклических оксониевых производных клозо-додекаборатного аниона [63, 64] 7-гидроксигруппой производных кумарина. Так, взаимодействием тетрабутиламмониевых солей тетрагидрофуранового и 1,4-диоксанового производных клозо-додекаборатного анионов (Bu4N)[B12H11O(CH2)4] и (Bu4N)[B12H11O(CH2CH2)2O] c 7-гидроксикумарином и 7-гидрокси-4-метилкумарином в ацетонитриле в присутствии K2CO3 получены соответствующие борсодержащие производные кумаринов 31–34, выделенные в виде цезиевых солей (схема 16 ) [44].
Схема 15 .
Схема 16 .
Схема 17 .
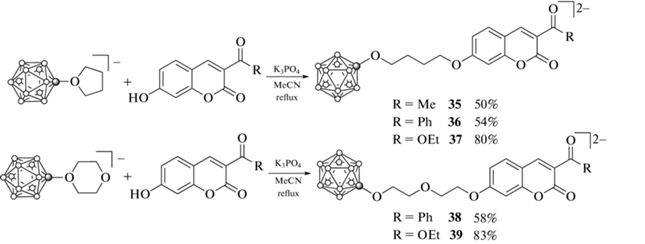
Этот подход также был использован для синтеза борсодержащих производных кумарина, содержащих различные электроноакцепторные заместители в положении 3 кумаринового скелета, введение которых способствует улучшению фотофизических характеристик [65]. Взаимодействием (Bu4N)[B12H11O(CH2)4] и (Bu4N)[B12H11O(CH2CH2)2O] c 7-гидрокси-3-ацетилкумарином, 7-гидрокси-3-бензоилкумарином и 7-гидрокси-3-карбоэтоксикумарином в ацетонитриле в присутствии K3PO4 получены соответствующие борсодержащие производные кумаринов 35–39, выделенные в виде цезиевых солей (схема 17 ) [66].
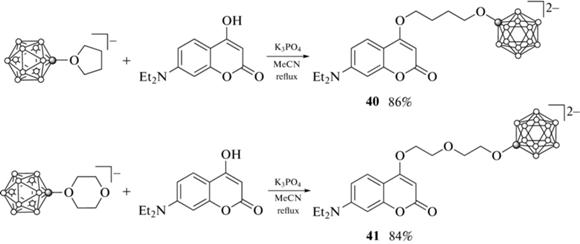
Циклические оксониевые производные клозо-додекаборатного аниона были использованы также для модификации кумарина со стороны лактонного кольца. Так, реакцией (Bu4N)[B12H11O(CH2)4] и (Bu4N)[B12H11O(CH2CH2)2O] c 7-диэтиламино-4-гидроксикумарином были получены соответствующие производные 40 и 41, выделенные в виде цезиевых солей (схема 18 ) [67].
Схема 18 .
Оценка липофильности производных 40 и 41 с помощью эксперимента по их распределению в системе н-октанол–вода (pH 7.4) показала, что она на два порядка ниже, чем у исходного 7-диэтиламино-4-гидроксикумарина. Это указывает на их неспособность проникать через клеточную мембрану путем пассивной диффузии [67].
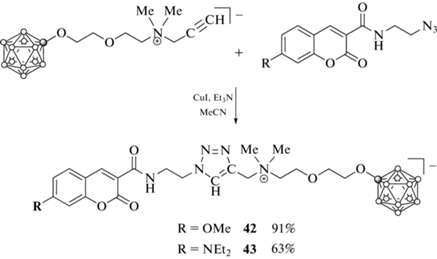
Это вызвало интерес к синтезу соединений с общим меньшим зарядом. Так, с помощью клик-реакции ацетилена (Bu4N)[B12H11OCH2CH2OCH2 CH2NMe2CH2C≡CH], в котором заряд клозо-додекаборатного аниона частично скомпенсирован внутримолекулярным аммониевым центром, с 7-метокси- и 7-диэтиламино-3-(2'-азидоэтил-карбамоил)кумаринами были получены борсодержащие кумарины 42 и 43 (схема 19 ) [68].
Схема 19 .
Производные 42 и 43 не проявляют токсичности против различных линий как здоровых, так и раковых клеток, однако уровень их клеточного накопления недостаточен для эффективной бор-нейтронозахватной терапии рака [68].
ПРОИЗВОДНЫЕ КУМАРИНА С ДИКАРБА-НИДО-УНДЕКАБОРАТНЫМ АНИОНОМ В КАЧЕСТВЕ ЗАМЕСТИТЕЛЯ
Одним из путей увеличения липофильности борсодержащих кумаринов является замена двухзарядного клозо-додекаборатного аниона [B12H12]2– однозарядным дикарба-нидо-ундекаборатным анионом [7,8-C2B9H12]– (нидо-карбораном) или металлокомплексами на его основе. Нидо-карборан образуется при удалении одной из связанных с обоими атомами углерода борных вершин [69]. Поэтому неудивительно, что первое производное кумарина с нидо-карбораном в качестве заместителя 44 было получено селективным деборированием орто-карборанового производного 23 фторидом цезия в этаноле (схема 20 ) [53].
Схема 20 .
Сравнительная оценка липофильности производных 23 и 44 по их распределению в системе н-октанол–вода (pH 7.4) показала, что деборирование орто-карборана приводит к cнижению липофильности полученного кумарина на два порядка [53].
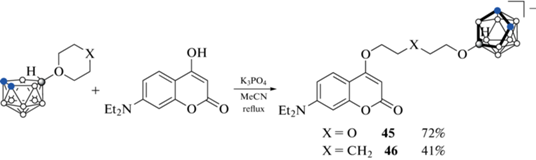
Подобно клозо-додекаборатному аниону, раскрытие циклических оксониевых производных нидо-карборана является удобным способом синтеза его разнообразных производных, в том числе обладающих биологической активностью [70]. Борсодержащие кумарины 45 и 46 были получены взаимодействием 10-O(CH2CH2)2O-7,8-C2B9H11 и 10-(CH2)5O-7,8-C2B9H11 c 7-диэтиламино-4-гидроксикумарином (схема 21 ) [67].
Схема 21 .
Оценка липофильности борсодержащих кумаринов 45 и 46 по распределению в системе н-октанол–вода (pH 7.4) показала, что их липофильность близка липофильности исходного 7-диэтиламино-4-гидроксикумарина [67].
ПРОИЗВОДНЫЕ КУМАРИНА С БИС(ДИКАРБОЛЛИД)АМИ КОБАЛЬТА И ЖЕЛЕЗА В КАЧЕСТВЕ ЗАМЕСТИТЕЛЕЙ
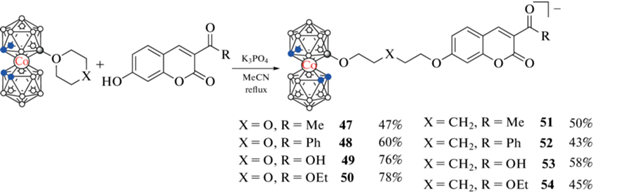
Бис(дикарболлид)ные комплексы кобальта и железа [3,3'-M(1,2-C2B9H11)2]– (M = Co, Fe) привлекают внимание исследователей, работающих в области бор-нейтронозахватной терапии рака благодаря своей замечательной устойчивости, высокому содержанию бора, хорошей биологической совместимости и практически неограниченным возможностям их модификации [71–73]. Как и в случае клозо-додекаборатного аниона, для присоединения бис(дикарболлид)ов кобальта и железа к различным биологически активным молекулам широко используются реакции раскрытия их циклических оксониевых производных [74]. Взаимодействием 1,4-диоксанового и тетрагидропиранового производных бис(дикарболлид)а кобальта c 7-гидрокси-3-ацетилкумарином, 7-гидрокси-3-бензоилкумарином, 7-гидрокси-3-карбоксикумарином и 7-гидрокси-3-карбоэтоксикумарином в ацетонитриле в присутствии K3PO4 получен ряд борсодержащих кумаринов 47–54 (схема 22 ) [66].
Схема 22 .
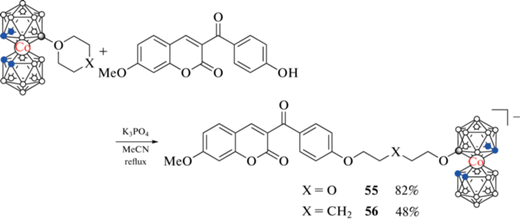
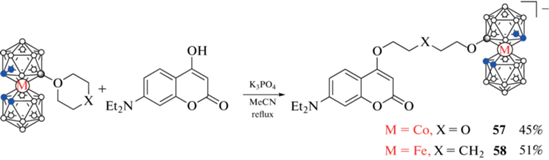
Для получения борсодержащих кумарина также могут быть использованы реакции модификации лактонного кольца. Так, взаимодействием 1,4-диоксанового и тетрагидропиранового производных бис(дикарболлид)а кобальта c 7-метокси-4-(4'-гидроксибензоил)кумарином в ацетонитриле в присутствии K3PO4 были получены борсодержащие кумарины 55 и 56 (схема 23 ) [66], а реакции 1,4-диоксанового производного бис(дикарболлид)а кобальта и тетрагидропиранового производного бис(дикар-боллид)а железа с 7-диэтиламино-4-гидроксикумарином в аналогичных условиях привели к кумаринам 57 и 58 соответственно (последний был выделен в виде цезиевой соли) (схема 24 ) [67].
Схема 23 .
Схема 24 .
Оценка липофильности производных 57 и 58 с помощью эксперимента по распределению в системе н-октанол–вода показала, что по сравнению с их клозо-додекаборатными (40 и 41) и нидо-карборановыми (45 и 46) аналогами металлокарборансодержащие кумарины обладают гораздо большей липофильностью, приближающейся к липофильности орто-карборансодержащего кумарина 23 [67].
БОРОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ КУМАРИНА
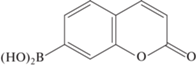
В отличие от рассмотренных выше производных кумарина с полиэдрическими гидридами бора, в качестве заместителей интерес к бороновым кислотам на основе кумарина изначально связан не с перспективой их использования в бор-нейтронозахватной терапии рака, а с их использованием в качестве индикаторов активных форм кислорода (reactive oxygen species, ROS), таких как гидроксил-радикал HO•, пероксинитрит ONOO–, супероксид ${\text{O}}_{2}^{{ \bullet --}},$ перекись водорода H2O2, которые часто вырабатываются во время окислительного стресса и могут повреждать липиды, белки и ДНК, что способствует старению и развитию многих заболеваний человека, включая рак, воспаление, сердечно-сосудистые и нейродегенеративные заболевания. В частности, коммерчески доступная кумарин-7-бороновая кислота 59 (рис. 4) известна как селективный и чувствительный индикатор на пероксинитрит и гидропероксиды [75].
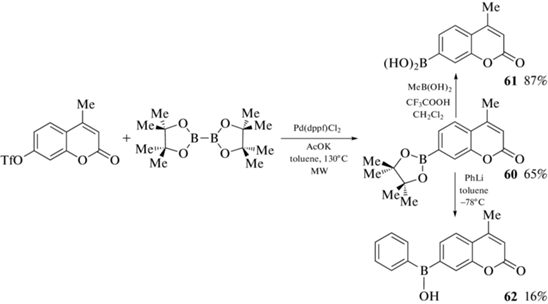
Это вызвало интерес к синтезу и исследованию свойств подобных производных кумарина. Так, 7-пинаколборат-4-метилкумарин 60 был получен Pd-катализируемым кросс-сочетанием 7-трифлат-4-метилкумарина с бис(пинаколато)дибором. Последующая реакция пинаколбората 60 с метилбороновой кислотой в дихлорметане в присутствии трифторуксусной кислоты дала 4-метил-7-кумаринбороновую кислоту 61 (схема 25 ). В свою очередь, реакция пинаколбората 60 с фениллитием в тетрагидрофуране привела к соответствующей фенилбориновой кислоте 62 (схема 25 ). Фенилбориновая кислота 62 продемонстрировала беспрецедентно короткий отклик на перекись водорода, причем эта повышенная реактивность сохраняется и в тех случаях, когда H2O2 эндогенно вырабатывается клетками [76].
Схема 25 .
Схема 26 .
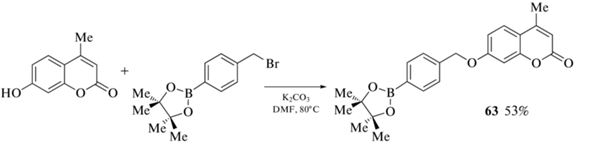
Пинаколборатное производное 63 было получено алкилированием 7-гидрокси-4-метилкумарина пара-пинаколборатобензилбромидом (схема 26 ). Полученное соединение продемонстрировало высокую чувствительность как к экзогенной, так и к эндогенной H2O2 в клетках [77].
Схема 27.
Схема 28 .
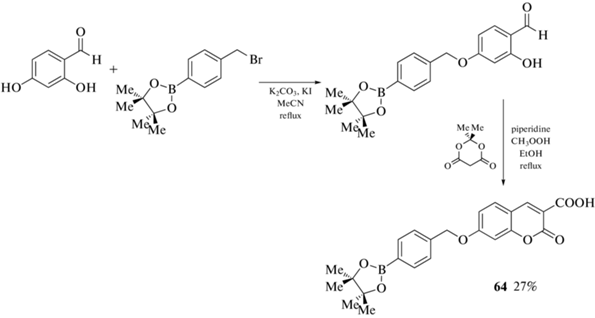
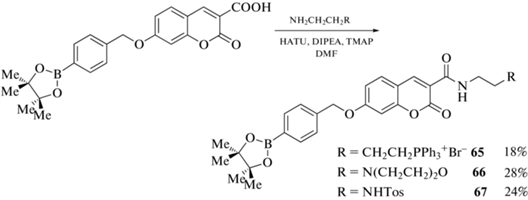
Пинаколборатное производное 64 было получено алкилированием 2,4-дигидробензальдегида пара-пинаколборатобензилбромидом в ацетонитриле с последующей конденсацией образующегося эфира с кислотой Мельдрума в этаноле в присутствии пиперидина и уксусной кислоты (схема 27 ). Взаимодействием кислоты 64 с аминами [Ph3P(CH2)4NH2]Br, O(CH2CH2)2NCH2CH2NH2 и TosNHCH2CH2NH2 в N,N-диметилформамиде были получены соответствующие амиды 65–67 (схема 28 ). Проведена оценка полученных соединений для обнаружения эндо- и экзогенного пероксинитрита ONOO– в мышиных макрофагах RAW264.7 [78].
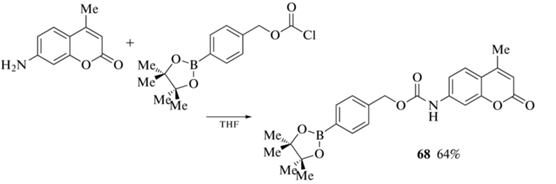
Пинаколборатное производное 68 было получено ацилированием 7-амино-4-метилкумарина пара-пинаколборатобензилоксикарбонил хлоридом в тетрагидрофуране (схема 29 ) [79].
Схема 29 .
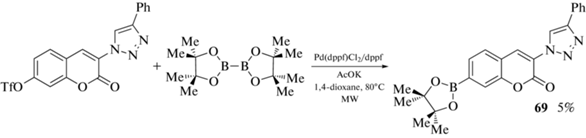
Пинаколборатное производное 69 было синтезировано Pd-катализируемым кросс-сочетанием бис(пинаколато)дибора B2pin2 с 7-трифлат-3-(4'-фенилтриазол-1'-ил)-кумарином (схема 30 ) [80].
Схема 30 .
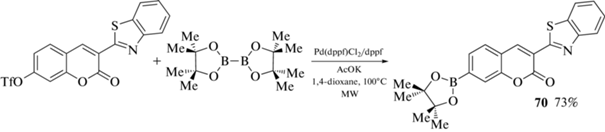
Пинаколовый эфир 3-(бензотиазол-2’-ил)-7-кумаринбороновой кислоты 70 был получен Pd-катализируемым кросс-сочетанием 7-трифлат-3-(бензотиазол-2'-ил)-кумарина с бис(пинаколато)дибором (схема 31 ). Полученное производное является флуоресцентным индикатором с быстрым откликом для обнаружения пероксинитрита ONOO– [81].
Схема 31 .
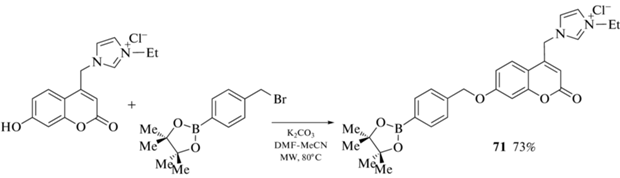
Пинаколборатное производное 71 было получено алкилированием хлорида 1-этил-3-(4'-метил-7-гидроксикумарин)имидазолия пара-пинаколборатобензилбромидом (схема 32 ). Полученное производное обладает хорошей растворимостью в воде и может быть использовано для обнаружения и количественного анализа ONOO– в биологических системах [82].
Схема 32 .
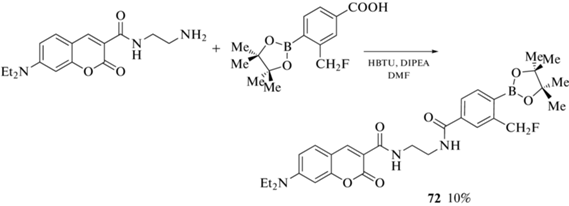
Более редкими являются примеры введения пинаколборатного заместителя в лактонное кольцо. Так, соединение 72 было получено реакцией 7-диэтиламино-3-(2'-аминоэтил)карбамоилкумарина с 3-фторметил-4-пинаколборатбензойной кислотой (схема 33 ) [83].
Схема 33 .
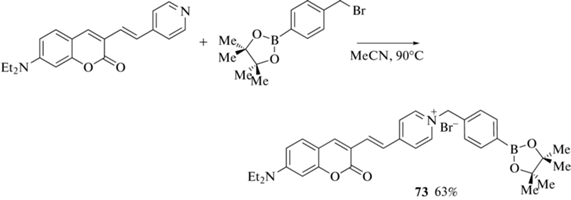
Катионное производное кумарина с пинаколборатной группой 73 было получено алкилированием пиридинового заместителя, присоединенного к 3-му положению 7-диэтиламинокумарина, пара-пинаколборатобензилбромидом (схема 34 ) [84].
Схема 34 .
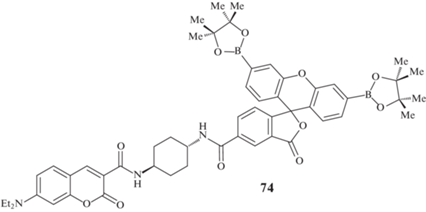
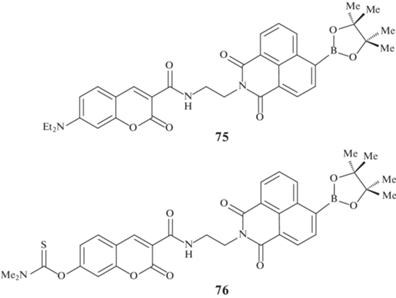
Помимо этого получен ряд соединений, содержащих в своем составе два различных флюорофора – кумарин и флуоресцеин 74 (рис. 5) [85], кумарин и нафталимид 75 и 76 (рис. 6) [86, 87] и другие [88], в которых пинаколборатная группа находится во втором флюорофоре.
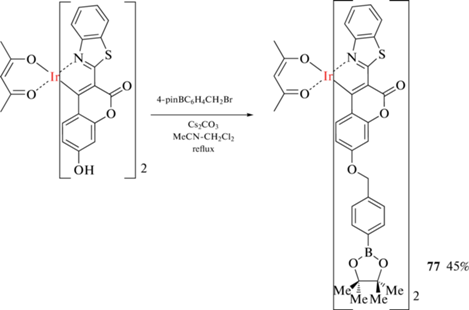
Реакцией комплекса иридия(III) с циклометаллированным 3-(бензотиазол-2'-ил)-7-кумариновым лигандом с пара-пинаколборатобензилбромидом получен комплекс 77, который может служить фосфоресцентной пробой на H2O2 (схема 35 ) [89].
Схема 35 .
Стоит отметить, что борный фрагмент (бороновая кислота или ее эфир) в полученных индикаторах активных форм кислорода играет роль распознающей группы, окислительный гидролиз которой приводит к образованию соответствующего гидроксильного производного [90–92]. Таким образом, здесь можно отметить аналогию с бор-нейтронозахватной терапией рака, где роль борного фрагмента также заключается в распознавании и захвате тепловых нейтронов, что приводит к разрушению самого фрагмента.
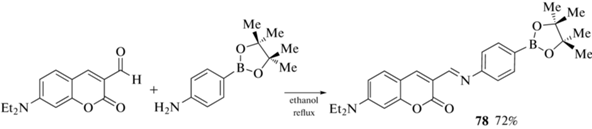
Существуют и примеры использования борсодержащих производных кумарина в качестве сенсоров с сохранением борного фрагмента. Так, кумарин 78, полученный реакцией 7-диэтиламино-3-формилкумарина с пара-пинаколборат-анилином (схема 36 ), исследовался в качестве селективного сенсора на катион ртути Hg2+ и может найти применение для ее обнаружения как во внешней среде, так и на клеточном уровне [93].
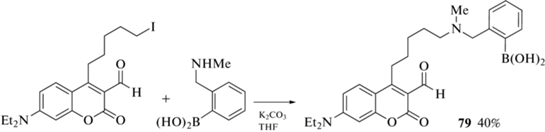
В качестве другого примера можно привести кумарин 79, полученный алкилированием орто-(метиламино)метилфенилбороновой кислоты 7-диэтиламино-3-формил-4-(5'-иодпентил)кумарином (схема 37 ), который является селективным сенсором на допамин и норэпинефрин [94].
Схема 36 .
Схема 37 .
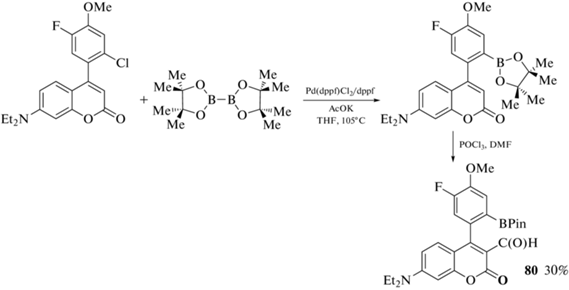
Кумарин 80, полученный Pd-катализируемым кросс-сочетанием 7-диэтиламино-3-(4'-метокси-5'-фтор-2'-хлорфенил)кумарина с бис(пинаколато)дибором с последующим введением формильной группы реакцией с POCl3 в N,N-диметилформамиде (схема 38 ), является селективным сенсором на глюкозамин [95].
Схема 38 .
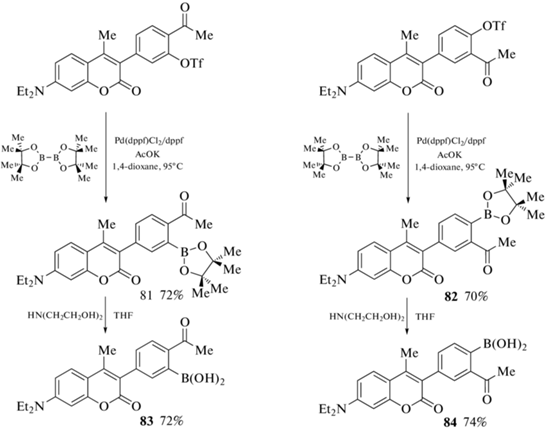
Пинаколборатные производные кумарина 81 и 82 получены Pd-катализируемым кросс-сочетанием соответствующих трифлатов с бис(пинаколато)дибором. Обработка 81 и 82 диэтаноламином в тетрагидрофуране привела к бороновым кислотам 83 и 84 (схема 39 ). Полученные кумаринбороновые кислоты быстро связываются с семикарбазидом с образованием диазаборинов, обладающих повышенной флуоресценцией, что делает их удобными инструментами для изучения бактериальной вирулентности in vitro [96].
Схема 39 .
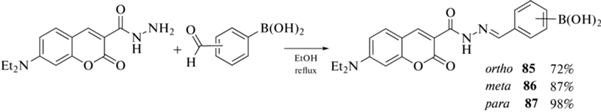
С целью изучения влияния природы борного компонента на внутриклеточное накопление борсодержащих кумаринов взаимодействием 3-карбогидразид-7-диэтиламинокумарина с альдегидами фенилбороновых кислот в этаноле получен ряд кумаринов 85–87, являющихся структурными аналогами карборанилсодержащего кумарина 24 (схема 40 ). В отличие от карборанилкумаринов, бороновые кислоты 85–87 локализуются не в липидных каплях, а в эндоплазматическом ретикулуме [54].
Схема 40 .
Бороновые кислоты и их эфиры широко используются в органическом синтезе для получения диарильных соединений по реакции Сузуки. Так, пинаколборатные производные 88 и 89 были получены Pd-катализируемым кросс-сочетанием 3-(4'-бромфенил)кумарина и 7-диэтиламино-3-(4'-бромфенил)кумарина с бис(пинаколато)дибором B2pin2 (схема 41 ). Полученные пинаколборатные производные были задействованы для синтеза бифенилкумаринов, проявляющих свойства перспективных люминесцентных материалов [97].
Схема 41 .
ПРОЧИЕ БОРСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ КУМАРИНА
Еще одной группой борсодержащих производных кумарина, которую из-за отсутствия связи бор–углерод нельзя отнести к борорганическим производным, являются бордипирриновые (BODIPY) производные. К настоящему времени синтезировано большое количество таких производных самого разнообразного строения, объединяющих в своем составе две флюорофорные системы. Эта область химии кумаринов была недавно подробно рассмотрена в обзоре [98] и выходит за пределы данной работы.
Помимо производных, в которых различные борные фрагменты связаны со скелетом кумарина ковалентной связью, недавно была описана аммониевая соль 7-амино-4-метилкумарина с клозо-декаборатным анионом [99].
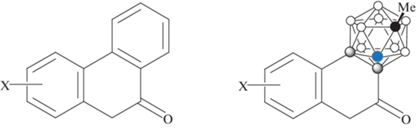
Еще одну группу соединений представляют производные орто-карборана, в которых он заменяет собой одно из ароматических колец бензо[c]кумарина (рис. 7, 8), образующиеся в ходе Ir-катализируемого кросс-сочетания карборанилкарбоновых кислот с бензойными кислотами [100].
ЗАКЛЮЧЕНИЕ
В обзоре рассмотрены методы синтеза различных борсодержащих производных кумарина, включая производные, содержащие в качестве заместителей полиэдрические борные кластеры (карбораны, металлакарбораны, клозо-додекаборатный анион), а также производные с дигидроксиборильной (–B(OH)2) и пинаколборильной (–Bpin) группами. При этом основными местами модификации являются положения 3 и 7 кумаринового скелета. Обсуждаются свойства и потенциальные области применения различных борсодержащих производных кумарина. О неослабевающем интересе исследователей к борсодержащим производным кумарина свидетельствуют новые статьи [101, 102], опубликованные в течение месяца после отправки данного обзора в редакцию журнала.
Список литературы
Терпеноиды и кумарины / Под ред. Ред. Пигулевский Г.В. Л.: Наука, 1965. 196 с.
Murray R.D.H., Mendez J. The Natural Coumarins: Occurrence Chemistry and Biochemistry. Chichester: John Wiley and Sons, 1982. 702 p.
Murray R.D.H. Naturally occurring coumarins. In: Progress in the Chemistry of Organic Natural Products, V. 72, Springer-Verlag, Wien, 1997. P. 1–119. https://doi.org/10.1007/978-3-7091-6527-0_1
Murray R.D.H. The naturally occurring coumarins // Progress in the Chemistry of Organic Natural Products. V. 83. Wien: Springer-Verlag, 2002. P. 1. https://doi.org/10.1007/978-3-7091-6172-2
Sarker S.D., Nahar L. Progress in the chemistry of naturally occurring coumarins // Progress in the Chemistry of Organic Natural Products. V. 106. Cham: Springer Int. Publ. AG, 2017. P. 241. https://doi.org/10.1007/978-3-319-59542-9_3
Hoult J.R.S., Payá M. // Gen. Pharmacol.: The Vascular System. 1996. V. 27. № 4. P. 713. https://doi.org/10.1016/0306-3623(95)02112-4
Lacy A., O’Kennedy R. // Curr. Pharm. Design. 2004. V. 10. № 30. P. 3797. https://doi.org/10.2174/1381612043382693
Borges F., Roleira F., Milhazes N. et al. // Curr. Med. Chem. 2005. V. 12. № 8. P. 887. https://doi.org/10.2174/0929867053507315
Musa M.A., Cooperwood J.S., Khan M.O.F. // Curr. Med. Chem. 2008. V. 15. № 26. P. 2664. https://doi.org/10.2174/092986708786242877
Borges M.F.M., Roleira F.M.F., da Silva Pereira Milhazes N.J. et al. // Front. Med. Chem. 2009. V. 4. P. 23. https://doi.org/10.2174/978160805207310904010023
Kostova I., Bhatia S., Grigorov P. et al. // Curr. Med. Chem. 2011. V. 18. № 25. P. 3929. https://doi.org/10.2174/092986711803414395
Peng X.-M., Damu G.L.V., Zhou C.-H. // Curr. Pharm. Design. 2013. V. 19. № 21. P. 3884. https://doi.org/10.2174/1381612811319210013
Bansal Y., Sethi P., Bansal G. // Med. Chem. Res. 2013. V. 22. № 7. P. 3049. https://doi.org/10.1007/s00044-012-0321-6
Sandhu S., Bansal Y., Silakari O., Bansal G. // Bioorg. Med. Chem. 2014. V. 22. № 15. P. 3806. https://doi.org/10.1016/j.bmc.2014.05.032
Thakur A., Singla R., Jaitak V. // Eur. J. Med. Chem. 2015. V. 101. P. 476. https://doi.org/10.1016/j.ejmech.2015.07.010
Grovera J., Jachak S.M. // RSC Adv. 2015. V. 5. № 49. P. 38892. https://doi.org/10.1039/C5RA05643H
Hassan M.Z., Osman H., Ali M.A., Ahsan M.J. // Eur. J. Med. Chem. 2016. V. 123. P. 236. https://doi.org/10.1016/j.ejmech.2016.07.056
Fotopoulos I., Hadjipavlou-Litina D. // Med. Chem. 2020. V. 16. № 3. P. 272. https://doi.org/10.2174/1573406415666190416121448
Qin H.-L., Zhang Z.-W., Ravindar L., Rakesh K.P. // Eur. J. Med. Chem. 2020. V. 207. 112832. https://doi.org/10.1016/j.ejmech.2020.112832
Feng D., Zhang A., Yang Y., Yang P. // Arch. Pharm. 2020. V. 353. e1900380. https://doi.org/10.1002/ardp.201900380
Mishra S., Pandey A., Manvati S. // Heliyon. 2020. V. 6. № 1. e03217. https://doi.org/10.1016/j.heliyon.2020.e03217
Dorababu A. // Eur. J. Med. Chem. Rep. 2021. V. 2. 100006. https://doi.org/10.1016/j.ejmcr.2021.100006
Sharifi-Rad J., Cruz-Martins N., López-Jornet P. et al. // Oxidative Medicine and Cellular Longevity. 2021. V. 2021. 6492346. https://doi.org/10.1155/2021/6492346
Sahoo C.R., Sahoo J., Mahapatra M. et al. // Arab. J. Chem. 2021. V. 14. № 2. 102922. https://doi.org/10.1016/j.arabjc.2020.102922
Li Z., Kong D., Liu Y., Li M. // Genes Deseases. 2022. V. 9. № 1. P. 80. https://doi.org/10.1016/j.gendis.2021.03.007
Rostom B., Karaky R., Kassab I., Sylla-Iyarreta Veitía M. // Eur. J. Pharm. 2022. V. 922. 174867. https://doi.org/10.1016/j.ejphar.2022.174867
Keri R.S., Budagumpi S., Somappa S.B. // J. Clin. Pharm. Ther. 2022. V. 47. № 7. P. 915. https://doi.org/10.1111/jcpt.13644
Pereira A., Martins S., Caldeira A.T. Coumarins as fluorescent labels of biomolecules. // Phytochemicals in Human Health. London: IntechOpen, 2020. https://doi.org/10.5772/intechopen.85973
Hawthorne M.F. // Angew. Chem. Int. Ed. 1993. V. 32. № 7. P. 950. https://doi.org/10.1002/anie.199309501
Soloway A.H., Tjarks W., Barnum B.A. et al. // Chem. Rev. 1998. V. 98. № 7. P. 1515. https://doi.org/10.1021/cr941195u
Hu K., Yang Z., Zhang L. et al. // Coord. Chem. Rev. 2020. V. 405. 213139. https://doi.org/10.1016/j.ccr.2019.213139
Sivaev I.B., Bregadze V.I. // Eur. J. Inorg. Chem. 2009. № 11. P. 1433. https://doi.org/10.1002/ejic.200900003
Issa F., Kassiou M., Rendina L.M. // Chem. Rev. 2011. V. 111. № 9. P. 5701. https://doi.org/10.1021/cr2000866
Scholz M., Hey-Hawkins E. // Chem. Rev. 2011. V. 111. № 11. P. 7035. https://doi.org/10.1021/cr200038x
Leśnikowski Z.J. // J. Med. Chem. 2016. V. 59. № 17. P. 7738. https://doi.org/10.1021/acs.jmedchem.5b01932
Fink K., Uchman M. // Coord. Chem. Rev. 2021. V. 431. 213684. https://doi.org/10.1016/j.ccr.2020.213684
Murphy N., McCarthy E., Dwyer R., Farràs P. // J. Inorg. Biochem. 2021. V. 218. 111412. https://doi.org/10.1016/j.jinorgbio.2021.111412
Авдеева В.В., Гараев Т.М., Малинина Е.А. и др. // Журн. неорган. химии. 2022. Т. 67. № 1. С. 33.
Chen Y., Du F., Tang L. et al. // Mol. Ther. Oncolytics. 2022. V. 24. P. 400. https://doi.org/10.1016/j.omto.2022.01.005
Cebula J., Fink K., Boratynski J., Goszczynski T.M. // Coord. Chem. Rev. 2023. V. 477. 214940. https://doi.org/10.1016/j.ccr.2022.214940
Shatenshtein A.I., Zakharkin L.I., Petrov E.S. et al. // J. Organomet. Chem. 1970. V. 23. № 2. P. 313. https://doi.org/10.1016/S0022-328X(00)92944-9
Kresge A.J., Pruszynski P., Stang P.J., Williamson B.L. // J. Org. Chem. 1991. V. 56. № 15. P. 4808. https://doi.org/10.1021/jo00015a048
Казанцев А.В., Отращенков Е.А., Аксартов М.М. и др. // Журн. орган. химии. 2002. Т. 38. № 11. С. 1691.
Justus E., Izteleuova D.T., Kasantsev A.V. et al. // Collect. Czech. Chem. Commun. 2007. V. 72. № 12. P. 1740. https://doi.org/10.1135/cccc200071740
Казанцев А.В., Нарамбекова А., Епп А.А. // Журн. общ. химии. 2014. Т. 84. № 8. С. 1307.
Казанцев А.В., Аксартов М.М., Алимбеков А.З. // Вест. Караганд. универ., Сер. Химия. 2010. № 2. С. 21.
Казанцев А.В., Бутякин В.В., Отращенков Е.А., Мудлахметов З.М. // Изв. Акад. наук, Сер. хим. 1995. № 10. С. 2058.
Казанцев А.В., Изтелеуова Д.Т., Аксартов М.М. и др. // Хим. журн. Казахстана. 2005. № 5. С. 224.
Корольков И.В., Горин Е.Г., Казанцев А.В. и др. // Хим. журн. Казахстана. 2019. № 2. С. 219.
Казанцев А.В., Нарембекова А. // Журн. общ. химии. 2015. Т. 85. № 4. С. 700.
Казанцев А.В., Казьяхметова Д.Т., Аксартов М.М., Алимбеков А.З. // Вест. Караганд. универ., Сер. Химия. 2010. № 4. С. 58.
Казанцев А.В., Изтелеуова Д.Т., Аксартов М.М. // Вест. Караганд. универ., Сер. Химия. 2007. № 2. С. 55.
Wu A., Kolanowski J.L., Boumelhem B.B. et al. // Chem. Asian J. 2017. V. 12. № 14. P. 1704. https://doi.org/10.1002/asia.201700423
Marfavi A., Yeo J.H., Leslie K.G. et al. // Aust. J. Chem. 2022. V. 75. № 8–9. P. 716. https://doi.org/10.1071/CH21320
Sauerwein W.A.G., Bet P.M., Wittig A. // Neutron Capture Therapy. Principles and Berlin: Applications Springer-Verlag, 2012. P. 117. https://doi.org/10.1007/978-3-642-31334-9_8
Сиваев И.Б., Брегадзе В.И., Кузнецов Н.Т. // Изв. Акад. наук, Сер. хим. 2002. № 8. С. 1256.
Nakamura H., Ueno M., Lee J.-D. et al. // Tetrahedron Lett. 2007. V. 48. № 18. P. 3151. https://doi.org/10.1016/j.tetlet.2007.03.043
Justus E., Awad D., Hohnholt M. et al. // Bioconjugate Chem. 2007. V. 18. № 4. P. 1287. https://doi.org/10.1021/bc070040t
Lee J.-D., Ueno M., Miyajima Y., Nakamura H. // Org. Lett. 2007. V. 9. № 2. P. 323. https://doi.org/10.1021/ol062840+
Hattori Y., Kusaka S., Mukumoto M. et al. // J. Med. Chem. 2012. V. 55. № 15. P. 6980. https://doi.org/10.1021/jm300749q
Fujimura A., Yasui S., Igawa K. et al. // Cells. 2020. V. 9. № 10. 2149. https://doi.org/10.3390/cells9102149
Kitamatsu M., Inoue K., Yamagata N., Michiue H. // Processes. 2022. V. 10. № 11. 2200. https://doi.org/10.3390/pr10112200
Sivaev I.B., Semioshkin A.A., Brellochs B. et al. // Polyhedron. 2000. V. 19. № 6. P. 627. https://doi.org/10.1016/S0277-5387(00)00293-X
Sivaev I.B., Kulikova N.Yu., Nizhnik E.A. et al. // J. Organomet. Chem. 2008. V. 693. № 3. P. 519. https://doi.org/10.1016/j.jorganchem.2007.11.027
Liu X., Xu Z., Cole J.M. // J. Phys. Chem. C. 2013. V. 117. № 32. P. 16584. https://doi.org/10.1021/jp404170w
Kosenko I., Laskova J., Kozlova A. et al. // J. Organomet. Chem. 2020. V. 921. 121370. https://doi.org/10.1016/j.jorganchem.2020.121370
Serdyukov A., Kosenko A., Druzina A. et al. // J. Organomet. Chem. 2021. V. 946–947. 121905. https://doi.org/10.1016/j.jorganchem.2021.121905
Laskova J., Serdyukov A., Kosenko I. et al. // Molecules. 2022. V. 27. № 23. 8575. https://doi.org/10.3390/molecules27238575
Grimes R.N. Carboranes. London, Academic Press, 2016. P. 179. https://doi.org/10.1016/B978-0-12-801894-1.00007-X
Stogniy M.Yu., Sivaev I.B. // Reactions. 2022. V. 3. № 1. P. 172. https://doi.org/10.3390/reactions3010013
Sivaev I.B., Bregadze V.I. // Collect. Czech. Chem. Commun. 1999. V. 64. № 5. P. 783. https://doi.org/10.1135/cccc19990783
Dash B.P., Satapathy R., Swain B.R. et al. // J. Organomet. Chem. 2017. V. 849–850. P. 170. https://doi.org/10.1016/j.jorganchem.2017.04.006
Fuentes I., Garcia-Mendiola T., Sato S. et al. // Chem. Eur. J. 2018. V. 24. № 65. P. 17239. https://doi.org/10.1002/chem.201803178
Друзина А.А., Шмалько А.В., Сиваев И.Б., Брегадзе В.И. // Успехи химии. 2021. Т. 90. № 7. С. 785.
Zielonka J., Sikora A., Hardy M. et al. // Chem. Res. Toxicol. 2012. V. 25. № 9. P. 1793. https://doi.org/10.1021/tx300164j
Gatin-Fraudeta B., Ottenweltera R., Le Saux T. et al. // Proc. Natl. Acad. Sci. USA. 2021. V. 118. № 50. e2107503118. https://doi.org/10.1073/pnas.210750311
Li Y., Ren L., Gao T. et al. // Tetrahedron Lett. 2023. V. 114. 154291. https://doi.org/10.1016/j.tetlet.2022.154291
Weber M., Yamada N., Tian X. et al. // Front. Chem. 2020. V. 8. P. 39. https://doi.org/10.3389/fchem.2020.00039
Lo L.-C., Chu C.-Y. // Chem. Commun. 2003. № 21. P. 2728. https://doi.org/10.1039/B309393J
Y L.D., Y N.N., Li M., Wang B. // Tetrahedron Lett. 2010. V. 51. № 8. P. 1152. https://doi.org/10.1016/j.tetlet.2009.12.049
Modrzejewska J., Szala M., Grzelakowska A. et al. // Molecules. 2021. V. 26. № 19. 5940. https://doi.org/10.3390/molecules26195940
Grzelakowska A., Modrzejewska J., Kolinska J. et al. // Free Radical Biol. Med. 2022. V. 179. P. 34. https://doi.org/10.1016/j.freeradbiomed.2021.12.260
Zhu H., Tamura T., Fujisawa A. et al. // J. Am. Chem. Soc. 2020. V. 142. № 37. P. 15711. https://doi.org/10.1021/jacs.0c02547
Shen Y., Zhang X., Zhang Y. et al. // Sensors Actuators B: Chem. 2018. V. 255. № 1. P. 42. https://doi.org/10.1016/j.snb.2017.08.020
Albers A.E., Okreglak V.S., Chang C.J. // J. Am. Chem. Soc. 2006. V. 128. № 30. P. 9640. https://doi.org/10.1021/ja063308k
Xu K., He L., Yang X. et al. // Analyst. 2018. V. 143. № 15. P. 3555. https://doi.org/10.1039/C8AN00842F
Du Y., Wang, B., Jin D. et al. // Analyt. Chim. Acta. 2020. V. 1103. P. 174. https://doi.org/10.1016/j.aca.2019.12.059
Niu P., Liu J., Xu F. et al. // ACS Appl. Bio Mater. 2022. Vol. 5. № 4. P.1683. https://doi.org/10.1021/acsabm.2c00058
Li C., Wang S., Huang Y. et al. // Dalton Trans. 2014. V. 43. № 14. P. 5595. https://doi.org/10.1039/C3DT53498G
Saxon E., Peng X. // ChemBioChem. 2021. V. 23. № 3. e202100366. https://doi.org/10.1002/cbic.202100366
Messina M.S., Quargnali G., Chang C.J. // ACS Bio Med Chem Au. 2022. V. 2. № 6. P. 548. https://doi.org/10.1021/acsbiomedchemau.2c00052
Wang L., Hou X., Fang H., Yang X. // Current Med. Chem. 2022. V. 29. № 14. P. 2476. https://doi.org/10.2174/0929867328666210902101642
Lin C., Zhang M, Yan X. et al. // Z. Anorg. Allg. Chem. 2020. V. 646. № 23–24. P. 1892. https://doi.org/10.1002/zaac.202000135
Secor K.E., Glass T.E. // Org. Lett. 2004. V. 6. № 21. P. 3727. https://doi.org/10.1021/ol048625f
Tran T.M., Alan Y., Glass T.E. // Chem. Commun. 2015. V. 51. № 37. P. 7915. https://doi.org/10.1039/C5CC00415B
Cambray S., Bandyopadhyay A., Gao J. // Chem. Commun. 2017. V. 53. № 93. P. 12532. https://doi.org/10.1039/C7CC07389E
Zhang H., Luo Q., Mao Y. et al. // J. Photochem. Photobiol. A: Chem. 2017. V. 346. P. 10. https://doi.org/10.1016/j.jphotochem.2017.05.039
Sharma S.J., Sekar N. // Dyes and Pigments. 2022. V. 202. 110306. https://doi.org/10.1016/j.dyepig.2022.110306
Goeva L.V., Zhuchkova A.F., Malinin E.A. et al. // Russ. J. Inorg. Chem. 2020. V. 67. № 8. P. 1144. https://doi.org/10.1134/S0036023622080149
Au Y.K., Lyu H., Quan Y., Xie Z. // Chin. J. Chem. 2020. V. 38. № 4. P. 383. https://doi.org/10.1002/cjoc.201900475
Das B.C., Yadav P., Das S. et al. // Molecules. 2023. V. 28. № 3. 1052. https://doi.org/10.3390/molecules28031052
Pedro G., Duarte F., Cheptsov D.A. et al. // Sensors. 2023. V. 23. № 3. 1689. https://doi.org/10.3390/s23031689
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии