Журнал неорганической химии, 2023, T. 68, № 6, стр. 724-736
Механохимический синтез производных клозо-декаборатного аниона с пендантными функциональными группами
Е. Ю. Матвеев a, b, *, А. С. Кубасов a, А. И. Ничуговский b, В. В. Авдеева a, К. Ю. Жижин a, b, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b МИРЭА – Российский технологический университет (Институт тонких химических
технологий им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
* E-mail: cat1983@yandex.ru
Поступила в редакцию 19.12.2022
После доработки 09.01.2023
Принята к публикации 17.01.2023
- EDN: UETDTF
- DOI: 10.31857/S0044457X22602243
Аннотация
Разработан новый метод получения производных клозо-декаборатного аниона с пендантными функциональными группами, заключающийся во взаимодействии 1,4-диоксанового, тетрагидропиранового и тетрагидрофуранового производных аниона [B10H10]2– с С-, O-, S- и F-нуклеофильными реагентами (цианидом калия, гидроксидом калия, ацетатом натрия, гидросульфидом калия, тиоцианатом калия, тиосульфатом натрия и фторидом калия) в условиях механохимического синтеза. Показано, что данные реакции протекают через раскрытие экзополиэдрических заместителей оксониевого типа и приводят к образованию клозо-декаборатов с соответствующими С-, O-, S- и Hal-функциональными группами. Разработанный метод позволяет синтезировать производные аниона [B10H10]2– с пендантными группами различного строения за малое время и без применения апротонных полярных растворителей, что значительно облегчает процесс выделения продуктов. Полученные клозо-декабораты за счет наличия донорных центров различного типа могут быть использованы в качестве полидентатных лигандов для получения комплексных соединений d-элементов. Также синтезированные соединения могут быть платформой для дальнейшей функционализации за счет реакционной способности присоединенных пендантных групп. Полученные производные аниона [B10H10]2– были исследованы методами элементного анализа, ИК-, 11B, 13C, 1H ЯМР-спектроскопии и ESI масс-спектрометрии. Строение соединения Cs2[B10H9O(CH2)2O(CH2)2SCN] определено с помощью метода РСА.
ВВЕДЕНИЕ
Полиэдрические анионы клозо-типа [BnHn]2– (n = 6–12) привлекают интерес исследователей как полностью неорганические кластеры, характеризующиеся высокой устойчивостью к действию высоких температур и окислителей, при этом относительно легко подвергающиеся функционализации за счет замещения экзополиэдрических атомов водорода на различные функциональные группы [1–3]. Соединения на основе наиболее известных клозо-боратных анионов [B10H10]2– и [B12H12]2– перспективны для применения в различных областях науки и техники, например, в создании систем для хранения энергии, легких композиционных материалов, материалов для электронной техники и т.д. [4–8]. Одним из самых интересных и актуальных представляется направление по использованию производных кластерных анионов бора в медицине, в том числе в синтезе соединений для диагностики и нейтронозахватной терапии злокачественных опухолей (10B-NCT) [9–11]. Препараты на основе кластерных анионов бора и карборанов проявляют гаметоцидную и бактерицидную активность [12, 13], обладают противомикробным [14] и противовирусным [15–17] действием. В связи с этим поиск новых методов функционализации анионов [B10H10]2– и [B12H12]2– является актуальной задачей.
Для конструирования производных клозо-боратных анионов с заданными электронным и геометрическим строением и свойствами может применяться несколько подходов, включающих методы прямой функционализации борного кластера, а также модификацию уже введенных функциональных групп. Одним из наиболее удобных методов прямой функционализации клозо-декаборатного и клозо-додекаборатного анионов является замещение экзополиэдрических атомов водорода на разнообразные функциональные группы, протекающее по механизму электрофильно-индуцируемого нуклеофильного замещения (electrophilic-induced nucleophilic substitution, EINS) [18–24]. Такой подход дает большие возможности для дизайна обширного круга клозо-боратов, содержащих экзополиэдрические связи B–O, B–N, B–S, B–C и т.д. Функционализация уже введенных заместителей позволяет кардинально расширить круг синтезируемых производных. Например, в последнее время набирает популярность подход, связанный с модификацией тиольных и нитрильных групп в соответствующих производных анионов [B10H10]2– и [B12H12]2– [25–32]. Замещенные клозо-бораты перспективны и в координационной химии d-элементов в роли полидентатных лигандов за счет наличия нескольких специфических донорных центров [33–36].
Непосредственная близость борного кластера часто накладывает определенную специфику на реакционную способность экзополиэдрических заместителей. Поэтому один из важнейших методов функционализации кластерных анионов бора связан с получением производных, содержащих пендантные функциональные группы, обособленные от борного полиэдра спейсерной цепью. Такие производные удобно получать за счет двухэтапной функционализации анионов [B10H10]2–, которая включает в себя замещение экзополиэдрических атомов водорода на молекулы циклических простых эфиров с последующим взаимодействием образующихся продуктов с нуклеофильными реагентами. В ходе второго этапа происходит раскрытие присоединенных циклических заместителей оксониевого типа с образованием клозо-боратов с пендантными функциональными группами. Данный подход позволяет использовать обширный круг нуклеофильных реагентов с донорными атомами C-, N-, O-, S- и т.д., в том числе биологически активных [37–49]. Это преимущество в совокупности с регулированием типа введенного циклического заместителя дает возможность синтезировать клозо-бораты с заданным строением спейсерной цепи и пендантной группы.
Одним из недостатков данного подхода является частая необходимость использования апротонных полярных растворителей, в том числе высококипящих, что приводит к значительным трудозатратам в ходе выделения продуктов. Более того, некоторые реакции, протекающие в данных условиях, могут приводить к деструкции экзополиэдрического заместителя [43]. Эти нюансы в совокупности с относительно большим временем протекания реакций (иногда оно может достигать нескольких часов) делают необходимой разработку новых подходов к раскрытию циклических оксониевых заместителей в соответствующих производных клозо-боратных анионов.
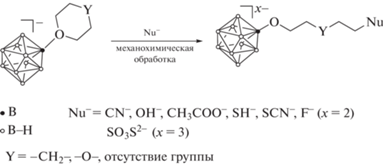
В данной работе разработан новый метод получения производных клозо-декаборатного аниона с пендантными функциональными группами, заключающийся во взаимодействии тетрагидрофуранового, тетрагидропиранового и 1,4-диоксанового производных аниона [B10H10]2– с С-, O-, S- и Hal-нуклеофильными реагентами (цианидом калия, гидроксидом калия, ацетатом натрия, гидросульфидом калия, тиоцианатом калия, тиосульфатом натрия и фторидом калия) в условиях механохимического синтеза. Данный способ является динамично развивающимся методом получения неорганических и координационных соединений без использования “мокрой химии” [50–52]. На данный момент примеры применения этого подхода в химии бороводородов и кластерных анионов бора достаточно редки и ограничиваются синтезом комплексных гидридов [53–55], производных карборанов [56–58], металлоборанов [59, 60], производных кластерных анионов бора [61] и комплексных соединений на их основе [62].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. [2-(1-(1,4-диоксаний))]нонагидро-клозо-декаборат тетрабутиламмония (n-Bu4N)[2-B10H9O(CH2)4O], [2-(1-(тетрагидропираний))]нонагидро-клозо-декаборат тетрабутиламмония (n-Bu4N)[2-B10H9O(CH2)5] и [2-(1-(тетрагидрофураний))]нонагидро-клозо-декаборат тетрабутиламмония (n-Bu4N)[2-B10H9O(CH2)4] были синтезированы по разработанной ранее методике [63]. Соединения 1,4-диоксан, тетрагидропиран и тетрагидрофуран очищали согласно [64]. Гидросульфид калия получали согласно [65]. Цианид калия (98%, Aldrich), гидроксид калия (х. ч., Химмед), ацетат натрия (99%, Aldrich), тиоцианат калия (99%, Aldrich), тиосульфат натрия (99%, Aldrich), фторид калия (99%, Aldrich), метанол (99.9%, Aldrich), фторид цезия (99%, Aldrich) использовали без дополнительной очистки.
ИК-спектры соединений записывали на ИК-Фурье-спектрометре ИНФРАЛЮМ ФТ-02 в области 400–4000 см–1. Образцы готовили в виде таблеток из смеси исследуемого соединения и KBr. 1H, 11B, 13C ЯМР-спектры растворов исследуемых веществ в D2O записывали на ЯМР-спектрометре Bruker DPX-300 на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию.
Масс-спектры записывали с использованием четырехканального насоса Agilent 1200 (G1311A) и тройного квадрупольного масс-спектрометра TSQ Quantum Access MAX.
Элементный анализ на бор проводили на масс-спектрометре с индуктивно связанной плазмой ELAN DRC-e PerkinElmer. Содержание углерода, водорода и азота в образцах определяли на элементном CHNS-анализаторе Eurovector “EuroEA 3000”.
РСА. Кристаллы Cs2[B10H9O(CH2)2O(CH2)2SCN] были получены изотермическим упариванием раствора соединения в метаноле. Набор дифракционных отражений для кристаллов Cs2[B10H9O(CH2)2O(CH2)2SCN] получен в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker APEX2 CCD (λMoKα, графитовый монохроматор, ω–ϕ-сканирование). Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы уточнены в анизотропном приближении. Все атомы водорода в Cs2[B10H9O(CH2)2O(CH2)2SCN] уточнены по модели “наездника” с тепловыми параметрами Uизо = 1.2 Uэкв (Uизо) соответствующего неводородного атома.
При сборе и обработке массива отражений использовали программы APEX2, SAINT и SADABS [66–68]. Структура расшифрована и уточнена с помощью программ комплекса OLEX2 [69].
Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структуры приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные, параметры эксперимента и уточнения структуры Cs2[B10H9O(CH2)2O(CH2)2SCN]
| Соединение | Cs2[B10H9O(CH2)2O(CH2)2SCN] |
|---|---|
| Брутто-формула | C5H17B10Cs2NO2S |
| М | 529.17 |
| T, K | 150.00 |
| Сингония | Орторомбическая |
| Пр. гр. | Pnna |
| a, Å | 24.464(3) |
| b, Å | 8.5741(8) |
| c, Å | 8.1135(9) |
| V, Å3 | 1701.9(3) |
| Z | 4 |
| ρрасч, г/см3 | 2.065 |
| μ, мм–1 | 4.398 |
| F(000) | 984.0 |
| Излучение, λ, Å | 0.71073 |
| Число отражений: | |
| измеренных | 4510 |
| независимых (N) | 1498 [Rint = 0.0631] |
| R1, wR2 по N0 | R1 = 0.1388, wR2 = 0.2633 |
| R1, wR2 по N | R1 = 0.1652, wR2 = 0.2733 |
Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 2205579).
Общая методика синтеза. Навески 0.45 г (1.0 ммоль) (Bu4N)[2-B10H9O(CH2)4O], 0.45 г (1.0 ммоль) (Bu4N)[2-B10H9O(CH2)5] или 0.45 г (1.0 ммоль) (Bu4N)[2-B10H9O(CH2)4] и 1.2 ммоль соли – нуклеофильного реагента (78 мг KCN, 67 мг KOH, 98 мг CH3COONa, 86 мг KSH, 116 мг KSCN, 190 мг Na2S2O3, 70 мг KF) тщательно перемешивали, пересыпали в стакан для помола в атмосфере аргона и добавляли стальные размольные шары. Далее проводили механохимическую обработку на вибрационной мельнице Retsch MM 400 при 25 Гц в течение 30 мин. После охлаждения стакана до комнатной температуры его открывали, к полученной смеси добавляли 10 мл метанола и при необходимости отфильтровывали выпавший осадок. К полученному фильтрату добавляли 1.1 мл 2 М раствора фторида цезия в метаноле (1.7 мл в случае продукта реакции с тиосульфатом натрия). Выпавший белый осадок отфильтровывали, перекристаллизовывали из смеси вода–метанол (1 : 1) и сушили в глубоком вакууме при 60°С в течение 1 ч.
2-[2-(2-Цианоэтокси)этокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)2O(CH2)2CN]. Выход 0.46 г (92%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 2.97 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.65 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.78 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.94 (2H, т, –O–СН2–CH2–O–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.0 (c, 1В, В (4)); –29.1 (c, 2В, В (7, 8)); –23.6 (c, 4B, В (3, 5) + В (6, 9)); –5.6 (c, 1B, В (10)); –3.1 (с, 1B, В (1)); –1.6 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 17.4 (–O–СН2–CH2–O–CH2–CH2–), 64.4 (–O–СН2–CH2–O–CH2–CH2–), 69.0 (–O–СН2–CH2–O–CH2–CH2–), 70.3 (–O–СН2–CH2–O–CH2–CH2–), 119.5 (С≡N). ИК-спектр (KBr), см–1: 2453 (ν(В–Н)), 2243 (ν(C≡N)), 1085 (ν(C–O)). Найдено, %: C 11.81; H 3.39; N 2.78; B 21.60. Вычислено для C5H17B10NCs2O2, %: C 12.08; H 3.45; N 2.82; B 21.75. ESI MS. Найдено, а.е.м.: 232.30 {[B10H9O(CH2)2O(CH2)2CN]2– + H+}–. (C5H18B10NO2). Вычислено: М = 232.31. Найдено, а.е.м.: 364.19 {[B10H9O(CH2)2O(CH2)2CN]2– + Cs+}–. (C5H17B10NCsO2). Вычислено: М = 364.21.
2-[5-Цианопентокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)5CN]. Выход 0.45 г (90%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 1.23 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 1.41 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 1.48 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.27 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–); 3.08 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.6 (c, 1В, В (4)); –29.8 (c, 2В, В (7, 8)); ‒24.1 (c, 4B, В (3, 5) + В (6, 9)); –5.2 (c, 1B, В (10)); –3.1 (с, 1B, В (1)); –2.0 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 22.9 (–O–СН2–CH2–CH2–CH2–CH2); 30.2 (–O–СН2–CH2–CH2–CH2–CH2); 32.4 (–O–СН2–CH2–CH2–CH2–CH2); 51.4 (–O–СН2–CH2–CH2–CH2–CH2–); 70.9 (–O–СН2–CH2–CH2–CH2–CH2–), 118.5 (С≡N). ИК-спектр (KBr), см–1: 2443 (ν(В–Н)), 2251 (ν(C≡N)), 1089 (ν(C–O)). Найдено, %: C 14.26; H 3.82; N 2.76; B 21.66. Вычислено для C6H19B10Cs2NO, %: C 14.55; H 3.87; N 2.83; B 21.83. ESI MS. Найдено, а.е.м.: 230.33 {[B10H9O(CH2)5CN]2– + H+}–. (C6H20B10NO). Вычислено: М = 230.34. Найдено, а.е.м.: 362.23 {[B10H9O(CH2)5CN]2– + Cs+}–. (C6H19B10CsNO). Вычислено: М = 362.24.
2-[4-цианобутокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)4CN]. Выход 0.43 г (89%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 1.17 (2Н, м, –O–СН2–CH2–CH2–CH2–); 1.37 (2Н, м, –O–СН2–CH2–CH2–CH2); 2.70 (2Н, т, –O–СН2–CH2–CH2–CH2–); 2.90 (2Н, т, –O–СН2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.6 (c, 1В, В (4)); –28.8 (c, 2В, В (7, 8)); ‒23.4 (c, 4B, В (3, 5) + В (6, 9)); –4.9 (c, 1B, В (10)); –3.7 (с, 1B, В (1)); –1.6 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 31.3 (–O–СН2–CH2–CH2–CH2–); 35.6 (–O–СН2–CH2–CH2–CH2–); 58.0 (‒O–СН2–CH2–CH2–CH2–); 72.4 (–O–СН2–CH2–CH2–CH2–), 118.6 (С≡N). ИК-спектр (KBr), см–1: 2450 (ν(В–Н)), 2255 (ν(C≡N)), 1029 (ν(C–O)). Найдено, %: C 12.15; H 3.50; N 2.86; B 22.29. Вычислено для C5H17B10Cs2NO, %: C 12.48; H 3.56; N 2.91; B 22.47. ESI MS. Найдено, а.е.м.: 216.30 {[B10H9O(CH2)4CN]2– + H+}–. (C5H18B10NO). Вычислено: М = 216.31. Найдено, а.е.м.: 348.19 {[B10H9O(CH2)4CN]2– + Cs+}–. (C5H17B10CsNO). Вычислено: М = 348.21.
2-[2-(2-гидроксоэтокси)этокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)2O(CH2)2OH]. Получено 0.46 г (выход 94%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 3.09 (2H, т, ‒O–СН2–CH2–O–CH2–CH2–), 3.17 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.70 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 4.09 (2H, т, –O–СН2–CH2–O–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.2 (c, 1В, В (4)); –29.2 (c, 2В, В (7, 8)); ‒23.5 (c, 4B, В (3, 5) + В (6, 9)); –3.8 (c, 1B, В (10)); –2.8 (с, 1B, В (1)); –1.0 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 53.6 (–O–СН2–CH2–O–CH2–CH2–), 66.4 (–O–СН2–CH2–O–CH2–CH2–), 70.4 (–O–СН2–CH2–O–CH2–CH2–), 73.8 (–O–СН2–CH2–O–CH2–CH2–). ИК-спектр (KBr), см–1: 3400 (ν(O–Н)), 2457 (ν(В–Н)), 1087 (ν(C–O–C)). Найдено, %: C 9.56; H 3.68; B 21.98. Вычислено для C4H18B10Cs2O3, %: C 9.84; H 3.72; B 22.15. ESI MS. Найдено, а.е.м.: 223.29 {[B10H9O(CH2)2O(CH2)2ОH]2– + + H+}–. (C4H19B10O3). Вычислено: М = 223.30. Найдено, а.е.м.: 355.18 {[B10H9O(CH2)2O(CH2)2OH]2– + + Cs+}–. (C4H18B10CsO3). Вычислено: М = = 355.20.
2-[5-гидроксопентокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)5OH]. Выход 0.44 г (90%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 2.18 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.28 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.35 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.71 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–); 4.32 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.4 (c, 1В, В (4)); –28.8 (c, 2В, В (7, 8)); ‒23.5 (c, 4B, В (3, 5) + В (6, 9)); –5.8 (c, 1B, В (10)); –2.8 (с, 1B, В (1)); –0.8 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 28.7 (–O–СН2–CH2–CH2–CH2–CH2); 31.7 (–O–СН2–CH2–CH2–CH2–CH2); 40.2 (–O–СН2–CH2–CH2–CH2–CH2); 52.4 (‒O–СН2–CH2–CH2–CH2–CH2–); 71.7 (–O–СН2–CH2–CH2–CH2–CH2–). ИК-спектр (KBr), см–1: 3396 (ν(O–Н)), 2476 (ν(В–Н)), 1082 (ν(C–O–C)). Найдено, %: C 12.09; H 4.08; B 22.04. Вычислено для C5H20B10Cs2O2, %: C 12.35; H 4.15; B 22.24. ESI MS. Найдено, а.е.м.: 221.33 {[B10H9O(CH2)5ОH]2– + H+}–. (C5H21B10O2). Вычислено: М = 221.33. Найдено, а.е.м.: 353.22 {[B10H9O(CH2)5OH]2– + Cs+}–. (C5H20B10CsO2). Вычислено: М = 353.23.
2-[4-гидроксобутокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)4OH]. Выход 0.44 г (93%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 1.36 (2Н, м, –O–СН2–CH2–CH2–CH2–); 1.42 (2Н, м, –O–СН2–CH2–CH2–CH2); 3.10 (2Н, т, –O–СН2–CH2–CH2–CH2–); 3.26 (2Н, т, –O–СН2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –33.6 (c, 1В, В (4)); –28.8 (c, 2В, В (7, 8)); –23.6 (c, 4B, В (3, 5) + В (6, 9)); –5.2 (c, 1B, В (10)); –2.8 (с, 1B, В (1)); –0.8 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 28.2 (–O–СН2–CH2–CH2–CH2–); 30.1 (–O–СН2–CH2–CH2–CH2–); 53.4 (–O–СН2–CH2–CH2–CH2–); 74.3 (–O–СН2–CH2–CH2–CH2–). ИК-спектр (KBr), см–1: 3989 (ν(O–Н)), 2454 (ν(В–Н)), 890 (ν(C–O–C)). Найдено, %: C 9.88; H 3.77; B 22.70. Вычислено для C4H18B10Cs2O2, %: C 10.18; H 3.84; B 22.90. ESI MS. Найдено, а.е.м.: 207.28 {[B10H9O(CH2)4ОH]2– + + H+}–. (C4H19B10O2). Вычислено: М = 207.30. Найдено, а.е.м.: 339.19 {[B10H9O(CH2)4OH]2– + Cs+}–. (C4H18B10CsO2). Вычислено: М = 339.20.
2-[2-(2-ацетоксиэтокси)этокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)2O(CH2)2OС(О) СН3]. Получено 0.47 г (выход 88%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 3.10 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.19 (2H, т, ‒O–СН2–CH2–O–CH2–CH2–), 3.59 (3H, с, ‒OC(O)CH3), 3.74 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 4.20 (2H, т, –O–СН2–CH2–O–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.4 (c, 1В, В (4)); –29.3 (c, 2В, В (7, 8)); –23.7 (c, 4B, В (3, 5) + + В (6, 9)); –4.1 (c, 1B, В (10)); –2.8 (с, 1B, В (1)); –1.1 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 28.9 (–OC(O)CH3), 53.8 (–O–СН2–CH2–O–CH2–CH2–), 66.7 (–O–СН2–CH2–O–CH2–CH2–), 70.5 (–O–СН2–CH2–O–CH2–CH2–), 75.4 (–O–СН2–CH2–O–CH2–CH2–), 151.6 (–OC(O)CH3). ИК-спектр (KBr), см–1: 2476 (ν(В–Н)), 1670 (ν(C=O)). Найдено, %): C 13.30; H 3.76; B 20.21. Вычислено для C6H20B10Cs2O4, %: C 13.59; H 3.80; B 20.39. ESI MS. Найдено, а.е.м.: 265.33 {[B10H9O(CH2)2O(CH2)2OС(О)СН3]2– + H+}–. (C6H21B10O4). Вычислено: М = 265.34. Найдено, а.е.м.: 397.23 {[B10H9O(CH2)2O(CH2)2OС(О)СН3]2– + + Cs+}–. (C6H20B10CsO4). Вычислено: М = 397.24.
2-[5-ацетоксипентокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)5OС(О)СН3]. Выход 0.45 г (85%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 2.20 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.31 (2Н, м, ‒O‒СН2–CH2–CH2–CH2–CH2–); 2.35 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.56 (3H, с, –OC(O)CH3); 2.74 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–); 4.45 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.1 (c, 1В, В (4)); –28.5 (c, 2В, В (7, 8)); –23.4 (c, 4B, В (3, 5) + В (6, 9)); –5.7 (c, 1B, В (10)); –2.1 (с, 1B, В (1)); –0.6 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 25.1 (–OC(O)CH3); 28.5 (‒O–СН2–CH2–CH2–CH2–CH2); 31.8 (–O–СН2–CH2–CH2–CH2–CH2); 40.4 (–O–СН2–CH2–CH2–CH2–CH2); 52.9 (–O–СН2–CH2–CH2–CH2–CH2–); 72.3 (–O–СН2–CH2–CH2–CH2–CH2–), 151.2 (–OC(O)CH3). ИК-спектр (KBr), см–1: 2485 (ν(В–Н)), 1681 (ν(C=O)). Найдено, %: C 15.64; H 4.16; B 20.32. Вычислено для C7H22B10Cs2O3, %: C 15.92; H 4.20; B 20.47. ESI MS. Найдено, а.е.м.: 263.36 {[B10H9O(CH2)5OС(О)СН3]2– + H+}–. (C7H23B10O3). Вычислено: М = 263.37. Найдено, а.е.м.: 395.25 {[B10H9O(CH2)5OС(О)СН3]2– + Cs+}–. (C7H22B10CsO3). Вычислено: М = 395.26.
2-[4-ацетоксибутокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)4OС(О)СН3]. Выход 0.43 г (84%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 1.36 (2Н, м, –O–СН2–CH2–CH2–CH2–); 1.43 (2Н, м, –O–СН2–CH2–CH2–CH2); 2.58 (3H, с, –OC(O)CH3); 3.10 (2Н, т, –O–СН2–CH2–CH2–CH2–); 3.38 (2Н, т, –O–СН2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –33.2 (c, 1В, В (4)); –28.9 (c, 2В, В (7, 8)); –23.6 (c, 4B, В (3, 5) + В (6, 9)); –5.1 (c, 1B, В (10)); –3.1 (с, 1B, В (1)); –1.4 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 23.8 (–OC(O)CH3); 28.4 (–O–СН2–CH2–CH2–CH2–); 30.3 (–O–СН2–CH2–CH2–CH2–); 53.4 (–O–СН2–CH2–CH2–CH2–); 76.5 (–O–СН2–CH2–CH2–CH2–), 151.5 (–OC(O)CH3). ИК-спектр (KBr), см–1: 2491 (ν(В–Н)), 1672 (ν(C=O)). Найдено, %: C 13.80; H 3.87; B 20.89. Вычислено для C6H20B10Cs2O3, %: C 14.02; H 3.92; B 21.02. ESI MS. Найдено, а.е.м.: 249.34 {[B10H9O(CH2)4OС(О)СН3]2– + H+}–. (C6H21B10O3). Вычислено: М = 249.34. Найдено, а.е.м.: 381.23 {[B10H9O(CH2)4OС(О)СН3]2– + Cs+}–. (C6H20B10CsO3). Вычислено: М = 381.24.
2-[2-(2-меркаптоэтокси)этокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)2O(CH2)2SH]. Получено 0.46 г (выход 92%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 3.23 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.70 (2H, т, ‒O–СН2–CH2–O–CH2–CH2–), 3.94 (2H, т, ‒O–СН2–CH2–O–CH2–CH2–), 4.09 (2H, т, –O–СН2–CH2–O–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.0 (c, 1В, В (4)); –28.7 (c, 2В, В (7, 8)); –23.5 (c, 4B, В (3, 5) + В (6, 9)); –7.4 (c, 1B, В (10)); –4.1 (с, 1B, В (1)); 1.5 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 47.6 (–O–СН2–CH2–O–CH2–CH2–), 69.6 (–O–СН2–CH2–O–CH2–CH2–), 70.1 (–O–СН2–CH2–O–CH2–CH2–), 72.4 (–O–СН2–CH2–O–CH2–CH2–). ИК-спектр (KBr), см–1: 2686 (ν(C–Н) S–CH2), 2451 (ν(В–Н)), 1082 (ν(C–O)). Найдено, %: C 9.21; H 3.53; S 6.31; B 21.28. Вычислено для C4H18B10Cs2O2S, %: C 9.53; H 3.60; S 6.36; B 21.44. ESI MS. Найдено, а.е.м.: 239.37 {[B10H9O(CH2)2O(CH2)2SH]2– + H+}–. (C4H19B10O2S). Вычислено: М = 239.37. Найдено, а.е.м.: 371.25 {[B10H9O(CH2)2O(CH2)2SH]2– + Cs+}–. (C4H18B10CsO2S). Вычислено: М = 371.26.
2-[5-меркаптопентокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)5SH]. Выход 0.43 г (85%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 1.17 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 1.38 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 1.46 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.21 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–); 3.09 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.2 (c, 1В, В (4)); –29.5 (c, 2В, В (7, 8)); –24.0 (c, 4B, В (3, 5) + В (6, 9)); –5.1 (c, 1B, В (10)); –3.3 (с, 1B, В (1)); –2.0 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 20.2 (–O–СН2–CH2–CH2–CH2–CH2); 29.9 (–O–СН2–CH2–CH2–CH2–CH2); 32.1 (–O–СН2–CH2–CH2–CH2–CH2); 51.1 (–O–СН2–CH2–CH2–CH2–CH2–); 70.9 (–O–СН2–CH2–CH2–CH2–CH2–). ИК-спектр (KBr), см–1: 2692 (ν(C–Н) S–CH2), 2455 (ν(В–Н)), 1082 (ν(C–O)). Найдено, %: C 9.27; H 3.54; S 6.30; B 21.30. Вычислено для C4H18B10Cs2O2S, %: C 9.53; H 3.60; S 6.36; B 21.44. ESI MS. Найдено, а.е.м.: 239.37 {[B10H9O(CH2)5SH]2– + H+}–. (C4H18B10CsO2S). Вычислено: М = 239.37. Найдено, а.е.м.: 371.26 {[B10H9O(CH2)5SH]2– + Cs+}–. (C4H18B10CsO2S). Вычислено: М = 371.27.
2-[4-меркаптобутокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)4SH]. Выход 0.44 г (91%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.5…–0.50 (9H, м, В10Н9), 2.54 (2Н, м, –O–СН2–CH2–CH2–CH2–); 2.78 (2Н, м, –O–СН2–CH2–CH2–CH2); 2.90 (2Н, т, –O–СН2–CH2–CH2–CH2–); 3.51 (2Н, т, –O–СН2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –33.8 (c, 1В, В (4)); –29.6 (c, 2В, В (7, 8)); –23.6 (c, 4B, В (3, 5) + В (6, 9)); –6.1 (c, 1B, В (10)); –2.7 (с, 1B, В (1)); –1.3 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 25.2 (–O–СН2–CH2–CH2–CH2–); 28.2 (–O–СН2–CH2–CH2–CH2–); 38.4 (–O–СН2–CH2–CH2–CH2–); 72.5 (‒O–СН2–CH2–CH2–CH2–). ИК-спектр (KBr), см–1: 2690 (ν(C–Н) S–CH2), 2459 (ν(В–Н)), 1079 (ν(C–O–C)). Найдено, %: C 9.59; H 3.67; S 6.51; B 22.00. Вычислено для C4H18B10Cs2OS, %: C 9.84; H 3.72; S 6.57; B 22.15. ESI MS. Найдено, а.е.м.: 223.36 {[B10H9O(CH2)4SH]2– + H+}–. (C4H19B10OS). Вычислено: М = 223.37. Найдено, а.е.м.: 355.25 {[B10H9O(CH2)4SH]2– + Cs+}–. (C4H18B10CsOS). Вычислено: М = 355.27.
2-[2-(2-(S-тиоцианато)этокси)этокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)2O(CH2)2S CN]. Получено 0.48 г (выход 91%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 3.28 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.77 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.96 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 4.25 (2H, т, –O–СН2–CH2–O–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –33.6 (c, 1В, В (4)); –29.3 (c, 2В, В (7, 8)); –23.5 (c, 4B, В (3, 5) + В (6, 9)); –7.1 (c, 1B, В (10)); –2.8 (с, 1B, В (1)); –1.5 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 38.6 (–O–СН2–CH2–O–CH2–CH2–), 68.5 (–O–СН2–CH2–O–CH2–CH2–), 69.8 (–O–СН2–CH2–O–CH2–CH2–), 72.9 (–O–СН2–CH2–O–CH2–CH2–), 104.1 (S–C≡N). ИК-спектр (KBr), см–1: 2488 (ν(В–Н)), 2135 (ν(C≡N) S–C≡N). Найдено, %: C 11.04; H 3.19; N 2.60; S 5.99; B 20.29. Вычислено для C5H17B10Cs2NO2S, %: C 11.35; H 3.24; N 2.65; S 6.06; B 20.43. ESI MS. Найдено, а.е.м.: 264.36 {[B10H9O(CH2)2O(CH2)2SCN]2– + H+}–. (C5H18B10NO2S). Вычислено: М = 264.38. Найдено, а.е.м.: 396.26 {[B10H9O(CH2)2O(CH2)2SCN]2– + + Cs+}–. (C5H17B10CsNO2S). Вычислено: М = = 396.27.
2-[5-(S-тиоцианато)пентокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)5SCN]. Выход 0.46 г (88%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 2.21 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.33 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.38 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.85 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–); 4.34 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –33.9 (c, 1В, В (4)); –28.5 (c, 2В, В (7, 8)); –23.0 (c, 4B, В (3, 5) + В (6, 9)); –5.0 (c, 1B, В (10)); –2.3 (с, 1B, В (1)); –1.8 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 26.6 (–O–СН2–CH2–CH2–CH2–CH2); 34.4 (–O–СН2–CH2–CH2–CH2–CH2); 40.2 (–O–СН2–CH2–CH2–CH2–CH2); 54.1 (–O–СН2–CH2–CH2–CH2–CH2–); 74.9 (–O–СН2–CH2–CH2–CH2–CH2–), 100.6 (S–C≡N). ИК-спектр (KBr), см–1: 2474 (ν(В–Н)), 2138 (ν(C≡N) S–C≡N). Найдено, %): C 13.35; H 3.59; N 2.61; S 6.01; B 20.34. Вычислено для C6H19B10Cs2NOS, %: C 13.67; H 3.63; N 2.66; S 6.08; B 20.51. ESI MS. Найдено, а.е.м.: 262.39 {[B10H9O(CH2)5SCN]2– + + H+}–. (C6H20B10NOS). Вычислено: М = 262.40. Найдено, а.е.м.: 394.30 {[B10H9O(CH2)5SCN]2– + + Cs+}–. (C6H19B10CsNOS). Вычислено: М = 394.30.
2-[4-(S-тиоцианато)бутокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)4SCN]. Выход 0.44 г (86%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 1.17 (2Н, м, –O–СН2–CH2–CH2–CH2–); 1.38 (2Н, м, –O–СН2–CH2–CH2–CH2); 2.70 (2Н, т, –O–СН2–CH2–CH2–CH2–); 2.91 (2Н, т, –O–СН2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.6 (c, 1В, В (4)); –28.6 (c, 2В, В (7, 8)); –23.5 (c, 4B, В (3, 5) + В (6, 9)); –5.1 (c, 1B, В (10)); –3.7 (с, 1B, В (1)); –1.7 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 31.3 (–O–СН2–CH2–CH2–CH2–); 35.7 (–O–СН2–CH2–CH2–CH2–); 58.0 (–O–СН2–CH2–CH2–CH2–); 72.6 (–O–СН2–CH2–CH2–CH2–), 102.8 (S–C≡N). ИК-спектр (KBr), см–1: 2492 (ν(В–Н)), 2131 (ν(C≡N) S–C≡N). Найдено, %: C 11.42; H 3.29; N 2.68; S 6.20; B 20.34. Вычислено для C5H17B10Cs2NOS, %: C 11.70; H 3.34; N 2.73; S 6.25; B 21.07. ESI MS. Найдено, а.е.м.: 248.37 {[B10H9O(CH2)4SCN]2– + H+}–. (C5H18B10NOS). Вычислено: М = 248.38. Найдено, а.е.м.: 380.26 {[B10H9O(CH2)4SCN]2– + Cs+}–. (C5H17B10CsNOS). Вычислено: М = 380.28.
2-[2-(2-(S-тиосульфато)этокси)этокси]нонагидро-клозо-декаборат цезия Cs3[B10H9O(CH2)2O(CH2)2 SO3S]. Получено 0.63 г (выход 88%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 3.30 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.77 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 3.97 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 4.25 (2H, т, ‒O–СН2–CH2–O–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –33.4 (c, 1В, В (4)); –29.3 (c, 2В, В (7, 8)); –23.3 (c, 4B, В (3, 5) + В (6, 9)); –7.0 (c, 1B, В (10)); –2.9 (с, 1B, В (1)); –1.5 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 38.9 (–O–СН2–CH2–O–CH2–CH2–), 68.5 (–O–СН2–CH2–O–CH2–CH2–), 69.8 (–O–СН2–CH2–O–CH2–CH2–), 73.0 (–O–СН2–CH2–O–CH2–CH2–). ИК-спектр (KBr), см–1: 2490 (ν(В–Н)), 1379, 1157 (ν(S–O)). Найдено, %: C 6.44; H 2.32; S 8.93; B 14.96. Вычислено для C4H17B10Cs3O5S2, %: C 6.71; H 2.39; S 8.96; B 15.10. ESI MS. Найдено, а.е.м.: 583.22 {[B10H9O(CH2)2O(CH2)2SO3S]3– + 2Cs+}–. (C4H17B10Cs2O5S2). Вычислено: М = 583.23.
2-[5-(S-тиосульфато)пентокси]нонагидро-клозо-декаборат цезия Cs3[B10H9O(CH2)5SO3S]. Выход 0.61 г (86%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 2.21 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.32 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.39 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 2.88 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–); 4.35 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –33.7 (c, 1В, В (4)); –28.4 (c, 2В, В (7, 8)); –23.1 (c, 4B, В (3, 5) + В (6, 9)); –4.8 (c, 1B, В (10)); –2.5 (с, 1B, В (1)); –1.6 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 26.6 (–O–СН2–CH2–CH2–CH2–CH2); 34.4 (–O–СН2–CH2–CH2–CH2–CH2); 40.3 (–O–СН2–CH2–CH2–CH2–CH2); 54.2 (–O–СН2–CH2–CH2–CH2–CH2–); 75.0 (–O–СН2–CH2–CH2–CH2–CH2–). ИК-спектр (KBr), см–1: 2483 (ν(В–Н)), 1381, 1162 (ν(S–O)). Найдено, %: C 8.19; H 2.62; S 8.92; B 15.01. Вычислено для C5H19B10Cs3O4S2, %: C 8.41; H 2.68; S 8.98; B 15.14. ESI MS. Найдено, а.е.м.: 581.24 {[B10H9O(CH2)5SO3S]3– + 2Cs+}–. (C5H19B10Cs2O4S2). Вычислено: М = 581.25.
2-[4-(S-тиосульфато)бутокси]нонагидро-клозо-декаборат цезия Cs3[B10H9O(CH2)4SO3S]. Выход 0.60 г (85%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 1.18 (2Н, м, –O–СН2–CH2–CH2–CH2–); 1.40 (2Н, м, –O–СН2–CH2–CH2–CH2); 2.70 (2Н, м, –O–СН2–CH2–CH2–CH2–); 2.92 (2Н, т, –O–СН2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.9 (c, 1В, В (4)); –28.8 (c, 2В, В (7, 8)); –23.5 (c, 4B, В (3, 5) + + В (6, 9)); –5.2 (c, 1B, В (10)); –3.7 (с, 1B, В (1)); –1.8 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 31.3 (–O–СН2–CH2–CH2–CH2–); 35.7 (–O–СН2–CH2–CH2–CH2–); 58.0 (–O–СН2–CH2–CH2–CH2–); 72.8 (–O–СН2–CH2–CH2–CH2–). ИК-спектр (KBr), см–1: 2469 (ν(В–Н)), 1382, 1164 (ν(S–O)). Найдено, %: C 6.59; H 2.40; S 9.10; B 15.28. Вычислено для C4H17B10Cs3O4S2, %: C 6.86; H 2.45; S 9.16; B 15.44. ESI MS. Найдено, а.е.м.: 567.21 {[B10H9O(CH2)4SO3S]3– + 2Cs+}–. (C4H17B10Cs2O4S2). Вычислено: М = 567.23.
2-[2-(2-фтороэтокси)этокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)2O(CH2)2F]. Получено 0.46 г (выход 94%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 3.81 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 4.11 (2H, т, ‒O–СН2–CH2–O–CH2–CH2–), 4.40 (2H, т, –O–СН2–CH2–O–CH2–CH2–), 4.89 (2H, т, –O–СН2–CH2–O–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.0 (c, 1В, В (4)); –25.7 (c, 2В, В (7, 8)); –23.7 (c, 4B, В (3, 5) + В (6, 9)); –5.4 (c, 1B, В (10)); –2.8 (с, 1B, В (1)); –1.6 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 61.3 (–O–СН2–CH2–O–CH2–CH2–), 66.7 (–O–СН2–CH2–O–CH2–CH2–), 72.9 (–O–СН2–CH2–O–CH2–CH2–), 78.4 (–O–СН2–CH2–O–CH2–CH2–). ИК-спектр (KBr), см–1: 2486 (ν(В–Н)), 1088 (ν(C–O–C)). Найдено, %: C 9.51; H 3.45; B 21.89. Вычислено для C4H17B10Cs2FO2, %: C 9.80; H 3.50; B 22.06. ESI MS. Найдено, а.е.м.: 225.27 {[B10H9O(CH2)2O(CH2)2F]2– + H+}–. (C4H18B10FO2). Вычислено: М = 225.29. Найдено, а.е.м.: 357.18 {[B10H9O(CH2)2O(CH2)2F]2– + Cs+}–. (C4H17B10CsFO2). Вычислено: М = 357.19.
2-[5-фторопентокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)5F]. Выход 0.45 г (92%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 3.06 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 3.20 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 3.45 (2Н, м, –O–СН2–CH2–CH2–CH2–CH2–); 3.88 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–); 4.30 (2Н, т, –O–СН2–CH2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –33.9 (c, 1В, В (4)); –29.3 (c, 2В, В (7, 8)); –23.1 (c, 4B, В (3, 5) + В (6, 9)); –5.0 (c, 1B, В (10)); –2.6 (с, 1B, В (1)); –1.5 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 22.9 (–O–СН2–CH2–CH2–CH2–CH2); 30.4 (–O–СН2–CH2–CH2–CH2–CH2); 40.2 (–O–СН2–CH2–CH2–CH2–CH2); 71.5 (–O–СН2–CH2–CH2–CH2–CH2–); 75.2 (–O–СН2–CH2–CH2–CH2–CH2–). ИК-спектр (KBr), см–1: 2488 (ν(В–Н)), 1084 (ν(C–O–C)). Найдено, %: C 12.02; H 3.86; B 21.97. Вычислено для C5H19B10Cs2FO, %: C 12.30; H 3.92; B 22.15. ESI MS. Найдено, а.е.м.: 223.30 {[B10H9O(CH2)5F]2– + H+}–. (C5H20B10FO). Вычислено: М = 223.32. Найдено, а.е.м.: 355.21 {[B10H9O(CH2)5F]2– + Cs+}–. (C5H19B10CsFO). Вычислено: М = 355.22.
2-[4-фторобутокси]нонагидро-клозо-декаборат цезия Cs2[B10H9O(CH2)4F]. Выход 0.44 г (92%). 1H ЯМР-спектр (D2O, δ, м.д.): 0.50…–0.50 (9H, м, В10Н9), 3.12 (2Н, м, –O–СН2–CH2–CH2–CH2–); 3.34 (2Н, м, –O–СН2–CH2–CH2–CH2); 3.76 (2Н, т, –O–СН2–CH2–CH2–CH2–); 4.29 (2Н, т, –O–СН2–CH2–CH2–CH2–). 11B {1H} ЯМР-спектр (D2O, δ, м.д.): –34.2 (c, 1В, В (4)); –24.7 (c, 2В, В (7, 8)); –23.5 (c, 4B, В (3, 5) + В (6, 9)); –5.3 (c, 1B, В (10)); –3.4 (с, 1B, В (1)); –1.2 (с, 1B, В (2)). 13C ЯМР-спектр (D2O, δ, м.д.): 22.3 (–O–СН2–CH2–CH2–CH2–); 31.7 (–O–СН2–CH2–CH2–CH2–); 73.5 (–O–СН2–CH2–CH2–CH2–); 78.6 (–O–СН2–CH2–CH2–CH2–). ИК-спектр (KBr), см–1: 2490 (ν(В–Н)), 1085 (ν(C–O–C)). Найдено, %: C 9.84; H 3.55; B 22.66. Вычислено для C4H17B10Cs2FO, %: C 10.13; H 3.61; B 22.80. ESI MS. Найдено, а.е.м.: 209.28 {[B10H9O(CH2)4F]2– + H+}–. (C4H18B10FO). Вычислено: М = 209.29. Найдено, а.е.м.: 341.17 {[B10H9O(CH2)4F]2– + Cs+}–. (C4H17B10CsFO). Вычислено: М = 341.19.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В данном исследовании был разработан новый метод получения клозо-декаборатов с пендантными С-, O-, S- и Hal-функциональными группами, заключающийся во взаимодействии замещенных производных клозо-декаборатного аниона [2-B10H9X]– (X = 1,4-диоксан, тетрагидропиран, тетрагидрофуран) с нуклеофильными реагентами (KCN, KOH, CH3COONa, KSH, KSCN, Na2S2O3, KF) в условиях механохимического синтеза (схема 1 ).
Схема 1 . Взаимодействие анионов [B10H9O(CH2)4O]–, [B10H9O(CH2)5]– и [B10H9O(CH2)4]– с нуклеофильными реагентами в условиях механохимического синтеза.
В отличие от “традиционных” методов получения подобных соединений предложенный подход не требует применения апротонных полярных растворителей и значительно сокращает как время непосредственного взаимодействия реагентов, так и время, необходимое на выделение образующихся продуктов.
Раскрытие циклического заместителя в анионах [B10H9X]– (X = 1,4-диоксан, тетрагидропиран, тетрагидрофуран) и образование клозо-декаборатов с концевыми функциональными группами удобно контролировать по данным 11B {1H} ЯМР–спектроскопии образующихся соединений.
Реагенты и продукты реакций относятся к монозамещенным клозо-декаборатам, поэтому их 11B {1H} ЯМР–спектры не имеют принципиальных отличий, а происходит только изменение химических сдвигов и перераспределение сигналов от атомов бора.
Например, в 11B {1H} ЯМР–спектре соли Bu4N[B10H9O(CH2)4O] присутствуют два синглета при 0.8 и –6.4 м.д., которые относятся к неэквивалентным апикальным вершинам борного кластера. В спектре производного Cs2[B10H9O(CH2)2O(CH2)2CN] эти сигналы сближаются относительно друг друга и наблюдаются при –3.6 и –5.6 м.д. Сигнал от ипсо-атома бора является единственным сигналом, который не расщепляется в дублет в спектре 11B ЯМР, он смещается с 8.0 до –1.6 м.д. Также наблюдается перераспределение сигналов от оставшихся экваториальных атомов бора: если в спектре исходного аниона присутствуют три сигнала при 21.5, 23.5 и 30.0 м.д. с соотношением интегральных интенсивностей 2 : 2 : 3 соответственно, то в спектре продукта реакции эти сигналы наблюдаются примерно при тех же химических сдвигах, но с соотношением интегральных интенсивностей 4 : 2 : 1. Такие изменения в 11B {1H} ЯМР-спектрах продуктов реакций однозначно свидетельствуют об изменении типа связи В–О с оксониевого на алкоксильный.
Спектры всех полученных соединений имеют достаточно схожий вид, так все они относятся к типу [B10H9OR]n (n = –1, –2), а пендантная функциональная группа практически не влияет на характер химической связи в борном кластере. Поэтому метод 11B {1H} ЯМР-спектроскопии, являясь очень удобным для контроля протекания реакций раскрытия циклического заместителя, в то же время не может быть использован для установления строения присоединенной пендантной группы. Эта информация была получена при использовании методов ИК-, 13С и 1Н ЯМР-спектроскопии.
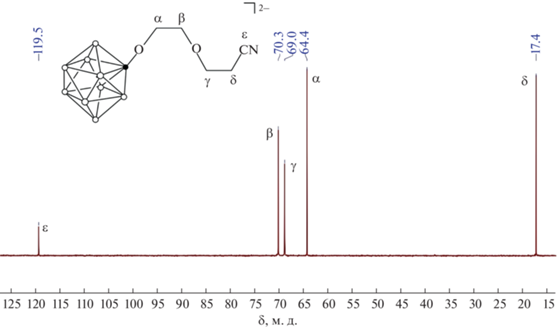
Так, в 1Н ЯМР-спектрах продуктов реакций происходят значительные изменения по сравнению со спектрами исходных производных клозо-декаборатного аниона. Например, в 1Н ЯМР-спектре соли Bu4N[B10H9O(CH2)4O] наблюдаются два триплета при 3.85 и 4.31 м.д., которые относятся к 1,4-диоксановому заместителю. В спектре же соединения Cs2[B10H9O(CH2)2O(CH2)2CN] присутствуют четыре сигнала при 2.97, 3.65, 3.78 и 3.94 м.д. от неэквивалентных метиленовых групп алкоксильной спейсерной цепи. Аналогичные изменения наблюдаются в 13С ЯМР-спектрах продуктов реакций. Так, в спектре того же продукта присутствуют сигналы при 17.4, 64.4, 69.0 и 70.3 м.д. от атомов углерода спейсерной цепи, а также сигнал при 119.5 м.д. от присоединенной группы –С≡N (рис. 1). Изменения аналогичного характера наблюдаются в спектрах и остальных полученных производных клозо-декаборатного аниона с пендантными функциональными группами.
В ИК-спектрах синтезированных соединений также наблюдаются интересные изменения, связанные с раскрытием циклического заместителя и введением пендантной группы. Например, в спектрах производных с присоединенными группами –SCN и –СN присутствуют узкие полосы с максимумами при 2130–2140 см–1 (ν(–S–C≡N)) и 2240–2260 см–1 (ν(–C≡N)) соответственно. Наблюдение таких полос поглощения свидетельствует о получении производных именно с S–тиоцианатной и С–цианидной пендантными группами [70]. Как правило, все спектры содержат высокоинтенсивную полосу поглощения валентных колебаний В–Н от борного полиэдра в диапазоне 2440–2510 см–1, а полоса при 940–970 см–1, отвечающая валентным колебаниям С–О+–С в исходном соединении, исчезает.
Состав полученных клозо–декаборатов с пендантными функциональными группами позволил подтвердить метод ESI масс-спектрометрии. Как правило, в анионной части масс-спектров в подавляющем большинстве случаев присутствуют высокоинтенсивные пики от однозарядных ионов {Cs+ + [B10H9spacerNu]2–}– и {H+ + [B10H9spacerNu]}–, где spacer = ‒OCH2CH2OCH2CH2–, –OCH2CH2CH2CH2– или –OCH2CH2CH2CH2CH2–. Например, в масс-спектре производного Cs2[B10H9O(CH2)2O(CH2)2F] наблюдаются пики с максимальной интенсивностью при m/z 225.27 и 357.18 от анионов состава {Cs+ + [B10H9O(CH2)2O(CH2)2F]2–}– и {H+ + + [B10H9O(CH2)2O(CH2)2F]}–, что находится в очень хорошем соответствии с расчетными значениями (m/z 225.29 и 357.19 соответственно).
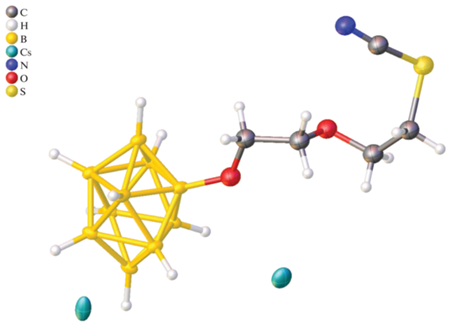
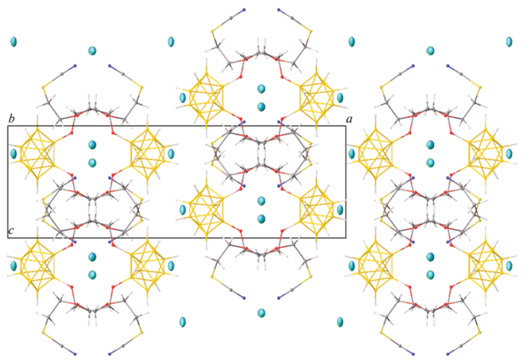
Строение соединения Cs2[B10H9O(CH2)2O(CH2)2SCN] было установлено методом РСА. Кристаллографически независимая часть орторомбической ячейки (пр. гр. Pnna, Z = 4, Z = 0.5) соединения Cs2[B10H9O(CH2)2O(CH2)2SCN] содержит половину аниона [B10H9O(CH2)2O(CH2)2SCN]2– (рис. 2) и два катиона Cs+ с заселенностью 0.5, в связи с чем экзополиэдрический заместитель аниона разупорядочен на две позиции. Длина связи B–O составляет 1.49(4) Å, связей C≡N и S–C – 1.13(5) Å и 1.696(13) Å соответственно, что согласуется с литературными данными [23, 36, 43, 48, 49].
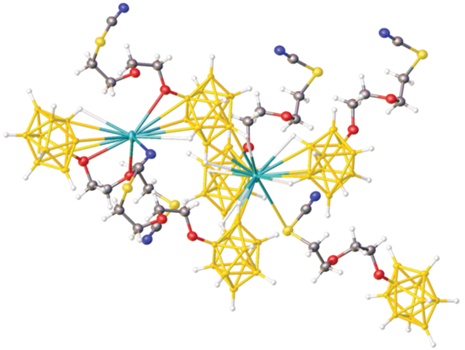
Один из катионов цезия находится в окружении четырех борных остовов и двух атомов серы, в то время как второй – в окружении двух борных остовов трех атомов кислорода от двух экзополиэдрических заместителей и атома азота от третьего аниона (рис. 3). Расстояние Cs–S составляет 3.966(17) Å, Cs–N – 3.07(5), а расстояние Cs–B лежит в диапазоне 3.49(3)–3.86(3) Å.
Анионы [B10H9O(CH2)2O(CH2)2SCN]2– образуют сдвоенные слои (рис. 4), в которых экзополиэдрические заместители “координированы” на атомы Cs, располагающиеся внутри каналов, образованных этими заместителями. Другие катионы расположены между этими слоями и “координируют” борные остовы.
Таким образом, в ходе настоящего исследования был разработан новый метод получения производных аниона [B10H10]2– с пендантными функциональными группами, заключающийся во взаимодействии анионов [2-B10H9O(CH2)4O]–, [2-B10H9O(CH2)5]– и [2-B10H9O(CH2)4]– с рядом С-, O-, S- и F-нуклеофильных реагентов в условиях механохимического синтеза. Показано, что данный метод позволяет синтезировать производные клозо-декаборатного аниона с пендантными группами различного строения с высокими выходами за относительно малое время и без применения апротонных полярных растворителей. Использование клозо-декаборатов с различным типом экзополиэдрических заместителей позволяет конструировать производные со спейсерными группами с заданными длиной и составом. Синтезированные соединения в дальнейшем могут быть модифицированы за счет реакционной способности пендантных групп, а также могут быть использованы в качестве полидентатных лигандов за счет наличия донорных центров различного типа.
Список литературы
Zhao X., Yang Z., Chen H., Wang Z. et al. // Coord. Chem. Rev. 2021. V. 444. P. 214042. https://doi.org/10.1016/j.ccr.2021.214042
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czechosl. Chem. Commun. 2010. V. 75. № 11. P.1149. https://doi.org/10.1135/cccc2010054
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czechosl. Chem. Commun. 2002. V. 67. № 6. P. 679. https://doi.org/10.1135/cccc20020679
Sivaev I.B. // Chem. Heterocycl. Compd. 2017. V. 53. № 6. P. 638. https://doi.org/10.1007/s10593-017-2106-9
Yan Y., Rentsch D., Battaglia C. et al. // Dalton Trans. 2017. V. 46. № 37. P. 12434. https://doi.org/10.1039/C7DT02946B
Yan J., Yang W., Zhang Q. et al. // Chemical Communications. 2020. V. 56. № 79. P. 11720. https://doi.org/10.1039/D0CC04709K
Dash B.P., Satapathy R., Maguire J.A. et al. // New J. Chem. 2011. V. 35. № 10. P. 1955. https://doi.org/10.1039/C1NJ20228F
Ould-Amar S., Peti E., Granie D. et al. // Renewable Energy. 2019. V. 143. P. 551. https://doi.org/10.1016/j.renene.2019.05.019
Goszczyński T.M., Fink K., Boratyński J. et al. // Expert Opin. Biol. Ther. 2018. V. 18. № 1. P. 205. https://doi.org/10.1080/14712598.2018.1473369
Zharkov D.O., Yudkina A.V., Riesebeck T. et al. // Am. J. Cancer Res. 2021. V. 11. № 10. P. 4668.
Ali F., Hosmane N., Zhu Y. // Molecules. 2020. V. 25. № 4. P. 828. https://doi.org/10.3390/molecules25040828
Leśnikowski Z.J., Schinazi R.F. // J. Org. Chem. 1993. V. 58. № 24. P. 6531. https://doi.org/Leśnikowski.1021/jo00076a001
Lesnikowski Z.J., Shi J., Schinazi R.F. // J. Organometal. Chem. 1999. V. 581. P. 156. https://doi.org/10.1016/S0022-328X(99)00129-1
Sun Y.J., Zhang J.L., Zhang Y.B. et al. // Chemistry. 2018. V. 24. P. 10364 https://doi.org/10.1002/chem.201801602
Białek-Pietrasa M., Olejniczak A.B., Paradowska E. et al. // J. Organomet. Chem. 2015. V. 798. P. 99. https://doi.org/10.1016/j.jorganchem.2015.07.002
Авдеева В.В., Гараев Т.М., Малинина Е.А. и др. // Журн. неорган. хим. 2022. Т. 67. № 1. С. 33] https://doi.org/10.1134/S0036023622010028
Tetsushi Totani, Katsutoshi Aono, Kiyoe Yamamoto, Katsuya Tawara // J. Med. Chem. 1981. V. 24. № 12. P. 1492. https://doi.org/10.1021/jm00144a024
Матвеев Е.Ю., Кубасов А.С., Разгоняева Г.А. и др. // Журн. неорган. химии. 2015. Т. 60. № 7. С. 858.
Нелюбин А.В., Клюкин И.Н., Жданов А.П. и др. // Журн. неорган. химии. 2021. Т. 66. № 2. С. 134.
Nelyubin A.V., Klyukin I.N., Zhdanov A.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1750. https://doi.org/10.1134/S0036023619140043
Zhizhin K.Y., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Klyukin I.N., Zhdanov A.P., Matveev E.Yu. et al. // J. Inorg. Chem. Commun. 2014. V. 50. P. 28. https://doi.org/10.1016/j.inoche.2014.10.008
Klyukin I.N., Kubasov A.S., Limarev I.P. et al. // Polyhedron. 2015. V. 101. P. 215. https://doi.org/10.1016/j.poly.2015.09.025
Клюкин И.Н., Воинова В.В., Селиванов Н.А. и др. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1536.
Nelyubin A.V., Klyukin I.N., Novikov et al. // Mendeleev Commun. 2021. V. 31. № 2. P. 201. https://doi.org/10.1016/J.MENCOM.2021.03.018
Nelyubin A.V., Selivanov N.A., Bykov A.Y. et al. // Int. J. Mol. Sci. 2021. V. 22. № 24. P. 13391. https://doi.org/10.3390/ijms222413391
Kubasov A.S., Turishev E.S., Polyakova I.N. et al. // J. Organomet. Chem. 2017. V. 828. P. 106. https://doi.org/10.1016/j.jorganchem.2016.11.035
Голубев А.В., Кубасов А.С., Турышев Е.С., и др. // Журн. неорган. химии. 2020. Т. 65. № 9. С. 1198.
Kubasov A.S., Matveev E.Y., Turyshev E.S. et al. // Inorgan. Chim. Acta. 2018. V. 477. P. 277. https://doi.org/10.1016/j.ica.2018.03.013
Zhdanov A.P., Klyukin I.N., Bykov A.Y. et al. // Polyhedron. V. 123. P. 176. https://doi.org/10.1016/j.poly.2016.11.035
Stogniy M.Y., Erokhina S.A., Sivaev I.B. et al. // Phosphorus, Sulfur and Silicon and the Related Elements. 2019. P. 983 https://doi.org/10.1080/10426507.2019.1631312
Laskova J., Ananiev I., Kosenko I. et al. // Dalton Transactions. 2022. V. 51. № 8. P. 3051.
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. V. 6. P. 60. https://doi.org/10.3390/cryst6050060
Malinina E.A., Avdeeva V.V., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2010. V. 55. P. 2148. https://doi.org/10.1134/S0036023610140032
Kubasov A.S., Matveev E.Yu., Retivov V.M. et al. // Russ. Chem. Bull. 2014. V. 63. P. 187. https://doi.org/10.1007/s11172-014-0412-2
Matveev E.Y., Novikov I.V., Kubasov AS. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 2. P. 187. https://doi.org/10.1134/S0036023621020121
Semioshkin A.A., Sivaev I.B., Bregadze V.I. // Dalton Trans. 2008. V. 8. P. 977. https://doi.org/10.1039/B715363E
Матвеев Е.Ю., Акимов С.С., Кубасов А.С. и др. // Журн. неорган. химии. 2017. Т. 62. № 6. С. 827.
Prikaznov A.V., Las’kova Y.N., Semioshkin A.A. et al. // Russ. Chem. Bull. 2011. V. 60. № 12. P. 2550. https://doi.org/10.1007/s11172-011-0392-4
Матвеев Е.Ю., Лимарев И.П., Ничуговский А.И. и др. // Журн. неорган. химии. 2019. Т. 64. № 8. С. 811.
Матвеев Е.Ю., Новиков С.С., Левицкая В.Я. и др. // Тонкие химические технологии. 2022. Т. 17. № 5. С. 427.
Kikuchi S., Kanoh D., Sato S. et al. // J. Controlled Release. 2016. V. 237. P. 160. https://doi.org/10.1016/j.jconrel.2016.07.017
Laskova J., Kozlova A., Ananyev I. et al. // J. Organomet. Chem. 2017. V. 834. P. 64. https://doi.org/10.1016/j.jorganchem.2017.02.009
Serdyukov A., Kosenko I., Druzina A., Grin et al. // J. Organomet. Chem. 2021. V. 946. P. 121905. https://doi.org/10.1016/j.jorganchem.2021.121905
Imperio D., Muz B., Azab et al. // Eur. J. Org. Chem. 2019. V. 2019. № 43. P. 7228. https://doi.org/10.1002/ejoc.201901412
Druzina A.A., Kosenko I.D., Zhidkova O.B. // INEOS Open. 2020. V. 3. № 2. P. 70. https://doi.org/10.32931/io2008a
Матвеев Е.Ю., Левицкая В.Я., Новиков С.С. и др. // Журн. неорган. химии. 2022. Т. 67. № 12. С. 1717.
Semioshki A., Laskov J., Zhidkov O. et al. // J. Organomet. Chem. 2010. V. 695. № 3. P. 370. https://doi.org/10.1016/j.jorganchem.2009.10.038
Sivaev I.B., Kulikova N.Y., Nizhnik E.A. et al. // J. Organomet. Chem. 2008. V. 693. № 3. P. 519. https://doi.org/10.1016/j.jorganchem.2007.11.027
Beillard A., Bantreil X., Métro T.X. et al. // Chem. Rev. 2019. V. 119. № 12. P. 7529. https://doi.org/10.1021/acs.chemrev.8b00479
Friščić T., Mottillo C., Titi H.M. // Angew. Chem. 2020. V. 132. № 3. P. 1030. https://doi.org/10.1002/ange.201906755
Tan D., García F. // Chem. Rev. 2019. V. 48. № 8. P. 2274. https://doi.org/10.1039/C7CS00813A
Suárez-Alcántara K., Tena García J.R. // Materials. 2021. V. 14. № 10. P. 2561. https://doi.org/10.3390/ma14102561
Mal’tseva N.N., Generalova N.B., Masanov A.Yu. et al. // Rus. J. Inorg. Chem. 2012. V. 57. № 13. P. 1631. https://doi.org/10.1134/S0036023612130049
Huot J., Cuevas F., Deledda S. et al. // Materials. 2019. V. 12. № 17. P. 2778. https://doi.org/10.3390/ma12172778
Shin S., Um K., Ko G.H. et al. // Org. Lett. 2022. V. 24. № 17. P. 3128. https://doi.org/10.1021/acs.orglett.2c00756
Sha Y., Zhou Z., Zhu M. et al. // Angew. Chem. Int. Ed. 2022. P. e202203169.
Wang Q., Liu B., Feng K. et al. // Adv. Synthesis Catalysis. 2022. V. 364. № 24. P. 4174.
Volkov V.V., Myakishev K G. // Inorg. Chim. Acta. 1999. V. 289. № 1–2. P. 51. https://doi.org/10.1016/S0020-1693(99)00057-2
Borisov A.P., Makhaev V.D., Usyatinskii A.Y. et al. // Russ. Chem. Bull. 1993. V. 42. № 10. P. 1637. https://doi.org/10.1007/BF00697029
Volkov V.V., Myakishev K.G. // 8 Int. Meeting on Boron Chemistry (IMEBORON VIII), Program and Abstracts, The University of Tennessee, Knoxville, USA, 1993, p. 151
Malinina E.A., Korolenko S.E., Kubasov A.S. et al. // J. Solid State Chem. 2021. V. 302. P. 122413. https://doi.org/10.1016/j.jssc.2021.122413
Жижин К.Ю., Мустяца В.Н., Малинина Е.А. и др. // Журн. неорган. химии. 2004. Т. 49. № 2. С. 221.
Органикум. В 2-х т. Пер. с нем. Т. 1. М.: Мир, 1992.
Руководство по неорганическому синтезу. Пер. с нем. /Под ред. Брауэра Г. М.: Мир, 1985. Т. 2.
Bruker, SAINT, Bruker AXS Inc., Madison, WI, 2018.
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Crystallogr. 2015. V. 48. № 1. P. 3. https://doi.org/10.1107/S1600576714022985
Sheldrick G.M. // Acta Crystallogr. Sect. C Struct. Chem. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Pretsch E., Clerc T., Seibl J. et al. Tables of spectral data for structure determination of organic compounds. Springer Science & Business Media, 2013.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии