Журнал неорганической химии, 2023, T. 68, № 7, стр. 930-938
Спектральные исследования процесса координации 1-метил-2-(пиридин-4-ил)-3,4-фуллеро[60]пирролидина высокозамещенным порфирином кобальта(II)
Н. Г. Бичан a, *, В. А. Мозгова a, Е. Н. Овченкова a, М. С. Груздев a, Т. Н. Ломова a
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, Россия
* E-mail: bng@isc-ras.ru
Поступила в редакцию 19.01.2023
После доработки 20.03.2023
Принята к публикации 20.03.2023
- EDN: RIICFS
- DOI: 10.31857/S0044457X23600081
Аннотация
При взаимодействии (5,15-бис[3,5-бис(трет-бутил)фенил]-10,20-бис{4,6-бис[3,5-бис(3,6-ди-трет-бутилкарбазол-9-ил)фенокси]пиримидин-5-ил}порфина с Co(AcO)2 · 4H2O получен новый дендримерный комплекс кобальта(II) CoP. Процесс двухступенчатой двухсторонней координации 1-метил-2-(пиридин-4'-ил)-3,4-фуллеро[60]пирролидина (PyC60) кобальт(II)порфирином, полное кинетическое описание которого получено с помощью методов УФ-видимой и флуоресцентной спектроскопии, заканчивается образованием устойчивого комплекса 1 : 2, триады состава (PyC60)2CoP. Константа устойчивости (K) координационного комплекса равна (9.9 ± 2.4) × 108 л2 моль–2 (lgK = = 9.0). Химическое строение триады установлена методами УФ-, видимой, 1H ЯМР- и ИК-спектроскопии. Обнаружен и изучен эффект тушения флуоресценции PyC60 в составе триады и обоснован статический механизм процесса тушения. Результат может быть использован в оптоэлектронике при оптимизации структур донорно-акцепторных систем со свойством фотоиндуцированного переноса электрона.
ВВЕДЕНИЕ
Металлопорфирины, координированные с фуллерен-содержащими молекулярными лигандами, представляют собой идеальные химические структуры при разработке систем для передачи и обработки солнечной энергии [1–7]. В качестве перспективных светособирающих комплексов рассматривают дендримеры, содержащие порфирины [8–10]. В работе [11] исследовали карбазол- фенилазометиновый дендример четвертого поколения с порфириновым ядром и ветвлением, содержащим карбазольные заместители, в качестве “хозяина” для фуллеренов (С60, С70 и С84). Этот дендример имеет значительно более высокую константу ассоциации с фуллеренами по сравнению с дендримерами более низкого поколения, а инкапсуляции С60/С70/С84 достигали за счет взаимодействия дендрона и ядра. Актуальность введения заместителей на периферию макроциклов, содержащих карбазольные фрагменты, связана с повышением квантового выхода флуоресценции порфиринов, расширением области поглощения в электронных спектрах [8, 12], а также с относительной легкостью и разнообразием модификации молекулы карбазола [13–20].
При получении фотоактивных систем на основе порфиринов используется также подход дендримерного ветвления по аксиальной оси [21–23]. Модификация порфирина фосфора(V) была проведена по аксиальной оси с использованием карбазол-содержащих дендронов [21–23]. Получено три новых комплекса, у которых отсутствует флуоресценция из-за эффективного переноса электрона (photoinduced electron transfer, PET) в пределах сложной молекулы. По данным исследования эффективности преобразования падающего фотона в ток (IPCE), молекулярная структура дендримеров может значительно влиять на их фотоэлектрические свойства [21].
Этот же подход был использован при получении систем на основе фталоцианина кремния(IV) и аксиальных фуллеродендримеров различных генераций (nC60, n = 2, 4 или 8) [22]. Время жизни образующихся благодаря PET ион-радикальных пар увеличивается в ряду SiPc-8C60 > SiPc-4C60 > > SiPc-2C60, что может быть связано с миграцией электронов среди субъединиц С60. В работе [23] получено несколько периферически и аксиально замещенных морфолинилдендримерных фталоцианинов цинка(II) и кремния(IV). Интенсивность, квантовый выход и время жизни флуоресценции были выше для фталоцианина кремния(IV) с дендримерным ветвлением по аксиальной оси. В то же время квантовый выход синглетного кислорода был значительно ниже, чем у фталоцианина цинка(II) c дендримерным ветвлением на периферии. Это в основном связано с эффективным внутримолекулярным PET от донорного морфолинила к акцептору – фталоцианину. Отмечено, что этот ряд дендримерных фталоцианинов может быть хорошим кандидатом для фотодинамической терапии рака.
Авторы [11] использовали дендримеры, содержащие 4, 8 и 16 порфиринов цинка(II) в ветвлении, для создания мультифотосинтетических реакционных центров, способных посредством связи Zn–N присоединять PyC60. Успешный дизайн таких донорно-акцепторных ансамблей позволил получить супрамолекулярные комплексы с большим временем жизни (0.25 мс) при комнатной температуре.
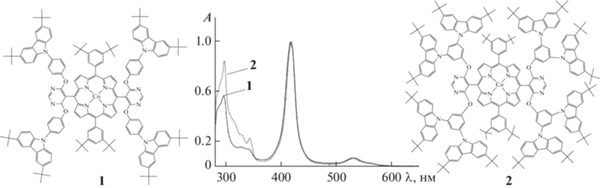
Ранее было показано, что порфирины кобальта(II) могут быть успешно использованы для синтеза донорно-акцепторных систем со свойством фотоиндуцированного переноса электрона [24–26]. В наших работах [24, 26–33] получены донорно-акцепторные (1 : 2) комплексы порфиринов кобальта(II) с фуллеро[60 ] пирролидинами. В работе [24] представлен {5,15-бис[3,5-бис(трет-бутил)фенил]-10,20-бис[4,6-(4-(3,6-ди-трет-бутил-9H-карбазол-9-ил)фенокси)пиримидин-5-ил]порфинато}кобальт(II) (рис. 1, формула 1) и его донорно-акцепторные комплексы с PyC60 и 2,5-ди(пиридин-2-ил)-3,4-фуллеро[70 ] пирролидином (Py2C70). Пирролидино[60 ] фуллерен, несмотря на наличие объемных заместителей, образует триаду с константой устойчивости K, равной (9.2 ± 2.9) × × 109 л2 моль–2 (lgK = 10.0), тогда как реакция с Py2C70 заканчивается образованием диады (K = (8.3 ± ± 1.6) × 104 л2 моль–2, lgK = 4.9) из-за стерических затруднений. Для определения влияния ветвления более высокого порядка на состав образующихся координационных комплексов с PyC60 в настоящей работе получен дендримерный порфириновый комплекс кобальта(II) второй генерации (рис. 1, формула 2). Исследованы его стехиометрия, химическое строение, кинетика и механизм образования, фотофизические свойства, а также место среди десяти известных аналогов в отношении устойчивости и вкладов в нее.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(5,15-бис[3,5-бис(трет-бутил)фенил]-10,20-бис{4,6-[3,5-бис-(3,6-ди-трет-бутилкарбазол-9-ил)фенокси]пиримидин-5-ил}порфин (H2P) был синтезирован по методике [24] с использованием в качестве исходных компонентов 3,5-бис-(3,6-ди-трет-бутилкарбазол-9-ил)фенола и 5,15-бис[3,5-бис(трет-бутил)фенил]-10,20-бис(4,6-дихлорпиримидин-5-ил)порфирина. Выход 60%. ЭСП в толуоле (λmax, нм (lgε)): 298 (5.15), 344 (2.63), 423 (5.43), 512 (4.12), 550 (3.85), 593 (3.71), 649 (3.60). ИК-спектр в KBr (ν, см–1): 421, 470, 575, 614, 648, 661, 687, 716, 741, 764, 783, 798, 810, 839, 878, 901, 916, 971 δ(N–H); 1035, 1060, 1081, 1106, 1128, 1160, 1233, 1262, 1294, 1321, 1364, 1393, 1417, 1479, 1547, 1605, 2866, 2905, 2928, 2961, 3048, 3317 ν(N–H). MS (MALDI-TOF), m/z: найдено 3432.07 [M]+, для C240H260N16O4 рассчитано 3432.83.
(5,15-бис[3,5-бис(трет-бутил)фенил]-10,20-бис{4,6-бис[3,5-бис(3,6-ди-трет-бутилкарбазол-9-ил)фенокси]пиримидин-5-ил}порфинато)кобальт(II) (CoP) был получен взаимодействием H2P (40 мг, 0.012 ммоль) с Co(AcO)2 · 4H2O (15 мг, 0.06 ммоль) в кипящем диметилформамиде (ДМФА) в течение 20 мин. Завершение реакции контролировали по прекращению изменений в электронном спектре поглощения (ЭСП) пробы реакционной смеси в CHCl3. Реакционную смесь охлаждали и экстрагировали продукты в хлороформ после разбавления водой. Раствор в CHCl3 многократно промывали дистиллированной водой для удаления ДМФА. Продукты реакции хроматографировали на колонке с Al2O3 (II степень активности по Брокману) с использованием хлороформа. Выход CoP составил 80%. ЭСП в толуоле (λmax, нм (lgε)): 298 (5.19), 324 (4.69), 344 (4.62), 420 (5.26), 533 (4.09). ИК-спектр в KBr (ν, см–1): 422, 458 ν(Co–N); 470, 576, 613, 652, 662, 687, 713, 731, 741, 763, 797, 810, 841, 851, 878, 901, 930, 1002, 1035, 1061, 1106, 1128, 1160, 1232, 1262, 1294, 1321 1364, 1393, 1417, 1479, 1549, 1605, 1693, 2866, 2905, 2927, 2960, 3047. Спектр 1Н ЯМР в CDCl3 (δ, м. д.): 16.57 (4H, уш. с, Hβ), 15.20 (4H, уш. с, Hβ), 12.51 (4H, уш. с, Ar–H), 11.15 (2H, с, Ar–H), 9.49 (2H, с, Ar–H), 8.08 (8H, м, Ar–H), 7.83 (24H, м, Carb–H), 6.64 (24H, м, Carb–H), 7.11 (4H, м, Ar–H), 2.40 (36H, с, –CH3), 1.52–1.16 (144 H, м, –CH3). MS (MALDI-TOF) m/z: найдено 3491.66 [M+2H]+, для C240H258N16O4Co рассчитано 3489.75.
1-Метил-2-(пиридин-4'-ил)-3,4-фуллеро[60 ] пирролидин (PyС60) был синтезирован и выделен по методике [33]. Толуол марки “ЭКОС” осушали гидроксидом калия и перед использованием перегоняли (tкип = 110.6°С). Содержание воды определяли титрованием по Фишеру, оно не превышало 0.01%.
Кинетику двухсторонней реакции CoP с PyС60 в толуоле изучали спектрофотометрически при 298 K в диапазоне концентраций PyС60 1.9 × 10–5–9.4 × 10–5 моль/л методом избыточных концентраций. Растворы CoP и PyС60 в свежеперегнанном толуоле готовили непосредственно перед использованием во избежание образования перекисей в среде растворителя. Измерения оптической плотности для серии растворов с постоянной концентрацией CoP (3.2 × 10−6 моль/л) и переменной концентрацией замещенного фуллерена проводили на рабочей длине волны 420 нм сразу после смешивания реагентов и во времени. ЭСП реагирующей системы регистрировали с использованием в качестве нулевой линии спектра PyС60 той же концентрации, что и в рабочем растворе. Растворы термостатировали при (298 ± 0.1) K в закрытых кварцевых кюветах в специальной ячейке спектрофотометра. Константы скорости реакции формально первого порядка рассчитывали по уравнению:
Равновесие реакции CoP с PyС60 в толуоле исследовали при 298 K в диапазоне концентраций PyС60 6.2 × 10–7–9.4 × 10–5 моль/л с использованием времязависимого спектрофотометрического титрования методом молярных отношений. Константы равновесия (K) определяли по уравнению для трехкомпонентной системы с двумя окрашенными соединениями:
Стационарная флуоресценция и флуоресценция с временным разрешением использованы для изучения фотофизических свойств комплексов. Для РуС60 и донорно-акцепторных комплексов с CoP спектры флуоресценции измеряли в толуоле в кварцевых кюветах (10 × 10 мм). Готовили серию растворов в толуоле с постоянной концентрацией РуС60 (6.1 × 10–5 моль/л) и различными концентрациями CoP ((0–3.7) × 10–5 моль/л). Интенсивность флуоресценции PyC60 контролировали на длине волны 709 нм. Константу Штерна–Фольмера (Ksv) определяли для оценки эффективности тушения флуоресценции РуС60 в составе комплекса с CoP по уравнению:
где I0 и I – интенсивность флуоресценции РуС60 в отсутствие и при добавлении порфирина кобальта(II) соответственно; СCoP – концентрация CoP.
Константы связывания (KBH) были рассчитаны с использованием модифицированного уравнения Бенези–Хильдебранда:
Кривые затухания флуоресценции и значения времени жизни флуоресценции РуС60 определены путем реконволюции кривых затухания с использованием пакета программ EasyTau 2 (PicoQuant, Германия). Для PyC60 и систем PyC60–CoP в толуоле применена биэкспоненциальная модель затухания флуоресценции. Функцию отклика прибора (IRF) системы измеряли по сигналу рассеянного света разбавленной суспензии коллоидного кремнезема (LUDOX®). Время жизни флуоресценции (τF) было получено методом свертки отклика прибора.
ЭСП-, ИК-, 1H ЯМР- и масс-спектры регистрировали соответственно на спектрофотометре Agilent 8453, спектрометрах VERTEX 80v, Bruker Avance III-500 и масс-спектрометре Shimadzu Confidence. Измерения стационарной флуоресценции и флуоресценции с временным разрешением проводили на спектрофлуориметре FluoTime 300 PicoQuant с лазером LDH-P-C-450 в качестве источника возбуждения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Наличие в структуре карбазол-содержащих порфириновых комплексов, включая CoP и дендример первой генерации [24], карбазольных фрагментов проявляется в специфике их ЭСП (рис. 1). Как и в спектрах (5,10,15,20-тетрафенилпорфинато)кобальта(II) (CoTPP), полоса Соре (1a1g → 2eu) и Q-полоса (1a1g → 1eu) наблюдаются в спектрах при 420 и 530 нм соответственно. Дополнительно в спектрах появляются полосы в области 200–400 нм, отвечающие за поглощение карбазольных фрагментов. В случае комплекса кобальта(II) с дендримером второй генерации (CoP) поглощение в этой области, как и следовало ожидать [8], гораздо интенсивнее.
С целью получения новой донорно-акцепторной системы, способной к фотоиндуцированному переносу электрона, и установления влияния степени ветвления периферийных заместителей на свойства упомянутой системы была изучена реакция координации между новым дендримерным порфириновым комплексом CoP и молекулярным лигандом PyС60, способными выступать соответственно как донор и акцептор электрона в составе образующегося координационного комплекса при его фотовозбуждении. По изменению ЭСП CoP при изменяющейся концентрации PyC60 и в ходе реакции в реакционных смесях всех взятых составов (см. Экспериментальную часть) идентифицированы два равновесия в ходе реакции, первое из которых устанавливается сразу после сливания растворов реагентов, а второе – во времени с измеримой скоростью. Первое равновесие (τ = 0) характеризуется постепенным уменьшением интенсивности поглощения в полосе Соре при всех составах реакционных смесей CoP–PyC60, второе (τ = ∞) – смещением полосы Соре от 420 до 438 нм. На рис. 2а представлена спектральная картина для реакции во времени в реакционной смеси одного конкретного состава, характерная и для всех других взятых составов. Несмотря на введение объемных заместителей на периферию макроцикла, динамика спектров повторяет картину при взаимодействии с PyC60 производных CoTPP [26, 33], в том числе {5,15-бис[3,5-бис(трет-бутил)фенил]-10,20-бис[4,6-(4-(3,6-ди-трет-бутил-9H-карбазол-9-ил)фенокси)-пиримидин-5-ил]порфинато}кобальта(II) (рис. 1, формула 1) [24].
Рис. 2.
Изменение ЭСП CoP в толуоле при 298 K с добавкой PyС60 9.36 × 10–5 моль/л в течение 20 мин (а) и зависимость lg k2 эф [с–1]–\lg {{C}_{{{\text{Py}}{{{\text{C}}}_{{60}}}}}}[моль/л] (tgα = 0.72, R2 = 0.97) (б).
Количественно описать оба равновесия и скорость второй стадии реакции удается благодаря зарекомендовавшему себя подходу, основанному на спектрофотометрическом времязависимом титровании (обработка данных по спектрофотометрическому титрованию при τ = 0 и ∞ после прохождения медленной реакции в смесях всех составах) [34].
Состав образующихся координационных комплексов (донорно-акцепторных систем) CoP с PyC60, участвующих в быстром и медленном равновесиях, определяли из линейных зависимостей lgI–\lg {{C}_{{{\text{Py}}{{{\text{C}}}_{{60}}}}}}. Тангенс угла наклона (tgα) прямых равен соответственно 0.9 и 1.02 (рис. 3), что означает участие по одной молекуле PyС60 и образование комплексов состава 1 : 1 в обоих равновесиях. Численные значения констант устойчивости равны: K1 = (6.8 ± 1.5) × 104 (lgK1 = 4.8) и K2 = (1.5 ± ± 0.2) × 104 (lgK2 = 4.2) л/моль. Константа устойчивости (PyС60)2CoP K (K1 × K2) = (9.9 ± 2.4) × × 108 л2/моль2 (lgK = 9.0).
Рис. 3.
Зависимости lg I от \lg {{C}_{{{\text{Py}}{{{\text{C}}}_{{60}}}}}} для реакции CoP с PyС60 при 298 K при τ = 0 (tg α = 0.89, R2 = 0.99) (1) и τ = ∞ (tg α = 1.02, R2 = 0.98) (2).
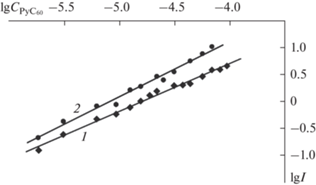
При изучении кинетики медленной реакции, идущей после установления быстрого равновесия до второго равновесия, определен первый порядок по (PyС60)CoP, а значит и по CoP (квазиравновесие). Эффективные константы скорости (k2 эф) представлены в табл. 1.
Таблица 1.
Эффективные константы скорости (k2 эф) реакции (PyС60)CoP с PyС60 в толуоле при 298 K
| {{C}_{{{\text{Py}}{{{\text{C}}}_{{60}}}}}} × 105, моль/л | (k2 эф ± δk2 эф) × 103, с–1 |
|---|---|
| 1.9 | 2.8 ± 0.2 |
| 2.5 | 3.4 ± 0.2 |
| 3.1 | 4.3 ± 0.2 |
| 4.4 | 6.0 ± 0.4 |
| 5.6 | 6.6 ± 0.5 |
| 6.9 | 7.2 ± 0.4 |
| 8.1 | 7.6 ± 0.3 |
| 9.4 | 9.6 ± 0.3 |
Линейные зависимости lg k2 эф [с–1]–f(\lg {{C}_{{{\text{Py}}{{{\text{C}}}_{{60}}}}}} [моль/л]) с тангенсом угла наклона, близким к 1 (tg α = 0.72) (рис. 2б), свидетельствуют о первом порядке реакции по PyС60. Численное значение константы скорости k2 = 7.7 ± 0.5 моль–1 л с–1. Константа скорости k–2 (k2/K2) = 5.3 × 10–4 с–1 (7.7 моль–1 л с–1/1.5 × 104 л моль–1). Значения скоростей прямой и обратной реакций медленного равновесия подтверждают возможность пренебрежения обратной реакцией при изучении кинетики медленного двухстороннего процесса в реакции CoP с PyС60. По представленным данным, образование гексакоординационного порфиринового (1 : 2) комплекса кобальта(II), структура которого подтверждена физико-химическими методами (см. далее), проходит через промежуточный пентакоординационный (1 : 1) комплекс:
(1)
{\text{CoP}} + {\text{Py}}{{{\text{С}}}_{{60}}}\overset {{{K}_{1}}} \leftrightarrows {\text{(Py}}{{{\text{С}}}_{{60}}}){\text{CoP}},{\text{ мгновенно}},(2)
\begin{gathered} ({\text{Py}}{{{\text{С}}}_{{60}}}){\text{CoP}} + \\ + \,\,{\text{Py}}{{{\text{С}}}_{{60}}}\underset{{{{k}_{{2 - }}}}}{\overset{{{{K}_{2}},{{k}_{2}}}}{\longleftrightarrow}}\,\,{{({\text{Py}}{{{\text{С}}}_{{60}}})}_{2}}{\text{CoP}},{\text{ во времени}}.~~~~~~ \\ \end{gathered}Проведенные исследования показали, что комплексы кобальта(II) с замещенными по мезо- и β-положениям порфиринами координируют две молекулы PyC60 по однотипному механизму, описанному выше. Информация о стабильности донорно-акцепторных диад и триад на основе порфириновых комплексов кобальта(II) и PyC60 представлена в табл. 2. Значения констант устойчивости K изученных донорно-акцепторных систем находятся в диапазоне 108–1010 л2/моль2. Введение различных заместителей на периферию макроцикла порфириновых комплексов кобальта(II) влияет как на величину общей константы устойчивости, так и на вклады величин K1 и K2 в ее значение. Несмотря на достаточно высокое значение общей константы устойчивости для новой триады (PyС60)2CoP, видно, что K2 для данного комплекса имеет самое низкое значение, которое в 80 раз меньше, чем для донорно-акцепторного комплекса на основе PyC60 и CoTBPP, имеющего донорные заместители в пара-положениях фенильных колец порфиринового макроцикла, и в 10 раз меньше, чем для триады, образованной карбазол-содержащим порфирином кобальта(II) первой генерации. Таким образом, введение объемных заместителей уменьшает значение K2 триады, но увеличивает сродство к PyC60 при образовании диады (табл. 2).
Таблица 2.
Константы устойчивости донорно-акцепторных систем порфириновых комплексов кобальта(II) с PyC60
| Комплекс | K1, л/моль | K2, л/моль | K = K1 × K2, л2/моль2 |
|---|---|---|---|
| (PyC60)2CoTPP | (5.4 ± 1.2) × 104 | (8.7 ± 1.4) × 104 | (4.7 ± 1.2) × 109 |
| (PyC60)2CoTIPP1 | (1.6 ± 0.4) × 104 | (2.0 ± 0.4) × 105 | (3.2 ± 0.9) × 109 |
| (PyC60)2CoDTBCP2 | (6.1 ± 1.73) × 104 | (1.5 ± 0.4) × 105 | (9.2 ± 2.9) × 109 |
| (PyC60)2CoP | (6.8 ± 1.5) × 104 | (1.5 ± 0.2) × 104 | (9.9 ± 2.4) × 108 |
| (PyC60)2CoP(2-Py)3 | (1.8 ± 0.3) × 104 | (5.8 ± 0.6) × 105 | (1.0 ± 0.1) × 1010 |
| (PyC60)2CoTBPP4 | (1.0 ± 0.1) × 104 | (1.2 ± 0.3) × 106 | (1.3 ± 0.1) × 1010 |
| (PyC60)2CoTTP5 | (2.3 ± 0.2) × 104 | (6.4 ± 0.3) × 105 | (1.5 ± 0.9) × 1010 |
| (PyC60)2CoOEP6 | (4.3 ± 1.0) × 104 | (9.6 ± 2.2) × 105 | (4.1 ± 1.1) × 1010 |
| (PyC60)2CoT(CF3P)P7 | (5.9 ± 1.5) × 104 | (7.4 ± 1.7) × 105 | (4.4 ± 1.3) × 1010 |
| (PyC60)2CoTPP(OC8H17)8 | (1.1 ± 0.3) × 105 | (4.0 ± 0.9) × 105 | (4.5 ± 1.0) × 1010 |
2 Формула 1 на рис. 1.
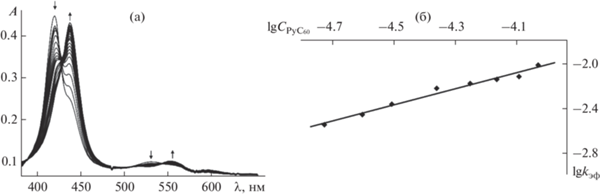
Константа устойчивости новой донорно-акцепторной триады (PyС60)2CoP была определена также методом флуоресцентного титрования. Поскольку порфирины кобальта(II) не флуоресцируют, т. к. ион Со имеет частично заполненную открытую d-оболочку и сопряженная π-система изменяется за счет перекрывания dπ-орбиталей металла и π*-орбиталей порфирина [35], была изучена флуоресценция PyC60 при различных добавках CoP. Известно, что фуллерены С60, С70 [36] и их производные [37, 38] обладают способностью флуоресцировать с низким квантовым выходом. Для растворов С60 и С70 в толуоле это значение составляет 2.6 × 10–4 и 5.7 × 10–4 соответственно. Квантовый выход для PyC60 равен 5.3 × 10–4 [33]. При взаимодействии PyC60 с CoP происходит тушение его флуоресценции (рис. 4а).
Рис. 4.
Тушение флуоресценции PyC60 при его взаимодействии с CoP (а). Кинетика затухания флуоресценции PyC60 в толуоле с добавкой CoP (СCoP = 4.62 × 106 моль/л) (б).
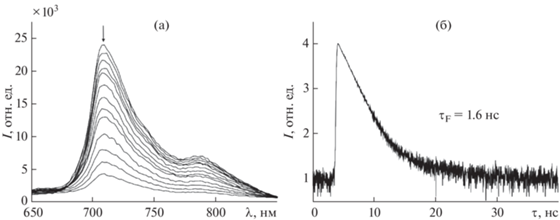
Анализ линейной части зависимости относительной интенсивности флуоресценции от концентрации тушителя позволяет определить константу Штерна–Фольмера Ksv. Значение константы Ksv 5.8 × 104 л/моль. Оценка стабильности полученной системы была проведена с помощью анализа уравнения Бенези–Хильдебранда. Константа KBH = 3.8 × 109 л2/моль2. Это значение хорошо согласуется с данными, полученными из спектрофотометрического титрования. Для определения возможного механизма тушения флуоресценции при связывании PyC60 с CoP были получены значения времени жизни флуоресценции PyC60 для растворов PyC60–CoP в толуоле при различных добавках CoP (рис. 4б). Установлено, что время жизни флуоресценции PyC60 остается неизменным в смесях PyC60–CoP и соответствует значению 1.6 нс. Некоординированный PyC60 демонстрирует биэкспоненциальное затухание с временем жизни флуоресценции (τ0) ⁓ 1.6 нс [33]. Такое поведение связано со статическим механизмом тушения флуоресценции PyC60 при координации его с CoP.
Значения Ksv и времени жизни флуоресценции PyC60 позволяют вычислить бимолекулярную константу скорости тушения kq = Ksv/τ0 = 3.6 × × 1013 л/моль с. Большое значение константы указывает на эффективное тушение PyC60 порфирином кобальта(II).
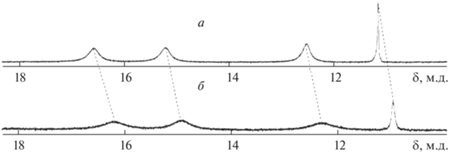
Образование новой донорно-акцепторной триады было дополнительно подтверждено данными 1H ЯМР- и ИК-спектроскопии. 1H ЯМР-исследования (рис. 5) выявили связывание пиридиновой группы PyC60 с ионом металла CoP. При координации PyC60 сигналы протонов пиррольных фрагментов (Hβ) порфиринового макроцикла при 16.57 и 15.20 м.д., проявляющиеся в виде двух уширенных синглетов, претерпевают смещение в сильное поле на 0.39 и 0.26 м.д. соответственно. Такое смещение объясняется уменьшением дезэкранирующего эффекта кольцевого тока в порфириновом макроцикле вследствие образования донорно-акцепторных связей Co–{{{\text{N}}}_{{{\text{Py}}{{{\text{C}}}_{{60}}}}}}. Действительно, результаты DFT расчета (B3LYP + D3BJ/6-31G) для родственных структур демонстрируют существенную дестабилизацию ВЗМО при образовании триады [39]. В случае дендримерного порфирина кобальта(II) первой генерации (рис. 1, формула 1) образование триады с PyC60 сопровождается также сильнопольным сдвигом Hβ-сигналов и их проявлением в виде уширенного мультиплета [24]. В случае CoTPP и (PyС60)2CoТРP сигналы β-протонов проявляются в виде одного уширенного синглета при 15.94 и 13.50 м.д. соответственно [28]. Таким образом, периферийные заместители порфиринового макроцикла оказывают влияние не только на положение сигнала, но и на величину его сдвига при образовании порфирин-фуллереновых триад.
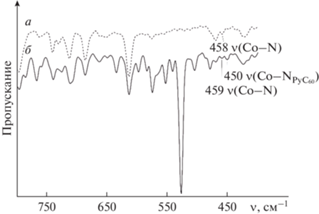
Анализ ИК-спектра (PyС60)2CoP по сравнению со спектрами отдельных ее компонентов подтверждает, что в образовании триады участвует пиридильная группа фуллеро[60 ] пирролидина. Проявление новой связи в виде сигнала при 450 см–1 свидетельствует об образовании именно связи Co–{{{\text{N}}}_{{{\text{Py}}{{{\text{C}}}_{{60}}}}}} (рис. 6) [40]. ИК-спектр триады состоит из сигналов колебаний порфиринового макроцикла, находящихся в высокочастотной области 1600–800 см–1, и колебаний фуллеро[60 ] пирролидина, лежащих в низкочастотной области 800–400 см–1. Полосы фуллеренового каркаса С60 проявляются при 574 и 527 см–1 [41] и не меняют своего положения при образовании триады, тогда как колебательные частоты пиридинового и пирролидинового колец фуллерена смещаются примерно на 1–12 см–1 по сравнению с частотами колебаний связей исходного PyС60. Отсутствие смещения скелетных колебаний пиррольных колец CoP в спектре триады указывает на то, что Co остается в плоскости макроцикла при координации двух молекул PyC60, это подтверждается теоретическими расчетами, сделанными на примере изоструктурного дендримерного комплекса первой генерации [24].
ЗАКЛЮЧЕНИЕ
Получен и исследован физико-химическими методами новый дендримерный порфириновый комплекс кобальта(II), содержащий 3,5-бис(трет-бутил)фенил- и 3,5-бис-(3,6-ди-трет-бутилкарбазол-9-ил)феноксигруппы (СоР). Реакция образования донорно-акцепторной системы (триады) на его основе с PyС60 изучена методами УФ-видимой и флуоресцентной спектроскопии. Константы устойчивости, полученные этими методами ((9.9 ± 2.4) × 108 и 3.8 × 109 л2 моль–2 соответственно), близки. Представлена корреляция констант устойчивости донорно-акцепторных систем на основе порфиринов кобальта с их химическим строением. Методом времяразрешенной флуоресцентной спектроскопии определены минимальные изменения времени жизни флуоресценции PyC60 с возрастающими добавками CoP и его среднее значение, равное 1.6 нс. Структура новой супрамолекулярной триады (PyC60)2CoP дополнительно подтверждена методами ИК- и 1H ЯМР-спектроскопии.
Список литературы
Sutton L.R., Scheloske M., Pirner K.S. et al. // J. Am. Chem. Soc. 2004. V. 126. № 33. P. 10370. https://doi.org/10.1021/ja048983d
D'Souza F., Ito O. // Coord. Chem. Rev. 2005. V. 249. № 13. P. 1410. https://doi.org/10.1016/j.ccr.2005.01.002
Миронов А.Ф. // Макрогетероциклы. 2011. Т. 4. № 3. С. 186.
Nikolaou V., Charisiadis A., Stangel C. et al. // J. Carbon Res. 2019. V. 5. № 3. P. 57. https://doi.org/10.3390/c5030057
Лебедева В.С., Миронова Н.А., Рузиев Р.Д. и др. // Макрогетероциклы. 2018. Т. 11. № 4. С. 339. https://doi.org/10.6060/mhc180690l
Моторина Е.В., Климова И.А., Бичан Н.Г. и др. // Журн. неорган. химии. 2022. Т. 67. № 12. С. 1779. https://doi.org/10.31857/S0044457X22600712
Цивадзе А.Ю., Чернядьев А.Ю. // Журн. неорган. химии. 2020. Т. 65. № 11. С. 1469. https://doi.org/10.31857/S0044457X20110197
Loiseau F., Campagna S., Hameurlaine A. et al. // J. Am. Chem. Soc. 2005. V. 127. № 32. P. 11352. https://doi.org/10.1021/ja0514444
Organista-Mateos U., Martínez-Klimov M.E., Pedro-Hernández L.D. et al. // J. Photochem. Photobiol. A: Chemistry. 2017. V. 343. P. 58. https://doi.org/10.1016/j.jphotochem.2017.04.020
Maes W., Dehaen W. // Eur. J. Org. Chem. 2009. V. 2009. № 28. P. 4719. https://doi.org/10.1002/ejoc.200900512
Albrecht K., Kasai Y., Kuramoto Y. et al. // Chem. Commun. 2013. V. 49. № 9. P. 865. https://doi.org/10.1039/c2cc36451d
Bichan N.G., Ovchenkova E.N., Ksenofontov A.A. et al. // Dyes Pigm. 2022. V. 204. P. 110470. https://doi.org/10.1016/j.dyepig.2022.110470
Gruzdev M.S., Chervonova U.V., Ksenofontov A.A. et al. // Opt. Mater. 2021. V. 122. P. 111661. https://doi.org/10.1016/j.optmat.2021.111661
Сюткин Р.В., Абашев Г.Г., Шкляева Е.В. и др. // Журн. орг. химии. 2011. Т. 47. № 4. С. 532.
Груздев М.С., Червонова У.В., Венедиктов Е.А. и др. // Журн. общ. химии. 2015. Т. 85. № 6. С. 964.
Staderini M., Vanni S., Baldeschi A.C. et al. // Eur. J. Med. Chem. 2023. V. 245. P. 114923. https://doi.org/10.1016/j.ejmech.2022.114923
Banerjee A., Kundu S., Bhattacharyya A. et al. // Org. Chem. Frontiers. 2021. V. 8. № 11. P. 2710. https://doi.org/10.1039/d1qo00092f
Çelik F., Aydın A., Bektaş K.İ. et al. // Russ. J. Gen. Chem. 2022. V. 92. № 10. P. 2145. https://doi.org/10.1134/s1070363222100279
Скрылькова А.С., Егоров Д.М., Тарабанов Р.В. // Журн. общ. химии. 2021. Т. 91. № 91. С. 1627. https://doi.org/10.31857/S0044460X21100206
Devi E.R., Sreenivasulu R., Rao M.V.B. et al. // Russ. J. Gen. Chem. 2021. V. 91. № 6. P. 1105. https://doi.org/10.1134/s1070363221060189
Xu T., Lu R., Liu X. et al. // Org. Lett. 2007. V. 9. № 5. P. 797. https://doi.org/10.1021/ol062979k
El-Khouly M.E., Kang E.S., Kay K.-Y. et al. // Chem. Eur. J. 2007. V. 13. № 10. P. 2854. https://doi.org/10.1002/chem.200601254
Guo Q., Chen L., Pan S. et al. // Dalton Trans. 2018. V. 47. № 37. P. 13164. https://doi.org/10.1039/c8dt02275e
Ovchenkova E.N., Bichan N.G., Gruzdev M.S. et al. // New J. Chem. 2021. V. 45. № 20. P. 9053. https://doi.org/10.1039/d1nj00980j
Subedi D.R., Jang Y., Ganesan A. et al. // J. Porphyrins Phthalocyanines. 2021. V. 25. № 05–06. P. 533. https://doi.org/10.1142/s1088424621500449
Ovchenkova E.N., Motorina E.V., Bichan N.G. et al. // J. Organomet. Chem. 2022. V. 977. P. 122458. https://doi.org/10.1016/j.jorganchem.2022.122458
Бичан Н.Г., Овченкова Е.Н., Груздев М.С. и др. // Журн. структур. химии. 2018. Т. 59. № 3. С. 734. https://doi.org/10.26902/JSC20180332
Бичан Н.Г., Овченкова Е.Н., Мозгова В.А. и др. // Журн. неорган. химии. 2019. Т. 64. № 5. С. 490. https://doi.org/10.1134/S0044457X19050027
Бичан Н.Г., Овченкова Е.Н., Мозгова В.А. и др. // Журн. физ. химии. 2020. Т. 94. № 6. С. 873.
Bichan N.G., Ovchenkova E.N., Kudryakova N.O. et al. // J. Coord. Chem. 2017. V. 70. № 14. P. 2371. https://doi.org/10.1080/00958972.2017.1335867
Bichan N.G., Ovchenkova E.N., Ksenofontov A.A. et al. // J. Mol. Liq. 2021. V. 326. P. 115306. https://doi.org/10.1016/j.molliq.2021.115306
Bichan N.G., Ovchenkova E.N., Mozgova V.A. et al. // Polyhedron. 2021. V. 203. P. 115223. https://doi.org/10.1016/j.poly.2021.115223
Bichan N.G., Ovchenkova E.N., Mozgova V.A. et al. // Molecules. 2022. V. 27. P. 8900. https://doi.org/10.3390/molecules27248900
Lomova T.N., Motorina E.V., Klyuev M.V. // Macroheterocycles. 2013. V. 6. № 4. P. 327. https://doi.org/10.6060/mhc130644l
Liu Y., Bian Y., Zhang Y. et al. // J. Phys. Chem. Lett. 2021. V. 12. № 22. P. 5349. https://doi.org/10.1021/acs.jpclett.1c01123
Ma B., Sun Y.-P. // J. Chem. Soc., Perkin Trans. 2. 1996. № 10. P. 2157. https://doi.org/10.1039/p29960002157
Brites M.J., Santos C., Nascimento S. et al. // New J. Chem. 2006. V. 30. № 7. P. 1036. https://doi.org/10.1039/b601649a
Luo C., Fujitsuka M., Watanabe A. et al. // J. Chem. Soc., Faraday Trans. 1998. V. 94. № 4. P. 527. https://doi.org/10.1039/a706672d
Ovchenkova E.N., Bichan N.G., Tsaturyan A.A. et al. // J. Phys. Chem. C. 2020. V. 124. P. 4010. https://doi.org/10.1021/acs.jpcc.9b11661
Thornton D.A., Verhoeven P.F.M. // Spectrosc. Lett. 1995. V. 28. № 4. P. 587. https://doi.org/10.1080/00387019508009902
Martin M.C., Du X., Kwon J. et al. // Phys. Rev. B. 1994. V. 50. № 1. P. 173. https://doi.org/10.1103/PhysRevB.50.173
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии