Журнал неорганической химии, 2023, T. 68, № 8, стр. 1126-1134
Анти- и прооксидантные свойства наночастиц диоксида церия, функционализированных галловой кислотой
М. М. Созарукова a, *, Е. В. Проскурнина b, И. В. Михеев c, Л. А. Полевой a, А. Е. Баранчиков a, В. К. Иванов a, c
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Медико-генетический научный центр им. академика Н.П. Бочкова
115522 Москва, ул. Москворечье, 1, Россия
c Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: S_MadinaM@bk.ru
Поступила в редакцию 18.04.2023
После доработки 10.05.2023
Принята к публикации 11.05.2023
- EDN: MZAJQY
- DOI: 10.31857/S0044457X23600834
Аннотация
Впервые получены золи СеО2, функционализированные галловой кислотой (ГК) в различных мольных соотношениях (CeO2@ГК 1 : 1, 1 : 2, 2 : 1). Проанализирована антиоксидантная активность полученных наноматериалов по отношению к алкилпероксильным радикалам методом люминол-активированной хемилюминесценции. Показано, что композиты CeO2@ГК обладают разнонаправленной редокс-активностью, обусловленной сочетанием антиоксидантных и прооксидантных свойств. Установлено, что редокс-активность композитов CeO2@ГК в большей степени обусловлена лигандом – галловой кислотой. При этом иммобилизация галловой кислоты на поверхности наночастиц диоксида церия приводит к снижению ее антиоксидантной и прооксидантной активности. Данный эффект наиболее выражен в случае золя CeO2@ГК состава 2 : 1, снижение антиоксидантной и прооксидантной емкости галловой кислоты составляет 40 ± 3 и 58 ± 9% соответственно.
ВВЕДЕНИЕ
Развитие нанотехнологий способствует созданию наноматериалов, перспективных для биомедицинского применения [1]. Основные требования, предъявляемые к таким наноматериалам в отношении их использования в составе фармпрепаратов, связаны с биосовместимостью, отсутствием токсичности, эффективностью терапевтического воздействия. Одним из основных инструментов модификации физико-химических свойств и биохимической активности наноматериалов является функционализация их поверхности различными лигандами [2, 3]. Относительно новым направлением в этой области является создание гибридных антиоксидантов, инактивирующих разные типы свободных радикалов, путем иммобилизации соединений с антиоксидантной активностью на поверхности наночастиц [4–6].
Одними из наиболее известных природных антиоксидантов являются фенольные соединения [7–9]. Ярким представителем этой группы веществ является галловая кислота (3,4,5-тригидроксибензойная кислота, ГК) – продукт гидролиза танинов [10]. Галловая кислота обращает на себя внимание благодаря широкому спектру биологических применений, обусловленных ее антиоксидантными, противомикробными, противовоспалительными, противоопухолевыми, антимутагенными и другими свойствами [11, 12]. Успешное применение галловой кислоты для функционализации поверхности наноматериалов было продемонстрировано на примере различных неорганических наночастиц; усиление биологической активности наночастиц, в том числе антиоксидантных свойств наночастиц после иммобилизации на их поверхности галловой кислоты, наблюдали для Fe3O4 [13], γ-AlOOH [14], SiO2 [15], Ag-Se [16], Au [17–19] и др.
Среди перспективных нанобиоматериалов особое место занимает нанодисперсный СеО2 [20–24]. Возросший научный и практический интерес к диоксиду церия связан с обнаруженной у него способностью имитировать функции различных ферментов (энзимоподобная активность) [25–31]. Сочетание энзимоподобной активности с относительно низкой токсичностью делает наночастицы СеО2 перспективными компонентами фармацевтических препаратов нового поколения, в том числе для комбинированной антиоксидантной терапии заболеваний, обусловленных нарушениями редокс-метаболизма [32–36].
Сочетание наночастиц СеО2 с галловой кислотой описано в единственном исследовании in vivo, в котором продемонстрирован защитный эффект галловой кислоты и наночастиц СеО2 от нефротоксического действия цисплатина [37]. Полученные в этой работе результаты позволяют сделать вывод о потенциальном синергетическом действии галловой кислоты и нанодисперсного диоксида церия и рассматривать их в качестве перспективных нефропротекторов при химиотерапии [37]. Вместе с тем механизм обнаруженных терапевтических эффектов неясен, что требует проведения дальнейших исследований.
В настоящей работе впервые получены золи диоксида церия, стабилизированные галловой кислотой в различных мольных соотношениях (1 : 1, 1 : 2, 2 : 1). Хемилюминесцентным методом выполнен анализ антиоксидантной активности полученных материалов в отношении биохимически важных алкилпероксильных радикалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электростатически стабилизированный золь СеО2 получали методом термогидролиза [38]. В качестве прекурсора использовали гексанитратоцерат(IV) аммония (#215473, Sigma). Водный раствор (NH4)2Ce(NO3)6 (100 г/л) нагревали при 95°C в течение 24 ч. Осадок трехкратно промывали изопропанолом и редиспергировали в деионизованной воде. Оставшийся изопропанол удаляли кипячением коллоидного раствора диоксида церия в течение 1 ч при постоянном перемешивании. Концентрация полученного золя СеО2, определенная термогравиметрическим методом, составила 22.3 г/л (0.13 М).
Предварительно был приготовлен водный раствор лиганда – галловой кислоты (30 ммоль/л, ГК, #G7384, Sigma). Поверхность наночастиц СеО2 функционализировали постепенным добавлением электростатически стабилизированного золя СеО2 к раствору лиганда с последующим перемешиванием в течение 30 мин. Мольное соотношение СеО2 : лиганд составляло 1 : 1, 1 : 2 и 2 : 1.
Рентгенофазовый анализ высушенных образцов золей СеО2 проводили на дифрактометре Bruker D8 Advance (Германия), CuKα-излучение, геометрия θ–2θ.
Для регистрации электронных спектров поглощения золей СеО2 использовали спектрофотометр СФ-2000. Регистрацию спектров проводили в диапазоне длин волн от 200 до 700 нм.
Исследование коллоидных растворов СеО2 методом динамического рассеяния света и анализ их электрокинетических свойств проводили при 20°C с использованием анализатора Photocor Complex (мощность излучения 25 мВт, диодный лазер, λ = 650 нм).
Анализ образцов методом инфракрасной (ИК) спектроскопии проводили на ИК-Фурье-спектрометре Bruker Vertex 70, оснащенном модулем однократного нарушенного полного внутреннего отражения (НПВО, алмазный кристалл). Диапазон волновых чисел 4000–100 см–1, разрешение 1 см–1, число сканирований 64, число сканирований фона 64, температура кристалла 50°С. Обработка результатов измерений включала выравнивание базовой линии всего спектра в диапазоне от 4000 до 100 см–1, сглаживание спектра по 25 точкам, сглаживание (генерация прямолинейной области спектра) области поглощения CO2 от 2200 до 2400 см–1. Образцы для исследования представляли собой нестабилизированный золь СеО2, композит CeO2@ГК (1 : 1) и исходный образец лиганда (галловая кислота). Для исследования жидких образцов на термостатируемый алмазный кристалл при 50°С наносили от 6 до 9 мкл пробы, в течение 3–5 мин дожидались полного высыхания образца, затем проводили регистрацию спектров; для исследования твердых образцов порошок наносили на кристалл, затем прижимали винтом и проводили регистрацию спектров.
Антиоксидантную активность золей СеО2 анализировали по отношению к алкилпероксильным радикалам методом люминол-активированной хемилюминесценции [39] на 12-канальном приборе Lum-1200 (DISoft, Россия). Образование радикалов происходило в результате термоиндуцированной реакции разложения 2,2'-азо-бис(2-амидинопропан) дигидрохлорида (АБАП). Регистрацию хемилюминесценции проводили в среде фосфатного буферного раствора (PBS, 100 мМ, рН 7.4) при 37°C. В кювету с PBS добавляли смесь АБАП (2.5 μM, #123072, Sigma) с люминолом (2.0 μM, #123072, Sigma) и регистрировали свечение. После выхода интенсивности хемилюминесценции на постоянный уровень к смеси добавляли аликвоту исследуемого образца. Для обработки хемилюминограмм использовали программное обеспечение PowerGraph (версия 3.3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физико-химическая характеристика композитов CeO2@ГК. Рентгенограммы высушенного исходного золя СеО2, полученного термогидролизом гексанитратоцерата(IV) аммония, и композита CeO2@ГК (1 : 1) представлены на рис. 1а.
Рис. 1.
Рентгенограммы порошков СеО2 и композита СеО2@ГК (1 : 1) (а); УФ-спектры поглощения нестабилизированного золя СеО2, композита СеО2@ГК (1 : 1) и галловой кислоты (б), композитов СеО2@ГК (1 : 1, 1 : 2, 2 : 1) (в).
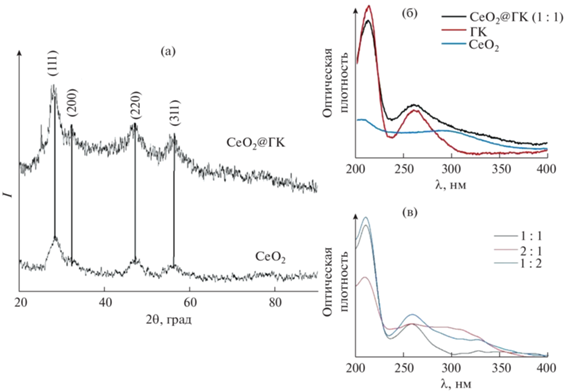
На рентгенограммах образцов СеО2 присутствуют рефлексы (111), (200), (220), (311), характерные для однофазного кубического диоксида церия (PDF2 34-0394). Функционализация поверхности наночастиц СеО2 органическим лигандом не приводит к существенному изменению вида дифрактограмм (рис. 1а). Рентгенограмма наночастиц СеО2, стабилизированных галловой кислотой (1 : 1), по расположению рефлексов соответствует рентгенограмме индивидуального нанокристаллического диоксида церия (рис. 1а). Размеры частиц, определенные по соотношению Шеррера [40] для наночастиц СеО2 без стабилизатора и диоксида церия в составе композита CeO2@ГК (1 : 1), составили 3.3 и 3.6 нм соответственно.
На электронных спектрах поглощения образцов немодифицированного золя СеО2 и индивидуального раствора галловой кислоты (рис. 1б) присутствуют полосы поглощения, характерные для диоксида церия (область 280–300 нм) и анионной формы галловой кислоты (211 и 260 нм).
В спектрах поглощения композитов CeO2@ГК (рис. 1б, 1в) положение полос, характерных для индивидуальных компонентов, остается неизменным. Отметим, что при иммобилизации галловой кислоты на других носителях, например на наночастицах γ-AlOOH, наблюдался батохромный сдвиг ее полос поглощения при 215 и 264 нм [14]. Увеличение содержания СеО2 в составе композита CeO2@ГК (2 : 1) (рис. 1в) приводило к увеличению интенсивности полосы поглощения СеО2 и уменьшению интенсивности полос поглощения галловой кислоты.
Методом динамического рассеяния света для наночастиц СеО2 без стабилизатора и композита СeO2@ГК (1 : 1) были определены величины средних гидродинамических диаметров частиц, равные 12 и 16 нм соответственно. Анализ электрокинетических свойств золей показал, что модификация поверхности нанодисперсного диоксида церия галловой кислотой (1 : 1) привела к снижению абсолютной величины ζ-потенциала от +40.1 ± 0.5 до +31.2 ± 0.7 мВ. Это связано с тем, что на поверхности частиц в исходном золе СеО2 находятся протонированные ОН-группы, а галловая кислота присутствует в растворе в анионной форме. Аналогичный характер изменения ζ-потенциала после связывания с галловой кислотой наблюдали ранее для наночастиц γ-AlOOH [14]. Поскольку коллоидные растворы с абсолютным значением ζ-потенциала более 30 мВ считаются стабильными, можно констатировать, что золь СеО2, модифицированный галловой кислотой (1 : 1), обладает хорошей агрегативной устойчивостью.
В ИК-спектре нестабилизированного золя CeO2 в диапазоне от 4000 до 100 см–1 были идентифицированы полосы поглощения, характерные для диоксида церия (рис. 2а).
Рис. 2.
ИК-Фурье-спектры нестабилизированного золя CeO2 и композита CeO2@ГК (1 : 1) в диапазоне от 4000 до 100 см–1 (а), деконволюция ИК-Фурье-спектра нестабилизированного золя CeO2 в диапазоне от 550 до 100 см–1 (б).
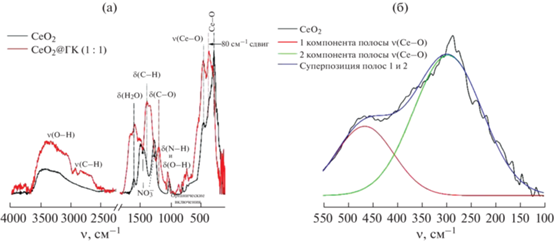
Полосы поглощения диоксида церия наблюдали при 720 [41], 457 и 285 см–1 [42]. Сигнал при 285 см–1 является суперпозицией нескольких полос поглощения [42], что подтверждает деконволюция спектра (рис. 2б). В качестве аналитического критерия оценки взаимодействия наночастиц СеО2 и лиганда были выбраны величины смещений (ΔνCe–O, см–1) максимумов полос поглощения диоксида церия при 285 и 457 см–1. На рис. 2а приведен ИК-спектр композита CeO2@ГК (1 : 1), в котором наблюдается сдвиг полос поглощения связи Ce–O (ΔνCe–O) на 80 и 10 см–1 соответственно. Полосы поглощения в ИК-спектре нестабилизированного золя СеО2 (рис. 2а) при 1030, 807 и 736 см–1 обусловлены присутствием органических компонентов [43]. Полоса поглощения c максимумом при 1280 см–1, а также неразрешенный сигнал с максимумами при 1513 и 1460 см–1 (рис. 2а) соответствуют остаточным нитрат-ионам [44]. Полоса поглощения при 1630 см–1 обусловлена колебаниями H–O–H, широкая полоса в области 3430 см–1 соответствует валентным колебаниям связи О–Н [45].
Различие в величинах смещений полос при 285 и 457 см–1 вызвано в первую очередь различиями в энергии нековалентного взаимодействия функциональных групп лиганда с наночастицей CeO2. Поскольку в молекулах галловой кислоты имеются OH-группы фенольного типа, вероятнее всего, взаимодействие между диоксидом церия и лигандом происходит за счет образования водородных связей между Ce–OH и галлат-ионами или хемосорбции галлат-ионов на поверхности наночастиц CeO2. Аналогичный механизм связывания наночастиц с лигандом наблюдали при взаимодействии галловой кислоты с наночастицами магнетита [13]. Таким образом, на основании анализа ИК-спектров можно сделать заключение о формировании композита CeO2@ГК (1 : 1).
Антиоксидантные свойства композитов CeO2@ГК. Антиоксидантные свойства модифицированных золей СеО2 анализировали по отношению к алкилпероксильным радикалам методом люминол-активированной хемилюминесценции. Хемилюминограммы, зарегистрированные после добавления композитов CeO2@ГК (1 : 1, 1 : 2, 2 : 1) к раствору, содержащему АБАП (источник свободных радикалов) и люминол, представлены на рис. 3.
Рис. 3.
Хемилюминесцентные кривые для композитов CeO2@ГК (1 : 1, 1 : 2, 2 : 1); концентрация по CeO2: 0.50 мкМ (1 : 1), 0.25 мкМ (1 : 2), 0.50 мкМ (2 : 1).
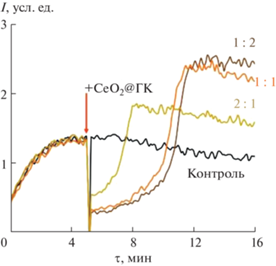
Как видно, добавление композитов СеО2@ГК (1 : 1, 1 : 2, 2 : 1) к раствору с алкилпероксильными радикалами и люминолом приводит к подавлению свечения с последующим выходом интенсивности люминол-зависимой хемилюминесценции на новый стационарный уровень. Хемилюминограммы композитов СеО2@ГК отражают разнонаправленную редокс-активность наночастиц СеО2, модифицированных галловой кислотой, по отношению к алкилпероксильным радикалам. Для понимания роли нанодисперсного диоксида церия и вклада лиганда в наблюдаемую редокс-активность были зарегистрированы хемилюминограммы для нестабилизированного золя СеО2 и индивидуального раствора галловой кислоты (рис. 4).
Рис. 4.
Хемилюминесцентные кривые для нестабилизированного золя СеО2, индивидуального раствора галловой кислоты и композитов CeO2@ГК 1 : 1 (0.50 мкМ) (a), 1 : 2 (0.25 мкМ) (б), 2 : 1 (0.50 мкМ) (в), в скобках указана концентрация по СеО2.
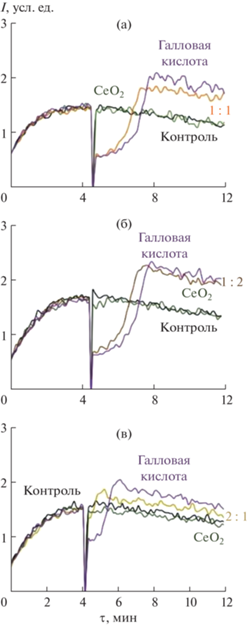
В исследованном диапазоне концентраций (0.02–1.00 мкМ) исходный нестабилизированный золь СеО2 не проявлял антиоксидантную активность по отношению к алкилпероксильным радикалам (рис. 4). Поскольку анализ антиоксидантных свойств золей осуществляли в среде, содержащей ионы ${\text{PO}}_{4}^{{3 - }}$, можно предположить, что отсутствие влияния со стороны наночастиц СеО2 на люминол-зависимую хемилюминесценцию было обусловлено фосфатированием поверхности наночастиц СеО2, что хорошо коррелирует с литературными данными. Ингибирующее влияние фосфат-ионов на различные виды каталитической активности нанодисперсного диоксида церия было подробно исследовано ранее [46–48]. Анализ хемилюминесцентных кривых композитов СеО2@ГК (1 : 1, 1 : 2, 2 : 1), а также их компонентов (рис. 4), наночастиц СеО2 и галловой кислоты, позволил сделать вывод о том, что редокс-активность модифицированных золей СеО2 в основном обусловлена галловой кислотой. Галловой кислоте присуща двойственная роль в свободнорадикальных реакциях [10, 49–51]. Являясь сильным антиоксидантом, галловая кислота одновременно зарекомендовала себя в качестве эффективного агента, индуцирующего апоптоз клеток за счет прооксидантной активности [10, 50]. Радикал-перехватывающие свойства производных галловой кислоты (3,4,5-тригидроксибензойная кислота) напрямую зависят от присутствия в структуре гидроксильных групп и их стерической доступности [52]. В частности, наиболее эффективными при инактивации свободных радикалов являются пара- и орто-гидроксильные группы фенольных кислот [50, 53]. На антиоксидантную активность галловой кислоты в значительной степени влияет присутствие переходных металлов, например, ионов Fe(II) или Fe(III) [49, 54, 55]. Важным фактором, регулирующим антиоксидантную и прооксидантную активность галловой кислоты в системах типа Фентона, Fe(III)/H2O2, является ее концентрация [10, 50]. При низких концентрациях галловой кислоты (соотношение в реакционной среде ГК : Fe(II) < 2 : 1) преобладает прооксидантный эффект: восстановление ионов Fe3+ до Fe2+ приводит к образованию HO•. При высоких концентрациях галловой кислоты (соотношение в реакционной среде ГК : Fe(II) > 2 : 1) общий эффект – антиоксидантный благодаря радикал-перехватывающей активности галловой кислоты по отношению к гидроксильным радикалам. Галловая кислота способна стимулировать образование свободных радикалов, проявляя прооксидантную активность, за счет слабого хелатирования ионов металлов [10, 50].
В зависимости от мольного соотношения между наночастицами СеО2 и галловой кислотой (1 : 1, 1 : 2, 2 : 1) виды хемилюминесцентных кривых композитов СеО2@ГК различаются (рис. 4). Взаимодействие наночастиц СеО2 с галловой кислотой приводит к ослаблению ее антиоксидантных и прооксидантных свойств. Данный эффект наиболее выражен в случае золя СеО2, модифицированного галловой кислотой в мольном соотношении 2 : 1 (рис. 4в). Вероятно, это обусловлено частичным окислением галловой кислоты при связывании с наночастицами СеО2. В работе, посвященной кинетическим аспектам окисления галловой кислоты гексанитратоцератом(IV) аммония в азотнокислой среде, показано, что эта реакция идет через стадию образования первичного комплекса между ионами Ce(IV) и галловой кислотой [49]. Первичный комплекс диспропорционирует с образованием Ce(III) и продукта окисления типа о-бензохинона. Дальнейшее окисление приводит к образованию ионов Ce(III) и конечных продуктов – муравьиной кислоты и СО2. С увеличением содержания в реакционной смеси Ce(IV) константа скорости окисления галловой кислоты заметно снижается. Поскольку Ce(IV) существует в азотнокислой среде в виде аквагидроксокомплексов, замедление реакции окисления галловой кислоты связывают с образованием димерных ионов, обладающих малой реакционной способностью [56]. Важное значение для формирования димеров имеет pH реакционной среды. Влияет рН среды и на характер взаимодействия наночастиц и лиганда. Галловая кислота представляет собой двухосновную органическую кислоту со значениями pKa, равными 4.1 (для карбоксильной группы) и 8.38 (для гидроксильной группы). Ранее было показано, что стабилизация коллоидных растворов золота галловой кислотой при низких значениях pH может идти через формирование комплекса между наночастицами Au и карбоксильной группой лиганда, а при более высоких рН – за счет взаимодействия наночастиц Au c гидроксильной группой [18].
Для количественного описания антиоксидантных и прооксидантных свойств композитов СеО2@ГК были введены параметры S и ΔI (рис. 5а). Антиоксидантная емкость (S) представляет собой площадь области подавления хемилюминесценции, прооксидантная емкость (ΔI) – разность между начальным (I0) и последующим (после добавления образца) стационарным уровнями хемилюминесценции (I).
Рис. 5.
Хемилюминесцентная кривая для композита СеО2@ГК (1 : 1, 0.17 мкМ) с обозначенными параметрами S (антиоксидантная емкость) и ΔI (прооксидантная емкость) (а); гистограммы распределения параметров S (б) и ΔI (в) для разных концентраций композитов СеО2@ГК (1 : 1, 1 : 2, 2 : 1); указаны концентрации по СеО2.
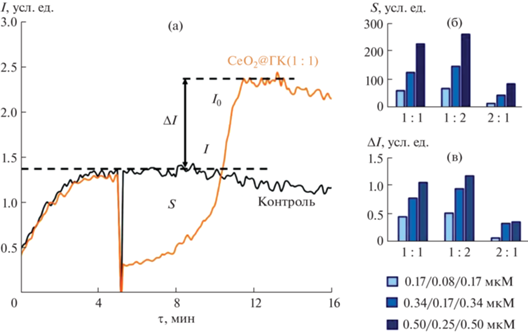
Сравнение значений параметров S и ΔI, определенных для одинаковых концентраций модифицированных золей СеО2, продемонстрировало, что увеличение доли диоксида церия в составе композитов СеО2@ГК (1 : 1, 1 : 2, 2 : 1) приводит к существенному снижению S и ΔI (рис. 5б, 5в). Таким образом, наиболее ярко выраженная редокс-активность, проявляющаяся как сочетание антиоксидантных и прооксидантных свойств, характерна для композита СеО2@ГК (1 : 2), а наименьшей активностью обладает композит СеО2@ГК (2 : 1) (рис. 5б, 5в). Эти данные согласуются с немногочисленными исследованиями, в которых показано, что наночастицы СеО2, стабилизированные лигандами в различных соотношениях, проявляют различную биологическую активность [57]. Так, среди образцов СеО2, модифицированных лимонной кислотой/ЭДТА в соотношениях 100 : 0, 70 : 30, 60 : 40, 50 : 50, 40 : 60, 30 : 70, 20 : 80, 0 : 100, наибольшей антиоксидантной активностью и значимыми нейропротекторными свойствами обладали наночастицы СеО2, стабилизированные лигандом в соотношении 50 : 50 [57].
В ряде предшествующих исследований показано, что модификация различных наночастиц галловой кислотой приводит к синергетическому эффекту, выраженному в усилении биологической активности полученных наноматериалов [13–15, 17–19]. Так, например, в случае наночастиц магнетита антиоксидантная активность образцов Fe3O4@ГК возрастала в 2–4 раза [13]. В настоящей работе для количественной оценки влияния наночастиц СеО2 на антиоксидантные и прооксидантные свойства галловой кислоты были зарегистрированы хемилюминесцентные кривые для разных концентраций композитов СеО2@ГК и индивидуального раствора галловой кислоты (рис. 6) и получены уравнения концентрационных зависимостей параметров S и ΔI (табл. 1).
Рис. 6.
Хемилюминесцентные кривые для композитов CeO2@ГК 1 : 1 (а), 1 : 2 (б), 2 : 1 (в) и индивидуального раствора галловой кислоты (г); зависимости параметров S (д) и ΔI (е) от концентрации галловой кислоты.
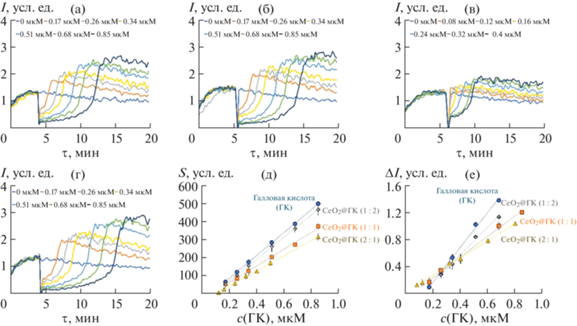
Таблица 1.
Антиоксидантная (S) и прооксидантная (ΔI) емкость галловой кислоты в составе композитов CeO2@ГК
| Образец | Уравнение зависимости антиоксидантной емкости (S, усл. ед.) от с, мкМ (n = 7, P = 0.95) |
Снижение антиоксидантной емкости, % | Уравнение зависимости прооксидантной емкости
(ΔI, усл. ед.) от с, мкМ (n = 7, P = 0.95) |
Снижение прооксидантной емкости, % |
|---|---|---|---|---|
| Галловая кислота (ГК) | S = (637 ± 30) × c – (43 ± 6), r = 0.999 | – | ΔI = (2.6 ± 0.4) × c – (0.33 ± 0.02), r = 0.998 | – |
| CeO2@ГК (1 : 1) | S = (466 ± 16) × c – (33 ± 8), r = 0.998 | 27 ± 3 | ΔI = (1.5 ± 0.1) × c – (0.06 ± 0.01), r = 0.998 | 35 ± 4 |
| CeO2@ГК (1 : 2) | S = (610 ± 50) × c – (52 ± 5), r = 0.999 | 9 ± 1 | ΔI = (2.0 ± 0.3) × c – (0.24 ± 0.04), r = 0.998 | 19 ± 5 |
| CeO2@ГК (2 : 1) | S = (410 ± 25) × c – (51 ± 9), r = 0.999 | 40 ± 3 | ΔI = (1.3 ± 0.1) × c – (0.033 ± 0.004), r = 0.999 | 58 ± 9 |
Для 1 мкмоль/л раствора галловой кислоты установлено, что иммобилизация на поверхности наночастиц СеО2 в мольном соотношении 2 : 1 приводит к снижению ее антиоксидантной и прооксидантной емкости на 40 ± 3% и 58 ± 9% соответственно. Как видно, связывание галловой кислоты с наночастицами диоксида церия в большей степени оказывает влияние на ее прооксидантные свойства. Отметим, что в недавнем исследовании in vivo было показано, что совместное использование наночастиц СеО2 и галловой кислоты обеспечивает защиту от нефротоксичного действия цисплатина [37]. Авторы выдвинули предположение о потенциальном синергетическом эффекте.
Благодаря различным видам биологической активности, включая противоопухолевую, противовирусную, антибактериальную, антимутагенную и др., галловая кислота является перспективным лигандом для получения на ее основе гибридных наноматериалов с новыми свойствами [50]. В свою очередь, это делает актуальным необходимость всестороннего анализа таких наноматериалов для дальнейшего биомедицинского применения. Результаты настоящего исследования могут способствовать пониманию механизмов взаимного влияния наночастиц и лигандов, а также прогнозированию вероятных биологических последствий при введении наночастиц в организм.
ЗАКЛЮЧЕНИЕ
Получены новые агрегативно-устойчивые золи диоксида церия, модифицированные галловой кислотой. Успешная функционализация поверхности наночастиц СеО2 подтверждена методом ИК-спектроскопии. Показано, что композиты СеО2@ГК (1 : 1, 1 : 2, 2 : 1) обладают разнонаправленной редокс-активностью по отношению к алкилпероксильным радикалам, проявляя как антиоксидантные, так и прооксидантные свойства. Установлено, что редокс-активность композитов обусловлена в большей степени галловой кислотой. Найдено, что модифицирование наночастиц СеО2 галловой кислотой приводит к снижению ее антиоксидантного и прооксидантного потенциала. Полученные данные могут иметь важное значение для разработки препаратов, применяемых при нарушениях редокс-метаболизма. Иммобилизация галловой кислоты на поверхности наночастиц СеО2 может оказаться полезным инструментом для регулирования ее антиоксидантных и прооксидантных свойств.
Список литературы
Fornaguera C., García-Celma M.J. // J. Pers. Med. 2017. V. 7. № 4. https://doi.org/10.3390/jpm7040012
Sur S., Rathore A., Dave V. et al. // Nano-Structures and Nano-Objects. 2019. V. 20. P. 100397.https://doi.org/10.1016/j.nanoso.2019.100397
Chakraborty A., Boer J.C., Selomulya C. et al. // Bioconjug. Chem. 2018. V. 29. № 3. P. 657.https://doi.org/10.1021/acs.bioconjchem.7b00455
Silvestri B., Vitiello G., Luciani G. et al. // ACS Appl. Mater. Interfaces. 2017. V. 9. № 43. https://doi.org/10.1021/acsami.7b11839
Vecchione R., Luciani G., Calcagno V. et al. // Nanoscale. 2016. V. 8. № 16. P. 8798. https://doi.org/10.1039/C6NR01192F
Rocha L.S.R., Simões A.Z., Macchi C. et al. // Sci. Rep. 2022. V. 12. № 1. P. 3341. https://doi.org/10.1038/s41598-022-07200-9
Olszowy M. // Plant Physiol. Biochem. 2019. V. 144. P. 135. https://doi.org/10.1016/j.plaphy.2019.09.039
Martins N., Barros L., Ferreira I.C.F.R. // Trends Food Sci. Technol. 2016. V. 48. P. 008. https://doi.org/10.1016/j.tifs.2015.11.008
Vuolo M.M., Lima V.S., Maróstica Junior M.R. // Bioact. Compd. Elsevier, 2019. P. 33. https://doi.org/10.1016/B978-0-12-814774-0.00002-5
Strlič M., Radovič T., Kolar J. et al. // J. Agric. Food Chem. 2002. V. 50. № 22. P. 6313. https://doi.org/10.1021/jf025636j
Lima V.N., Oliveira-Tintino C.D.M., Santos E.S. et al. // Microb. Pathog. 2016. V. 99. P. 56. https://doi.org/10.1016/j.micpath.2016.08.004
Karimova N.V., Luo M., Sit I. et al. // J. Phys. Chem. A. 2022. V. 126. № 2. P. 190. https://doi.org/10.1021/acs.jpca.1c07333
Shah S.T., A Yehya W., Saad O. et al. // Nanomaterials. 2017. V. 7. № 10. P. 306. https://doi.org/10.3390/nano7100306
Martakov I.S., Shevchenko O.G., Torlopov M.A. et al. // J. Inorg. Biochem. 2019. V. 199. P. 110782. https://doi.org/10.1016/j.jinorgbio.2019.110782
Deligiannakis Y., Sotiriou G.A., Pratsinis S.E. // ACS Appl. Mater. Interfaces. 2012. V. 4. № 12. P. 6609. https://doi.org/10.1021/am301751s
Mittal A.K., Kumar S., Banerjee U.C. // J. Colloid Interface Sci. 2014. V. 431. P. 194. https://doi.org/10.1016/j.jcis.2014.06.030
Daduang J., Palasap A., Daduang S. et al. // Asian Pacific J. Cancer Prev. 2015. V. 16. № 1. P. 169. https://doi.org/10.7314/APJCP.2015.16.1.169
Moreno-Álvarez S.A., Martínez-Castañón G.A., Niño-Martínez N. et al. // J. Nanoparticle Res. 2010. V. 12. № 8. P. 2741. https://doi.org/10.1007/s11051-010-0060-x
Wu Y.-Z., Tsai Y.-Y., Chang L.-S. et al. // Pharmaceuticals. 2021. V. 14. № 11. P. 1071. https://doi.org/10.3390/ph14111071
Shcherbakov A.B., Reukov V.V., Yakimansky A.V. et al. // Polymers (Basel). 2021. V. 13. № 6. P. 924. https://doi.org/10.3390/polym13060924
Popov A.L., Popova N., Gould D.J. et al. // ACS Appl. Mater. Interfaces. 2018. V. 10. № 17. P. 14367. https://doi.org/10.1021/acsami.7b19658
Singh S. // Biointerphases. 2016. V. 11. № 4. P. 04B202. https://doi.org/10.1116/1.4966535
Singh K.R., Nayak V., Sarkar T. et al. // RSC Adv. 2020. V. 10. № 45. P. 27194. https://doi.org/10.1039/D0RA04736H
Jiang D., Ni D., Rosenkrans Z.T. et al. // Chem. Soc. Rev. 2019. V. 48. № 14. P. 3683. https://doi.org/10.1039/C8CS00718G
Созарукова М.М., Шестакова М.А., Теплоногова М.А. и др. // Журн. неорган. химии. 2020. Т. 65. № 4. С. 554.
Filippova A.D., Sozarukova M.M., Baranchikov A.E. et al. // Molecules. 2023. V. 28. № 9. P. 3811. https://doi.org/10.3390/molecules28093811
Sozarukova M.M., Proskurnina E.V., Ivanov V.K. // Nanosyst. Physics, Chem. Math. 2021. V. 12. № 3. P. 283. https://doi.org/10.17586/2220-8054-2021-12-3-283-290
Sozarukova M.M., Proskurnina E. V., Popov A.L. et al. // RSC Adv. 2021. V. 11. № 56. P. 35351. https://doi.org/10.1039/D1RA06730C
Sheng J., Wu Y., Ding H. et al. // Adv. Mater. 2023. P. 2211210. https://doi.org/10.1002/adma.202211210
Ma Y., Tian Z., Zhai W. et al. // Nano Res. 2022. V. 15. № 12. P. 10328. https://doi.org/10.1007/s12274-022-4666-y
Wang G., Zhang J., He X. et al. // Chinese J. Chem. 2017. V. 35. № 6. P. 791. https://doi.org/10.1002/cjoc.201600845
Иванов В.К., Усатенко А.В., Щербаков А.Б. // Журн. неорган. химии. 2009. Т. 54. № 10. С. 1596.
Popov A.L., Popova N.R., Tarakina N.V. et al. // ACS Biomater. Sci. Eng. 2018. V. 4. № 7. P. 2453. https://doi.org/10.1021/acsbiomaterials.8b00489
Celardo I., Pedersen J.Z., Traversa E. et al. // Nanoscale. 2011. V. 3. № 4. P. 1411. https://doi.org/10.1039/c0nr00875c
Ciccarese F., Raimondi V., Sharova E. et al. // Antioxidants. 2020. V. 9. № 3. P. 211. https://doi.org/10.3390/antiox9030211
Yang Y., Sun W. // Nanoscale Adv. 2022. V. 4. № 17. P. 3504. https://doi.org/10.1039/D2NA00222A
Saif-Elnasr M., El-Ghlban S., Bayomi A.I. et al. // Arch. Biochem. Biophys. 2023. V. 740. P. 109594. https://doi.org/10.1016/j.abb.2023.109594
Shcherbakov A.B., Teplonogova M.A., Ivanova O.S. et al. // Mater. Res. Express. 2017. V. 4. № 5. P. 055008. https://doi.org/10.1088/2053-1591/aa6e9a
Alekseev A.V., Proskurnina E.V., Vladimirov Y.A. // Moscow Univ. Chem. Bull. 2012. V. 67. № 3. P. 127. https://doi.org/10.3103/S0027131412030029
Vorokh A.S. // Nanosyst. Physics, Chem. Math. 2018. P. 364. https://doi.org/10.17586/2220-8054-2018-9-3-364-369
Mokkelbost T., Kaus I., Grande T. et al. // Chem. Mater. 2004. V. 16. № 25. P. 5489. https://doi.org/10.1021/cm048583p
Popović Z.V., Grujić-Brojčin M., Paunović N. et al. // J. Nanoparticle Res. 2015. V. 17. № 1. P. 23. https://doi.org/10.1007/s11051-015-2859-y
Ramasamy V., Vijayalakshmi G. // Mater. Sci. Semicond. Process. 2016. V. 42. P. 334. https://doi.org/10.1016/j.mssp.2015.10.026
Diaconeasa Z., Barbu-Tudoran L., Coman C. et al. // Rom. Biotechnol. Lett. 2015. V. 20. P. 10679.
Barth A. // Prog. Biophys. Mol. Biol. 2000. V. 74. № 3–5. P. 141. https://doi.org/10.1016/S0079-6107(00)00021-3
Singh R., Singh S. // Colloids Surf. B: Biointerfaces. 2015. V. 132. P. 78. https://doi.org/10.1016/j.colsurfb.2015.05.005
Zhao Y., Li H., Lopez A. et al. // ChemBioChem. 2020. V. 21. № 15. P. 2178. https://doi.org/10.1002/cbic.202000049
Kumar A., Das S., Munusamy P. et al. // Environ. Sci. Nano. 2014. V. 1. № 6. P. 516. https://doi.org/10.1039/C4EN00052H
Yen G.-C., Duh P.-D., Tsai H.-L. // Food Chem. 2002. V. 79. № 3. P. 307. https://doi.org/10.1016/S0308-8146(02)00145-0
Badhani B., Sharma N., Kakkar R. // RSC Adv. 2015. V. 5. № 35. P. 27540. https://doi.org/10.1039/C5RA01911G
Sakagami H., Satoh K. // Anticancer Res. 1997. V. 17. № 1A. P. 221.
Lu Z., Nie G., Belton P.S. et al. // Neurochem. Int. 2006. V. 48. № 4. P. 263. https://doi.org/10.1016/j.neuint.2005.10.010
Wright J.S., Johnson E.R., DiLabio G.A. // J. Am. Chem. Soc. 2001. V. 123. № 6. P. 1173. https://doi.org/10.1021/ja002455u
Yoshiki Y., Okubo K., Akiyama Y. et al. // Luminescence. 2000. V. 15. № 3. P. 183. https://doi.org/10.1002/1522-7243(200005/06)15:3<183::AID-BIO584>3.0.CO;2-V
Kumamoto M., Sonda T., Nagayama K. et al. // Biosci. Biotechnol. Biochem. 2001. V. 65. № 1. P. 126. https://doi.org/10.1271/bbb.65.126
Chaudhari U.R., Rao B.M. // Z. Phys. Chem. 1989. V. 270O. № 1. P. 412. https://doi.org/10.1515/zpch-1989-27048
Estevez A., Ganesana M., Trentini J. et al. // Biomolecules. 2019. V. 9. № 10. P. 562. https://doi.org/10.3390/biom9100562
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


