Журнал неорганической химии, 2023, T. 68, № 9, стр. 1192-1201
Супрамолекулярные гибридные комплексы на основе октаэдрического йодидного кластера молибдена(II) и порфирината цинка(II)
М. В. Волостных a, *, П. А. Лобода b, А. А. Синельщикова a, П. В. Дороватовский c, Г. А. Киракосян a, d, М. А. Михайлов e, М. Н. Соколов e, Ю. Г. Горбунова a, b, d
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва,
Ленинский пр-т, 31, корп. 4, Россия
b Московский государственный университет им. М.В. Ломоносова, факультет фундаментальной
физико-химической инженерии
119234 Москва, ул. Колмогорова, 1с51, Россия
c Национальный исследовательский центр “Курчатовский институт”
123182 Москва, ул. Академика Курчатова, 1, Россия
d Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, корп. 1, Россия
e Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск,
пр-т Академика Лаврентьева, 3, Россия
* E-mail: marinavolostnykh@gmail.com
Поступила в редакцию 02.05.2023
После доработки 01.06.2023
Принята к публикации 05.06.2023
- EDN: WRCTAX
- DOI: 10.31857/S0044457X23600743
Аннотация
Продемонстрирована возможность образования супрамолекулярных гибридов на основе двух фотосенсибилизаторов – октаэдрического йодидного кластера молибдена(II) с шестью терминальными изоникотинатными лигандами (Bu4N)2[{Mo6I8}(OOC–C5H4N)6] (PyMoC, С) и порфирината цинка(II) А4-типа (ZnTPP, P). Методами спектрофотометрического титрования и ЯМР показано, что формирование комплексов СPn (n = 1–6) происходит в растворах некоординирующих хлорорганических растворителей за счет образования координационных связей металл–N-лиганд между компонентами. Использование октаэдрического кластера в качестве гексатопного N-лиганда и лабильность связей Zn…NPy в совокупности приводят к образованию серии комплексов СPn (n = 1–6), находящихся в динамическом равновесии в растворе. Несмотря на это, удалось подобрать условия и получить монокристаллы индивидуальных форм CP4 + 2 и CP6 + 2, методом рентгеноструктурного анализа определено их строение. Установлено, что кластер PyMoC координирует четыре или шесть молекул ZnTPP соответственно, при этом обе структуры содержат две “экстрамолекулы” порфирината цинка(II), связанные с кластером за счет водородных связей между атомами кислорода изоникотинатных групп и протонами воды, аксиально координированной к порфириновому металлоцентру.
ВВЕДЕНИЕ
Дизайн супрамолекулярных архитектур на основе соединений, обладающих ярко выраженными специфическими физико-химическими свойствами, является эффективной стратегией получения полифункциональных материалов [1–6]. Сочетание в единой системе компонентов различной природы (органических и неорганических) в результате синергизма может привести как к усилению имеющихся свойств, так и к появлению новых характеристик. Металлопорфирины являются фотосенсибилизаторами, которые часто используют в качестве органического компонента в химии материалов. Указанные соединения обладают уникальными фотофизическими и фотохимическими свойствами, а именно: высокой химической и термической стабильностью, способностью поглощать свет в видимой области, долгоживущими возбужденными состояниями. При этом оптические и окислительно-восстановительные свойства порфиринов можно легко настраивать путем металлирования и/или функционализации тетрапиррольного макроцикла [1, 7–10]. Примеры гибридных композитов на основе порфиринов и различных неорганических субстратов, таких как магнитные наночастицы [11, 12], углеродные наноматериалы (фуллерены, углеродные точки, оксид графена) [13–17], квантовые точки [18, 19] и полиоксометаллаты (ПОМ) [20–23], широко представлены в литературе в области химии материалов. В последнее время появились примеры дизайна и синтеза гибридных порфириновых архитектур, состоящих из более чем двух молекулярных компонентов [24, 25]. Показано, что сочетание порфиринов с ПОМ или кластерами иного строения, например халькогенидом германия, может приводить к усилению/появлению нелинейных оптических, фотоэлектрических и фотокаталитических свойств, возникающих в результате электронного взаимодействия между компонентами [26–28]. Для объединения строительных блоков в единую систему могут быть использованы разные подходы супрамолекулярной химии, среди которых наибольшее распространение получил метод образования координационных связей металл–лиганд [21, 25, 29, 30]. В этом случае сложные молекулярные архитектуры могут быть быстро получены в мягких условиях с помощью термодинамического контроля. В 2019 г. нашей группой была опубликована работа [31], в которой использование данного подхода впервые позволило сочетать в одной гибридной системе порфиринат цинка(II) А2-типа (5,15-бис(п-толил)порфиринат цинка) и октаэдрический йодидный кластер молибдена(II), функционализированный терминальными изоникотинатными группами. Выбранный для исследования гексаядерный галогенидный кластер обладает способностью к эффективной генерации синглетного кислорода, что позволяет отнести его к новому классу неорганических фотосенсибилизаторов [32–37]. Более того, большое октаэдрическое центральное ядро Mo6I8 может быть легко модифицировано различными функциональными группами, что очень важно с точки зрения получения супрамолекулярных гибридов [32, 38]. Два типа гибридов кластер–порфиринат цинка(II) (СР2 и СР6) были получены в кристаллическом виде и исследованы методом рентгеноструктурного анализа (РСА) на монокристаллах и порошке. При этом в растворе наблюдалось образование смеси неразличимых супрамолекулярных порфириновых комплексов СРn, находящихся в динамическом равновесии, вследствие быстрого обмена координационных связей Zn…NPy.
Известно, что комплексы Ru(II) также могут связывать N-гетероциклические лиганды, причем из-за медленного обмена связи Ru…NPy прочнее, чем Zn(II)-аналоги [29, 39–42]. Поэтому как один из вариантов расширения исследования [31] мы провели замену порфиринового металлоцентра с цинка(II) на рутений(II) и синтезировали новый строительный блок на основе порфирина А2-типа – 5,15-бис(п-толил)порфиринат (аква)(карбонил)рутения(II). Комбинируя его с октаэдрическим йодидным кластером молибдена(II), функционализированным изоникотинатными группами, мы получили серию стабильных трехмерных “side-to-face” супрамолекулярных архитектур СРn, существующих в растворе в виде дискретных индивидуальных частиц [43]. Другим направлением нашей работы является переход от порфирината цинка(II) А2-типа к более стерически затрудненным порфиринатам цинка(II) А4-типа с целью определения влияния количества заместителей в порфириновом строительном блоке на состав гибридных систем СРn.
Таким образом, в настоящей работе исследована возможность образования супрамолекулярных гибридных систем кластер–порфирин (СРn) на основе двух фотосенсибилизаторов (cхема 1) – порфирината цинка(II) А4-типа ZnTPP и октаэдрического йодидного кластера молибдена(II) с шестью терминальными изоникотинатными лигандами (Bu4N)2[{Mo6I8}(OOC–C5H4N)6] PyMoC с последующим детальным изучением продуктов в растворе и в твердом виде.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все использованные в работе реагенты были получены из коммерческих источников, кроме указанных отдельно. Подготовку растворителей осуществляли по стандартным методикам [44]. Исходные строительные блоки – 5,10,15,20-тетрафенилпорфиринат цинка(II) ZnTPP и (Bu4N)2[{Mo6I8}(OOC–C5H4N)6] PyMoC – синтезировали по опубликованным методикам [26, 37, 38]. Колоночную хроматографию проводили методом градиентного элюирования на силикагеле MN Kieselgel 60 (63–200 мкм; элюент CH2Cl2) в качестве неподвижной фазы.
Масс-спектры MALDI-TOF получены на масс-спектрометре Bruker Ultraflex II LRF 2000 в режиме положительных ионов с использованием дитранола в качестве матрицы.
Электронные спектры поглощения (ЭСП) в видимой и УФ-областях регистрировали на спектрофотометре Helios фирмы Thermo Electron Corporation в кварцевых прямоугольных кюветах толщиной 1 см. Спектрофотометрическое титрование проводили путем поэтапного добавления раствора PyMoC (0.033 экв на одно добавление) к раствору ZnTPP (88 мкM) в кварцевой кювете с тефлоновой пробкой. Дозирование титранта осуществляли с помощью шприцевого насоса LA-100 (Landgraf HLL). В качестве растворителя для титрования использовали CH2Cl2. Условия записи спектров поглощения: скорость сканирования 600 нм/мин, ширина полосы 1 нм, время отклика 0.1 с, накопление – 1 сканирование.
Схема 1 . Строительные блоки для супрамолекулярных комплексов кластер–порфирин: 5,10,15,20-тетрафенилпорфиринат цинка(II) ZnTPP (а) и (Bu4N)2[{Mo6I8}(OOC–C5H4N)6] PyMoC (катионы тетрабутиламмония не показаны для наглядности) (б).
Для изучения комплексообразования выбранного гексатопного кластерного N-лиганда с порфиринатом цинка(II) А4-типа и определения стехиометрии образующихся супрамолекулярных комплексов применяли метод изомолярных серий (метод Джоба) [47]. Для измерения спектров поглощения готовили серию растворов, содержащих кластер и порфирин в различных соотношениях при фиксированной общей концентрации 45 μM для обоих строительных блоков. Сумма мольных долей компонентов в каждом образце составляла 1, объем результирующего раствора – 3 мл. Изменения интенсивности поглощения Q-полосы при 548 нм были умножены на мольную долю порфирина и построен график Джоба.
Спектры ЯМР 1Н регистрировали на спектрометре Bruker Avance-III (600 МГц) в CDCl3 с внутренней стабилизацией по дейтерию при 303 K. Химические сдвиги (${{\delta }},\,\,{\text{м}}{\text{.д}}.$) в спектрах ЯМР 1Н приведены с использованием сигнала остаточных протонов растворителя (CDCl3, 7.28 м.д.) в качестве внутреннего стандарта.
Фиолетовые монокристаллы CP4 + 2 и CP6 + 2 были получены медленной диффузией гептана в раствор смеси ZnTPP и PyMoC (C : P = 1 : 4 и 1 : 7 соответственно) в СH2Cl2 при 5°С. Рентгеноструктурный анализ монокристаллов супрамолекулярных гибридных систем CP4+2 и CP6+2 выполняли на синхротронной станции “БЕЛОК” Национального исследовательского центра “Курчатовский институт” [48, 49] с использованием двухкоординатного детектора Rayonix SX165 CCD (T = 100 K, φ-сканирование с шагом 1.0). Для каждого набора данных записывали ~120 дифракционных кадров. Данные индексировали и обрабатывали с помощью программного пакета XDS [50]. Для полученных данных учитывали поглощение рентгеновского излучения по программе Scala [51]. Из-за свободного пространства и низкой интенсивности высокоугловых отражений монокристаллов CP4+2 и CP6 + 2 тепловые эллипсоиды были высокими.
Структуры решены с использованием программного комплекса Olex2 [52], программы SHELXT [53] и уточнены методом полноматричных наименьших квадратов (SHELXL-2014 [54]) по F 2 по всему набору данных в анизотропном приближении для неводородных атомов. Атомы H помещены в геометрически рассчитанные позиции с изотропными температурными факторами, в 1.2 (группы CH) или в 1.5 раза (группа CH3) превышающими эквивалентный изотропный температурный фактор связанных с ними атомов C. В обеих структурах использовали функцию Olex2 Solvent mask, чтобы вычесть электронную плотность разупорядоченных молекул хлористого метилена, которые не удалось уточнить. Для структуры CP6 + 2 таким образом удалены 10 молекул CH2Cl2 на элементарную ячейку, для структуры CP4 + 2 – четыре молекулы. В структуре CP4 + 2 вместо свободного изоникотинатного фрагмента на Mo(3) электронная плотность уточнена как OH-группа. По-видимому, частичный гидролиз приводит к смешанным заместителям на молибдене, в части ячеек все еще могут наблюдаться изоникотинатные фрагменты, но из-за разупорядочения уточнить их не удалось. В табл. S1, S5 приведены кристаллографические характеристики и детали дифракционного эксперимента, в табл. S2–S4, S6–S8 – длины связей и валентные углы.
Полные таблицы межатомных расстояний и валентных углов, координаты атомов и параметры атомных смещений структур депонированы в Кембриджском банке структурных данных (CCDC 2259979 для CP4 + 2, 2259980 для CP6 + 2; www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование процесса сборки порфирината цинка(II) А4-типа ZnTPP и октаэдрического йодидного кластера молибдена(II) PyMoC в растворе начали с проведения спектрофотометрического титрования. ЭСП ZnTPP в CH2Cl2 имеет характерный набор из двух Q-полос при 548 и 586 нм. Кластер в данном диапазоне (>500 нм) не поглощает [32]. Поэтапное добавление раствора PyMoC к раствору порфирина (88 μM) приводит к значительным изменениям в видимой области спектра (рис. 1), а именно к батохромному сдвигу Q(1,0)-полосы от 548 до 561 нм и уменьшению ее интенсивности с одновременным появлением новой длинноволновой полосы поглощения при 603 нм. Наблюдаемые изменения в спектрах поглощения могут свидетельствовать о формировании супрамолекулярных гибридных комплексов различного состава (CP1–6) за счет координации изоникотинатных групп кластера к металлоцентру порфирина и образования множественных связей Zn…NPy [31, 40].
Рис. 1.
Изменения ЭСП ZnTPP (88 μM) в CH2Cl2 при 298 K в процессе титрования раствором PyMoC (0.033 экв при каждом добавлении), l = 1 cм.

Далее была проведена оценка стехиометрии наиболее стабильного из образующихся супрамолекулярных гибридов CP1–6 методом изомолярных серий (метод Джоба) [47], основанным на изменении интенсивности поглощения ZnTPP (548 нм) при комплексообразовании с PyMoC в CH2Cl2 (рис. 2а). Четкий максимум на полученном графике при значении мольной доли ZnTPP 0.67 может свидетельствовать о том, что наиболее стабильным в данной системе является супрамолекулярный комплекс CP2. Подобный результат ранее был получен методом Джоба и для порфирината цинка(II) А2-типа [31], что логично, так как CP2 – это наименее стерически нагруженная симметричная гибридная частица в растворе.
Рис. 2.
График Джоба для ZnTPP при комплексообразовании с PyMoC в CH2Cl2 при 298 K и общей концентрации компонентов 45 μM (а); ЭСП ZnTPP и супрамолекулярных комплексов CP2 и CP4 (б); изменения концентрации ZnTPP, CP2 и CP4 при добавлении PyMoC (в); изменение поглощения ZnTPP при 548 нм при постепенном добавлении PyMoC (г). Представленные на рис. 2б–2г данные смоделированы и рассчитаны с помощью программы HypSpec (http://www.hyperquad.co.uk/HypSpec.htm) на основе результатов спектрофотометрического титрования (рис. 1).

Более точный анализ данных спектрофотометрического титрования (рис. 2б–2г) с помощью программы HypSpec выявил наилучшее соответствие между экспериментальными значениями и расчетными кривыми титрования при допущении одновременного существования в растворе как частицы CP2 c lg β = 8.9694 ± 0.0113, так и СP4 с lg β = = 17.5785 ± 0.0364 (Sigma = 2.0802 E-03), где β – кумулятивная константа связывания. При этом для порфирината цинка(II) А2-типа, согласно расчетной модели, второй наблюдаемой частицей в CH2Cl2, помимо CP2 (lg β = 9.16 ± 0.02), является координационно-насыщенный комплекс СР6. Таким образом, использование более объемной тетразамещенной молекулы ZnTPP стерически затрудняет образование полностью координированных гибридов СР6 и делает энергетически выгодным формирование в растворе частиц СР4, содержащих меньшее число молекул порфирина.
Супрамолекулярная сборка октаэдрического кластера молибдена(II) с ZnTPP была исследована также в растворе CDCl3 при 303 K с помощью ЯМР-спектроскопии. Спектр ЯМР 1H свободного кластера PyMoC содержит характерные сигналы резонанса протонов пиридильных фрагментов в ароматической области (Hо и Hm при 8.60 и 7.75 м.д. соответственно) (рис. 3) и сигналы протонов тетрабутиламмонийных катионов Bu4N+ в алифатической области при 3.19, 1.63–1.57, 1.42–1.34 и 0.93 м.д. (рис. S1 ). Спектр ЯМР 1H ZnTPP (рис. 3) полностью соответствует описанному в литературе [46, 55]. Добавление порфирината цинка(II) к раствору PyMoC приводит к изменению спектров обоих строительных блоков. Сигналы протонов ZnTPP в ароматической области незначительно смещаются в сильное поле, наибольший сдвиг наблюдается для Hβ (Δ = 0.03 м.д., рис. 3).
Рис. 3.
Спектры ЯМР 1Н (CDCl3, 600 MГц, 303 K, ароматическая область), полученные при титровании PyMoC (5 × × 10–4 M) раствором ZnTPP (8 × 10–3 M) до достижения молярных соотношений С : Р = 1 : 2, 1 : 4, 1 : 6, 1 : 10 (на вставках показана увеличенная область 7.25–5.50 м.д.); сигнал растворителя отмечен * (CHCl3, δH = 7.26 м.д.) (а); обозначения протонов, используемые для описания спектров ЯМР 1Н кластера и порфирина (б).
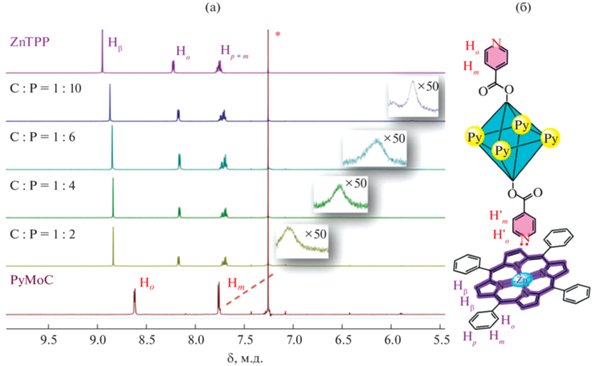
Более существенные изменения происходят в спектре PyMoC при добавлении 2 экв порфирина: сигналы протонов пиридильных фрагментов Ho и Hm уширяются настолько, что фактически не наблюдаются. Однако при масштабировании можно заметить широкие слабые сигналы в области 7.25–5.50 м.д., которые с увеличением количества добавляемого ZnTPP все больше смещаются в сильное поле. Значительное смещение в сильное поле и существенное уширение сигналов пиридильных протонов могут быть результатом экранирующего эффекта кольцевых токов координированных порфириновых макроциклов [56]. Для сигналов протонов Bu4N+ в алифатической области также наблюдается смещение в сильное поле в процессе титрования кластера порфиринатом цинка(II) (рис. S1 ). Подобный эффект, обнаруженный ранее для стерически менее затрудненных аналогов – порфиринатов цинка(II) и рутения(II) А2-типа [31, 43], отражает близкое расположение тетрабутиламмонийных катионов к периферии порфириновых макроциклов в растворе некоординирующего CDCl3. Все описанные выше наблюдения четко указывают на наличие аксиальной координации катионов Zn(II) металлоцентра порфириновых молекул к октаэдрическому кластеру молибдена, содержащему терминальные N-лиганды.
Несмотря на существование в растворе смеси разных динамических супрамолекулярных комплексов СPn (n = 1–6), кластер–порфириновые гибриды на основе порфиринатов цинка(II) относительно хорошо кристаллизуются, что позволяет подобрать условия для получения индивидуальных форм, причем как координационно-насыщенных (CP6), так и промежуточных форм, содержащих менее шести молекул порфирина.
Так, медленная диффузия н-гептана при 5°С в раствор смеси PyMoС–ZnTPP (С : Р = 1 : 7) в CH2Cl2 приводит к образованию монокристаллов, обозначенных как CP6 + 2, структура которых установлена методом РСА (рис. 4, табл. S2, S3 ). Кристаллы CP6 + 2 триклинные (пр. гр. $P\bar {1}$), параметры a = 20.503(4), b = 21.903(4), c = 26.674(5) Å, α = 102.98(3)°, β = 111.36(3)°, γ = 99.37(3)°, V = = 10468.5 Å3, Z ' = 0.5, Z = 1 определены при 100 K (табл. S1 ). Элементарная ячейка CP6 + 2 состоит из массива CP6 (рис. 4а), двух не координированных к кластеру порфиринов ZnTPP (рис. 4б), двух катионов тетра-н-бутиламмония и шестнадцати молекул хлористого метилена, из которых уточнены шесть (табл. S1 ).
Рис. 4.
Молекулярная структура комплекса CP6 + 2 по данным РСА. Атомы водорода и молекулы растворителя не показаны. Порфирины, координированные к кластеру, показаны фиолетовым (а), дополнительные два порфирина – синим (б), два катиона тетра-н-бутиламмония – оранжевым.

Уникальность этой структуры заключается в том, что несмотря на стерическую затрудненность, максимально возможное число молекул Zn(II) А4-порфирина координировано к изоникотинатным группам кластера.
Более того, еще две дополнительные молекулы порфирина находятся вблизи кластерного ядра за счет образования водородных связей между карбоксильным атомом кислорода изоникотинатных групп и протоном аксиально координированной к Zn(II) молекулы воды (O(41)⋯O(12) 2.744(5) Å, угол O(41)–H(41A)⋯O(12) 150.2°; O(41)⋯O(22) 2.743(4) Å, угол O(41)–H(41B)⋯O(22) 165.4°, рис. 4б, табл. S4 ). Структуры CP6+2, аналогичные по составу, уже были ранее представлены в нашей группе для А2-порфиринатов цинка(II) [31] и рутения(II) [43]. При этом молекулярная структура гибридного комплекса CP6 + 2 на основе Zn(II) A2-порфирина изоструктурна полученной в настоящей работе структуре CP6 + 2, содержащей тетразамещенные порфирины (табл. S1 ).
Интересно, что медленная диффузия н-гептана при 5°С в раствор смеси PyMoС–ZnTPP с соотношением компонентов С : Р = 1 : 4 в CH2Cl2 приводит к образованию монокристаллов нового строения, обозначенных как CP4 + 2, структура которых установлена методом РСА (рис. 5, табл. S6, S7 ). Полученные монокристаллы моноклинные (пр. гр. P21/c) с параметрами a = 21.347(4), b = = 25.990(5), c = 33.172(7) Å, α = 90°, β = 104.19(3)°, γ = 90°, V = 17843(7) Å3, Z ' = 0.5, Z = 2, определенными при 100 K (табл. S5 ). Гибридная структура CP4 + 2 содержит четыре Zn(II) А4-порфирина, координированных к кластерному ядру (рис. 5а). При этом в элементарную ячейку CP4 + 2 в удвоенном количестве (Z = 2) помимо массива CP4 входят две некоординированные молекулы ZnTPP (рис. 6 б), два катиона тетра-н-бутиламмония и четырнадцать молекул хлористого метилена, десять из которых уточнены (табл. S5 ). Две дополнительные молекулы порфирина, как и в описанной выше структуре CP6 + 2, находятся вблизи кластерного ядра за счет образования водородных связей между карбоксильным атомом кислорода изоникотинатных групп и протоном аксиально координированной к Zn(II) молекулы воды (O(6)⋯O(4) 2.716(8) Å, угол O(6)–H(6A)⋯O(4) 156.2°; O(6)⋯O(2) 2.810(9) Å, угол O(6)–H(6B)⋯O(2) 149.4°, рис. 5б, табл. S8 ). Получение кластер–порфириновой архитектуры CP4, хорошо коррелирует с результатами расчетов на основе данных спектрофотометрического титрования (см. выше). Однако помимо двух “экстрамолекул” ZnTPP, находящихся вблизи кластерного ядра за счет образования водородных связей, полученная структура имеет еще одну особенность. Вместо двух свободных изоникотинатных фрагментов, не участвующих в координации, обнаружены OH-группы с d(Mo(3)–O(5)) = 2.213(9) Å (рис. 5, табл. S6 ), что может свидетельствовать о прохождении частичного гидролиза и замены двух ионных карбоксилатных лигандов на гидроксильные заместители. Подобный гидролиз ранее наблюдали для октаэдрических кластеров молибдена, содержащих азидные и галогенидные внешние ионные лиганды, во влажных растворителях [57–59].
ЗАКЛЮЧЕНИЕ
Показана возможность получения супрамолекулярных гибридных комплексов на основе тетразамещенного порфирината цинка(II) и октаэдрического йодидного кластера молибдена, содержащего изоникотинатные лиганды в шести позициях в растворе и в твердом виде. Обнаружено, что использование более объемного А4-порфирина по сравнению с изученным ранее порфирином А2-типа приводит к смещению равновесия в растворе от координационно-насыщенной формы CP6 к менее стерически затрудненным CP2 и CP4. Однако в кристаллическом виде были выделены обе формы – CP4+2 и координационно-насыщенная CP6 + 2 и проведен их РСА на монокристаллах. Согласно полученным данным, помимо аксиально координированных к кластерному ядру четырех или шести Zn(II)-порфиринов, эти структуры содержат две дополнительные молекулы ZnTPP за счет образования водородных связей. Более того, в структуре CP4 + 2 наблюдается замена двух некоординированных внешних изоникотинатных лигандов на гидроксильные группы, что свидетельствует об их лабильности и возможности гидролиза в присутствии следов воды в растворителе. В дальнейшем предполагается подробное изучение фотофизических свойств полученных супрамолекулярных гибридных комплексов с целью выявления их особенностей по сравнению с индивидуальными строительными блоками.
Список литературы
Scandola F., Chiorboli C., Prodi A. et al. // Coord. Chem. Rev. 2006. V. 250. № 11–12. P. 1471. https://doi.org/10.1016/j.ccr.2006.01.019
La D.D., Ngo H.H., Nguyen D.D. et al. // Coord. Chem. Rev. 2022. V. 463. P. 214543. https://doi.org/10.1016/j.ccr.2022.214543
Pöthig A., Casini A. // Theranostics. 2019. V. 9. № 11. P. 3150. https://doi.org/10.7150/thno.31828
Baroncini M., Canton M., Casimiro L. et al. // Eur. J. Inorg. Chem. 2018. V. 2018. № 42. P. 4589. https://doi.org/10.1002/ejic.201800923
Antipin I.S., Alfimov M.V., Arslanov V.V. et al. // Russ. Chem. Rev. 2021. V. 90. № 8. P. 895. https://doi.org/10.1070/RCR5011
Агафонов М.А., Александров Е.В., Артюхова Н.А. и др. // Журн. структур. химии. 2022. Т. 63. № 5. С. 535. https://doi.org/10.26902/JSC_id93211
Drain C.M., Hupp J.T., Suslick K.S. et al. // J. Porphyr. Phthalocyanines. 2002. V. 6. № 4. P. 243. https://doi.org/10.1142/S1088424602000282
Cook L.P., Brewer G., Wong-Ng W. // Crystals. 2017. V. 7. № 7. P. 223. https://doi.org/10.3390/cryst7070223
Takagi S., Eguchi M., Tryk D. et al. // J. Photochem. Photobiol., C: Photochem. Rev. 2006. V. 7. № 2–3. P. 104. https://doi.org/10.1016/j.jphotochemrev.2006.04.002
Koifman O.I., Ageeva T.A., Beletskaya I.P. et al. // Macroheterocycles. 2020. V. 13. № 4. P. 311. https://doi.org/10.6060/mhc200814k
Yu J., Zhu S., Pang L. et al. // J. Chromatogr. A. 2018. V. 1540. P. 1. https://doi.org/10.1016/j.chroma.2018.02.006
Neamţu M., Nădejde C., Hodoroaba V.D. et al. // Appl. Catal., B: Environ. 2018. V. 232. № 2010. P. 553. https://doi.org/10.1016/j.apcatb.2018.03.079
D’Souza F., Ito O. // Coord. Chem. Rev. 2005. V. 249. № 13–14. P. 1410. https://doi.org/10.1016/j.ccr.2005.01.002
Menilli L., Monteiro A.R., Lazzarotto S. et al. // Pharmaceutics. 2021. V. 13. № 9. P. 1512. https://doi.org/10.3390/pharmaceutics13091512
Ksenofontov A.A., Bichan N.G., Khodov I.A. et al. // J. Mol. Liq. 2018. V. 269. P. 327. https://doi.org/10.1016/j.molliq.2018.08.069
Ksenofontov A.A., Lukanov M.M., Bichan N.G. et al. // Dye. Pigment. 2021. V. 185. № A. P. 108918. https://doi.org/10.1016/j.dyepig.2020.108918
Hu R., Zhai X., Ding Y. et al. // Chinese Chem. Lett. 2022. V. 33. № 5. P. 2715. https://doi.org/10.1016/j.cclet.2021.08.110
Zenkevich E., Blaudeck T., Sheinin V. et al. // J. Mol. Struct. 2021. V. 1244. P. 131239. https://doi.org/10.1016/j.molstruc.2021.131239
Mandal H., Chakali M., Venkatesan M. et al. // J. Phys. Chem. C. 2021. V. 125. № 8. P. 4750. https://doi.org/10.1021/acs.jpcc.0c08229
Zhou Y., Lu Q., Liu Q. et al. // Adv. Funct. Mater. 2022. V. 32. № 15. P. 2112159. https://doi.org/10.1002/adfm.202112159
Lamare R., Ruppert R., Boudon C. et al. // Chem. A. Eur. J. 2021. V. 27. № 65. P. 16071. https://doi.org/10.1002/chem.202102277
Yang Y., Tao F., Zhang L. et al. // Chinese Chem. Lett. 2022. V. 33. № 5. P. 2625. https://doi.org/10.1016/j.cclet.2021.09.093
Wang C., Cai M., Liu Y. et al. // J. Colloid Interface Sci. 2022. V. 605. P. 727. https://doi.org/10.1016/j.jcis.2021.07.137
Yao B.-J., Zhang X.-M., Li F. et al. // ACS Appl. Nano Mater. 2020. V. 3. № 10. P. 10360. https://doi.org/10.1021/acsanm.0c02276
Hajian R., Bahrami E. // Catal. Letters. 2022. V. 152. № 8. P. 2445. https://doi.org/10.1007/s10562-021-03827-x
Zhu Y., Huang Y., Li Q. et al. // Inorg. Chem. 2020. V. 59. № 4. P. 2575. https://doi.org/10.1021/acs.inorgchem.9b03540
Shehzad F.K., Zhou Y., Zhang L. et al. // J. Phys. Chem. C. 2018. V. 122. № 2. P. 1280. https://doi.org/10.1021/acs.jpcc.7b11244
Xu J., Xue L.-J., Hou J.-L. et al. // Inorg. Chem. 2017. V. 56. № 14. P. 8036. https://doi.org/10.1021/acs.inorgchem.7b00775
Allain C., Favette S., Chamoreau L. et al. // Eur. J. Inorg. Chem. 2008. V. 2008. № 22. P. 3433. https://doi.org/10.1002/ejic.200701331
Chandra B.K.C., D’Souza F. // Coord. Chem. Rev. 2016. V. 322. P. 104. https://doi.org/10.1016/j.ccr.2016.05.012
Volostnykh M.V., Mikhaylov M.A., Sinelshchikova A.A. et al. // Dalton Trans. 2019. V. 48. № 5. P. 1835. https://doi.org/10.1039/c8dt04452j
Mikhailov M.A., Brylev K.A., Abramov P.A. et al. // Inorg. Chem. 2016. V. 55. № 17. P. 8437. https://doi.org/10.1021/acs.inorgchem.6b01042
Fujii S., Tanioka E., Sasaki K. et al. // Eur. J. Inorg. Chem. 2020. V. 2020. № 31. P. 2983. https://doi.org/10.1002/ejic.202000440
Puche M., García-Aboal R., Mikhaylov M.A. et al. // Nanomaterials. 2020. V. 10. № 7. P. 1. https://doi.org/10.3390/nano10071259
López-López N., Muñoz Resta I., De Llanos R. et al. // ACS Biomater. Sci. Eng. 2020. V. 6. № 12. P. 6995. https://doi.org/10.1021/acsbiomaterials.0c00992
Mikhaylov M.A., Berezin A.S., Sukhikh T.S. et al. // J. Struct. Chem. 2022. V. 63. № 12. P. 2101. https://doi.org/10.1134/S0022476622120216
Mikhailov M.A., Berezin A.S., Sukhikh T.S. et al. // J. Struct. Chem. 2021. V. 62. № 12. P. 1896. https://doi.org/10.1134/S002247662112009X
Mikhailov M.A., Brylev K.A., Virovets A.V. et al. // New J. Chem. 2016. V. 40. № 2. P. 1162. https://doi.org/10.1039/C5NJ02246K
Fabrizi de Biani F., Grigiotti E., Laschi F. et al. // Inorg. Chem. 2008. V. 47. № 12. P. 5425. https://doi.org/10.1021/ic7018428
Satake A., Kobuke Y. // Tetrahedron. 2005. V. 61. № 1. P. 13. https://doi.org/10.1016/j.tet.2004.10.073
Chichak K., Walsh M.C., Branda N.R. // Chem. Commun. 2000. № 10. P. 847. https://doi.org/10.1039/b001259i
Gorbunova Y.G., Enakieva Y.Y., Sakharov S.G. et al. // J. Porphyr. Phthalocyanines. 2003. V. 7. № 12. P. 795. https://doi.org/10.1142/S1088424603000987
Volostnykh M.V., Kirakosyan G.A., Sinelshchikova A.A. et al. // Dalton Trans. 2023. V. 52. № 16. P. 5354. https://doi.org/10.1039/D3DT00251A
Armarego W.L.F., Chai C.L.L. // Purification of Organic Chemicals, in: Purif. Lab. Chem. Elsevier, 2009. P. 88. https://doi.org/10.1016/B978-1-85617-567-8.50012-3
Kieboom A.P.G. // Recl. des Trav. Chim. des Pays-Bas. 2010. V. 107. № 12. P. 685. https://doi.org/10.1002/recl.19881071209
Lindsey J.S., Schreiman I.C., Hsu H.C. et al. // J. Org. Chem. 1987. V. 52. № 5. P. 827. https://doi.org/10.1021/jo00381a022
Renny J.S., Tomasevich L.L., Tallmadge E.H. et al. // Angew. Chem. Int. Ed. 2013. V. 52. № 46. P. 11998. https://doi.org/10.1002/anie.201304157
Lazarenko V., Dorovatovskii P., Zubavichus Y. et al. // Crystals. 2017. V. 7. № 11. P. 325. https://doi.org/10.3390/cryst7110325
Svetogorov R.D., Dorovatovskii P.V., Lazarenko V.A. // Cryst. Res. Technol. 2020. V. 55. № 5. P. 1. https://doi.org/10.1002/crat.201900184
Kabsch W. // Acta Crystallogr., Sect. D: Biol. Crystallogr. 2010. V. 66. № 2. P. 125. https://doi.org/10.1107/S0907444909047337
Evans P. // Acta Crystallogr., Sect. D: Biol. Crystallogr. 2006. V. 62. № 1. P. 72. https://doi.org/10.1107/S0907444905036693
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. № 2. P. 339. https://doi.org/10.1107/S0021889808042726
Sheldrick G.M. // Acta Crystallogr., Sect. A: Found. Adv. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Crystallogr., Sect. C: Struct. Chem. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Wang F., Xu L., Nawaz M.H. et al. // RSC Adv. 2014. V. 4. № 106. P. 61378. https://doi.org/10.1039/C4RA10087E
Iwamoto H., Hori K., Fukazawa Y. // Tetrahedron Lett. 2005. V. 46. № 5. P. 731. https://doi.org/10.1016/j.tetlet.2004.12.028
Harada K., Nguyen T.K.N., Grasset F. et al. // NPG Asia Mater. 2022. V. 14. № 1. P. 21. https://doi.org/10.1038/s41427-022-00366-8
Mikhaylov M.A., Abramov P.A., Komarov V.Y. et al. // Polyhedron. 2017. V. 122. P. 241. https://doi.org/10.1016/j.poly.2016.11.011
Vorotnikov Y.A., Efremova O.A., Novozhilov I.N. et al. // J. Mol. Struct. 2017. V. 1134. № 2017. P. 237. https://doi.org/10.1016/j.molstruc.2016.12.052
Tat F.T., Zhou Z., MacMahon S. et al. // J. Org. Chem. 2004. V. 69. № 14. P. 4602. https://doi.org/10.1021/jo049671w
Дополнительные материалы
- скачать ESM.zip
- Приложение 1.
1. ЯМР спектроскопия S2
2. Рентгеноструктурный анализ S2
2.1. РСА супрамолекулярного комплекса CP6+2 S2
2.2. РСА супрамолекулярного комплекса CP4+2 S14
Инструменты
Журнал неорганической химии




