Журнал неорганической химии, 2023, T. 68, № 9, стр. 1202-1210
Синтез, строение, оптические и электрохимические свойства бис-циклометаллированных комплексов иридия(III) с N-бензилбензимидазолами
Д. Е. Смирнов a, С. В. Татарин a, М. А. Киселева a, b, И. В. Тайдаков c, d, М. Т. Метлин c, С. И. Беззубов a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва,
Ленинский пр-т, 31, Россия
b Московский государственный университет им. М.В. Ломоносова,
Химический факультет
119991 Москва, Ленинские горы, 1, Россия
c Физический институт им. П.Н. Лебедева РАН
119991 Москва, Ленинский пр-т, 53, Россия
d Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский пр-т, 47, Россия
* E-mail: bezzubov@igic.ras.ru
Поступила в редакцию 30.04.2023
После доработки 03.06.2023
Принята к публикации 06.06.2023
- EDN: YFVIQG
- DOI: 10.31857/S0044457X23601049
Аннотация
Получена серия бис-циклометаллированных комплексов иридия(III) с различными 2-арил-1-бензилбензимидазолами (арил = 4-хлорфенил, 4-трет-бутилфенил, 3,4-диметоксифенил) и 4,4'-дикарбокси-2,2'-бипиридином. Синтезированные комплексы изучены методами спектроскопии ЯМР 1H, масс-спектрометрии высокого разрешения, рентгеноструктурного анализа, спектрофотометрии, люминесцентной спектроскопии и циклической вольтамперометрии. В электронных спектрах комплексов полосы поглощения претерпевают заметный батохромный сдвиг при увеличении электронодонорных свойств бензимидазольного лиганда. В растворе комплексы обладают фотолюминесценцией в желто-красной области спектра с квантовым выходом в интервале 0.4–7.7% и временем жизни возбужденного состояния в диапазоне 71–408 нс. По данным циклической вольтамперометрии, в растворах изученных комплексов наблюдаются квазиобратимые редокс-переходы (Eox = 1.16–1.57 В отн. СВЭ, ацетонитрил).
ВВЕДЕНИЕ
Высокая устойчивость октаэдрических циклометаллированных комплексов иридия(III) и их уникальные оптические свойства, которые можно изменять в широких пределах путем варьирования лигандов, обеспечивают большой интерес исследователей к таким соединениям [1]. Яркая люминесценция, тонко “настраиваемое” время жизни триплетного возбужденного состояния и высокие молярные коэффициенты поглощения определяют применение комплексов иридия(III) в фосфоресцентных светоизлучающих диодах [2–4] и (фото)катализаторах [5, 6] и делают их перспективными агентами для биологического применения и сенсорики [7–10] и интересными в качестве сенсибилизирующих красителей [11–17]. Обычно для подобных задач комплексы конструируют, комбинируя вокруг иона металла три или два циклометаллированных лиганда. Во втором случае координационное окружение иона иридия(III), находящегося в бис-циклометаллированном фрагменте, дополняют до октаэдрического за счет одного бидентатного или двух монодентатных вспомогательных лигандов [1].
С технологической точки зрения удобно создавать комплексы иридия(III) под конкретное практическое применение на базе одного класса лигандов, изменяя лишь заместители и/или размер сопряженной π-системы. Анализ литературных данных показывает, что 2-арилбензимидазолы, получаемые в одну–две стадии из простых и доступных реагентов, допускают широкое варьирование электронных свойств заместителей и протяженности π-системы [18–27], чем выгодно отличаются от прочих потенциальных кандидатов для циклометаллирования. В частности, изучено много бис-циклометаллированных комплексов иридия(III) с различными 2-арилбензимидазолами, на основе этого установлен ряд корреляций структура–свойство и направленно синтезированы комплексы, показавшие достаточно эффективное преобразование электричества в свет и наоборот в соответствующих устройствах [28–33]. Тем не менее существуют проблемы дизайна и синтеза иридиевых эмиттеров для диодов, излучающих в синем и ближнем ИК-диапазоне спектра [34–37], а также при конструировании сенсибилизирующих красителей, интенсивно поглощающих свет при длинах волн >500 нм [38–40]. Для их решения требуются дальнейшие фундаментальные исследования влияния строения лигандов на свойства иридиевых комплексов.
В связи с этим в данной работе получены 2-арил-1-бензилбензимидазолы и новые бис-циклометаллированные комплексы иридия(III) на их основе со вспомогательным лигандом 4,4′-дикарбокси-2,2'-бипиридином. Последний выбран из-за своей способности обеспечивать связь с поверхностью оксидных полупроводников, что важно для эффективной работы сенсибилизирующего красителя [13]. Изучена зависимость оптических и окислительно-восстановительных свойств комплексов от заместителей в арильном фрагменте лигандов, а также влияние N-бензильного заместителя по результатам сравнения свойств новых комплексов и полученных ранее соединений на основе N-фенилбензимидазолов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали коммерчески доступные реагенты марки “х. ч.” и выше, которые дополнительно не очищали. Растворители перегоняли и высушивали согласно стандартным методикам. 4,4'-Дикарбокси-2,2'-бипиридин (H2dcbpy) получали по методике [41]. Синтез проводили в атмосфере аргона. Очистку веществ и другие манипуляции выполняли на воздухе.
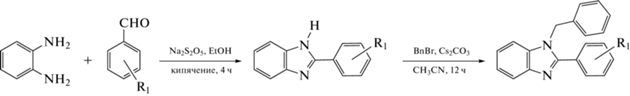
Синтез лигандов и комплексов. Бензимидазолы L1–L4 получали по однотипной двухстадийной схеме (схема 1 ). К раствору соответствующего альдегида (5 ммоль) в 20 мл этилового спирта прибавляли насыщенный водный раствор Na2S2O5 (0.95 г, 5 ммоль). К полученной суспензии спустя 10 мин добавляли 1,2-диаминобензол (0.54 г, 5 ммоль) и реакционную смесь кипятили в течение 5 ч. Полученный раствор отфильтровывали через бумажный фильтр и удаляли растворитель при пониженном давлении. Полученный осадок промывали водой, хлористым метиленом и высушивали при пониженном давлении и 50°С. Твердое вещество суспендировали в 20 мл ацетонитрила, добавляли 1.5 эквивалента Cs2CO3 и 1.05 эквивалента бензилбромида. Реакционную смесь перемешивали при комнатной температуре в течение 8 ч, затем упаривали досуха, добавляли 50 мл хлористого метилена и 50 мл насыщенного раствора NaHCO3. Органический слой отделяли, а водный слой 2 раза промывали CH2Cl2 (по 50 мл). Органические фракции объединяли и упаривали досуха. Далее полученное вещество перекристаллизовывали из смеси EtOH/CH2Cl2, отфильтровывали, промывали ледяным спиртом и высушивали при пониженном давлении и 50°С.
Схема 1 . Синтез 2-арил-1-бензилбензимидазолов L1–L4 (арил = 4-фенил (L1, 52%), 4-хлорфенил (L2, 82%), 4-трет-бутилфенил (L3, 63%), 3,4-диметоксифенил (L4, 78%)).
1-Бензил-2-фенилбензимидазол (L1) представляет собой бледно-желтый порошок, выход составляет 52%.
Спектр ЯМР 1H (CDCl3), δ, м.д.: 5.46 (с, 2H), 7.08–7.15 (м, 2H), 7.18–7.28 (м, 2H), 7.28–7.38 (м, 4H), 7.41–7.53 (м, 3H), 7.67–7.75 (м, 2H), 7.90 (д, J = 8.0 Гц, 1H). Спектр ЯМР 13C{1H} (CDCl3), δ, м.д.: 47.96, 110.15, 119.59, 122.28, 122.65, 125.56, 127.38, 128.37, 128.67, 128.86, 129.52, 129.68, 135.67, 136.00, 142.79, 153.77.
1-Бензил-2-(4-хлорфенил)бензимидазол (L2), бежевые кристаллы, выход 82%.
Спектр ЯМР 1H (CDCl3), δ, м.д.: 5.43 (с, 2H), 7.06–7.12 (м, 2H), 7.19–7.28 (м, 2H), 7.29–7.38 (м, 4H), 7.39–7.46 (м, 2H), 7.59–7.67 (м, 2H), 7.85–7.92 (м, 1H). Спектр ЯМР 13C{1H} (CDCl3), δ, м.д.: 47.94, 110.12, 119.65, 122.48, 122.92, 125.45, 127.52, 128.13, 128.67, 128.76, 130.11, 135.76, 135.78, 142.69, 152.55.
1-Бензил-2-(4-трет-бутилфенил)бензимидазол (L3), белый порошок, выход 63%.
Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.35 (с, 9H), 5.48 (с, 2H), 7.10–7.16 (м, 2H), 7.16–7.26 (м, 2H), 7.28–7.39 (м, 4H), 7.44–7.51 (м, 2H), 7.62–7.70 (м, 2H), 7.90 (d, J = 8.0 Гц, 1H). Спектр ЯМР 13C{1H} (CDCl3), δ, м.д.: 30.81, 34.46, 48.01, 110.10, 119.41, 122.26, 122.53, 125.37, 125.53, 126.51, 127.34, 128.55, 128.67, 135.63, 136.07, 142.63, 152.86, 153.83.
1-Бензил-2-(3,4-диметоксифенил)бензимидазол (L4), бесцветные кристаллы, выход 78%.
Спектр ЯМР 1H (CDCl3), δ, м.д.: 3.71 (с, 3H), 3.90 (с, 3H), 5.45 (с, 2H), 6.86–6.93 (м, 1H), 7.09–7.16 (м, 2H), 7.18–7.25 (м, 4H), 7.27–7.37 (м, 4H), 7.84–7.91 (м, 1H). Спектр ЯМР 13C{1H} (CDCl3), δ, м.д.: 47.99, 55.31, 55.54, 109.86, 110.54, 111.78, 119.26, 121.45, 121.84, 122.35, 122.58, 125.38, 127.35, 128.72, 135.81, 136.22, 142.38, 148.59, 150.05, 153.67.
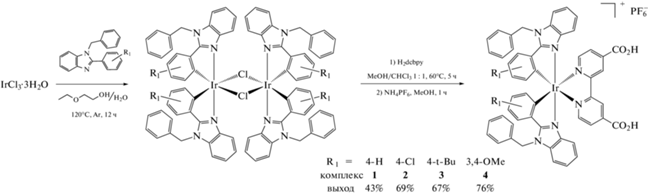
Комплексы 1–4 получали одинаково по следующей методике. На первой стадии 50 мг (0.142 ммоль) гидрата трихлорида иридия и 0.355 ммоль соответствующего лиганда суспендировали в смеси 2-этоксиэтанола (10 мл) и воды (3 мл). Реакционную смесь кипятили в течение 12 ч в атмосфере аргона (схема 2 ). Выделившийся осадок отфильтровывали, промывали эфиром и высушивали при пониженном давлении и 50°С. Продукты обладали крайне низкой растворимостью в большинстве доступных растворителей, поэтому их не исследовали и использовали далее без дополнительной очистки. На второй стадии 0.04 ммоль полученного димера смешивали с 22 мг (0.09 ммоль) 4,4'-дикарбокси-2,2'-бипиридина в смеси метанол/хлороформ (1 : 1 по объему) и кипятили в атмосфере аргона в течение 5 ч. К полученному раствору добавляли 33 мг (0.2 ммоль) NH4PF6 и растворитель удаляли. Осадок перекристаллизовывали из смеси хлористого метилена и гексана, отфильтровывали, промывали водой и высушивали в вакууме при 50°С.
Схема 2 . Синтез комплексов 1–4 состава [Ir(L)2(H2dcbpy)](PF6).
[Ir(L1)2(H2dcbpy)][PF6] (1), вещество подвергали дополнительной очистке колоночной хроматографией (SiO2, CH2Cl2 → MeOH), оранжевый порошок, выход 43%.
Спектр ЯМР 1H (400 MГц, CD3OD, 25°C), δ, м.д.: 5.89 (д, J = 8.2 Гц, 1H), 6.00–6.23 (м, 2H), 6.41 (д, J = 7.6 Гц, 1H), 6.81 (т, J = 7.5 Гц, 1H), 6.92–7.00 (м, 2H), 7.11 (д, J = 6.5 Гц, 2H), 7.26–7.36 (м, 4H), 7.61 (д, J = 8.3 Гц, 1H), 7.80 (д, J = 7.8 Гц, 1H), 8.11 (дд, J = 5.6, 1.5 Гц, 1H), 8.39 (д, J = 5.7 Гц, 1H), 9.19 (д, J = 0.8 Гц, 1H). Масс-спектр высокого разрешения (ESI) m/z: [M]+. Для ${{{\text{C}}}_{{{\text{52}}}}}{{{\text{H}}}_{{{\text{38}}}}}{\text{Ir}}{{{\text{N}}}_{{\text{6}}}}{\text{O}}_{4}^{ + }$ вычислено, %: 1003.2588. Найдено, %: 1003.2585.
[Ir(L2)2(H2dcbpy)][PF6] (2), оранжевый порошок, выход 69%.
Спектр ЯМР 1H (400 MГц, CD3OD, 25°C), δ, м.д.: 5.87 (д, J = 8.3 Гц, 1H), 6.05–6.20 (м, 2H), 6.31 (д, J = 2.1 Гц, 1H), 6.98–7.06 (м, 2H), 7.08 (д, J = 7.0 Гц, 2H), 7.28–7.38 (м, 4H), 7.64 (д, J = 8.3 Гц, 1H), 7.76 (д, J = 8.6 Гц, 1H), 8.16 (дд, J = 5.6, 1.5 Гц, 1H), 8.44 (д, J = 5.7 Гц, 1H), 9.22 (д, J = 0.9 Гц, 1H). Масс-спектр высокого разрешения (ESI) m/z: [M]+. Для ${{{\text{C}}}_{{{\text{56}}}}}{{{\text{H}}}_{{{\text{46}}}}}{\text{Ir}}{{{\text{N}}}_{{\text{6}}}}{\text{O}}_{8}^{ + }$ вычислено, %: 1123.3006. Найдено, %: 1123.3003.
[Ir(L3)2(H2dcbpy)][PF6] (3), темно-красный порошок, выход 67%.
Спектр ЯМР 1H (400 MГц, (CD3)2SO, 25°C), δ, м.д.: 0.84 (с, 9H), 5.80 (д, J = 8.2 Гц, 1H), 5.98–6.21 (м, 2H), 6.35 (д, J = 1.9 Гц, 1H), 6.93–7.01 (м, 2H), 7.14–7.19 (м, 2H), 7.22–7.30 (м, 4H), 7.70 (д, J = 8.4 Гц, 1H), 7.77 (д, J = 8.3 Гц, 1H), 7.99–8.14 (м, 2H), 9.17 (с, 1H). Масс-спектр высокого разрешения (ESI) m/z: [M]+. Для ${{{\text{C}}}_{{{\text{60}}}}}{{{\text{H}}}_{{{\text{54}}}}}{\text{Ir}}{{{\text{N}}}_{{\text{6}}}}{\text{O}}_{4}^{ + }$ вычислено, %: 1115.3836. Найдено, %: 1115.3832.
[Ir(L4)2(H2dcbpy)][PF6] (4), коричневый порошок, выход 76%.
Спектр ЯМР 1H (400 MГц, (CD3)2SO, 25°C), δ, м.д.: 3.08 (с, 3H), 3.53 (с, 3H), 5.73 (с, 1H), 5.76 (д, J = 8.4 Гц, 1H), 6.03–6.24 (м, 2H), 6.97 (т, J = = 7.8 Гц, 1H), 7.10–7.14 (м, 2H), 7.19–7.24 (м, 2H), 7.27–7.33 (м, 3H), 7.81 (д, J = 8.5 Гц, 1H), 7.93 (д, J = 5.9 Гц, 1H), 8.04 (д, J = 5.4 Гц, 1H), 8.83 (с, 1H).
Масс-спектр высокого разрешения (ESI) m/z: [M]+. Для ${{{\text{C}}}_{{{\text{52}}}}}{{{\text{H}}}_{{{\text{36}}}}}{\text{Ir}}{{{\text{N}}}_{{\text{6}}}}{{{\text{O}}}_{{\text{4}}}}{\text{Cl}}_{2}^{ + }{\text{,}}$ вычислено %: 1071.1788. Найдено, %: 1071.1791.
Спектры ЯМР 1H и 13С регистрировали при 25°С на спектрометре Bruker Avance 400, химсдвиги приведены в миллионных долях (м.д.) относительно сигналов остатков растворителя. Масс-спектры высокого разрешения измеряли на масс-спектрометре BrukermicroTOF-QTM ESI-TOF (электроспрей ионизация/времяпролетный детектор). Электронные спектры поглощения растворов комплексов измеряли на спектрофотометре СФ-2000 в кварцевых кюветах (1 см) при комнатной температуре. Для регистрации спектров фотолюминесценции использовали спектрофлуориметр Horiba Jobin-Yvon Fluorolog QM-75-22-C с установленным ФЭУ-детектором Hamamatsu R13456 (200–950 нм). В качестве источника возбуждения применяли ксеноновую дуговую лампу ArcTune мощностью 75 Вт. Кинетику люминесценции регистрировали на том же приборе с использованием субнаносекундных импульсных диодных источников DeltaLed (Horiba). Квантовый выход измеряли абсолютным методом с помощью интегрирующей сферы G8 (GMP S.a.). Циклические вольтамперограммы снимали на полярографе Экотест-ВА в трехэлектродной ячейке с углеситалловым рабочим электродом, платиновым вспомогательным электродом и стандартным хлорсеребряным электродом сравнения. Комплексы растворяли в 0.1 M растворе (н-Bu4N)ClO4 в ацетонитриле, насыщенном аргоном. Измерения проводили при развертке потенциала 100 мВ/с, ферроцен использовали в качестве внешнего стандарта. В переменнотоковом режиме задавали модуляцию с амплитудой 30 мВ и частотой 20 Гц.
Кристаллы лиганда L4 и комплексов 2–4 получены медленным упариванием растворов в смеси хлористого метилена и этанола, структура комплекса 1 получена ранее [42]. Рентгеноструктурные исследования выполнены на автоматическом дифрактометре Bruker D8 Venture при 150 K с использованием MoKα-излучения (λ = 0.71073 Å, графитовый монохроматор). Учет поглощения введен по измерениям интенсивности эквивалентных отражений [43]. Структуры расшифрованы прямым методом и уточнены полноматричным анизотропным МНК по F2 для всех неводородных атомов [44, 45]. Атомы водорода помещены в рассчитанные позиции и уточнены с использованием модели “наездника”. В структуре 2 две сильно неупорядоченные молекулы этанола не уточняли и для удаления соответствующей электронной плотности использовали процедуру SQUEEZE [46], входящую в пакет Olex2 [47]. Кристаллографические данные, детали эксперимента и уточнения структур приведены в табл. S1 . Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных: CCDC 2259779–2259782 (лиганд L4, комплексы 2–4) (http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез и строение лигандов и комплексов
Лиганды L1–L4 получены в две стадии конденсацией орто-фенилендиамина с ароматическими альдегидами [22, 26, 48] с последующим N-алкилированием N–H бензимидазолов бензилбромидом в присутствии карбоната цезия (схема 1 ) и исследованы методом спектроскопии ЯМР 1H и 13С (рис. S1–S8 ). Строение L4 подтверждено методом рентгеноструктурного анализа монокристалла (рис. S17 ).
Целевые комплексы 1–4 синтезированы в три стадии посредством циклометаллирования трихлоридом иридия бензимидазолов L1–L4 (с образованием димерных бис-циклометаллированных хлоридных комплексов), расщепления димеров под действием H2dcbpy и обмена хлорид-аниона на электрохимически инертный ${\text{PF}}_{6}^{ - }$ действием избытка NH4PF6 (схема 2 ). Соединения 1–4 охарактеризованы данными 1H ЯМР-спектроскопии (рис. S9–S12 ), масс-спектрометрии высокого разрешения (рис. S13–S16 ) и РСА.
В спектрах ЯМР 1H три наиболее слабопольных сигнала соответствуют протонам 4,4'-дикарбокси-2,2'-бипиридина [22, 26, 31], а остальные сигналы относятся к протонам циклометаллированных лигандов. Заслуживают внимания бензильные протоны N-CH2-Ph, которые в спектрах свободных некоординированных лигандов проявляются в виде синглета, а в спектрах комплексов 1–4 становятся диастереотопными, давая характерный мультиплет в области 6.00–6.20 м.д.
В масс-спектрах комплексов 1–4 можно выделить сигналы, соответствующие целым положительно заряженным комплексам, с изотопным распределением, совпадающим с теоретически предсказанным, а также ряд сигналов частиц, образованных при отщеплении H2dcbpy ([Ir(L)2]+) и координации к циклометаллированному фрагменту молекулы ацетонитрила ([Ir(L)2(CH3CN)]+). Подобное поведение при ионизации многократно наблюдали ранее для сходных бис-циклометаллированных комплексов иридия(III) [23, 25, 32, 33], что является следствием меньшей прочности связей металла со вспомогательным лигандом по сравнению со связями иридия с циклометаллированными лигандами.
В зависимости от степени протонирования дикарбоксибипиридина комплексы с ним могут иметь следующий состав: [Ir(L)2(H2dcbpy)](PF6) с полностью протонированными карбоксильными группами, [Ir(L)2(H1.5dcbpy)](PF6)0.5 с одной полностью, а другой наполовину протонированной карбоксильными группами и в виде цвиттер-иона [Ir(L)2(Hdcbpy)] с одной протонированной и одной депротонированной карбоксильными группами. В нашем случае комплексы 2 и 3 кристаллизовались по второму типу с половинными анионами, а комплекс 4 – в форме цвиттер-иона, этим он оказался схож с комплексом 1, структура которого была изучена ранее [42].
Вне зависимости от заряда комплекса центральный ион расположен в искаженном октаэдрическом окружении, образованном парами атомов углерода и азота циклометаллированных бензимидазолов и двумя атомами азота дикарбоксибипиридина (рис. 1). Длины связей Ir–C и Ir–N(L) одинаковые в пределах погрешности (рис. S18 ) и не демонстрируют значимых изменений при вариации лигандов в ряду L1–L4, тогда как расстояния Ir–N(dcbpy) существенно больше из-за трансвлияния более прочных связей иридий–углерод [1, 22, 31].
Рис. 1.
Молекулярные структуры комплексов 2 (а), 3 (б) и 4 (в). Эллипсоиды тепловых колебаний приведены с 50%-ной вероятностью. Атомы водорода, за исключением принадлежащих карбоксильным группам, не приведены для ясности.
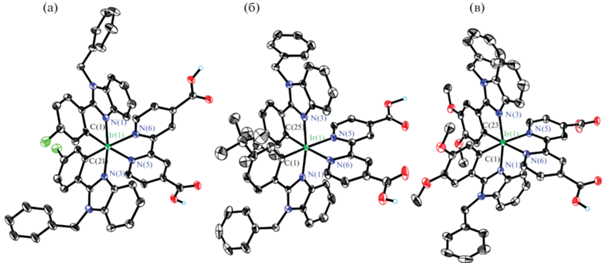
Кристаллы 2 и 3 устроены сходным образом: посредством водородных связей комплексы образуют центросимметричные димеры, которые объединены в цепи также за счет H-связей между карбоксильными группами (рис. S19, S20 ). 3D-упаковка формируется при участии многочисленных C−H···π-контактов. В кристалле комплекса 4 (рис. S21 ) Н-связанные центросимметричные димеры образуют цепи при помощи сольватированных молекул воды, тогда как в остальном упаковки всех четырех кристаллов похожи (включая ранее описанный комплекс 1 [42]).
Оптические и электрохимические свойства
Ввиду существования нескольких кислотно-основных форм комплексов 1–4, которые могут иметь сильно различающиеся свойства, измерения оптических характеристик комплексов проводили в растворах, подкисленных трифторметансульфоновой кислотой, чтобы зафиксировать кислотную форму с дважды протонированным дикарбоксибипиридином.
Электронные спектры поглощения комплексов имеют характерный для такого рода соединений вид [1, 22]; в них присутствует ряд перекрывающихся полос с максимумами в области 250–500 нм и молярными коэффициентами поглощения в интервале 1000–40 000 М–1 см–1 (рис. 2, табл. 1). Поглощение в диапазоне 250–350 нм вызвано электронными переходами, локализованными на лигандах, тогда как более длинноволновые полосы отвечают переносу заряда с металла на лиганды и между лигандами [22, 31]. Усиление электронодонорных свойств заместителей металлированного кольца мало сказывается на внутрилигандных электронных переходах, однако оно, по-видимому, приводит к повышению вероятности переходов с переносом заряда, что отражается в заметном увеличении светопоглощения в диапазоне 350–450 нм. В целом, электронные спектры комплексов 1–4 похожи на спектры аналогичных комплексов с N-фенилбензимидазолами, что, согласно [22, 31], свидетельствует о незначительном влиянии заместителя у атома азота на светопоглощение комплексов иридия(III).
Рис. 2.
Электронные спектры поглощения комплексов 1–4, измеренные в 0.01 М растворе трифторметансульфоной кислоты в смеси этанола и хлористого метилена (1 : 1) при 25°С.
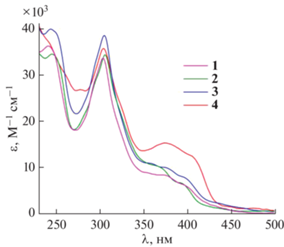
Таблица 1.
Оптические и электрохимические характеристики комплексов 1–4
| Комплекс | E1/2 (ΔEп, мВ), В | λпогл, нм (ε × 10–3, М–1 см–1) | λлюм, нм (кв. вых., %; τ, нс) |
|---|---|---|---|
| 1 | 1.27 * | 242 (36), 304 (34), 357 (9), 375 (9), 400 (6) | 645 (3.8; 105) |
| 2 | 1.16 (65) | 246 (35), 306 (34), 365 (11), 392 (7) | 611 (7.7; 307) |
| 3 | 1.17 (110), 1.56 (15) | 244 (40), 306 (39), 359 (11), 375 (10), 397 (8) | 660 (6.9; 71) |
| 4 | 1.20 (30), 1.58 (15) | 242 (37), 278 (27), 305 (36), 375 (15), 405 (13) | 433, 606 (0.4; 80/408), 775 |
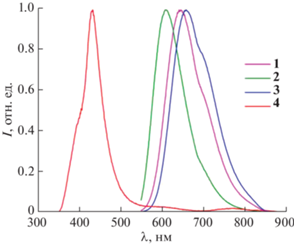
Люминесцентные спектры растворов комплексов регистрировали в дегазированной смеси растворителей. Комплексы 1–3 испускают в желто-оранжевой области спектра с квантовым выходом 3.8–7.7% и моноэкспоненциальной кинетикой затухания люминесценции (рис. 3, S22, табл. 1). Уменьшение времени жизни возбужденного состояния в ряду соединений 2–1–3 находится в согласии с увеличением электронодонорной активности лигандов и, как следствие, повышением доли орбиталей металла в триплетном излучательном состоянии комплексов [32]. Соединение 4 с наиболее электронодонорным бензимидазолом L4 демонстрирует три полосы испускания при возбуждении излучением с длиной волны 360 нм. Наиболее интенсивная из них, по всей вероятности, отвечает чисто лигандной люминесценции, тогда как оставшиеся слабые полосы возникают благодаря переходам с триплетных уровней, скорее всего, имеющих более существенный вклад орбиталей металла [22]. Испускание комплекса 4 при 600 нм, где, очевидно, есть наложение хвоста более высокоэнергетической полосы, затухает по биэкспоненциальному закону с временем жизни 80 и 408 нс, где последнее, по всей видимости, отвечает люминесценции лиганда при λмакс = 433 нм.
Рис. 3.
Спектры люминесценции комплексов 1–4, измеренные в 0.01 М дегазированном растворе трифторметансульфоной кислоты в смеси этанола и хлористого метилена (1 : 1) при 25°С. Длина волны возбуждения λвозб = 365 нм.
Исследование комплексов 1–4 с помощью циклической вольтамперометрии в постоянно-токовом (рис. 4, табл. 1) и переменно-токовом (рис. 5, табл. 1) режимах показало, что в области положительных потенциалов комплекс 2 участвует в одном квазиобратимом одноэлектронном процессе, а комплексы 3 и 4 – в двух, причем потенциалы соответствующих редокс-процессов мало зависят от природы лигандов. Комплекс 1 претерпевает необратимое окисление, что видно по одному пику окисления и двум пикам восстановления на его переменно-токовой вольтамперограмме.
Рис. 4.
Циклические вольтамперограммы комплексов 1–4, измеренные в 0.1 M растворе (н-Bu4N)PF6 в ацетонитриле, насыщенном аргоном. Развертка потенциала 100 мВ/с, ферроцен использовали в качестве внешнего стандарта.
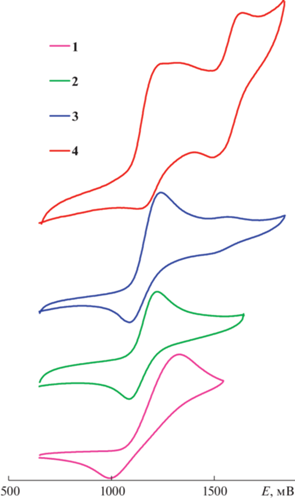
Рис. 5.
Циклические вольтамперограммы комплексов 1–4, измеренные в 0.1 M растворе (н-Bu4N)PF6 в ацетонитриле, насыщенном аргоном, измеренные с модуляцией с амплитудой 30 мВ и частотой 20 Гц. Развертка потенциала 100 мВ/с, ферроцен использовали в качестве внешнего стандарта.
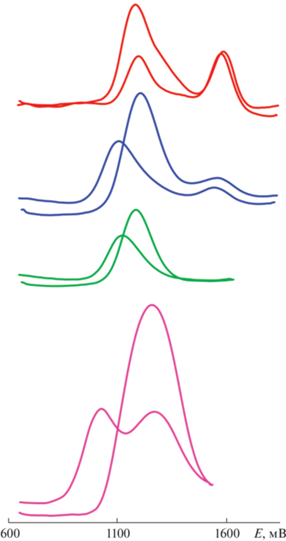
Измеренные редокс-характеристики комплексов 1–4 не согласуются с полученными ранее для аналогичных комплексов с N-фенилбензимидазолами [22]. Возможная причина заключается в том, что высшие занятые молекулярные орбитали (ВЗМО) комплексов 1–4 содержат значительно меньший вклад орбиталей циклометаллированных лигандов, чем их аналоги.
ЗАКЛЮЧЕНИЕ
Циклометаллирование 2-арил-1-бензилбензимидазолов с последующим введением вспомогательного 4,4'-дикарбокси-2,2'-бипиридина приводит к ряду новых комплексов иридия(III), демонстрирующих в кристаллическом состоянии зависимость характера водородных связей от степени протонирования вспомогательного лиганда. В подкисленных растворах цвет комплексов меняется от оранжевого до красного при усилении электронодонорных свойств заместителей в циклометаллированных лигандах. В спектрах испускания растворов комплексов наблюдается схожая зависимость, однако для комплекса с наиболее электронодонорным лигандом зафиксировано несколько полос испускания, причем квантовый выход фотолюминесценции полосы при 600 нм на порядок ниже, чем у остальных комплексов, по-видимому, за счет внутрилигандных безызлучательных переходов. В отличие от структурно близких комплексов иридия(III) с N-фенилбензимидазолами и тем же вспомогательным лигандом, полученные в работе соединения показывают квази- или необратимое редокс-поведение и незначительное изменение редокс-потенциалов при варьировании заместителей, что может свидетельствовать о большей доли орбиталей металла в ВЗМО комплексов.
Список литературы
Zysman-Colman E. (ed.). Iridium(III) in Optoelectronic and Photonics Applications. Chichester: Wiley, 2017. 753 p. https://doi.org/10.1002/9781119007166
Zhang C., Liu R., Zhang D. et al. // Adv. Funct. Mater. 2020. V. 30. № 33. P. 1907156. https://doi.org/10.1002/adfm.201907156
Kabir E., Wu Y., Sittel S. et al. // Inorg. Chem. Front. 2020. V. 7. № 6. P. 1362. https://doi.org/10.1039/C9QI01584A
Zhang Y., Qiao J. // iScience. 2021. V. 24. № 8. P. 102858. https://doi.org/10.1016/j.isci.2021.102858
Schreier M.R., Guo X., Pfund B. et al. // Acc. Chem. Res. 2022. V. 55. № 9. P. 1290. https://doi.org/10.1021/acs.accounts.2c00075
Hassan M.M., Guria S., Dey S. et al. // Sci. Adv. 2023. V. 9. № 16. P. 3311. https://doi.org/10.1126/sciadv.adg3311
Fan Z., Xie J., Sadhukhan T. et al. // Chem. Eur. J. 2022. V. 28. № 3. P. e202103346. https://doi.org/10.1002/chem.202103346
Ho P.-Y., Lee S.-Y., Kam C. et al. // Adv. Healthcare Mater. 2021. V. 10. № 24. P. 2100706. https://doi.org/10.1002/adhm.202100706
Busto N., Vigueras G., Cutillas N et al. // Dalton Trans. 2022. V. 51. № 25. P. 9653. https://doi.org/10.1039/D2DT00752E
He P., Chen Y., Li X.-N. et al. // Chemosensors. 2023. V. 11. № 3. P. 177. https://doi.org/10.3390/chemosensors11030177
Legalite F., Escudero D., Pellegrin Y. et al. // Dyes Pigm. 2019. V. 171. P. 107693. https://doi.org/10.1016/j.dyepig.2019.107693
Cai Y., Zhang Y., Wang H. et al. // ACS Appl. Bio Mater. 2021. V. 4. № 8. P. 6103. https://doi.org/10.1021/acsabm.1c00445
Sen A., Putra M.H., Biswas A.K. et al. // Dyes Pigments. 2023. V. 213. P. 111087. https://doi.org/10.1016/j.dyepig.2023.111087
Wahyuono R.A., Amthor S., Müller C. et al. // ChemPhotoChem. 2020. V. 4. № 8. P. 618. https://doi.org/10.1002/cptc.202000038
Bobo M.V., Paul A., Robb A.J. et al. // Inorg. Chem. 2020. V. 59. № 9. P. 6351. https://doi.org/10.1021/acs.inorgchem.0c00456
Zhou Y., He P., Mo X.-F. et al. // Inorg. Chem. 2021. V. 60. № 9. P. 6266. https://doi.org/10.1021/acs.inorgchem.0c03812
Kobayashi A., Muramatsu E., Yoshida M. et al. // Energies. 2021. V. 14. № 9. P. 2425. https://doi.org/10.3390/en14092425
Zhao J.-H., Hu Y.-X., Lu H.-Y. et al. // Org. Electron. 2017. V. 41. P. 56. https://doi.org/10.1016/j.orgel.2016.11.039
Liao H.-S., Xia X., Hu Y.-X. et al. // Synth. Met. 2022. V. 291. P. 117195. https://doi.org/10.1016/j.synthmet.2022.117195
Laha P., Husain A., Patra S. // J. Mol. Liq. 2022. V. 349. P. 118446. https://doi.org/10.1016/j.molliq.2021.118446
Lavrova M.A., Mishurinskiy S.A., Smirnov D.E. et al. // Dalton Trans. 2020. V. 49. № 46. P. 16935. https://doi.org/10.1039/D0DT03564E
Bezzubov S.I., Doljenko V.D., Troyanov S.I. et al. // Inorg. Chim. Acta. 2014. V. 415. P. 22. https://doi.org/10.1016/j.ica.2014.02.024
Tatarin S.V., Kalle P., Taydakov I.V. et al. // Dalton Trans. 2021. V. 50. № 20. P. 6889. https://doi.org/10.1039/D1DT00820J
Martìnez-Vollbert E., Ciambrone C., Lafargue-Dit-Hauret W. et al. // Inorg. Chem. 2022. V. 61. № 7. P. 3033. https://doi.org/10.1021/acs.inorgchem.1c02968
Билялова А.А., Татарин С.В., Калле П. и др. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 172.
Беззубов С.И., Долженко В.Д., Киселев Ю.М. // Журн. неорган. химии. 2014. Т. 59. № 6. С. 749.
Brunen S., Grell Y., Steinlandt P.S. et al. // Molecules. 2021. V. 26. № 7. P. 1822. https://doi.org/10.3390/molecules26071822
Fu-Quan H., Chun-Miao H., Hui X. // Chin. Chem. Lett. 2016. V. 27. P. 1193. https://doi.org/10.1016/j.cclet.2016.07.009
Martínez-Alonso M., Cerdá J., Momblona C. et al. // Inorg. Chem. 2017. V. 56. № 17. P. 10298. https://doi.org/10.1021/acs.inorgchem.7b01167
Liao H.-S., Hu Y.-X., Xia X. et al. // J. Organomet. Chem. 2022. V. 957. P. 122157. https://doi.org/10.1016/j.jorganchem.2021.122157
Bezzubov S.I., Kiselev Y.M., Churakov A.V. et al. // Eur. J. Inorg. Chem. 2016. V. 2016. № 3. P. 347. https://doi.org/10.1002/ejic.201501068
Bezzubov S.I., Zharinova I.S., Khusyainova A.A. et al. // Eur. J. Inorg. Chem. 2020. V. 2020. № 34. P. 3277. https://doi.org/10.1002/ejic.202000372
Tatarin S.V., Smirnov D.E., Taydakov I.V. et al. // Dalton Trans. 2023. V. 52. № 19. P. 6435. https://doi.org/10.1039/D3DT00200D
Zijian L., Si-Wei Z., Meng Z. et al. // Front. Chem. 2021. V. 9. P. 758357. https://doi.org/10.3389/fchem.2021.758357
Henwood A.F., Pal A.K., Cordes D.B. et al. // J. Mater. Chem. C. 2017. V. 5. № 37. P. 9638. https://doi.org/10.1039/C7TC03110F
Penconi M., Cazzaniga M., Kesarkar S. et al. // Photochem. Photobiol. Sci. 2017. V. 16. P. 1220. https://doi.org/10.1039/c7pp00119c
Park Y., Lee G.S., Lee W. et al. // Sci. Rep. 2023. V. 13. P. 1369. https://doi.org/10.1038/s41598-023-27487-6
Hasan K., Zysman-Colman E. // Inorg. Chem. 2012. V. 51. № 22. P. 12560. https://doi.org/10.1021/ic301998t
Henwood A.F., Hu Y., Sajjad M.T. et al. // Chem. Eur. J. 2015. V. 21. № 52. P. 19128. https://doi.org/10.1002/chem.201503546
Kalle P., Kiseleva M.A., Tatarin S.V. et al. // Molecules. 2022. V. 27. № 10. P. 3201. https://doi.org/10.3390/molecules27103201
Oki A.R., Morgan R.J. // Synth. Commun. 1995. V. 25. № 24. P. 4093. https://doi.org/10.1080/00397919508011487
Беззубов С.И., Билялова А.А., Кузнецова И.В. и др. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1087.
Sheldrick G.M. // SADABS. Version 2008/1. 2008. Bruker AXS Inc. Germany.
Sheldrick G.M. // Acta Cryst., Sect. A. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Cryst. 2015. V. C71. P. 3. https://doi.org/10.1107/S2053229614024218
Spek A.L. // Acta Cryst. 2015. V. C71. P. 9. https://doi.org/10.1107/S2053229614024929
Dolomanov O.V., Bourhis L.J., Gildea et al. // J. Appl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
He Y., Chen J., Yu X. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 6. P. 1264. https://doi.org/10.1134/S0036023622080162
Дополнительные материалы
- скачать ESM_1.zip
- Приложение 1.
1. Спектры ЯМР лигандов L1 – L4 и комплексов 1 – 4
2. Масс-спектры высокого разрешения комплексов 1 – 4
3. Рентгеноструктурные данные
4. Данные оптических измерений
- скачать ESM_2.zip
- Приложение 2. Report 1 - Report 4
Инструменты
Журнал неорганической химии